Координационная химия, 2019, T. 45, № 10, стр. 599-610
Принципы построения полимерных структур, гетероядерный (13C, 15N) CP-MAS ЯМР и термическое поведение разнолигандных комплексов висмута(III) общего состава [Bi(S2CNR2)2X] (X = NO3, Cl)
Е. В. Новикова 1, А. В. Иванов 1, *, И. В. Егорова 2, Р. С. Трошина 2, Н. А. Родионова 2, А. И. Смоленцев 3, 4, О. Н. Анцуткин 5, 6
1 Институт геологии и природопользования ДВО РАН
Благовещенск, Россия
2 Благовещенский государственный педагогический университет
Благовещенск, Россия
3 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
4 Новосибирский государственный университет
Новосибирск, Россия
5 Университет технологий
Лулео, Швеция
6 Университет Варвика
Ковентри, Великобритания
* E-mail: alexander.v.ivanov@chemist.com
Поступила в редакцию 29.03.2019
После доработки 08.04.2019
Принята к публикации 22.04.2019
Аннотация
Препаративно выделены кристаллические разнолигандные комплексы висмута(III) состава [Bi{S2CN(изо-C4H9)2}2(NO3)] (I) и [Bi{S2CN(C3H7)2}2Cl] (II). Оба соединения, формирующие 1D-полимерные структуры, охарактеризованы методами РСА (CIF files CCDC № 1877115 (I), 1876364 (II)) и CP-MAS ЯМР (13C, 15N) спектроскопии. Координация дитиокарбаматных лигандов является S,S′-анизобидентатно-концевой. Неорганические анионы, выполняющие μ2-мостиковую функцию, участвуют в связывании соседних металлических атомов с образованием зигзагообразных полимерных цепочек. При этом для мостиковых нитратных групп в I обнаружен новый способ связывания висмута(III) с участием всех атомов кислорода (O,O'-анизобидентатная координация к каждому из соседних атомов висмута). Для атомов висмута в изученных соединениях характерно восьмерное [BiS4O4] (I) или шестерное [BiS4Cl2] (II) окружение. Tермическое поведение полученных комплексов охарактеризовано по данным синхронного термического анализа, включающего одновременную регистрацию кривых термогравиметрии и дифференциальной сканирующей калориметрии. В обоих случаях единственным конечным продуктом термических превращений I и II является Bi2S3.
Низкая токсичность висмута и его соединений в сравнении с другими тяжелыми металлами, с одной стороны, предопределила тенденцию в промышленности к замене свинца и сурьмы на висмут, а с другой – позволяет использовать комплексы висмута(III) при создании лекарственных форм с противоязвенным, противовоспалительным и антибактериальным действием. При этом комплексы висмута, включающие диалкилдитиокарбаматные лиганды, кроме антибактериальной [1–4], обнаруживают также и противоопухолевую активность [5–9]. Помимо дитиокарбаматных комплексов [2–4, 9–18], висмут(III) образует также и разнолигандные соединения, внутренняя сфера которых, наряду с =NC(S)S– группами, включает и неорганические анионы: ${\text{NO}}_{3}^{ - }$ [19–24] и X– (X = Cl, Br, I) [25–28]. Последние могут быть использованы при получении материалов на основе пленок и наночастиц Bi2S3 [24, 27].
В настоящей работе препаративно выделены кристаллические разнолигандные комплексы висмута(III) общего состава [Bi(S2CNR2)2X] (R = = изо-C4H9, X = NO3 (I); R = C3H7, X = Cl (II)), для которых, по данным РСА, установлено формирование 1D-полимерных структур. Полученные соединения охарактеризованы по данным гетероядерной (13C, 15N) CP-MAS ЯМР спектроскопии; термическое поведение изучено методом синхронного термического анализа (СТА).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные Na{S2CN(C3H7)2} · H2O и Na{S2CN(изо-C4H9)2} · 3H2O получали взаимодействием эквимолярных масс соответствующих диалкиламинов, HN(C3H7)2 (Merck) и HN(изо-C4H9)2 (Aldrich) с сероуглеродом (Merck) в щелочной среде [29].
ИК-спектры (KBr; ν, см–1) для Na{S2CN(изо-C4H9)2} · 3H2O: 3362 с.ш, 2961 с, 2933 ср, 2893 о. сл, 2867 ср, 1641 ср, 1596 ср, 1477 с, 1463 сл, 1424 сл, 1400 ср, 1382 ср, 1367 сл, 1355 ср, 1337 сл, 1290 ср, 1233 с, 1202 ср, 1169 сл, 1150 ср, 1090 с, 1009 сл, 972 с, 936 ср, 909 сл, 868 ср, 817 сл, 805 сл, 612 ср, 557 сл, 467 сл.; для Na{S2CN(C3H7)2} · H2O: 3368 с.ш, 2963 ср, 2930 ср, 2872 ср, 2130 с, 1632 с, 1468 с, 1408 с, 1368 с, 1304 ср, 1298 ср, 1267 ср, 1237 с, 1198 с, 1138 с, 1107 сл, 1088 ср, 1028 ср, 970 с, 891 ср, 864 ср, 745 ср, 602 сл, 536 сл [18].
Спектры CP-MAS ЯМР 13С (δ, м.д.) для Na{S2CN(изо-C4H9)2} · 3H2O: 208.2 (−S2CN=); 66.7 (=NCH2−); 28.0, 27.1 (1 : 1, =CH−); 23.0, 22.4, 20.8 (1 : 1 : 2, −CH3) [30]; для Na{S2CN(C3H7)2} · H2O: 208.3 (−S2CN=); 59.4, 57.9 (1 : 1, =NCH2−); 22.3, 21.5 (1 : 1, −CH2−); 12.6, 11.5 (1 : 1, −CH3) [30].
Синтез 1D-полимерных комплексов, катена-поли[(μ2-нитрато-O,{O',O"})-бис(N,N-ди-изо-бутилдитиокарбамато-S,S')висмутa(III)] (I) и катена-поли[(μ2-хлоро)-бис(N,N-дипропил-дитиокарбамато-S,S')висмутa(III)] (II), выполняли по следующей реакции:
Для I/II реакцию между Bi(NO3)3 · 5H2O и Na{S2CN(изо-C4H9)2} · 3H2O/BiCl3 · H2O и Na{S2CN(C3H7)2} · H2O проводили в растворе ацетона–этанола (1 : 1)/ацетона. Исходные соли висмута использовали в 5%-ном сверхстехиометрическом избытке. Реакционные смеси перемешивали на магнитной мешалке в течение 1 ч и оставляли на сутки при комнатной температуре. Затем растворы отделяли от образовавшихся осадков фильтрованием с дополнительной отмывкой целевых комплексов из фазы осадков соответствующими растворителями. Желтые пластинчатые кристаллы I/II получали медленным испарением растворителей при комнатной температуре (для улучшения кристаллизации I в раствор добавляли небольшое количество CH2Cl2). Выход 64.4/78.0%; Тпл 155–158/146–148°С.
ИК-спектры I (KBr; ν, см–1): 2962 с, 2930 ср, 2898 о. сл, 2871 ср, 1634 ср, 1501 с, 1485 ср, 1466 ср, 1431 с, 1385 с, 1369 о. сл, 1358 ср, 1339 ср, 1311 с, 1249 с, 1195 ср, 1171 сл, 1149 с, 1128 сл, 1122 сл, 1090 ср, 1032 ср, 970 ср, 921 ср, 885 сл, 818 сл, 714 сл, 707 о. сл, 628 сл, 607 сл, 532 сл; II: 2964 с, 2929 ср, 2870 ср, 1493 с, 1464 ср, 1428 с, 1363 ср, 1341 сл, 1303 ср, 1270 сл, 1241 с, 1197 ср, 1148 с, 1102 сл, 1087 ср, 1032 сл, 962 ср, 894 ср, 765 сл, 752 ср, 619 сл, 602 ср, 536 сл.
CP-MAS ЯМР 13С, 15N спектры I (δ, м.д.): 204.4, 199.9 (1 : 1, –S2CN=); 63.7, 61.9, 57.6 (1 : 1 : 2, =NCH2–); 29.4, 28.2, 26.5 (1 : 1 : 2, –CH=); 23.6, 22.4, 21.8, 21.4, 20.8, 19.6, 19.0 (1 : 2 : 1 : 1 : 1 : 1 : 1, –CH3); 146.4, 140.1 (1 : 1, –S2CN=); 336.5 (N${\text{O}}_{3}^{ - }$); II: 200.1, 199.3 (1 : 1, –S2CN=); 57.7, 56.7, 55.6 (1 : 1 : 2, =NCH2–); 23.0, 20.8, 20.1 (1 : 2 : 1, –CH2–); 13.2, 12.7, 11.8 (1 : 2 : 1, –CH3); 143.7, 141.3 (1 : 1, ‒S2CN=).
Спектры CP-MAS ЯМР 13C/15N регистрировали на спектрометре Ascend Aeon (Bruker) с рабочей частотой 100.64/40.55 МГц, сверхпроводящим магнитом (В0 = 9.4 Тл) с замкнутым циклом конденсации гелия через внешний компрессор и Фурье-преобразованием. Использовали кросс-поляризацию (CP) с протонов: контактное время 1H−13C/1H−15N 2.0/1.5 мс. Подавление взаимодействий 13C−1H/15N−1H основывалось на эффекте декаплинга при использовании радиочастотного поля на резонансной частоте протонов (400.21 МГц) [31]. Поликристаллические образцы I/II массой ~61/29 мг помещали в 4.0 мм керамический ротор из ZrO2. При измерениях спектров ЯМР 13C/15N использовали вращение образцов под магическим углом (MAS) на частоте 5000–10 000/5000(1) Гц; число накоплений 23 400–30 000/31 648–78 200; длительность протонных π/2-импульсов 2.7/2.7 мкс; интервал между импульсами 2.0/2.0 с. Изотропные хим. сдвиги, δ(13C)/δ(15N) даны относительно одной из компонент внешнего стандарта – кристаллического адамантана (δ = 38.48 м.д. относительно тетраметилсилана)/кристаллического NH4Cl (δ = 0.0 м.д., –341 м.д. в абсолютной шкале [32]) с поправкой на дрейф напряженности магнитного поля, частотный эквивалент которого составил 0.031/0.011 Гц/ч. Однородность магнитного поля контролировали по ширине (2.6 Гц) референсной линии адамантана.
ИК-спектры комплексов I и II, запрессованных в таблетках с KBr, регистрировали на интерференционных ИК-спектрометрах с Фурье-преобразованием ФСМ–1201 и ФСМ–2202 в диапазонах 450–7500 и 400–4000 см–1. Управление прибором и обработку спектров осуществляли по программе FSpec (версия 4.0.0.2 для Windows, ООО “Мониторинг”, Россия).
РСА I/II выполнен c пластинчатых монокристаллов на дифрактометре Bruker-Nonius X8 Apex CCD/Bruker SMART 1000 CCD при 150(2)/120(2) K: MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор. Данные собраны по стандартной методике: φ- и ω-сканирование узких фреймов/в области полусферы. Поглощение учтено эмпирически (SADABS) [33]. Структуры определены прямым методом и уточнены методом наименьших квадратов (по F 2) в полноматричном анизотропном приближении неводородных атомов. Положения атомов водорода рассчитаны геометрически и включены в уточнение в модели “наездника”. Расчеты по определению и уточнению структуры выполнены по комплексу программ SHELXTL [33, 34]. Основные кристаллографические данные и результаты уточнения структур I и II приведены в табл. 1, основные длины связей и углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур [Bi{S2CN(изо-C4H9)2}2(NO3)] (I) и [Bi{S2CN(C3H7)2}2Cl] (II)
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C18H36N3O3S4Bi | C14H28N2S4ClBi |
| M | 679.72 | 597.05 |
| Сингония | Ромбическая | Моноклинная |
| Пр. гр. | Pca21 | P21/c |
| a, Å | 11.1947(7) | 9.6492(12) |
| b, Å | 10.8399(6) | 24.466(3) |
| c, Å | 21.5113(11) | 9.2616(11) |
| β, град | 90 | 95.514(3) |
| V, Å3 | 2610.4(3) | 2176.4(5) |
| Z | 4 | 4 |
| ρ(выч.), г/см3 | 1.730 | 1.822 |
| μ, мм–1 | 7.097 | 8.606 |
| F(000) | 1344 | 1160 |
| Размер кристалла, мм3 | 0.25 × 0.25 × 0.06 | 0.25 × 0.21 × 0.10 |
| Область сбора данных по θ, град | 2.62–27.50 | 2.12–28.00 |
| Интервалы индексов отражений | –9 ≤ h ≤ 14, –14 ≤ k ≤ 12, –27 ≤ l ≤ 23 |
–12 ≤ h ≤ 12, –32 ≤ k ≤ 32, –12 ≤ l ≤ 12 |
| Измерено отражений | 15 835 | 20 874 |
| Независимых отражений (Rint) | 5637 (0.0267) | 5224 (0.0495) |
| Отражений с I > 2σ(I) | 5327 | 5224 |
| Переменных уточнения | 271 | 203 |
| GOOF | 0.896 | 1.007 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0205 wR2 = 0.0453 |
R1 = 0.0274 wR2 = 0.0557 |
| R-факторы по всем отражениям | R1 = 0.0223 wR2 = 0.0458 |
R1 = 0.0350 wR2 = 0.0585 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.945/2.221 | –1.486/1.896 |
Таблица 2.
Длины связей (d, Å), валентные (ω, град) и торсионные (φ, град) углы в структурах I и II*
| Соединение I | |||
| связь | d, Å | связь | d, Å |
| Bi(1)–S(1) | 2.6309(10) | S(4)–C(10) | 1.742(3) |
| Bi(1)–S(2) | 2.8012(8) | N(1)–C(1) | 1.327(5) |
| Bi(1)–S(3) | 2.7335(8) | N(1)–C(2) | 1.474(4) |
| Bi(1)–S(4) | 2.6199(9) | N(1)–C(6) | 1.482(5) |
| Bi(1)–O(1) | 2.955(3) | N(2)–C(10) | 1.334(4) |
| Bi(1)–O(1)a | 2.961(3) | N(2)–C(11) | 1.483(4) |
| Bi(1)–O(2) | 3.007(3) | N(2)–C(15) | 1.461(4) |
| Bi(1)–O(3)a | 2.850(3) | O(1)–N(3) | 1.265(4) |
| S(1)–C(1) | 1.742(3) | O(2)–N(3) | 1.240(4) |
| S(2)–C(1) | 1.720(4) | O(3)–N(3) | 1.250(4) |
| S(3)–C(10) | 1.724(3) | ||
| угол | ω, град | угол | ω, град |
| S(1)C(1)S(2) | 118.1(2) | O(1)aBi(1)S(4) | 68.41(5) |
| S(1)Bi(1)S(2) | 66.17(3) | O(2)Bi(1)S(1) | 118.05(6) |
| S(3)C(10)S(4) | 117.55(16) | O(2)Bi(1)S(2) | 126.79(6) |
| S(3)Bi(1)S(4) | 67.19(3) | O(2)Bi(1)S(3) | 85.46(6) |
| S(1)Bi(1)S(3) | 85.90(3) | O(2)Bi(1)S(4) | 141.24(6) |
| S(1)Bi(1)S(4) | 87.96(3) | O(3)aBi(1)S(1) | 166.46(7) |
| S(2)Bi(1)S(3) | 144.16(3) | O(3)aBi(1)S(2) | 112.99(6) |
| S(2)Bi(1)S(4) | 88.87(3) | O(3)aBi(1)S(3) | 88.86(5) |
| O(1)Bi(1)S(1) | 77.24(6) | O(3)aBi(1)S(4) | 78.50(6) |
| O(1)Bi(1)S(2) | 120.81(5) | O(1)Bi(1)O(1)a | 148.65(9) |
| O(1)Bi(1)S(3) | 70.28(5) | O(1)Bi(1)O(2) | 42.41(8) |
| O(1)Bi(1)S(4) | 135.73(4) | O(1)Bi(1)O(3)a | 112.64(8) |
| O(1)aBi(1)S(1) | 130.27(6) | O(2)Bi(1)O(1)a | 106.54(8) |
| O(1)aBi(1)S(2) | 70.10(5) | O(2)Bi(1)O(3)a | 73.86(9) |
| O(1)aBi(1)S(3) | 119.88(5) | ||
| угол | φ, град | угол | φ, град |
| Bi(1)S(1)S(2)C(1) | 163.5(2) | S(2)C(1)N(1)C(2) | –7.2(5) |
| Bi(1)S(3)S(4)C(10) | –178.2(2) | S(2)C(1)N(1)C(6) | 172.4(3) |
| S(1)Bi(1)C(1)S(2) | 165.9(2) | S(3)C(10)N(2)C(11) | –0.7(4) |
| S(3)Bi(1)C(10)S(4) | –178.5(2) | S(3)C(10)N(2)C(15) | 175.9(2) |
| S(1)C(1)N(1)C(2) | 173.6(2) | S(4)C(10)N(2)C(11) | 179.7(3) |
| S(1)C(1)N(1)C(6) | –6.8(5) | S(4)C(10)N(2)C(15) | –3.6(4) |
| Соединение II | |||
| связь | d, Å | связь | d, Å |
| Bi(1)–S(1) | 2.6369(9) | S(3)–C(2) | 1.741(4) |
| Bi(1)–S(2) | 2.7207(9) | S(4)–C(2) | 1.714(4) |
| Bi(1)–S(3) | 2.6180(10) | N(1)–C(1) | 1.322(4) |
| Bi(1)–S(4) | 2.8290(10) | N(1)–C(3) | 1.477(4) |
| Соединение II | |||
| связь | d, Å | связь | d, Å |
| Bi(1)–Cl(1) | 2.9010(9) | N(1)–C(6) | 1.474(4) |
| Bi(1)–Cl(1)а | 3.1276(10) | N(2)–C(2) | 1.316(5) |
| S(1)–C(1) | 1.739(4) | N(2)–C(9) | 1.475(5) |
| S(2)–C(1) | 1.723(4) | N(2)–C(12) | 1.468(5) |
| угол | ω, град | угол | ω, град |
| S(1)C(1)S(2) | 117.7(2) | S(2)Bi(1)S(4) | 139.61(3) |
| S(1)Bi(1)S(2) | 67.13(3) | S(1)Bi(1)Cl(1) | 150.91(3) |
| S(4)C(2)S(3) | 118.4(2) | S(2)Bi(1)Cl(1) | 84.37(3) |
| S(3)Bi(1)S(4) | 65.90(3) | S(3)Bi(1)Cl(1) | 81.54(3) |
| S(1)Bi(1)S(3) | 89.96(3) | S(4)Bi(1)Cl(1) | 116.12(3) |
| S(1)Bi(1)S(4) | 84.76(3) | Bi(1)Cl(1)Bi(1)a | 109.10(3) |
| S(2)Bi(1)S(3) | 84.95(3) | Cl(1)Bi(1)Cl(1)а | 120.83(3) |
| угол | φ, град | угол | φ, град |
| Bi(1)S(1)S(2)C(1) | 170.7(2) | S(2)C(1)N(1)C(3) | 177.6(3) |
| Bi(1)S(3)S(4)C(2) | –173.7(2) | S(2)C(1)N(1)C(6) | 3.8(5) |
| S(1)Bi(1)C(1)S(2) | 172.0(2) | S(3)C(2)N(2)C(9) | 2.0(5) |
| S(3)Bi(1)C(2)S(4) | 174.6(2) | S(3)C(2)N(2)C(12) | –179.1(3) |
| S(1)C(1)N(1)C(3) | –1.7(5) | S(4)C(2)N(2)C(9) | –178.7(3) |
| S(1)C(1)N(1)C(6) | –175.5(3) | S(4)C(2)N(2)C(12) | 0.2(5) |
Координаты атомов, длины связей, валентные углы и температурные параметры для полученных комплексов депонированы в Кембриджском банке структурных данных (CCDC № 1877115 (I) и 1876364 (II); deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk).
Термическое поведение I, II изучали методом СТА с одновременной регистрацией кривых термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК). Исследование проводили на приборе STA 449C Jupiter (фирмы NETZSCH) в корундовых тиглях под крышкой с отверстием, обеспечивающим давление паров в процессе термолиза равное 1 атм. Скорость нагрева составляла 5°С/мин до 400°С в атмосфере аргона, масса навесок – 1.800–6.348/5.800–7.188 мг. Точность измерения температуры ±0.7°С, изменения массы ±1 × 10−4 мг.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В ИК-спектрах комплексов I/II полосы поглощения в области 2964–2870 см–1 обусловлены валентными колебаниями связей С–Н алкильных групп: νas(СН3) 2962/2964, νs(СН3) 2871/2870 и νas(СН2) 2930/2929 см–1 (для комплекса I слабоинтенсивная полоса ν(СН) наблюдается при 2898 см–1) [35]. Интенсивные (1149/1148 см–1) и среднеинтенсивные (970/962 см–1) полосы поглощения отнесены к колебаниям νas(СS2) и νs(СS2) соответственно [36–38].
Важной особенностью интенсивных полос поглощения при 1501/1493 см–1, отнесенных к валентным колебаниям связи ν(C–N) в =NC(S)S– группе, является их положение, занимаемое между диапазонами колебаний двойной С=N (1690–1640 см–1) и ординарной С–N (1360–1250 см–1) связей [29]. Это обстоятельство прямо указывает на частично двойной характер связи С–N в дитиокарбаматной группе. При этом смещение обсуждаемых полос поглощения в высокочастотную область для комплексов I, II, в сравнении с соответствующими диалкилдитиокарбаматами натрия (1477/1468 см–1), свидетельствует о возрастании вклада двоесвязанности в формально ординарную связь N–C(S)S при ковалентном связывании дитиокарбаматных (Dtc) лигандов висмутом(III).
Кроме того, в ИК-спектре комплекса I обнаруживается нитратная группа: среднеинтенсивная полоса валентных колебаний νs(N=O) при 1634 см–1; узкая полоса высокой интенсивности (1385 см–1), обусловленная валентными колебаниями νas(NO2); среднеинтенсивная полоса νs(NO2) при 1032 см–1, а также полоса плоскостного деформационного колебания δ(${\text{NO}}_{{\text{3}}}^{--}$) 714 см–1 (с плечом при 707 см–1) [39–41]. Весьма значительное различие (в 249 см–1) между двумя высокочастотными полосами свидетельствует о сложном характере координации нитратной группы [39–41].
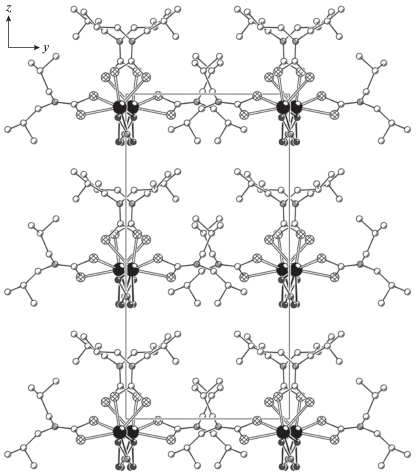
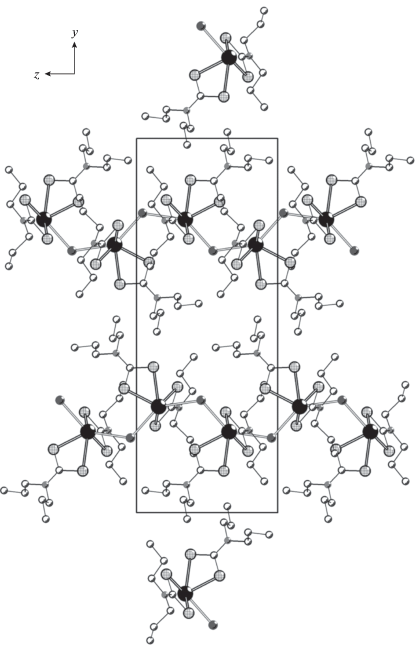
При установлении структурной организации полученных полимерных комплексов был использован метод РСА. У обоих комплексов I/II элементарная ячейка включает по четыре формульных единицы (рис. 1, 2). В обоих случаях комплексообразователь связывает два концевых S,S'-анизобидентатно координированных Dtc-лиганда, у которых одна из связей Bi–S (2.6199, 2.6309/2.6180, 2.6369 Å) значительно короче другой (2.7335, 2.8012/2.7207, 2.8290 Å). Обсуждаемая координация приводит к образованию в комплексах двух малоразмерных четырехчленных металлоциклов [BiS2C], объединяемых общим атомом металла. Взаимное расположение атомов в циклах близко к копланарному: значения торсионных углов BiSSC и SBiCS приведены в табл. 2. В каждом из комплексов наиболее значимое отклонение от плоскостной конфигурации обнаруживает лишь один из металлоциклов, что можно представить его перегибом по оси S(1)–S(2). Двугранные углы между среднеквадратичными плоскостями циклов в комплексах I/II составляют 84.68°/87.71°.
Для дитиокарбаматных лигандов в комплексах I, II общими являются две структурные особенности, обусловленные проявлением мезомерного эффекта =NC(S)S– групп: а) заметно меньшая длина связей N–C(S)S (1.316–1.334 Å) в сравнении с N–CH2 (1.461–1.483 Å), что отражает вклад двоесвязанности в формально ординарную связь и б) конфигурация структурного фрагмента C2N–CS2 близкая к плоской, что следует из значений торсионных углов SCNC (табл. 2).
В исследуемых комплексах неорганические анионы ${\text{NO}}_{{\text{3}}}^{--}$ и Cl– выполняют μ2-мостиковую структурную функцию, объединяя соседние молекулы [Bi{S2CN(изо-C4H9)2}2(NO3)] и [Bi{S2CN(C3H7)2}2Cl] в полимерные цепочки (рис. 3, 4). При этом координация мостиковых нитратных групп осуществляется необычным образом – при участии всех трех атомов кислорода. Поэтому группы ${\text{NO}}_{{\text{3}}}^{--}$ выполняют роль двойных мостиков: один из атомов кислорода – O(1) – участвует в связывании с двумя соседними атомами Bi, тогда как каждый из двух других – O(2) и O(3) – координирует только к одному из атомов металла (рис. 3). Отсюда следует, что по совокупности нитратная группа участвует в бидентатной координации к каждому из соседних атомов Bi.
Рис. 3.
Двухзвенный фрагмент полимерной цепи [Bi{S2CN(изо-C4H9)2}2(NO3)]n. Эллипсоиды 50%-ной вероятности; симметрическое преобразование: a 1/2 + x, –y, z. Атомы водорода не показаны.
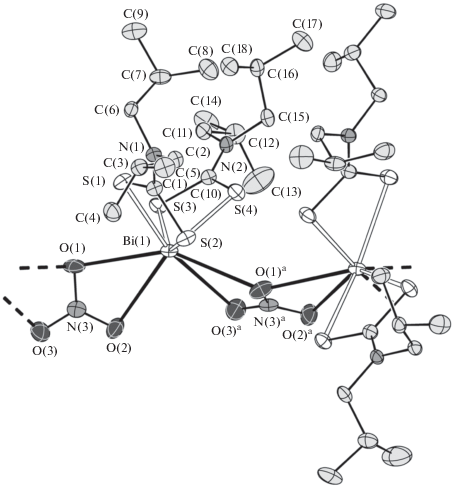
Рис. 4.
Двухзвенный фрагмент полимерной цепочки [Bi{S2CN(C3H7)2}2Cl]n. Эллипсоиды 50%-ной вероятности; симметрическое преобразование: ax, 1/2 –y, 1/2 + z. Атомы водорода не показаны.
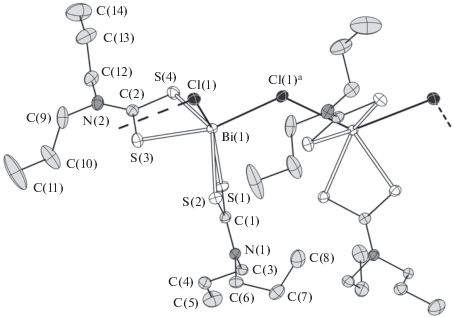
Ранее для дитиокарбаматно-нитратных комплексов висмута(III) описаны два типа мостиковой координации нитратных групп при участии одного (μ2-нитрато-O: Bi–O(NO2)–Bi, длина связей Bi–O 2.694 и 2.725 Å [24]) или двух атомов кислорода (μ2-нитрато-O,O': Bi–O(NO)O–Bi, Bi–O 2.772 и 2.827 Å [21]; Bi–O 2.723 и 2.856 Å) [24])11. В нашем случае связи Bi–O в диапазоне 2.850–3.007 Å (табл. 2) заметно длиннее и построение полимерной цепочки в соединении I реализуется принципиально иначе: за счет большего числа менее прочных связей Bi–O (рис. 3). Известно еще только одно соединение, в котором нитратные группы таким же образом участвуют в связывании соседних атомов висмута – разнолигандный комплекс, дополнительно включающий двухзарядные алкоксигруппы пентаэтиленгликоля и характеризующийся более прочными связями Bi–O (2.57–3.00 Å) [42]. Кроме того, среди полиядерных комплексов с чисто кислородным окружением комплексообразователя описаны также и соединения, в которых нитратная группа, образуя четыре (2.621–2.903 Å) [43] или шесть (2.725–2.875 Å) связей Bi–O [44], объединяет три атома висмута.
B наибольшей степени структурная организация комплекса II близка к описанной ранее для соединений состава [Bi{S2CN(CH2)4}2Cl] ∙ CHCl3 [27] и [Bi{S2CN(C2H5)(C2H4OH)}2Cl] [28]. Во всех этих случаях комплексы включают по два неэквивалентных S,S'-анизобидентатно координированных Dtc-лиганда и μ2-мостиковый атом хлора, асимметрично связывающий атомы висмута. При этом длина связей Bi–Cl (2.9010 и 3.1276 Å) в структуре II согласуется с соответствующими характеристиками μ2-Cl-лигандов и в таких неорганических анионах, как [Bi2Cl9]3– [18], [Bi2Cl10]4– [45], [Bi3Cl12]3– [46], а также в полимерном ([BiCl5]2–)n [47].
Значение угла BiBiBi 163.436(4)° в зигзагообразной полимерной цепочке структуры I отражает ее сглаженный характер. В цепочке структуры II (рис. 4) отклонение от линейности выражено в значительно большей степени: угол BiBiBi составляет 140.983(4)°. По совокупной координации двух концевых (Dtc) и двух мостиковых (${\text{NO}}_{{\text{3}}}^{--}$) лигандов комплексообразователь в I формирует восьмерное окружение [BiS4O4]. Аналогичным образом в комплексе II мостиковые атомы хлора достраивают внутреннюю сферу металла до [BiS4Cl2].
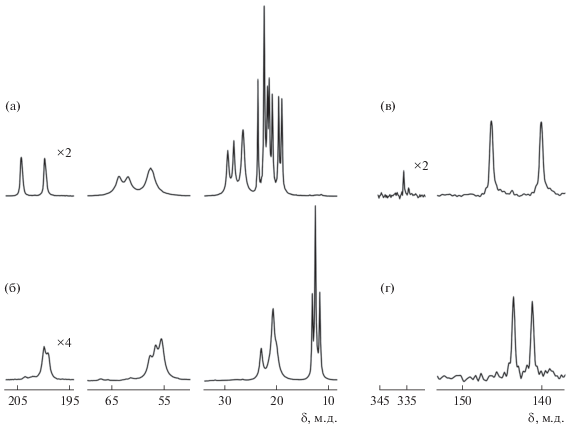
Спектры CP-MAS ЯМР 13C, 15N комплексов I, II свидетельствуют об индивидуальном характере полученных соединений (рис. 5). При этом дитиокарбаматные группы в составе исследуемых комплексов характеризуются существенно меньшими значениями хим. сдвигов 13С в сравнении с исходными натриевыми солями, что является прямым следствием ковалентного связывания Dtc-лигандов висмутом(III). Спектры ЯМР 13C комплексов I/II (рис. 5а, 5б), включающие резонансные сигналы групп =NC(S)S– (1 : 1), =NCH2– (1 : 1 : 2), =CH– (1 : 1 : 2)/–CH2– (1 : 2 : 1) и –CH3 (1 : 2 : 1 : 1 : 1 : 1 : 1)/(1 : 2 : 1), полностью согласуются с данными РСА о присутствии в составе каждого из комплексов двух Dtc-лигандов, отражая их неэквивалентность как в части дитиокарбаматных групп, непосредственно связанных с комплексообразователем, так и структурных групп в составе алкильных заместителей. Каждый из спектров ЯМР 15N, в свою очередь, представлен двумя резонансными сигналами (1 : 1) групп =NC(S)S–, а также дополнительным низкоинтенсивным сигналом NO3-группы в дитиокарбаматно-нитратном комплексе I (рис. 5в, 5г).
Рис. 5.
Спектры MAS ЯМР 13C (а, б) и 15N (в, г) поликристаллических образцов I (а, в) и II (б, г). Число накоплений/частота вращения образцов (в Гц): 23 400/10 000 (а), 30 000/5000 (б), 31 648/5000 (в), 78 200/5000 (г).
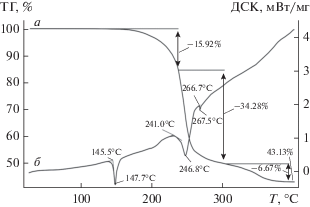
Термическое поведение полученных комплексов изучено в атмосфере аргона методом СТА с одновременной регистрацией кривых ТГ и ДСК (рис. 6, 7). Первые признаки начала потери массы образцами I/II проявляются при 132 и 160°С соответственно, что определяет границу их термической устойчивости. Эндоэффекты на кривых ДСК с экстремумами при 160.0 и 147.7°С отражают плавление комплексов: экстраполированные Tпл = 156.2 и 145.5°С. (При независимом определении в стеклянном капилляре установлены диапазоны плавления образцов: 155–158 и 146–148°C.) Для более четкого выявления характеристических точек низкоинтенсивных тепловых эффектов на кривой ДСК комплекса I было выполнено ее двойное дифференцирование (рис. 6в).
Рис. 6.
Кривые ТГ (а) и ДСК (б) комплекса I. На выноске (в) приведена вторая производная кривой ДСК.
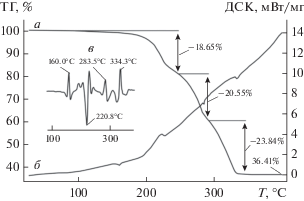
На кривой ТГ соединения I имеются три точки перегиба, свидетельствующие о сложном характере протекания термолиза. Начальный участок, до первой точки при 246.0°С, характеризуется потерей массы в 18.65%. Поскольку на этот участок проецируется экзоэффект при 220.8°C, логично предположить, что термическая деструкция на начальном этапе протекает при участии NO3-группы и одного из алкильных заместителей (17.37%). Термические превращения в области относительно низких температур с участием NO3-групп довольно типичны для дитиокарбаматно-нитратных комплексов [48]. На последующих участках дефрагментация комплекса идет по оставшимся алкильным заместителям и дитиокарбаматным группам с формированием Вi2S3 (остаточная масса которого 36.41%, несколько ниже расчетной 37.82%) как основного финального продукта термических превращений I. При этом каждой из обсуждаемых ступеней термолиза соответствует свой эндоэффект на кривой ДСК: при 283.5 и 334.3°C (рис. 6в).
Термолиз комплекса II формально проходит в одну стадию (рис. 7а). Однако дифференцирование кривой ТГ позволяет выявить точку перегиба при 236.0°С. Потеря массы на начальном этапе (до этой точки) в 15.92% указывает на диссоциацию двух групп –C3H7 (расч. 14.43%). Последующий ход кривой ТГ включает участок (до 301.0°С), отражающий основную потерю массы (34.28%) и финальный этап плавной десорбции летучих продуктов термолиза (6.67%), завершающийся стабилизацией остаточной массы при 388.0°С (43.13%). Последнее с высокой точностью соответствует ожидаемому значению массы для Bi2S3 (расч. 43.06%), что согласуется с данными по исследованию термолиза сольватированной формы хлоридно-дитиокарбаматного комплекса висмута(III) состава [Bi{S2CN(CH2)4}2Cl] ∙ CHCl3 [27]. Кривая ДСК, кроме теплового эффекта плавления, включает эндотермические эффекты при 246.8 и 267.5°С (рис. 7б). Первый обусловлен термическим разложением вещества (экстраполированная температура процесса 241.0°С). Второй, узкий и крайне низкоинтенсивный эндоэффект отражает плавление следов восстановленного висмута (экстраполированная Tпл = 266.7°С). Согласно данным [49], компактный металлический висмут плавится при 271.442°С. Понижение Tпл в нашем случае может объясняться двумя факторами: малым размером металлических частиц и присутствием Bi2S3 как основного компонента [49], серо-черный тонкодисперсный порошок которого обнаружен в обоих случаях при вскрытии тиглей.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Chauhan H.P.S., Joshi S., Carpenter J. // J. Therm. Anal. Calorim. 2016. V. 124. № 1. P. 117.
Tamilvanan S., Gurumoorthy G., Thirumaran S., Ciattini S. // Polyhedron. 2017. V. 121. P. 70.
Ariza-Roldán A.O., López-Cardoso E.M., Rosas-Valdez M.E. et al. // Polyhedron. 2017. V. 134. P. 221.
Tamilvanan S., Gurumoorthy G., Thirumaran S., Ciattini S. // Polyhedron. 2017. V. 123. P. 111.
Li H., Lai C.S., Wu J. et al. // J. Inorg. Biochem. 2007. V. 101. № 5. P. 809.
Ishak D.H.A., Ooi K.K., Ang K.-P. et al. // J. Inorg. Biochem. 2014. V. 130. P. 38.
Ozturk I.I., Banti C.N., Kourkoumelis N. et al. // Polyhedron. 2014. V. 67. P. 89.
Arda M., Ozturk I.I., Banti C.N. et al. // RSC Adv. 2016. V. 6. P. 29026.
Guo Y.-C., Ma Q.-G., Chen S.-Y. et al. // Chin. J. Struct. Chem. 2015. V. 34. № 7. P. 1028.
Venkatachalam V., Ramalingam K., Casellato U., Graziani R. // Polyhedron. 1997. V. 16. № 7. P. 1211.
Monteiro O.C., Nogueira H.I.S., Trindade T., Motevalli M. // Chem. Mater. 2001. V. 13. № 6. P. 2103.
Lai C.S., Tiekink E.R.T. // Z. Kristallogr. 2007. V. 222. № 10. P. 532.
Sun R.-Z., Guo Y.-C., Liu W.-M. et al. // Chin. J. Struct. Chem. 2012. V. 31. № 5. P. 655.
Иванов А.В., Егорова И.В., Иванов М.А. и др. // До-кл. РАН. 2014. Т. 454. № 2. С. 190 (Ivanov A.V., Egorova I.V., Ivanov M.A. et al. // Dokl. Phys. Chem. 2014. V. 454. № 1. P. 16).
Sivasekar S., Ramalingam K., Rizzoli C., Alexander N. // Inorg. Chim. Acta. 2014. V. 419. P. 82.
Chauhan R., Chaturvedi J., Trivedi M. et al. // Inorg. Chim. Acta. 2015. V. 430. P. 168.
Gowda V., Sarma B., Laitinen R.S. et al. // Polyhedron. 2017. V. 129. P. 123.
Иванов А.В., Герасименко А.В., Егорова И.В. и др. // Коорд. химия. 2018. Т. 44. № 4. С. 266 (Ivanov A.V., Gerasimenko A.V., Egorova I.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 8. P. 518).https://doi.org/10.1134/S1070328418080043
Yin H., Wang C. // Appl. Organomet. Chem. 2004. V. 18. № 4. P. 195.
Yin H.D., Wang C.H., Ma C.L. // Chem. Res. Chin. Univ. 2004. V. 20. № 5. P. 565.
Yin H.D., Wang C.H., Wang L. // Chin. J. Struct. Chem. 2004. V. 23. № 10. P. 1201.
Yin H.D., Hong M., Wang C.H. // Ind. J. Chem. A. 2005. V. 44. № 7. P. 1401.
Li F., Yin H.-D., Wang D.-Q. // Acta Crystallogr. E. 2007. V. 63. № 6. P. m1577.
Kun W.N., Mlowe S., Nyamen L.D. et al. // Chem. Eur. J. 2016. V. 22. № 37. P. 13127.
Raston C.L., Rawbottom G.L., White A.H. // Dalton Trans. 1981. № 6. P. 1352.
Raston C.L., Rawbottom G.L., White A.H. // Dalton Trans. 1981. № 6. P. 1372.
Koh Y.W., Lai C.S., Du A.Y. et al. // Chem. Mater. 2003. V. 15. № 24. P. 4544.
Jamaluddin N.A., Baba I., Halim S.N.A., Tiekink E.R.T. // Z. Kristallogr. NCS. 2015. V. 230. № 3. P. 239.
Бырько В.М. Дитиокарбаматы. М.: Наука, 1984. 341 с.
Ivanov A.V., Antzutkin O.N. // Top. Curr. Chem. 2005. V. 246. P. 271.
Pines A., Gibby M.G., Waugh J.S. // J. Chem. Phys. 1972. V. 56. № 4. P. 1776.
Ratcliffe C.I., Ripmeester J.A., Tse J.S. // Chem. Phys. Lett. 1983. V. 99. № 2. P. 177.
APEX2 (version 1.08), SAINT (version 7.03), SADABS (version 2.11), SHELXTL (version 6.12). Madison (WI, USA): Bruker AXS Inc., 2004.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Казицына Л.A., Куплетская Н.Б. Применение УФ-, ИК-, ЯМР- и масс-спектроскопии в органической химии. М.: Изд-во Моск. ун-та, 1979. 240 с.
Yin H.D., Li F., Wang D. // J. Coord. Chem. 2007. V. 60. № 11. P. 1133.
Brown D.A., Glass W.K., Burke M.A. // Spectrochim. Acta. A. 1976. V. 32. № 1. P. 137.
Kellner R., Nikolov G.S., Trendafilova N. // Inorg. Chim. Acta. 1984. V. 84. № 2. P. 233.
Тарасевич Б.Н. ИК спектры основных классов органических соединений. М.: МГУ им. М.В. Ломоносова, 2012. 55 с.
Беллами Л. Инфракрасные спектры сложных молекул. М.: ИЛ, 1963. 592 с.
Накамото К. Инфракрасные спектры неорганических и координационных соединений. М.: Мир, 1991. 536 с.
Rogers R.D., Bond A.H., Aguinaga S. // J. Am. Chem. Soc. 1992. V. 114. № 8. P. 2960.
Feyand M., Köppen M., Friedrichs G., Stock N. // Chem. Eur. J. 2013. V. 19. № 37. P. 12537.
Senevirathna D.C., Werrett M.V., Blair V.L. et al. // Chem. Eur. J. 2018. V. 24. № 26. P. 6722.
Адонин С.А., Горох И.Д., Самсоненко Д.Г. и др. // Коорд. химия. 2016. Т. 42. № 11. С. 659 (Adonin S.A., Gorokh I.D., Samsonenko D.G. et al. // Russ. J. Coord. Chem. 2016. V. 42. № 11. P. 695).https://doi.org/10.1134/S1070328416110014
Заева А.С., Иванов А.В., Герасименко А.В., Сергиенко В.И. // Журн. неорган. химии. 2015. Т. 60. № 2. С. 243 (Zaeva A.S., Ivanov A.V., Gerasimenko A.V., Sergienko V.I. // Russ. J. Inorg. Chem. 2015. V. 60. № 2. P. 203).https://doi.org/10.1134/S0036023615020229
Адонин С.А., Самсоненко Д.Г., Соколов М.Н., Федин В.П. // Коорд. химия. 2016. Т. 42. № 1. С. 29 (Adonin S.A., Samsonenko D.G., Sokolov M.N., Fedin V.P. // Russ. J. Coord. Chem. 2016. V. 42. № 1. P. 27).https://doi.org/10.1134/S1070328416010012
Лосева О.В., Родина Т.А., Иванов А.В. и др. // Изв. АН. Сер. хим. 2019. № 4. С. 782 (Loseva O.V., Rodina T.A., Ivanov A.V. et al. // Russ. Chem. Bull., Int. Ed. 2019. V. 68. № 4. P. 782. https://doi.org/10.1007/s11172-019-2486-3
Lin J.-C., Sharma R.C., Chang Y.A. // J. Phase Equilibr. 1996. V. 17. № 2. P. 132.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия