Координационная химия, 2019, T. 45, № 10, стр. 611-616
Синтез, строение и термораспад комплексов металлов с N-гетеРОциклическим лигандом
С. С. Шаповалов 1, *, О. Г. Тихонова 1, М. О. Григорьева 1, И. В. Скабицкий 1, Н. П. Симоненко 1
1 Институт общей и неорганический химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: schss@yandex.ru
Поступила в редакцию 24.04.2019
После доработки 07.05.2019
Принята к публикации 20.05.2019
Аннотация
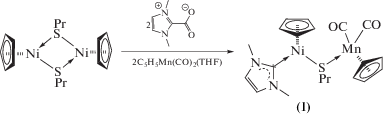
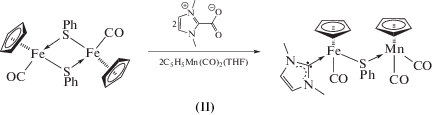
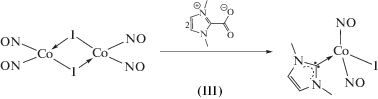
Получены и структурно охарактеризованы гетерометаллические халькогенидные комплексы никеля и железа (η5-C5H5)Ni(MeIm)S(µ2-SnPr)Mn(CO)2(η5-C5H5) (I) и (η5-C5H5)Fe(MeIm)(CO)(µ2-SPh)Mn(CO)2(η5-C5H5) (II), а также нитрозильный комплекс кобальта (MeIm)Co(NO)2I (IIIa, IIIб) (CIF files CCDC № 1911962 (I), 1911963 (II), 1911964 (IIIa) 1911965 (IIIb)). По данным ТГА–ДСК, для комплекса I теряется органическая часть молекулы с образованием остатка состава NiMnS, при термораспаде комплекса II происходит образование ферроцена.
N-гетероциклические карбены (NHC), среди которых особенно распространены производные имидазол-2-илидена – перспективные лиганды как для комплексов, применяемых в органическом синтезе и гомогенном катализе [1, 2], так и для стабилизации наночастиц [3]. Основными подходами к синтезу соединений на основе NHC являются депротонирование соответствующих солей имидазола сильными основаниями [4] и переметаллирование комплексов серебра с карбеновыми лигандами [5]. Оба этих подхода требуют введения в реакционную смесь дополнительных реагентов или проведения предварительной стадии. Более удобный способ синтеза производных диметилимидазолия – декарбоксилирование 1,3-диметилимидазол-2-карбоксилата (MeImCO2) в присутствии комплексов переходных металлов [6].
Возможность термического удаления органических лигандов позволяет использовать гетерометаллические комплексы в качестве прекурсоров неорганических материалов сложного состава и высокой гомогенности, зачастую недостижимых другими способами [7]. Широкий интерес к гетерометаллическим материалам вызван наличием кооперативного взаимодействия между двумя и более металлическими центрами, которое может повышать селективность и эффективность катализа, а также инициировать реакции, невозможные при наличии одного металлического центра [8].
Для стабилизации наноразмерных структур и материалов используют различные NHC. Так, 1,3-диметил-4,5-диундецилимидазол-2-илиден (LC-IMe), содержащий длинные углеводородные заместители, при взаимодействии с комплексом трис(2-норборнен)платина(0) стабилизирует частицы платины размером 2 нм [9]. На основе NHC, содержащих объемные заместители при атомах азота, и комплекса Ru(COD)(COT) (COD = = 1,5-циклооктадиен, COT = циклооктатераен) были получены наночастицы диаметром 1.2–1.4 нм [10]. Также в качестве лиганда можно использовать 1,3-диметилимидазол-2-илиден (IMe): взаимодействие Ni(COD)2 с MeImCO2 приводит к образованию наночастиц никеля с размерами 2–4 нм [11].
В настоящей работе изучены особенности термораспада комплексов, содержащих MeIm на примере ряда карбонильных и нитрозильных комплексов железа, кобальта и никеля, в том числе и гетерометаллических.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом и выделением соединений, проводили в атмосфере аргона и в абсолютированных растворителях. Соединения MeImCO2 [6], (η5-C5H5)Ni(MeIm)SnPr [12], [Co(NO)2I]2 [13] получали по литературным методикам. Коммерческий (η5-C5H5)Mn(CO)3 использовали без дополнительной очистки. Химический анализ выполняли на ЕА3000 CHNS-анализаторе (Euro Vector). Для ИК-спектроскопии использовали ИК-Фурье-спектрометр Bruker Alpha с приставкой Platinum ATR. Синхронный (ТГА–ДСК) термический анализ полученных комплексов выполняли с использованием термоанализатора SDT Q-600; контролируемый нагрев производили в Al2O3-тиглях в интервале 20–600°С со скоростью 10°/мин в токе аргона (скорость потока 250 мл/мин); массу исходной навески варьировали в диапазоне 3.5–10.5 мг.
Синтез (η5-C5H5)Ni(MeIm)(μ2-SnPr)Mn(CO)2-(η5-C5H5) (I). Желтый раствор 0.157 г (0.770 ммоль) (η5-C5H5)Mn(CO)3 в THF (30 мл) облучали УФ-светом при –40°С в течение 1 ч. Полученный красный раствор отфильтровывали к коричневому маслу (η5-C5H5)Ni(MeIm)SnPr, полученному из 0.150 г (0.377 ммоль) [(η5-C5H5)NiSPr]2 и 0.117 г (0.836 ммоль) MeImCO2, растворитель удаляли при пониженном давлении. Полученный зелено-коричневый масляный остаток промывали гексаном (3 × 5 мл), сушили и экстрагировали толуолом (3 × 10 мл). Полученный зеленый раствор фильтровали, концентрировали и кристаллизовали в смеси толуол–гексан при –26°С. Выход зеленых кристаллов I 0.219 г (62%)
| Найдено, %: | C 51.42, | H 4.84, | N 5.20, | S 6.27. |
| Для C20H25N2O2SMnNi (М = 471.12) | ||||
| вычислено, %: | C 50.99, | H 5.35, | N 5.25, | S 6.81. |
ИК (НПВО; ν, см–1): 2953 сл, ш, 1891 с, ш, 1803 о. с, ш, 1454 ср, ш, 1397 ср, ш, 1265 сл, 1222 ср, 1126 сл, 1011 сл, ш, 897 сл, 834 ср, 781 о. с, 728 о. с, ш, 675 с, 659 с, 612 о. с, 588 о. с, ш, 530 ср, 478 ср, 460 ср.
Синтез (η5-C5H5)Fe(CO)(MeIm)(μ2-SPh)Mn(CO)2-(η5-C5H5) (II). К коричневому раствору 0.309 г (0.600 ммоль) [(η5-C5H5)Fe(CO)SPh]2 в смеси толуола (8 мл) и MeCN (8 мл) добавляли 0.167 г (1.20 ммоль) тщательно размолотого Me2ImCO2 и кипятили в течение 2.5 ч, затем растворители удаляли при пониженном давлении. К остатку коричневого цвета отфильтровывали красный раствор, полученный облучением УФ-светом при –40°С в течение 1 ч желтого раствора 0.246 г (1.206 ммоль) (η5-C5H5)Mn(CO)3 в 35 мл THF. Растворитель удаляли при пониженном давлении. Полученный красно-коричневый масляный остаток промывали гексаном (2 × 10 мл), сушили и экстрагировали СН2Cl2. Полученный зелено-коричневый раствор фильтровали, концентрировали и кристаллизовали в смеси CH2Cl2–гексан при –26°С. Выход зеленых кристаллов 0.426 г (67%).
Монокристалл, пригодный для РСА вырастили диффузией паров пентана в насыщенный раствор комплекса в CH2Cl2.
| Найдено, %: | C 54.53, | H 4.24, | N 5.47, | S 5.98. |
| Для C24H23N2O3SMnFe (М = 530.29) | ||||
| вычислено, %: | C 54.36, | H 4.37, | N 5.28, | S 6.04. |
ИК (НПВО; ν, см–1): 3083 сл, ш, 1917 с, 1894 с, ш, 1824 о. с, ш, 1615 ср, ш, 1557 ср, 1453 с, ш, 1423 с, 1398 ср, 1364 ср, 1310 ср, ш, 1265 ср, 1223 ср, 1153 ср, 1118 ср, 1109 ср, 1084 ср, ш, 1062 ср, 1023 ср, 997 ср, 905 сл, ш, 842 ср, 818 с, 794 с, ш, 736 с, 713 с, 692 с, 674 о. с, ш, 658 о. с, 610 о. с, 588 о. с, 576 о. с, 558 о. с, ш, 542 о. с, 490 о. с, 473 с.
Синтез CoI(NO)2(MeIm) (IIIa, IIIб). К коричневому раствору 0.831 г (1.689 ммоль) [Co(NO)2I]2 в смеси толуола (8 мл) и MeCN (8 мл) добавляли 0.523 г (3.736 ммоль) тщательно размолотого MeImCO2 и кипятили при перемешивании в течение 30 мин. Далее растворитель удаляли в вакууме, остаток экстрагировали 2 × 20 мл СН2Cl2. Полученный коричневый раствор фильтровали, растворитель удаляли в вакууме, остаток экстрагировали диэтиловым эфиром с образованием темно-коричневого раствора, из которого при выдерживании при –26°С образовались черные кристаллы. Выход черных кристаллов 0.738 г (64%).
| Найдено, %: | C 17.94, | H 2.51, | N 16.60. |
| Для C5H8N4O2ICo (М = 341.98) | |||
| вычислено, %: | C 17.56, | H 2.36, | N 16.38. |
ИК (НПВО; ν, см–1): 3149 о. сл, 3112 о. сл, 3097 о. сл, 2992 о. сл, 2951 о. сл, ш, 2924 о. сл, 2870 о. сл, ш, 2851 о. сл, 1819 о. с, 1760 о. с, ш, 1574 о. сл, 1460 ср, 1399 о. сл, 1385 о. сл, 1337 о. сл, 1318 о. сл, 1264 о. сл, 1231 ср, 1129 о. сл, 1082 о. сл, 1017 о. сл, 843 о. сл, 750 сл, 742 сл, 669 о. сл, 640 о. сл, 591 о. сл.
РСА выполнен на дифрактометре Bruker APEX II CCD. Поглощение учтено методом множественного измерения эквивалентных отражений по программе TWINABS [14] для комплекса I и SADABS [15] для комплексов II и III. Структуры I–III определены прямым методом и уточнены методом наименьших квадратов относительно F 2 в анизотропном приближении неводородных атомов с использованием пакетов программ SHELX-2014 [16, 17] и OLEX2 [18]. Положения атомов Н рассчитаны геометрически. Кристаллографические данные и параметры уточнения структуры I–III приведены в табл. 1. Основные длины связей и валентные углы в I–III приведены в подписях к рис. 1–3. Структура I уточнялась как двойник с соотношением компонент 0.752(2) : 0.248(2). Структурный вклад разупорядоченых сольватных молекул CH2Cl2 в кристалле II ∙ 0.5CH2Cl2 удален с помощью процедуры SQUEEZE, реализованной в программе PLATON [19]. Координаты разупорядоченных атомов циклопентадиенильного лиганда в комплексах I и II уточнены с использованием изотропного приближения для менее заселенной компоненты и ограничениями для расстояний и тепловых параметров (инструкции SAME и DELU).
Таблица 1.
Кристаллографические данные и параметры уточнения структуры комплексов I–III
| Параметр | Значение | |||
|---|---|---|---|---|
| I | II | IIIа | IIIб | |
| Брутто-формула | C20H25N2NiO2SMn | C24H23N2O3SMnFe | C5H8N4O2ICo | C5H8N4O2ICo |
| M | 471.13 | 530.29 | 341.98 | 341.98 |
| Излучение (λ, Å) | MoKα (λ = 0.71073) | |||
| Температура, K | 150 | |||
| Сингония | Моноклинная | Моноклинная | Триклинная | Моноклинная |
| Пр. гр. | P21/n | P21/c | P1 | P21/c |
| а, Å | 8.3799(2) | 15.5789(4) | 7.5133(2) | 11.4540(3) |
| b, Å | 26.6815(9) | 10.0528(3) | 7.9940(2) | 13.1697(3) |
| c, Å | 9.5982(3) | 15.5957(5) | 9.5078(2) | 13.9285(3) |
| α, град | 90 | 90 | 76.9750(10) | 90 |
| β, град | 111.1661(9) | 98.8140(10) | 70.1320(10) | 95.4294(8) |
| γ, град | 90 | 90 | 82.5590(10) | 90 |
| V, Å3 | 2001.27(10) | 2413.62(12) | 522.37(2) | 2091.63(9) |
| Z | 4 | 4 | 2 | 8 |
| ρ(выч.), г/cм–3 | 1.564 | 1.459 | 2.174 | 2.172 |
| μ, мм–1 | 1.693 | 1.238 | 4.574 | 4.569 |
| F(000) | 976.0 | 1088.0 | 324.0 | 1296.0 |
| Интервал сканирования, град | 4.8–55.82 | 4.838–65.638 | 4.644–61.202 | 3.572–55.86 |
| Тип сканирования | ω | |||
| Независимых отражений (N1) | 4744 (Rint = 0.0510) | 7574 (Rint = 0.0408) | 2941 (Rint = 0.0189) | 4957 (Rint = 0.0246) |
| Отражений с I >2σ(I) (N2) |
4177 | 7574 | 2841 | |
| Число уточняемых араметров | 269 | 312 | 120 | 240 |
| GOОF (F 2) | 1.134 | 1.064 | 1.167 | 1.174 |
| R1 для N2 | 0.0374 | 0.0457 | 0.0168 | 0.0177 |
| wR2 для N1 | 0.0929 | 0.0861 | 0.0352 | 0.0364 |
| Δρmax/Δρmin, e Å–3 | 0.41/–0.40 | 0.46/–0.40 | 0.42/–0.48 | 0.38/–0.30 |
Рис. 1.
Молекулярная структура I. Некоторые длины связей и валентные углы: Ni(1)–C(1) 1.884(3), Ni(1)–S(1) 2.2087(7), Mn(1)–S(1) 2.3308(7), Mn(1)–C(14) 1.758(3), Mn(1)–C(15) 1.761(3) Å и C(1)Ni(1)S(1) 93.96(8)°, C(15)Mn(1)S(1) 95.55(8)°, C(14)Mn(1)S(1) 96.90(9)°, Ni(1)S(1)Mn(1) 112.33(3)°, C(11)S(1)Ni(1) 102.60(9)°, C(11)S(1)Mn(1) 109.44(9)°.
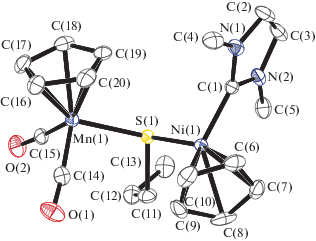
Рис. 2.
Молекулярная структура II. Некоторые длины связей и валентные углы: Fe(1)–S(1) 2.2920(5), Fe(1)–C(2) 1.961(2), Fe(1)–C(1) 1.743(2), Mn(1)–S(1) 2.3293(6), Mn(1)–C(12) 1.766(2), Mn(1)–C(13) 1.757(2) Å и C(1)Fe(1)S(1) 90.73(7)°, C(2)Fe(1)S(1) 88.96(6)°, C(12)Mn(1)S(1) 97.37(7)°, C(13)Mn(1)S(1) 96.14(7)°, Fe(1)S(1)Mn(1) 122.51(2)°, C(19)S(1)Fe(1) 107.82(7)°, C(19)S(1)Mn(1) 104.71(7)°.
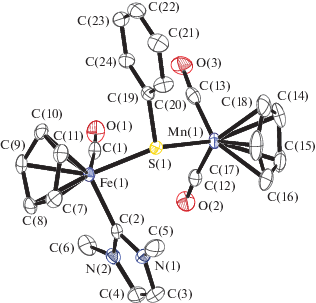
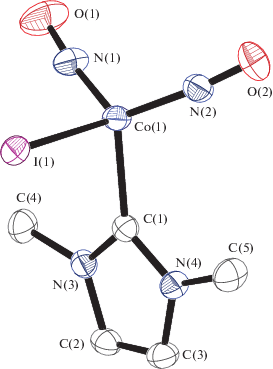
Рис. 3.
Молекулярная структура III. Некоторые длины связей и валентные углы: Co(1)– I(1) 2.6019(3), Co(1)–N(2) 1.6605(15), Co(1)–N(1) 1.6600(15), Co(1)–C(1) 1.9814(16) Å и N(1)Co(1)N(2) 121.35(7)°, C(1)Co(1)I(1) 94.80(4)°, N(1)Co(1)I(1) 106.91(6)°, N(2)Co(1)I(1) 106.66(5)°.
Координаты атомов и другие параметры структуры I–III депонированы в Кембриджском банке структурных данных (ССDC № 1911962 (I), 1911963 (II), 1911964 (IIIa) 1911965 (IIIb); http:// www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплексы, содержащие тиолатные лиганды и их аналоги, содержащие селен и теллур, можно использоваться как строительные блоки для синтеза гетерометаллических соединений за счет наличия неподеленных пар на атоме халькогена. Взаимодействие комплекса (η5-C5H5)Ni(MeIm)SnPr с аддуктом (η5-C5H5)Mn(CO)2(THF), полученным при облучении раствора (η5-C5H5)Mn(CO)3 в THF УФ-светом, приводит к образованию комплекса (η5-C5H5)Ni(MeIm)(μ2-SnPr)Mn(CO)2(η5-C5H5) (I), содержащий мостиковый тиолатный лиганд.
В ИК-спектре комплекса I наблюдаются полосы при 1891 и 1803 cм–1, соответствующие валентным колебаниям карбонильных групп. По данным РСА, длина связи Ni–S в I составляет 2.2087(7) Å, что меньше суммы ковалентных радиусов (СКР = rNi + rS = 2.29 Å), но больше аналогичной длины связи в схожем комплексе (η5-C5H5)Ni(MeIm)(μ2-SnPr)W(CO)5 (2.1933(7) Å) [12]. Это можно объяснить тем, что фрагмент (η5-C5H5)Mn(CO)2 более сильный акцептор по сравнению c M(CO)5 (M = Cr, Mo, W). Поскольку исходное соединение (η5-C5H5)Ni(MeIm)SnPr не было выделено в виде монокристаллов, длину связи Ni–S без дополнительной координации мы можем сравнить с соответствующим значением в трифенилфосфиновом комплексе (η5-C5H5)Ni(PPh3)SPh (Ni–S 2.192(l) Å) [20]. Длины связей Ni–С c карбеновым лигандом и Mn–S составляют 1.884 и 2.3308 Å соответственно, что меньше СКР (rNi + + rC = 1.97 Å, rMn + rS = 2.44 Å [21]). Это свидетельствует о кратности указанных связей. В аналогичной реакции получен гетерометаллический комплекс железа (η5-C5H5)Fe(CO)(MeIm)(μ2-SPh)Mn(CO)2(η5-C5H5) (II).
В ИК-спектре комплекса II наблюдается полосы при 1917, 1894 и 1824 cм–1, которые можно отнести к валентным колебания СО-групп. Из ИК-спектров комплексов I и II видно, что фрагмент (η5-C5H5)Ni(MeIm) более донорный по сравнению с его изолобальным аналогом (η5-C5H5)Fe(CO)(MeIm). В ИК-спектре комплекса сходного строения с мостиковой фенилтеллуридной группой также наблюдается смещение полос СО-групп в область больших частот (1948, 1900 и 1839 см–1 в KBr) [22]. В фотохимической реакции комплекса (η5-C5H5)Fe(CO)2SEt c (η5-C5H4Me)Mn(CO)2(THF) образуется гетерометаллический биядерный комплекс с тиолатным мостиком (η5-C5H5)Fe(μ-CO)(μ-SEt)Mn(CO)2(η5-C5H4Me), в котором присутствует связь Fe–Mn (2.617(2) Å), а частоты колебаний карбонильных групп в ИК-спектре составляют 1958, 1897 и 1774 cм–1 [23]. В этом случае смещение полос валентных колебаний обусловлено появлением связи металл–металл.
По данным РСА, длина связи Fe–S в II составляет 2.2920(5), Mn(1)–S(1) 2.3293(6), Fe(1)–C(1)карб 1.743(2) Å, что меньше соответствующих значений СКР (rFe + rS = 2.37 Å, rFe + rC = 1.81 Å, rMn + rS = 2.44 Å). Это свидетельствует о частичной кратности вышеуказанных связей.
Величины углов MnSM (M = Ni, Fe) составляют 112.33(3)° для I и 122.51(2)° для II. Сумма углов при атоме серы составляет 324° для I и 335° для II, что меньше 360° для катионного комплекса [(η5-C5H5)Mn(CO)2(μ-SC6H4NO2)(η5-C5H5)Mn(CO)2]-PF6 [24], в котором постулируется четырехэлектронная трехцентровая связь Mn–S–Mn с короткими связями Mn–S (2.178(3) Å).
При взаимодействии димерного нитрозильного комплекса [Co(NO)2I]2 с MeImCO2 происходит образование мономерного иодидного комплекса CoI(NO)2(MeIm) (III).
Комплекс III кристаллизуется из диэтилового эфира как смесь кристаллов двух полиморфов IIIa и IIIб, отличающихся упаковкой, но не молекулярным строением. По данным РСА, длины связи Co–C и Co–I составляют 1.981(2) и 2.6019(3) Å соответственно, в триклинной модификации и 1.975(2), 1.978(2), 2.6039(3), 2.6130(3) Å для двух независимых молекул в моноклинной модификации.
По данным ИК-спектроскопии, частоты валентных колебаний нитрозильных групп в III (1819 и 1760 см–1) смещены в область меньших частот по сравнению с таковыми в трифенилфосфиновом аналоге CoI(NO)2(PPh3) (1830 и 1771 см–1). Это свидетельствует о том, что MeIm более сильный донор, (Co–I 2.572(1) Å, углы NCoN и NCoI 121.73° и 113.74° (средн.) [25].
По данным ТГА–ДСК, термораспад комплекса I происходит ступенчато, но без четких границ: при 119–293°С теряется органическая часть с образованием остатка состава NiMnS. Для комплекса II на первой стадии термораспала (87–122°С) теряется одна СO-группа, на второй (122–168°С) происходит отщепление двух оставшихся молекул СO и фенильного заместителя мостикового тиолата, затем (168–206°С) удаляется лиганд MeIm, и при 206–309°С происходит отщепление ферроцена с образованием остатка состава MnS (общая потеря массы: эксп. 82.47%, расч. 82.91%). Подобное образование ферроцена известно при термораспаде ряда комплексов: (η5-C5H5)2Fe2(CO)4, (η5-C5H5)Fe(CO)2X (X = Br, Cl, I) [26], [(η5-C5H5)Fe(CO)SPh]2 [27]. Для подтверждения данных ТГА–ДСК было проведено нагревание образца II в капилляре в атмосфере аргона. В процессе термолиза происходила сублимация желтого вещества, которое охарактеризовано как ферроцен по данным ТСХ. Для комплекса III термораспад также проходит ступенчато: на первой стадии (112–249°С) происходит удаление двух NO-групп, на второй (249–420°С) удаляется лиганд MeIm. Оставшийся остаток CoI продолжает терять избыточный иод, и этот процесс не останавливается даже при 600°С.
Приведенные данные свидетельствуют о том, что 1,3-диметилимидазол-2-илиден является удобным лигандом для синтеза координационных соединений – предшественников неорганических материалов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Sommer W.J., Weck M. // Coord. Chem. Rev. 2007. V. 251. P. 860.
Zhukhovitskiy A.V., MacLeod M.J., Johnson J.A. // Chem. Rev. 2015. V. 115. P. 11503.
Hopkinson M.N., Richter C., Schedler M. et al. // Nature. 2014. V. 510. P. 485.
Eide E.F. van der, Liu T., Camaioni D.M. et al. // Organometallics. 2012. V. 31. P. 1775.
Li Sh., Kee Ch.W., Huang K.W. et al. // Organometallics. 2010. V. 29. P. 1924.
Voutchkova A.M., Appelhans L.N., Chianese A.R., Crabtree R.H. // J. Am. Chem. Soc. 2005. V. 127. P. 17624.
Hungria A.B., Raja R., Adams R.D. et al. // Angew. Chem. Int. Ed. 2006. V. 45. P. 4782.
Thomas J.M., Raja R., Lewis D.W. // Angew. Chem. Int. Ed. 2005. V. 44. P. 6456.
Martínez-Prieto L.M., Rakers L., López-Vinasco A.M. et al. // Chem. Eur. J. 2017. V. 23. P. 12779.
Lara P., Martínez-Prieto L.M., Roselló-Merino M. et al. // Nano-Structures Nano-Objects. 2016. V. 6. P. 39.
Díaz de los Bernardos M., Pérez-Rodríguez S., Gual A. et al. // Chem. Commun. 2017. V. 53. P. 7894.
Shapovalov S.S., Pasynskii A.A., Skabitskii I.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 11. P. 701. https://doi.org/10.1134/S1070328418110076
Haymore B., Feltham R.D. // Inorg. Synth. 1973. V. 14. P. 81.
Sheldrick G.M. TWINABS (2012/1). Göttingen (Germany): Univ. of Göttingen, 2012.
Sheldrick G.M. SADABS (2016/2). Göttingen(Germany): Univ. of Göttingen, 2016.
Sheldrick, G.M. // Acta Crystalljgr. A. 2008. V. 64. P. 112.
Sheldrick, G.M. // Acta Crystalljgr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Spek A.L. // Acta Crystalljgr. D. 2009. V. 65. P. 148.
Darkwa J., Bothata F., Koczon L.M. // J. Organomet. Chem. 1993. V. 455. P. 235.
Cordero B., Gґomez V., Platero-Prats A. E. et al. // Dalton Trans. 2008. P. 2832.
Pasynskii A.A., Shapovalov S.S., Tikhonova O.G. et al. // Russ. J. Coord. Chem. 2015. V. 41. P. 741. https://doi.org/10.1134/S1070328415110068
Albano V.G., Busetto L., Monari M., Zanotti V. // J. Organom. Chem. 1999. V. 583. P. 28.
Lau P., Braunwarth H., Huttner G. et al. // Organometallics. 1991. V. 10. P. 3861.
Haymore B.L., Huffman J.C., Butler N.E. // Inorg. Chem. 1983. V. 22. P. 168.
Hallaman B.F., Pauson P.L. // J. Chem. Soc. 1956. P. 3030.
Максимов Ю.В., Матвеев В.В., Тюрин В.Д. и др. // Изв. AH СССР. Cер. хим. 1991. Т. 4. С. 771.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия