Координационная химия, 2019, T. 45, № 12, стр. 707-712
Образование нового необычного полимерного соединения кадмия с мостиковыми тиоцианат-ионами
Ю. В. Кокунов 1, *, В. В. Ковалев 1, **, М. А. Кискин 1, Г. А. Разгоняева 1, И. Л. Еременко 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: kokunov@igic.ras.ru
** E-mail: kovavlad@igic.ras.ru
Поступила в редакцию 29.05.2019
После доработки 26.06.2019
Принята к публикации 08.07.2019
Аннотация
При взаимодействии тиоцианата кадмия с 2-(метиламино)пиридином (2-Map) в растворе этилового спирта получен новый необычный координационный полимер [Cd2(NCS )4(2-Map)3]. Определена его структура (CIF file CCDC № 1917586). Кристаллы триклинные, пр. гр. P¯1. Соединение – координационный полимер. Элементарное звено полимера – биядерный фрагмент [Cd2 (NCS )4(2-Map)3], в котором атомы Cd связаны μ-NCS -мостиками. Атом Cd(1) достраивает свое окружение (CdS2N4) до октаэдрического координацией по апикальным положениям двумя пиридиновыми атомами N молекул 2-Map. Координационное окружение атома Cd(2) (CdS2N3) – тригональная бипирамида, дополненная пиридиновым атомом азота молекулы 2-Map. Некоординированные атомы азота NH‑групп участвуют во внутрицепочечных H-связях с атомами азота NCS -групп. Получен спектр люминесценции синтезированного соединения.
Структурное разнообразие и потенциальное применение в оптике, электрохимии, магнитных материалах, катализе продолжают вызывать большой интерес к изучению строения и синтеза новых модифицированных органическими молекулами галогенидов и тиоцианатов металлов [1]. Одним из методов модификации является координация N‑гетероциклов к иону металла [2]. Кадмий – один из наиболее используемых металлов при получении полиядерных соединений различного типа. Его КЧ и стереохимия изменяются от 4 до 8 и, как правило, определяются природой лигандов.
Большое внимание в последние два десятилетия привлекают тиоцианатные соединения кадмия. Как известно, тиоцианат-ион является амбидентатным лигандом и может присоединяться к ионам металлов (например, Zn, Cd, Hg) атомом N или S или тем и другим одновременно, проявляя мостиковые свойства [3]. Многие из соединений кадмия находят применение для хранения газов, создания сенсоров, в получении материалов с нелинейными оптическими свойствами, в люминесценции. В последние годы исследования сфокусированы на создании галогенидных и тиоцианатных полиядерных соединений металлов с N-гетероциклическими молекулами. Пиридин и его некоторые производные обычно не люминесцируют, но координационные полимеры с их участием, особенно с кадмием, проявляют люминесцентные свойства. Ионы кадмия способны влиять на длину волны эмиссии координированных органических соединений, что делает их хорошими кандидатами для люминесцентных материалов [4–6].
Известно, что стерические и электронные эффекты монодентатных органических лигандов оказывают модифицирующее действие на полимерные структуры тиоцианатов и их свойства [7, 8]. В большинстве случаев в тиоцианатных комплексах кадмия проявляется тенденция к образованию двойных NCS -мостиков. Монодентатные лиганды занимают две транс-позиции в октаэдрическом окружении иона Cd2+. В ряде работ были представлены получение и строение тиоцианатных комплексов Cd с N-гетероциклическими органическими молекулами. Их строение зависит от соотношения Cd(NCS)2 : N-гетероцикл. При соотношении 1 : 4 реализуются молекулярные комплексы с октаэдрическим окружением иона металла Cd(NCS)2(N-гетероцикл)4 [9–12]. При соотношении 1 : 2 образуются полимерные цепочки с двойными NCS-мостиками и октаэдрическим окружением ионов Cd2+, состоящих из четырех мостиковых NCS-групп и два нейтральных N-донорных лигандов. При этом для комплексов Cd(NCS)2(Py)2 и Cd(NCS)2(4-EtPy)2 отмечено образование трех разных форм – стабильной и двух метастабильных. Их различие заключается в способе координации тиоцианат-иона: 1) атомы S и N находятся в транс-положении; 2) все эти же атомы находятся в цис-положении; 3) эти же атомы занимают цис-цис-транс-позиции. Первая и вторая формы – метастабильные [10–12]. При уменьшении соотношения Cd(NCS)2 : N-гетероцикл до 1 : 1 образуется соединение иного строения – Cd(NCS)2(Py). Октаэдрический ион Cd2+ координирован двумя N-атомами и тремя S группы NCS и одним N-гетероциклом.
Введение в пиридиновое кольцо в α-положение донорного заместителя NH2 влияет на геометрические и электронные параметры лиганда, что может проявляться в изменении строения полиядерных соединений с его участием. Кроме того, появляется способность таких лигандов к образованию H-связей [13, 14]. Примеры использования таких лигандов в координационных соединениях кадмия крайне редки. Известно лишь одно соединение тиоцианата кадмия с α-аминопиридином, в котором два органических лиганда монодентатно присоединены к иону Cd2+ [15]. Получено соединение нитрата кадмия с α-аминопиридином [16]. При взаимодействии пивалата кадмия с 2-амино-4-метилпиридином выделен моноядерный комплекс с двумя монодентатными производными пиридина [14]. Исследовано взаимодействиe 2‑амино-5-нитропиридина с хлоридом и бромидом кадмия. В обоих случаях получены координационные полимеры с мостиковыми галогенид-ионами и монодентатно присоединенными лигандами за счет пиридинового атома азота [14, 17].
Основной интерес к тиоцианатным координационным полимерам 3d-металлов, которые за счет мостиков NCS-групп образуют одно- и двухмерные сетки, связан с исследованием влияния химических и структурных особенностей на магнитные свойства этих соединений. Однако получение мостиковых структур для ряда 3d-металлов иногда труднодостижимо. Поэтому изучение систем с тиоцианатами Zn и Cd может помочь пониманию особенностей химического состава и строения тиоцианатных полимеров металлов.
Мы исследовали взаимодействие тиоцианата кадмия с 2-(метиламино)пиридином (2-Map), в котором в положении 2 находится группа NHCH3. Получен координационный полимер [Cd2(NCS )4(2-Map)3]n (I), определена его структура и изучены фотолюминесцентные свойства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза нового соединения использовали Cd(NO3)2 ∙ 4H2O (>99%), 2-(метиламино)пиридин (99%), NH4NCS (“х. ч.”) и этанол (96%).
ИК-спектр твердого образца регистрировали на ИК спектрофотометре с Фурье-преобразованием Perkin-Elmer Spectrum 65 методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
Элементный анализ выполняли на автоматическом С,H,N,S-анализаторе Carlo Erba EA 1108.
Синтез I. Раствор Cd(NO3)2 ∙ 4H2O (0.95 г, 3.1 ммоль) в 6 мл этанола нагревали до 35–40°С и добавляли при перемешивании раствор 2-Map (0.33 г, 3.1 ммоль) в 4 мл этанола. Выпавший в результате реакции осадок не исследовали, а полученную суспензию сразу использовали для синтеза тиоцианатного комплекса. Для этого раствор NH4NCS (0.47 г, 6.2 ммоль) в 5 мл этанола нагревали до 35–40°С и постепенно добавляли при перемешивании к суспензии. Через 10 мин после полного растворения твердой фазы полученный прозрачный раствор выдерживали при комнатной температуре в течение 2 сут в условиях медленного испарения растворителя. Выделившиеся призматические кристаллы отделяли декантацией, промывали этанолом и высушивали на воздухе. По данным элементного анализа кристаллы отвечали комплексу кадмия состава [Сd2(NCS)4(2-Map)3]. Выход 35%.
| Найдено, %: | N 17.33; | C 33.64; | H 2.75; | S 15.31. |
| Для C22H24N10S4Cd2 | ||||
| вычислено, %: | N 17.86; | C 33.67; | H 3.08; | S 16.31. |
ИК-спектр (ν, см–1): 3415 сл. (νas(N–H(NH2))), 3351 сл (νs(N–H)), 2993 о.сл, 2927 о.сл, 2857 о.сл. и 2817 о.сл. (νsym(C–H)), 2124 ср, 2095 с и 2072 с (νas(NCS )), 1664 сл (δ(N–H)), 1611 с (ν(C=N и C=C)), 1571 с и 1527 ср (νas(N–H)), 1460 с, 1448 с (ν(C=N и C=C)), 1419 с, 1335 ср, 1288 с (δ(C–H)), 1165 ср и 1073 сл (ν(C=N)), 994 сл, 927 о.сл (δ(C–H)), 763 с, 738 ср, 637 сл, 508 ср.
РСА монокристалла соединения I выполнен на дифрактометре Bruker SMART APEX II (CD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор) [18]. Введена полуэмпирическая поправка на поглощение [19]. Структура расшифрована прямыми методами и уточнена полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Учтено разупорядочение одной из координированных молекул 2-Map по двум позициям с заселенностями 0.715(3) и 0.285(3) с использованием функций ограничения DFIX и FLAT. Расчеты проведены по комплексу программ SHELX-2014 [20]. Кристаллографические параметры и детали уточнения структуры I: М = 781.55, размер бесцветного кристалла 0.20 × 0.10 × 0.07 мм, T = 150(2) K, триклинная сингония, пр. гр. P$\bar {1}$, a = 8.87830(10), b = 11.4684(2), c = 15.8755(3) Å, α = 105.7300(10)°, β = 101.1300(10)°, γ = 103.6360(10)°, V = 1453.88(4) Å3, Z = 2, ρ(выч.) = 1.785 г/см3, μMo = 1.782 мм–1, θ = = 1.93°–30.57°, –11 ≤ h ≤ 12, –16 ≤ k ≤ 16, –22 ≤ l ≤ 22. Всего 18167 отражений, независимых 8834, отражений с I ≥ 2σ(I) 7613, Rint = 0.023, Tmin/Tmax = = 0.600/0.746, S = 0.957, R1 = 0.0497, wR2 = 0.0928 (для всех данных), R1 = 0.0407, wR2 = 0.0883 (для I ≥ 2σ(I)), Δρmin/Δρmax = –1.210/2.101 е Å–3.
Полный набор рентгеноструктурного эксперимента для I депонирован в Кембриджском банке структурных данных (№ 1917586; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РФА мелкокристаллического образца I выполнен на дифрактометре Bruker D8 Advance (CuKα, Ni-фильтр, LYNXEYE детектор, геометрия на отражение. Спектры возбуждения и эмиссии твердых образцов [Сd2(NCS)4(2-Map)3] регистрировали при комнатной температуре в видимом диапазоне спектра с использованием спектрометра Perkin-Elmer LS-55.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Координационное соединение I представляет собой 1D-координационный полимер. Элементарное звено полимера – биядерный фрагмент [Cd2(NCS )4(2-Map)3], в котором атомы Cd связаны NCS-мостиками (Cd···Cd 5.877, Cd–N 2.321(3), 2.326(3), Cd–S 2.5814(9), 2.7016(11) Å) (рис. 1). Фазовая чистота образца подтверждена методом РФА (рис. 2). Между собой биялерные фрагменты связаны в цепочку парами μ-NCS-мостиков (Cd···Cd 5.704, Cd–N 2.331(3), 2.366(3), Cd–S 2.5965(10), 2.7379(11) Å). Атом Cd(1) достраивает свое окружение (CdS2N4) до октаэдрического координацией по апикальным положениям двумя пиридиновыми атомами молекул 2-Map (Cd–N 2.366(3), 2.375(3) Å). Координационное окружение атома Cd(2) (CdS2N3) – тригональная бипирамида (τ = 0.79) [20] и дополнено пиридиновым атомом азота молекулы 2-Map (Cd–N 2.266(3) Å). Некоординированные атомы азота NH-групп участвуют во внутрицепочечных H-связях с атомами азота NCS-групп (NH···N) 3.071–3.173 Å, углы N–H···N 131°–150°) (рис. 1). Эти данные сравнимы с результатами для комплекса Cd(HPz)2(NCS)2, в котором NH-группа также находится в положении 2 к координированному атому N (NH···N 3.150 Å, углы NHN 131°) [21]. Основные длины связей и углов в соединении I приведены в табл. 1.
Рис. 1.
Фрагмент полимерной цепочки координационного соединения [Сd2(NCS)4(2-Map)3]. Коды симметрии: (A) x, –1 + y, z: (B) x, 1 + y, z.
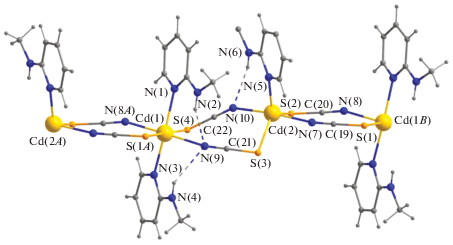
Рис. 2.
Порошковая рентгенограмма [Сd2(NCS)4(2-Map)3] (1 – эксперимент, 2 – расчетная диффрактограмма, λ = 1.541 Å).
Таблица 1.
Основные длины связей (Å) и валентные углы (град) в I
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| Cd(1)–N(8) | 2.326(3) | N(8)Cd(1)N(9) | 178.45(14) |
| Cd(1)–N(9) | 2.366(3) | N(8)Cd(1)N(3) | 84.06(14) |
| Cd(1)–N(3) | 2.366(3) | N(9)Cd(1)N(3) | 94.74(14) |
| Cd(1)–N(1) | 2.375(3) | N(8)Cd(1)N(1) | 88.46(14) |
| Cd(1)–N(3X)* | 2.403(7) | N(9)Cd(1)N(1) | 92.91(13) |
| Cd(1)–S(1) | 2.7016(11) | N(3)Cd(1)N(1) | 165.95(11) |
| Cd(1)–S(4) | 2.7379(11) | N(8)Cd(1)N(3) | 105.4(2) |
| Cd(2)–N(5) | 2.266(3) | N(9)Cd(1)N(3X) | 73.1(2) |
| Cd(2)–N(7) | 2.321(3) | N(1)Cd(1)N(3X) | 164.3(2) |
| Cd(2)–N(10) | 2.331(3) | N(8)Cd(1)S(1) | 92.46(8) |
| Cd(2)–S(2) | 2.5814(9) | N(9)Cd(1)S(1) | 86.77(9) |
| Cd(2)–S(3) | 2.5965(10) | N(3)Cd(1)S(1) | 99.38(9) |
| N(1)–C(1) | 1.341(5) | N(1)Cd(1)S(1) | 92.79(8) |
| N(1)–C(5) | 1.349(5) | N(3A)Cd(1)S(1) | 79.7(2) |
| N(2)–C(1) | 1.362(6) | N(8)Cd(1)S(4A)** | 90.91(8) |
| N(2)–C(6) | 1.447(6) | N(9)Cd(1)S(4A) | 89.89(9) |
| N(3)–C(11) | 1.370(5) | N(3)Cd(1)S(4A) | 82.16(8) |
| N(3)–C(7) | 1.371(5) | N(1)Cd(1)S(4A) | 86.09(8) |
| N(4)–C(7) | 1.348(5) | N(3A)Cd(1)S(4A) | 100.6(2) |
| N(4)–C(11) | 1.424(7) | S(1)Cd(1)S(4) | 176.42(3) |
| N(3A)–C(11X) | 1.386(7) | N(5)Cd(2)N(7) | 90.66(11) |
| N(3A)–C(7X) | 1.384(7) | N(5)Cd(2)N(10) | 95.52(11) |
| N(4A)–C(7X) | 1.350(8) | N(7)Cd(2)N(10) | 173.80(12) |
| N(4A)–C(12X) | 1.34(3) | N(5)Cd(2)S(2) | 124.34(7) |
| N(5)–C(17) | 1.353(4) | N(7)Cd(2)S(2) | 92.55(8) |
| N(5)–C(13) | 1.361(4) | N(10)Cd(2)S(2) | 84.40(8) |
| N(6)–C(13) | 1.350(5) | N(5)Cd(2)S(3B)*** | 108.93(7) |
| N(6)–C(18) | 1.453(5) | N(7)Cd(2)S(3B) | 82.39(9) |
| N(7)–C(19) | 1.150(4) | N(10)Cd(2)S(3B) | 95.08(8) |
| N(8)–C(20) | 1.159(5) | S(2)Cd(2)(3B) | 126.57(4) |
| N(9)–C(21) | 1.151(5) | C(19)S(1)Cd(1) | 98.83(13) |
| N(10)–C(22) | 1.153(4) | C(20)S(2)Cd(2) | 100.34(13) |
| C(19)–S(1) | 1.641(3) | C(21)S(3)Cd(2B) | 100.05(12) |
| C(20)–S(2) | 1.644(4) | C(22)S(4)Cd(1A) | 94.96(12) |
| C(21)–S(3) | 1.643(3) | N(7)C(19)S(1) | 178.8(4) |
| C(22)–S(4) | 1.635(4) | N(8)C(20)S(2) | 177.8(4) |
| N(9)C(21)S(3) | 178.6(3) | ||
| N(10)C(22)S(4) | 179.5(3) |
Полученный координационный полимер I имеет необычную структуру, включающую одновременно 5- и 6-кординационные ионы кадмия. Как видно, уменьшение соотношения Cd : L c 1 : 2 до1 : 1.5 приводит к заметной структурной перестройке. У 6-координационного иона кадмия имеется четыре мостиковых NCS-группы, координирующие ион кадмия атомами N и S c транс-расположением одноименных атомов. Две транс-позиции в октаэдре занимают пиридиновые атомы азота. В 5-координационном фрагменте ион кадмия также имеет четыре мостиковые NCS-группы, однако только атомы азота находятся в транс-позиции, а угол SCdS имеет величину 126°. Расстояния Cd–N(NCS) в октаэдре 2.326–2.366 Å, а в 5-координационном фрагменте эти значения имеют близкие величины 2.32–2.331 Å. В тригональной бипирамиде экваториальную плоскость занимают два мостиковых атома S(NCS) и атом N(2-Map), в апикальных позициях находятся атомы N мостиковых NCS-групп. Расстояния Cd–S в октаэдрическом фрагменте равны 2.7016 и 2.7379 Å, а в тригональной бипирамиде они значительно короче (Cd–S 2.581 и 2.596 Å). В [11] при анализе строения изомеров [Cd(NCS)2(Рy)2] было отмечено, что в одном из них наблюдается разворот пиридиновых колец относительно друг друга. В нашем соединении такого эффекта не обнаружено, что, по-видимому, связано с образованием H-связей N–H···N, стабилизирующих структуру.
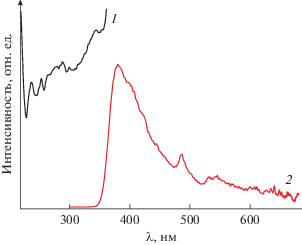
Исследования люминесцентных свойств твердого [Сd2(NCS)4(2-Map)3] при комнатной температуре показали, что спектр возбуждения при длине волны 380 нм имеет полосы 237, 253, 279, 290 и 345 нм (рис. 3). В спектре эмиссии при длине волны возбуждения 290 нм наблюдается широкая полоса с максимумом при 380 нм и плечами при 398, 420 и 444 нм и полосы меньшей интенсивности при 487, 530 и 546 нм. Согласно данным [5], координационные соединения кадмия с пиридиновыми лигандами показывают интенсивную флуоресценцию, обычно связываемую с n–π-переходами ароматического кольца органического лиганда при его координации к иону кадмия.
Рис. 3.
Спектры возбуждения (λвозб = 380 нм (1)) и эмиссии (λэм = 290 (2)) твердых образцов [Сd2(NCS)4(2-Map)3] при комнатной температуре.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Xu X., Chen R., Sun Q. et al. // Chem. Soc. Rev. 2014. V. 43. P. 3259.
Wang T.-G., Li S., Yu J.-H., Xu J.-Q. // Solid State Sciences. 2015. V. 41. P. 25.
Zhang H., Wang X., Zhang K., Teo B.K. // Coord. Chem. Rev. 1999. V. 183. P. 157.
Palion-Gazda J., Gryca I., Maron A., Machura B. // Polyhedron. 2017. V. 135. P. 109.
Chattopadhyay T., Banerjee S., Bana K.S. et al. // Polyhedron. 2008. V. 27. P. 2452.
Wavg R.-J., Hu Q.-S., Yu J.-H., Xu J.Q. // Polyhedron. 2017. V. 128. P. 160.
Banerjee S., Wu B., Sascahn P.-G. et al. // Inorg. Chim. Acta. 2005. V. 358. P. 535.
Saber M.R., Abu-Youssef M.A.M., Goher M.A.S. et al. // J. Mol. Struct. 2012. V. 1008. P. 17.
Wohlert S., Jess I., Nather C. // Inorg. Chim. Acta. 2013. V. 407. P. 243.
Wohlert S., Jess I., Nather C. // Z. Anorg. Allg. Chem. 2013. V. 639. P. 385.
Newmann T., Jess I., Nather C. // Z. Anorg. Allg. Chem. 2015. V. 641. P. 622.
Wohlert S., Boeckmann J., Jess I., Nather C. // Cryst. Eng. Commun. 2012. V. 14. № 17. P. 5412.
Zhou W.-W., Zhao W., Wei B. et al. // Inorg. Chim. Acta. 2012. V. 386. P. 17.
Гоголева Н.В., Шмелев М.А., Кискин М.А. и др. // Изв. АН. Cер. хим. 2016. № 5. С. 1198.
Jin Q.-H., Sun J.-J., Wu J.-Q. et al. // J. Chem. Crystallogr. 2010. V. 40. P. 310.
Tai X.S., Feng Y.-M. // Z. Kristallogr. NCS. 2008. V. 223. P. 39.
Seth S.K. // CrystEngCommun. 2013. V. 15. P. 1772.
SMART (Control) and SAINT (Integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
da Silva P.B., Frem R.C.G., Netto A.V.G. et al. // Inorg. Chem. Commun. 2006. V. 9. P. 235.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


