Координационная химия, 2019, T. 45, № 2, стр. 111-114
Металлоценилсодержащие и непредельные производные фуллеропирролидина: синтез и гидрирование
Н. В. Абрамова 1, *, В. А. Шмакова 1, А. П. Плешкова 1, В. И. Соколов 1
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: natalyaanv@yandex.ru
Поступила в редакцию 19.06.2018
После доработки 24.08.2018
Принята к публикации 03.07.2018
Аннотация
Изучена возможность гидрирования ферроценил-, цимантренил- и рутеноценилсодержащих производных N-метил-2-(3-хлорвинил)-фуллеропирролидина и N-метил-2-(2-стирил)-фуллеропирролидина водородом при катализе Pd/C. Синтезировано новое соединение N-метил-2-(3-хлорвинил-3-рутеноценил)-фуллеропирролидин.
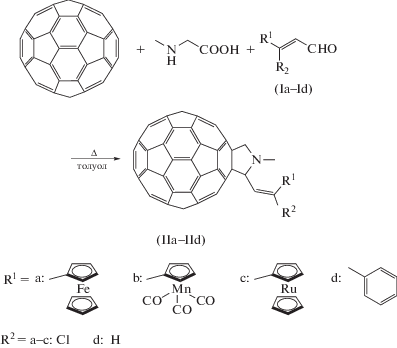
Функционализации фуллеренов посвящен большой объем публикаций, так как эта область исследований является молодой и активно развивающейся. Среди известных способов модификации фуллерена С60 следует выделить реакции циклоприсоединения как основной способ получения гетероциклических производных фуллерена. Наиболее известным методом получения фуллеропирролидинов является реакция Прато, заключающаяся в присоединении азометинилида, образующегося в результате взаимодействия альдегида и аминокислоты, по двойной связи фуллерена [1–3].
В литературе описан ряд соединений, содержащих металлоценильный и фуллереновый фрагменты. Среди них были выделены производные ферроцена [4, 5], рутеноцена [6], циклопентадиенилтрикарбонилмарганца (цимантрена), циклопентадиенилтрикарбонилрения [7–9] и некоторых других замещенных металлоценов [10, 11]. Молекулы, имеющие в своем составе фуллереновый и металлоценильный фрагменты, представляют особый интерес с точки зрения электрофизических и оптических свойств. Не менее интересны химические свойства этих соединений, обусловленные наличием кратных связей и металла в своем составе.
В настоящей работе мы исследовали возможность гидрирования хлорвинилметаллоцензамещенных (ферроцен-, цимантрен- и рутеноцен-) фуллеропирролидинов в разных условиях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее были получены и охарактеризованы N‑метил-2-(3-хлорвинил-3-ферроценил)-фуллеропирролидин (IIa) и N-метил-2-(3-хлорвинил-3-цимантренил)-фуллеропирролидин (IIb) [7]. Мы продолжили ряд производных металлоценов, получив новое соединение – N-метил-2-(3-хлорвинил-3-рутеноценил)-фуллеропирролидин (IIc) по реакции Прато (схема 1).
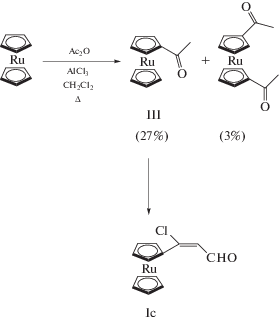
Исходный альдегид (2-рутеноценил-2-хлор-акролеин, Ic) получали известным способом [12] из моноацетилрутеноцена (III), синтезированного по модифицированной нами методике. Согласно известной методике [13], для ацилирования уксусным ангидридом использовали двукратный избыток рутеноцена, при этом выход III составил 14% при отсутствии побочных продуктов. Ввиду низкого выхода продукта монозамещения мы попробовали использовать реагенты в эквивалентном количестве и увеличить время реакции в 2 раза. В результате образовалась смесь моно- и диацетилрутеноцена в соотношении 9 : 1. Выход III составил 27%, что почти в 2 раза превышает первоначальный результат (схема 2).
Схема 1.
Схема 2. III и Ic – светл.
Соединение IIc было получено с выходом 12% и идентифицировано по спектрам ЯМР 1Н и 13С. Так, в спектре ЯМР 1Н наблюдаются сигналы от протонов пирролидинового цикла (один синглет от N-метильной группы (2.89 м. д.) и три дублета (4.17, 4.84 и 5.07 м. д.), дублет от протона винильной группы (6.44 м. д) и сигналы протонов незамещенного (4.38 м. д.) и замещенного (4.61, 4.65, 4.92, 5.02 м. д.) Ср-колец металлоценильного фрагмента. Примечательно, что в спектре IIc наблюдается сдвиг сигнала от пирролидинового протона в сильное поле относительно сигнала от протонов свободного циклопентадиенильного кольца, чего не наблюдается у остальных производных. Спектр ЯМР 13С содержит сигналы от атомов углерода N-метильной группы (40.2 м. д.), пирролидинового (69.0, 70.1 м. д.) и рутеноценового (72.0) фрагментов, винильной группы (71.5 м. д.) и фуллерена (120.7–147.4 м. д.).
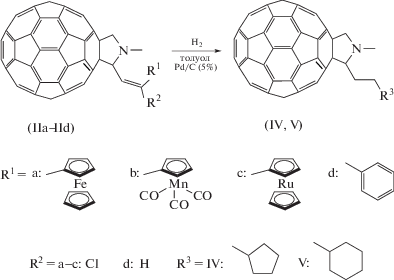
С целью изучения влияния фуллеренового и металлоценильного фрагментов в соединениях IIa–IIc на их химические свойства, мы проводили реакции их гидрирования. Согласно [14] производные ферроцена, содержащие дополнительную сопряженную двойную связь, восстанавливаются водородом до циклопентановых производных, причем сначала происходит восстановление свободной двойной связи, а затем циклопентадиенильного кольца. Мы предположили, что гидрирование хлорвинилметаллоценов в составе молекул фуллеропирролидинов будет протекать аналогичным путeм с образованием N-метил-2-[(β-циклопентил)этил]-фуллеропирролидина (IV) (схема 3).
Схема 3.
К сожалению, нам не удалось выделить соединение IV в индивидуальном виде методом колоночной хроматографии. Однако его присутствие в выделенной смеси и соотношение с исходным субстратом было определено по спектрам ЯМР 1H и MALDI-TOF.
При изучении гидрирования металлоценилсодержащих хлорвинил-фуллеропирролидинов мы обнаружили, что гидрирование в среде CF3C(O)OH приводит к разрушению соединения IIа, в то же время проведение реакции в растворе толуола при катализе Pd/C приводит к образованию смеси соединений IIа и IV в соотношении 2 : 3 соответственно. Этот вывод сделан на основании анализа спектра ЯМР 1Н. В спектре, помимо сигналов от протонов исходного соединения IIа, наблюдаются сигналы от протонов продукта гидрогенолиза IV: мультиплеты, принадлежащие протонам циклопентильного (0.55 м. д.) и этильного (0.97 м. д.) фрагментов, синглет от протонов N-метильной группы при 2.84 м. д., смещенный в более сильное поле относительно аналогичного сигнала в субстрате (2.91 м. д.) [7], и сигналы от пирролидиновых протонов (4.23, 4.96, 5.02 м. д.). Кроме того, молекулярный ион с массой 874, соответствующий продукту гидрогенолиза IV, наблюдается в спектре MALDI-TOF. С целью повышения выхода продукта IV мы провели реакцию при температуре 50°С, однако наблюдали разрушение пирролидинового фрагмента исходного фуллеропирролидина, о чем свидетельствует отсутствие сигналов от пирролидиновых протонов исходного соединения и появление сигналов от алифатических протонов в сильном поле в спектре ЯМР 1Н.
В случае аналогичной реакции с соединениями IIb и IIc мы не наблюдаем образование продукта гидрирования ни по двойной связи, ни по циклопентадиенильному кольцу. В то же время проведение гидрирования этих соединений с добавкой нескольких капель CF3C(O)OH приводит к образованию N-метил-2-[(β-циклопентил)этил]- фуллеропирролидина в различных соотношениях. Для сравнения мы также проводили гидрирование N-метил-2-(2-стирил)-фуллеропирролидина (IId), полученного по методике [9]. Результаты гидрирования IIa–IId в различных условиях представлены в табл. 1. Соединение IId не подвергается гидрированию с образованием продукта V в выбранных нами условиях.
Таблица 1.
Результаты гидрирования IIa–IId в различных условиях
| Субстрат | Время реакции, ч | Добавление CF3C(O)OH | Соотношение IIх : IV (V) (x = a–d) |
|---|---|---|---|
| IIa | 2 | 2 : 3 | |
| IIb | 6.5 | ||
| IIb | 6.5 | + | 2.5 : 1 |
| IIc | 8 | ||
| IIc | 10.5 | ||
| IIc | 10.5 | + | 1 : 5 |
| IId | 6.5 | ||
| IId | 6.5 | + |
Мы наблюдаем интересный результат: два близких по свойствам заместителя – рутеноцен и ферроцен, по-разному ведут себя в реакциях гидрирования. Ферроценильный заместитель частично восстанавливается в толуоле, но разрушается в среде CF3C(O)OH, в то время как рутеноценильный фрагмент успешно гидрируется в присутствии CF3C(O)OH. Наличие в молекуле цимантренильного фрагмента также способствует восстановлению в присутствии CF3C(O)OH. Стирильный фрагмент в тех же условиях оказался полностью инертным. Таким образом, металлоценильные группы в составе исследуемых молекул имеют решающее значение для гидрирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для проведения реакций использовали С60 99.9%-ной чистоты производства Института металлоорганической химии им. Г.А. Разуваева. 3‑Хлор-3-ферроценилакролеин, 3-хлор-3-цимантренилакролеин и соединения IIa и IIb получали по методике [7]. Coединение IId получали по методике [9].
Спектры ЯМР 1Н и 13С регистрировали на спектрометре Bruker 400 HX (в CDCl3, внутренний стандарт – TMS). Масс-спектры положительных ионов MALDI регистрировали на приборе Bruker Autoflex III с азотным лазером с λ = 337 нм.
Синтез IIc. К раствору 0.216 г (0.3 ммоль) С60 в 250 мл толуола в токе аргона добавляли 0.144 г (0.45 ммоль) Ic и 0.08 г (0.9 ммоль) саркозина. Смесь кипятили в течение 11.5 ч. Реакционную смесь упаривали и хроматографировали смесью толуол–гексан (1 : 1). Выход IIc 37.4 мг (12%).
Спектр ЯМР 1Н (CDCl3; δ, м. д.; J, Гц): 2.89 (с., 3Н, N–CH3); 4.17 (д., 1Н, CH2-пирролид.; J = 9.0); 4.38 (с., 5Н, Ср); 4.61 (м., 1Н, Ср); 4.65 (м., 1Н, Ср); 4.84 (д., 1Н, CH-пирролид., J = 9.0); 4.92 (м., 1Н, Ср); 5.01 (м., 1Н, Ср); 5.07 (д., 1Н, CH2-пирролид., J = 9.0); 6.44 (д., 1Н, СCl=СН, J = 9.0). Спектр ЯМР 13C (CDCl3; δ, м. д): 40.2 (N–CH3); 69.0 (C); 70.1 (CH2); 71.5 (CH=СCl); 72.0 (Cp); 120.7–147.4 (C60). Масс-спектр MALDI-TOF, m/z: 1067 [M–H]+.
Синтез III. К раствору 1.16 г (5 ммоль) рутеноцена в 100 мл CH2Cl2 добавляли 1.49 г (11.2 ммоль) AlCl3, смесь доводили до кипения и в течение часа прикапывали раствор 0.42 мл (4.42 ммоль) уксусного ангидрида в 25 мл CH2Cl2. После добавления уксусного ангидрида смесь кипятили в течение 2 ч. Выход III 0.3257 г (27%).
Спектр ЯМР 1Н (CDCl3; δ, м. д.): 2.29 (с., 3Н, –COCH3); 4.59 (с., 5Н, Cp); 4.78 (м., 2Н, Cp); 5.09 (м., 2Н, Cp).
Общая методика гидрирования соединений IIа–IId. В автоклав помещали 20 мг соединения (IIа–IId), растворяли в 2 мл толуола, добавляли катализатор Pd/C (5%) и 2 капли CF3C(O)OH (либо без добавления кислоты). Автоклав заполняли водородом (давление водорода 11 атм) и оставляли при комнатной температуре и перемешивании на 2–10.5 ч. Реакционную смесь отфильтровывали от катализатора, промывали и упаривали. Степень протекания гидрогенолиза определяли по спектрам ЯМР 1Н.
Масс-спектр MALDI-TOF IIa, m/z: 1022 [M–H]+.
ЯМР 1Н IV (CDCl3; δ, м. д.): 0.55 (м., 9Н, циклопентан); 0.97 (м., 4Н, CH2–CH2); 2.84 (с., 3Н, N–CH3); 4.23 (д., 1Н, пирролид.); 4.96(с., 1Н, пирролид.); 5.02 (д., 1Н, пирролид.). Масс-спектр MALDI-TOF, m/z: 874 [M–H]+.
ЯМР исследования проводили в Центре исследования строения молекул ИНЭОС РАН.
Список литературы
Prato M., Maggini M. // Chem. Res. 1998. V. 31. P. 519.
Maggini M., Scorrano G.J. // J. Am. Chem. Soc. 1993. V. 115. P. 9798.
Guldi D.M., Maggini M., Scorrano G., Prato M. // J. Am. Chem. Soc. 1997. V. 119. P. 974.
Kharisov B.I., Kharissova O.V., Gomez M.J. // Ind. Eng. Chem. Res. 2009. V. 48. P. 545.
Guldi D.M., Maggini M., Scorrano G., Prato M. // J. Am. Chem. Soc. 1997. V. 199. P. 974.
Oviedo J.J., de la Cruz P., Garin J. et al. // Tetrahedron Lett. 2005. V. 45. P. 4781.
Abramova N.V., Ginzburg A.G., Sokolov V.I. // Russ. Chem. Bull. 2010. V. 59. P. 1964.
Abramova N.V., Ginzburg A.G., Peregudov A.S. et al. // Russ. Chem. Bull. 2008. V. 57. P. 1967.
Abramova N.V., Peregudova S.M., Emel’yanova A.O. et al. // Russ. Chem. Bull. Int. Ed. 2007. V. 56. P. 361.
Sokolov V.I., Bashilov V.V, Dolgushin F.M. // Tetrahedron Lett. 2009. V. 50. P. 5347.
Sokolov V.I., Abramova N.V., Mutseneck E.V. et al. // Mendeleev Commun. 2007. V. 17. P. 202.
Hofer O., Schlogl K. // J. Organometal. Chem. 1968. V. 13. P. 443.
Rausch M.D., Fischer E.O., Grubert H. // J. Am. Chem. Soc. 1960. V. 82. P. 76.
Sokolov V.I., Troitskaya L.L., Khrushcheva N.S., Reutov O.A. // J. Organometal. Chem. 1989. V. 378. P. 227.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия