Координационная химия, 2019, T. 45, № 3, стр. 158-169
Темплатный синтез комплексов олова(IV) с тридентатными иминопиридиновыми лигандами
А. В. Пискунов 1, *, О. Ю. Трофимова 1, А. В. Малеева 1, А. В. Черкасов 1
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
* E-mail: pial@iomc.ras.ru
Поступила в редакцию 20.06.2018
После доработки 05.09.2018
Принята к публикации 24.08.2018
Аннотация
Методом темплатного синтеза на тетрахлориде олова с применением различных аминофенолов и α‑карбонилзамещенных пиридинов получены шестикоординационные комплексы металла, содержащие тридентатные основания Шиффа, включающие ONN-хелатирующий фрагмент. Структура пяти соединений исследована методом РСА (CIF files CCDC nos. 849152–1849156). Обнаружена высокая чувствительность ЭСП полученной серии соединений к природе заместителей в различных фрагментах органического лиганда.
Основания Шиффа являются одними из самых распространенных лигандных систем применяемых в дизайне координационных соединений [1]. Наиболее часто они используются при построении комплексов переходных металлов [2]. Однако в последнее время исследователи все чаще используют этот тип органических лигандов в химии элементов главных подгрупп [3]. При этом очень интенсивно развивается координационная химия олова(IV). Анализ литературы за последние несколько лет демонстрирует всплеск исследований в данном направлении. Наряду с большим разнообразием структурных типов координационных соединений олова(IV), которые синтезируются на основе оснований Шиффа [4, 5], наблюдается неукоснительный рост прикладных задач, которые могут решаться с применением такого рода комплексов. Среди них можно отметить широкий спектр биологически активных препаратов, обладающих антимикробным [6], цитотоксическим [7–9], бактерицидным [10], противогрибковым [11], ДНК-ориентированным химиотерапевтическим [12, 13], противовоспалительным [14] и антитуберкулезным [15] действием. Получены новые флуоресцентные биомаркеры [7], люминесцентные материалы [16, 17], катализаторы тонкого органического синтеза [18, 19], а также компоненты для создания материалов нелинейной оптики [20].
Одними из перспективных лигандов, сочетающих в себе полидентатную функцию и наличие возможных биологически активных фрагментов, являются тридентатные основания Шиффа, содержащие иминопиридиновый фрагмент и способную к ковалентному связыванию с металлом фенольную группу. С лигандами такого типа получены комплексы как переходных (Ni [21], Cu [22–25], Mn [26, 27], Co [22], Fe [28–30], Zn [21, 22, 31], Cd [21, 31]), так и непереходных элементов (Pb [32]). Соединения олова с данными лигандами находятся в центре внимания многих исследователей из-за структурного разнообразия получаемых производных и перспектив их использования [33–35]. В [36] показано, что пентадентатные лиганды, содержащие иминопиридиновый фрагмент успешно собираются в координационной сфере тетрахлорида олова. В настоящем исследовании методом темплатного синтеза из различных замещенных о-аминофенолов и α-карбонилзамещенных пиридинов при участии тетрахлорида олова синтезирована серия комплексoв олова(IV) (I–XIX), содержащих различные тридентатные основания Шиффа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе применяли коммерческие реактивы: 2-пиридинкарбоксальдегид (Aldrich), 2-бензоилпиридин (Aldrich), 2-ацетилпиридин (Aldrich), SnCl4 (Aldrich), 4,6-ди-трет-бутил-о-аминофенол (Aldrich), 4-метил-о-аминофенол (Aldrich), 5‑метил-о-аминофенол (Aldrich), 4-трет-бутил-о-аминофенол (Aldrich), 4-хлор-о-аминофенол (Aldrich), 4-нитро-о-аминофенол (Aldrich), 4-нитро-6-хлор-о-аминофенол (Aldrich). Использованные растворители марок “х. ч.” и “ч. д. а.” осушали по стандартным методикам [37].
ИК-спектры регистрировали на ИК-Фурье-спектрометре ФСМ-1201 (суспензии в вазелиновом масле; кюветы KBr). Спектры ЯМР получали в CDCl3(I, VIII, X, XI, XII, XV) и (CD3)2CO(II, III, IV, V, VI, IX, XIII, XIV, XVI, XVII, XVIII, XIX) с помощью ЯМР спектрометра Bruker AvanceIII (400МГц) с внутренним стандартом Me4Si. ЭСП регистрировали на спектрометрах Perkin-Elmer Lambda 25 и SHIMADZUUV-3600.
Синтез комплексов I–XIX. Все операции по синтезу и исследованию комплексов олова с тридентатными ONN-лигандами проводили в аэробной атмосфере. К раствору тетрахлорида олова (1 ммоль) в 30 мл метанола при нагревании до 50°С и перемешивании приливали раствор 2-пиридинкарбоксальдегида (I–VII) (или 2-бензоилпиридина (VIII–XIV), 2-ацетилпиридина (XV–XIX)) (1 ммоль) и 4,6-ди-трет-бутил-о-аминофенола (I,VIII, XV) (или 4-метил-о-аминофенола (II, IX, XVI), 5-метил-о-аминофенола (III, X, XVII), 4-трет-бутил-о-аминофенола (IV, XI, XVIII), 4-хлор-о-аминофеноал (V, XII, XIX), 4-нитро-о-аминофенола (VI, XIII), 4-нитро-6-хлор-о-аминофенола (VII, XIV)) (1 ммоль) в 15 мл того же растворителя. При этом цвет реакционной смеси постепенно менялся в течение 15 мин. Дальнейшее перемешивание продолжали в течение 6 ч, что приводило к количественному выпадению мелкокристаллического осадка целевого комплекса. Кристаллы комплек-сов I, VIII, IX, X и XII, пригодные для РСА, получали путем медленного упаривания раствора соответствующих соединений в метаноле.
Комплекс 2,4-ди-трет-бутил-6-((пиридин-2-илметилен)амино)фенолятотрихлоролово(IV) (I): фиолетовые кристаллы, выход 70%.
ИК-спектр (ν, см–1): 1608 с, 1598 с, 1530 с, 1478 с, 1445 с, 1363 с, 1297 с, 1275 с, 1243 с, 1197 с, 1161 с, 920 с, 862 с, 827 с, 765 с.
ЯМР 1H (CDCl3; 293 K; δ, м. д.): 1.32 (с., 9H, t‑Bu), 1.48 (с., 9H, t-Bu), 7.33 (д., J = 2.1 Гц, 1Har), 7.54 (д., J = 2.1 Гц, 1Har), 7.84 (м., 1HPy), 8.02 (д., J = 7.8 Гц, 1HPy), 8.29 (т. д., J = 7.8 Гц, J = 1.3 Гц, 1HPy), 8.64 (с., J (119Sn–1H) = 98.3 Гц, С–H), 9.12 (д., J = 5.1 Гц, J(119Sn–1H) = 25.4 Гц, 1HPy); ЯМР 13C (CDCl3; 293 K; δ, м. д.): 29.2 (CH3(t-Bu)), 30.1 (CH3(t-Bu)), 35.1 (C(t-Bu)), 35.6 (C(t-Bu)), 110.6, 123.2, 128.0, 128.2, 131.8, 133.0, 141.5, 141.7, 142.8, 142.9, 145.9 (Carl), 157.3 (C=N);1 ЯМР 19Sn (CDCl3; 293 K; δ, м. д.): –514.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 367 (10 979), 494 (7456); толуол: 378 (13 370), 522 (10 750); метанол: 369 (10 690), 497 (7650); диэтиловый эфир: 373 (13 970), 515 (10 550); хлористый метилен: 381 (10 440), 521 (10 440).
Комплекс 4-метил-2-((пиридин-2-илметилен)амино)фенолятотрихлоролово(IV) (II): красно-фиолетовый мелкокристаллический порошок, выход 72%.
ИК-спектр (ν, см–1): 1606 с, 1540 с, 1489 с, 1290 с, 1276 с, 1242 с, 1211 с, 1149 с, 881 с, 819 с, 812 с, 778 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 2.32 (с., 3H, CH3), 6.94 (д., J = 8.5Гц, 1Har), 7.34 (д. д., J = = 2.4 Гц, J = 8.5 Гц, 1Har), 7.73 (с., 1Har), 8.27 (м., 1HPy), 8.53(м., 1HPy), 8.70 (т. д., J = 7.8 Гц, J = = 1.3 Гц, 1HPy), 9.18 (д., J = 5.3 Гц, 1HPy), 9.52 (с., 1H, С–H); ЯМР 119Sn ((CD3)2CO); 293 K; δ, м. д.): –513.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 350 (10 729), 480 (7518).
Комплекс 5-метил-2-((пиридин-2-илметилен)амино)фенолятотрихлоролово(IV) (III): красный мелкокристаллический порошок, выход 69%.
ИК-спектр (ν, см–1): 1602 с, 1588 с, 1537 с, 1485 с, 1298 с, 1285 с, 1244 с, 1157 с, 1125 с, 925 с, 902 с, 806 с, 806 с, 799 с, 773 с, 730 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 2.36 (с., 3H, CH3), 6.77 (д., J = 8.4 Гц, 1Har), 6.87 (с., 1Har), 7.87 (д., J = 8.4 Гц, 1Har), 8.25 (м., 1HPy), 8.50 (м., 1HPy), 8.69 (м., 1HPy), 9.16 (д., J = 5.1 Гц, 1HPy), 9.47 (с., J (119Sn–1H) = 108.6 Гц, С–H); ЯМР 13C ((CD3)2CO); 293 K; δ, м. д.): 21.2 (CH3); 118.4, 119.8, 120.3, 129.7, 130.2, 136.3, 138.3, 144.5, 145.6, 147.1, 147.4 (Car); 157.1 (C=N); 1ЯМР 19Sn ((CD3)2CO); 293 K; δ, м. д.): –513.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 358 (5473), 461 (5228).
Комплекс 4-(трет-бутил)-2-((пиридин-2-илметилен)амино)фенолятотрихлоролово(IV) (IV): крас-ный мелкокристаллический порошок, выход 56%.
ИК-спектр (ν, см–1): 1602 с, 1526 с, 1487 с, 1365 с, 1275 с, 1241 с, 1173 с, 1155 с, 1131 с, 922 с, 839 с, 781 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 1.35 (с., 9H, t-Bu), 6.98 (д., J = 8.9 Гц, J(119Sn–1H) = 7.6 Гц 1Har), 7.62 (д. д., J = 8.9 Гц, J = 2.4 Гц, 1Har), 7.94 (д., J = 2.4 Гц, 1Har), 8.26 (м., 1HPy), 8.52 (м., 1HPy), 8.70 (т.д., J = 7.8 Гц, J = 1.5 Гц, J(119Sn–1H) = 6.4 Гц, 1HPy), 9.18 (д., J = 5.3 Гц, J(119Sn–1H) = 26.8 Гц, 1HPy), 9.62 (с., J(119Sn–1H) = 109.0 Гц, С–H). ЯМР 13C ((CD3)2CO); 293 K; δ, м. д.): 30.5 (CH3(t-Bu)); 34.1 (C(t-Bu)); 114.7, 119.5, 129.9, 130.4, 133.5; 134.5, 139.1, 141.4, 142.0, 144.5, 145.6 (Car); 156.9 (C=N); 1ЯМР 19Sn ((CD3)2CO); 293 K; δ, м. д.): –514.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 352 (10 346), 478(7241).
Комплекс 4-хлор-2-((пиридин-2-илметилен)амино)фенолятотрихлоролово(IV) (V): оранжевый мелкокристаллический порошок, выход 35%.
ИК-спектр (ν, см–1): 1599 с, 1590 с, 1473 с, 1289 с, 1270 с, 1239 с, 1228 с, 1173 с, 1157 с, 1119 с, 1026 с, 940 с, 875 с, 816 с, 775 с, 661 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 7.08 (д., J = 9.0 Гц 1Har), 7.52 (д. д., J = 9.0Гц, J = 9.0 Гц, 1Har), 8.04 (д., J = 8.7 Гц, 1Har), 8.34 (м., 1HPy), 8.59 34 (м., 1HPy), 8.76 (т. д., J = 7.7Гц, J = 1.5 Гц, 1HPy), 9.22 (д., J = 5.1 Гц, 1HPy), 10.04 (с.,С–H).
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 338 (10 520),468 (7447).
Комплекс 4-нитро-2-((пиридин-2-илметилен)-амино)фенолятотрихлоролово(IV) (VI): оранжевый мелкокристаллический порошок, выход 36%.
ИК-спектр (ν, см–1): 1595 с, 1571 с, 1504 с, 1483 с, 1345 с, 1300 с, 1286 с, 1255 с, 1134 с, 1028 с, 885 с, 778 с, 748 с, 657с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 7.24 (д., J = 9.3 Гц 1Har), 8.4 (м., 2H, 1Har, 1HPy), 8.72 (д., J = = 8.7 Гц, 1Har), 8.83 (м., 1HPy), 8.96 (д., J = 2.6 Гц, 1HPy), 9.26(д., J = 5.3 Гц, 1HPy), 10.04 (с., J(119Sn–1H) = 104.4 Гц, С–H); ЯМР 13C ((CD3)2CO); 293 K; δ, м. д.): 116.0, 120.1, 124.0, 129.4, 131.3, 138.9, 140.5, 143.3, 145.1, 145.2, 146.2 (Car), 163.0 (C=N);
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 318 (19 257), 428 (8955).
Комплекс 2-хлор-4-нитро-6-((пиридин-2-илметилен)амино)фенолятотрихлоролово(IV) (VII): оранжевый мелкокристаллический порошок, выход 32%.
ИК-спектр (ν, см–1): 1590 с, 1570 с, 1504 с, 1479 с, 1331 с, 1326 с, 1301 с, 1233 с, 903 с, 875 с, 776 с, 754 с, 743 с.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 326 (17 532), 425 (6994).
Комплекс 2,4-ди-трет-бутил-6-((фенил(пиридин-2-ил)метилен)амино)фенолятотрихлоролово(IV) (VIII): фиолетовые кристаллы, выход 65%.
ИК-спектр (ν, см–1): 1593 с, 1542 с, 1532 с, 1440 с, 1364 с, 1309 с, 1267 с, 1247с, 1202 с, 1148 с, 1030 с, 999 с, 832 с, 789 с, 747 с, 697 с.
ЯМР 1H (CDCl3; 293 K; δ, м. д.): 0.92 (с., 9H, t‑Bu), 1.46 (с., 9H, t-Bu), 6.37 (с., 1Har), 7.37 (с., 1Har), 7.51 (м., 2Har), 7.62 (д., J = 7.9 Гц, 1Har), 7.74 (м., 3H, 2Har и 1HPy)), 7.86 (м., 1HPy), 8.18 (т.д., J = = 7.9 Гц, J = 1.5 Гц, 1HPy), 9.28 (д., J = 5.3 Гц, 1HPy); ЯМР 13С (CDCl3; 293 K; δ, м. д.): 29.3 (CH3(t-Bu)), 30.6 (CH3(t-Bu)), 34.0 (C(t-Bu)), 35.6 (C(t-Bu)), 116.4(J(119Sn) = 36.5 Гц), 124.6, 127.4, 127.7, 127.8, 130.3, 130.7, 131.4, 131.5, 140.14, 140.8, 143.0, 144.3, 145.1 (J(119Sn) = 19.2 Гц), 146.7 (Car), 157.5 (C=N); ЯМР 119Sn (CDCl3; 293 K; δ, м. д.): ‒507.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 369 (9986), 501 (7501).
Комплекс 4-метил-2-((фенил(пиридин-2-ил)метилен)амино)фенолятотрихлоролово(IV) (IX): темно-красные кристаллы, выход 59%.
ИК-спектр (ν, см–1): 1597 с, 1536 с, 1483 с, 1444 с, 1311 с, 1271 с, 1236 с, 1142 с, 1115 с, 835 с, 817 с, 788 с, 704 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 1.90 (с., 3H, CH3), 6.16 (с., 1Har), 6.92 (д., J = 8.5 Гц,1Har), 7.20 (д. д., J = 8.5Гц,J = 2.3 Гц,1Har), 7.65 (м., 2Har), 7.88 (м., 3Har), 7.98 (д., J = 8.0 Гц,1HPy), 8.31 (м., 1HPy), 8.63 (м., 1HPy), 9.30 (д., J = 5.3 Гц,1HPy); ЯМР 119Sn ((CD3)2CO); 293 K; δ, м. д.): –506.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 352 (6420), 486 (5125).
Комплекс 5-метил-2-((фенил(пиридин-2-ил)метилен)амино)фенолятотрихлоролово(IV) (X · MeOH): красные кристаллы, выход 42%.
ИК-спектр (ν, см–1): 1594 с, 1444 с, 1307 с, 1268 с, 1160 с, 1115 с, 984 с, 792 с, 747 с, 705 с.
ЯМР 1H (CDCl3; 293 K; δ, м. д.): 2.25 (с., 3H, Me), 6.25 (м., 2Har), 6.94 (с., 1Har), 7.49 (м., 2Har), 7.62 (д., J = 8.0 Гц, 1Har), 7.74 (м., 3H, 2Harи 1HPy), 7.89 (м., 1HPy), 8.20 (т.д., J = 7.8 Гц, J = 1.5 Гц, 1HPy), 9.25 (д., J = 5.2 Гц, 1HPy); ЯМР 13C (CDCl3; 293 K; δ, м. д.): 22.0 (CH3), 120.6, 120.9, 121.9, 123.2, 127.4, 127.9, 128.0, 130.8, 130.83, 131.8, 143.2, 144.0, 145.2, 146.9, 147.3 (Car), 159.9 (C=N); ЯМР 119Sn (CDCl3; 293 K; δ, м. д.): –503.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 362 (8164), 466 (8663).
Комплекс 4-(трет-бутил)-2-((фенил(пиридин-2-ил)метилен)амино)фенолятотрихлоролово(IV) (XI): малиновый мелкокристаллический порошок, выход 33%.
ИК-спектр (ν, см–1): 1599 с, 1536 с, 1483 с, 1366 с, 1269 с, 1249 с, 1153 с, 832 с, 706 с, 579 с.
ЯМР 1H (CDCl3; 293 K; δ, м. д.): 0.92 (с., 9H, t-Bu), 6.48 (д., J = 2.2 Гц, 1Har), 7.06 (д., J = 8.8 Гц, 1Har), 7.37 (д. д., J = 2.2 Гц, J = 8.8 Гц, 1Har), 7.53 (м., 2Har), 7.66 (д., J = 7.8 Гц, 1Har), 7.76 (м., 3H, 2Har и 1HPy), 7.91 (м., 1HPy), 8.21 (т. д., J = 7.8 Гц, J = 1.5 Гц, 1HPy), 9.28 (д., J = 5.0 Гц, 1HPy); ЯМР 13C (CDCl3; 293 K; δ, м. д.): 30.6 (CH3(t-Bu)), 34.0 (C(t-Bu)), 118.5, 120.4, 124.4, 127.5, 127.5, 127.8, 128.1, 130.8, 130.8, 131.0, 131.7, 133.7, 141.6, 143.1, 144.0, 145.3, 147.4 (Car), 158.0 (С=N); ЯМР 119Sn (CDCl3; 293 K; δ, м. д.): –504.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 354 (8353), 484 (6534).
Комплекс 4-хлор-2-((фенил(пиридин-2-ил)-метилен)амино)фенолятотрихлоролово(IV) (XII): красные кристаллы, выход 36%.
ИК-спектр (ν, см–1): 1592 с, 1470 с, 1308 с, 1296 с, 1266 с, 1239 с, 1228 с, 1148 с, 1032 с, 988 с, 837 с, 796 с, 746 с, 703 с, 667 с, 576 с.
ЯМР 1H (CDCl3; 293 K; δ, м. д.): 6.26 (д., J = 2.3 Гц, 1Har), 7.09 (д., J = 9.0 Гц, 1Har), 7.50 (д., J = 7.8 Гц, 2Har), 7.76 (д., J = 7.8 Гц, 1Har), 7.81 (м., 4H, 3Har и 1HPy), 7.97 (м., 1HPy), 8.26 (м., 1HPy), 9.30 (д., J = = 5.4 Гц, 1HPy); ЯМР 13C (CDCl3; 293 K; δ, м. д.): 121.7, 122.2, 123.4, 125.4, 127.0, 127.0, 128.4, 128.7, 129.9, 131.0, 132.2, 135.1, 136.2, 143.3, 143.6, 145.5, 149.9 (Car), 158.6 (C=N); ЯМР 119Sn (CDCl3; 293 K; δ, м. д.): –503.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 326 (8890), 474 (6720).
Комплекс 4-нитро-2-((фенил(пиридин-2-ил)-метилен)амино)фенолятотрихлоролово(IV) (XIII): оранжевый мелкокристаллический порошок, выход 48%.
ИК-спектр (ν, см–1): 1594 с, 1568 с, 1346 с, 1314 с, 1249 с, 1127 с, 842 с, 816 с, 801 с, 747 с, 733 с, 703 с, 658 с, 573 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 7.21 (д., J = 9.3 Гц, J (119Sn–1Н) = 6.9 Гц, 1Har), 7.43 (д., J = 2.7 Гц, 1Har), 7.76 (м., 2Har), 7.94 (м., 3Har), 8.18 (д., J = 7.8 Гц, 1HPy), 8.26 (д. д., J = 9.3 Гц, J = 2.7 Гц, 1Har), 8.45 (м., 1HPy), 8.74 (т. д., J = 7.8 Гц, J = 1.5 Гц, 1HPy), 9.37 (д., J = 5.2 Гц, 1HPy); ЯМР 13C ((CD3)2CO); 293 K; δ, м. д.): 118.9, 120.3, 124.4, 126.9, 128.8, 129.6, 130.89, 130.9, 131.2, 132.6, 138.4, 142.4, 145.5, 146.0, 155.6 (Car), 163.9 (C=N); ЯМР 119Sn ((CD3)2CO); 293 K; δ, м. д.): –505.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 317 (20803), 435 (9079).
Комплекс 2-хлор-4-нитро-6-((фенил(пиридин-2-ил)метилен)амино)фенолятотрихлоролово(IV) (XIV): желтый мелкокристаллический порошок, выход 30%.
ИК-спектр (ν, см–1): 1595 с, 1586 с, 1514 с, 1335 с, 1310 с, 1291 с, 1227 с, 891 с, 750 с, 738с, 696 с, 610 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 7.39 (д., J = 2.7 Гц, 1Har), 7.79 (м., 2Har), 7.94(м., 4Har), 8.24 (д., J = 7.9 Гц, 1Har), 8.36 (м., 1HPy), 8.50 (м., 1HPy), 8.77 (т. д., J = 7.9 Гц, J = 1.5 Гц, 1HPy) , 9.41 (д., J = = 5.2 Гц, 1HPy); ЯМР 119Sn ((CD3)2CO); 293 K; δ, м. д.): –507.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 320 (20 090), 432 (8018).
Комплекс 2,4-ди-трет-бутил-6-((1-(пиридин-2-ил)этилиден)амино)фенолятотрихлоролово(IV) (XV): фиолетовый мелкокристаллический порошок, выход 56%.
ИК-спектр (ν, см–1): 1597 с, 1476 с, 1438 с, 1367 с, 1261 с, 1245 с, 1203 с, 1168 с, 835 с, 771 с, 766 с.
ЯМР 1H (CDCl3; 293 K; δ, м. д.): 1.33 (с., 9H, t-Bu), 1.49 (с., 9H, t-Bu), 3.04 (c., 3H, CH3), 7.44 (д., J = 1.8 Гц, 1Har), 7.54 (д., J = 1.8 Гц, 1Haryl), 7.91 (м., 1HPy), 8.26 (д., J = 8.0 Гц, 1HPy), 8.38 (т.д., J = 8.0 Гц, J = 1.2 Гц, 1HPy), 9.25 (д., J = 4.8 Гц, J (119Sn–1Н) = = 27.8 Гц, 1HPy); ЯМР 13C (CDCl3; 293 K; δ, м. д.): 18.2 (CH3), 29.3 (CH3(t-Bu)), 31.2 (CH3(t-Bu)), 34.5 (C(t-Bu)), 35.6 (C(t-Bu)), 116.3, 125.3, 125.6, 127.7, 129.8, 140.2, 140.8, 143.4, 144.2, 145.3, 147.8 (Car), 156.5 (C=N); ЯМР 119Sn (CDCl3; 293 K; δ, м. д.): –509.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 357 (6773), 480 (4331).
Комплекс 4-метил-2-((1-(пиридин-2-ил)этилиден)амино)фенолятотрихлоролово(IV) (XVI): красно-оранжевый мелкокристаллический порошок, выход 52%.
ИК-спектр (ν, см–1):1597 с, 1548 с, 1487 с, 1447 с, 1370 с, 1291 с, 1262 с, 1246 с, 1135 с, 1028 с, 825 с, 783 с, 773 с, 591с, 568 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 2.86 (с., 3H, CH3), 3.29 (с., 3H, CH3), 6.96 (д., J = 8.5 Гц, J (119Sn–1H) = 7.8 Гц, 1Har), 7.31 (д.д., J = 8.7 Гц, J = 2.3 Гц, 1Har), 7.77 (с., 1Har), 8.31 (м., 1HPy), 8.76 (м., 1HPy), 8.88 (д., J = 8.2 Гц, 1HPy), 9.25 (д., J = 5.3 Гц, 1HPy); ЯМР 13C ((CD3)2CO); 293 K; δ, м. д.): 17.78 (CH3), 30.62 (CH3), 119.2, 119.4, 119.6, 123.2, 127.8, 127.9, 129.4, 131.7, 134.9, 144.9, 145.0 (Car), 157.03 (C=N); ЯМР 119Sn ((CD3)2CO); 293 K; δ, м. д.): –507.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 350 (10 730), 480 (7520).
Комплекс 5-метил-2-((1-(пиридин-2-ил)этилиден)амино)фенолятотрихлоролово(IV) (XVII): оранжевый мелкокристаллический порошок, выход 48%.
ИК-спектр (ν, см–1): 1610 с, 1598 с, 1586с, 1562 с, 1480 с, 1441 с, 1366 с, 1299 с, 1263 с, 1249 с, 1166 с, 1140 с, 1120 с, 1030 с, 809 с, 774 с, 735 с, 580 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 2.36 (с., 3H, CH3), 3.24 (с., 3H, CH3, J (119Sn–1H) = 131.0 Гц), 6.77 (д.д., J = 8.6 Гц, J = 1.9 Гц, 1Har), 6.90 (с., 1Har), 7.84 (д., J = 8.6 Гц, 1Har), 8.30 (м., 1HPy), 8.75 (м., 1HPy), 8.86 (д., J = 7.9 Гц, 1HPy), 9.24 (д., J = 5.1 Гц, J (119Sn–1H) = 31.0 Гц, 1HPy); ЯМР 119Sn ((CD3)2CO); 293 K; δ, м. д.): –507.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 349 (6807), 448 (6140).
Комплекс 4-(трет-бутил)-2-((1-(пиридин-2-ил)этилиден)амино)фенолятотрихлоролово(IV) (XVIII): красный мелкокристаллический порошок, выход 33%.
ИК-спектр (ν, см–1): 1597 с, 1538 с, 1486 с, 1365 с, 1358 с, 1259 с, 1248 с, 1186 с, 1144 с, 1031 с, 839 с, 833 с, 778 с, 721 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 1.37 (с., 9H, t-Bu), 3.33 (с., 3H, CH3), 7.01 (д., J = 8.9 Гц, J (119Sn–1H) = 7.6 Гц, 1Har) 7.57 (д. д., J = 8.9 Гц, J = = 2.7 Гц, 1Har), 7.86 (д., J = 2.4 Гц, 1Har), 8.31 (м., 1HPy), 8.79 (т.д., J = 8.1 Гц, J = 1.6 Гц, 1HPy), 8.89 (д., J = 8.1 Гц, 1HPy), 9.25 (д., J = 5.4 Гц, J (119Sn–1H) = 31.5 Гц, 1HPy); ЯМР 119Sn ((CD3)2CO); 293 K; δ, м. д.): –507.
УФ-спектр ((λ, нм (ε, л см–1 моль–1)): ацетонитрил: 342 (751), 464 (4923).
Комплекс 4-хлор-2-((1-(пиридин-2-ил)этилиден)амино)фенолятотрихлоролово(IV) (XIX): оранжевый мелкокристаллический порошок, выход 23%.
ИК-спектр (ν, см–1): 1594 с, 1546 с, 1480 с, 1376 с, 1368 с, 1285 с, 1261 с, 1245 с, 1194 с, 1169 с, 1130 с, 1123 с, 1101 с, 1029 с, 871 с, 835 с, 827 с, 784 с, 772 с, 669 с, 590 с, 565 с.
ЯМР 1H ((CD3)2CO); 293 K; δ, м. д.): 3.37 (с., 3H, CH3), 7.09 (д., J = 9.0 Гц, J (119Sn–1H) = 7.2 Гц, 1Har) 7.49 (д. д., J = 9.0 Гц, J = 2.5 Гц, J (119Sn–1H) = = 8.0 Гц, 1Har), 7.95 (д., J = 2.5 Гц, 1Har), 8.37 (м., 1HPy), 8.81 (т.д., J = 7.9 Гц, J = 1.6 Гц, 1HPy), 8.97 (д., J = 7.9 Гц, 1HPy), 9.27 (д.д., J = 5.4 Гц, J = 1.6 Гц, 1HPy); ЯМР 13C ((CD3)2CO); 293 K; δ, м. д.): 17.7 (CH3), 120.9, 122.2, 122.9, 126.7, 128.4, 129.0, 130.0, 133.4, 133.5, 145.1, 145.2 (Car), 157.5 (C=N); ЯМР 119Sn ((CD3)2CO); 293 Kδ, м. д.): –506.
УФ-спектр (λ, нм (ε, л см–1 моль–1)): ацетонитрил: 330 (7247), 453 (4917).
РСА комплексов I, VIII–X, XII проведен на дифрактометрах Bruker Smart Apex (VIII, X) и Agilent Xcalibur E (I, IX, XII) (ω-сканирование, МоКα-излучение, λ = 0.71073 Å, T = 100(2) K). Структуры решены прямым методом и уточнены полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении для неводородных атомов. Водородные атомы в I, VIII–X, XII были помещены в геометрически рассчитанные положения и уточнены изотропно с фиксированными тепловыми параметрами U(H)iso = 1.2U(C)eq(U(H)iso = 1.5U(C)eq для метильных фрагментов). Интегрирование экспериментальных наборов интенсивностей, учет поглощения и уточнение структур проведены с использованием программных пакетов SAINT [38], SADABS [39], SHELX [40] и CrysAlisPRO [41]. Кристаллографические данные и параметры рентгеноструктурных экспериментов приведены в табл. 1, избранные длины связей и валентны углы – в табл. 2.
Таблица 1.
Кристаллографические данные и параметры рентгеноструктурных экспериментов для комплексов I, VIII–X, XII
| Комплекс | I | VIII | IX | X· MeOH | XII |
|---|---|---|---|---|---|
| Сингония | Моноклинная | Моноклинная | Моноклинная | Моноклинная | Моноклинная |
| Пр. гр. | P21/с | P21/n | P21/n | P21/с | P21/n |
| a,Å | 13.9657(2) | 13.2864(5) | 9.21140(10) | 13.5209(6) | 9.1668(2) |
| b, Å | 12.12140(10) | 14.9148(5) | 15.51260(10) | 14.4120(6) | 15.5670(3) |
| c, Å | 14.3498(2) | 13.3845(5) | 13.56540(10) | 22.3666(10) | 13.5275(3) |
| β, град | 109.512(2) | 96.2550(10) | 98.8020(10) | 103.0010(10) | 98.060(2) |
| V, Å3 | 2289.68(6) | 2636.54(17) | 1915.57(3) | 4246.7(3) | 1911.30(7) |
| Z | 4 | 4 | 4 | 8 | 4 |
| ρ(выч.), Мг/м3 | 1.550 | 1.538 | 1.777 | 1.703 | 1.852 |
| µ, мм–1 | 1.478 | 1.295 | 1.763 | 1.599 | 1.906 |
| θ, град | 2.89–30.03 | 2.05–28.70 | 3.18–30.03 | 1.69–27.89 | 2.88–30.03 |
| Число наблюдаемых отражений | 45 565 | 27 234 | 69 507 | 41 573 | 37 494 |
| Число независимых отражений | 6696 | 6792 | 5583 | 10116 | 5576 |
| Rint | 0.0525 | 0.0303 | 0.0284 | 0.0255 | 0.0995 |
| S(F 2) | 1.033 | 1.058 | 1.065 | 1.047 | 0.998 |
| R1/wR2 (I >2σ(I)) | 0.0262/0.0469 | 0.0283/0.0652 | 0.0144/0.0358 | 0.0240/0.0558 | 0.0385/0.0511 |
| R1/wR2 (по всем параметрам) | 0.0374/0.0494 | 0.0366/0.0689 | 0.0151/0.0362 | 0.0317/0.0589 | 0.0643/0.0557 |
| Δρmax/Δρmin), eÅ–3 | 0.468/–0.488 | 1.266/–0.320 | 0.480/–0.331 | 0.785/–0.369 | 0.891/–0.601 |
Таблица 2.
Избранные длины связей (Å) и валентные углы (град) в комплексах I, VIII–X, XII
| Связь | I | VIII | IX | X(А) | X(Б) | XII |
|---|---|---|---|---|---|---|
| d, Å | ||||||
| Sn(1)–O(1) | 2.030(2) | 2.011(2) | 2.0285(8) | 2.031(2) | 2.041(2) | 2.038(2) |
| Sn(1)–N(1) | 2.200(2) | 2.209(2) | 2.2017(8) | 2.196(2) | 2.205(2) | 2.205(2) |
| Sn(1)–N(2) | 2.229(2) | 2.203(2) | 2.2110(9) | 2.217(2) | 2.196(2) | 2.212(2) |
| Sn(1)–Cl(1) | 2.4303(5) | 2.4004(5) | 2.3949(3) | 2.4226(5) | 2.4359(6) | 2.4229(7) |
| Sn(1)–Cl(2) | 2.3486(5) | 2.3466(5) | 2.3506(3) | 2.3441(5) | 2.3347(5) | 2.3528(7) |
| Sn(1)–Cl(3) | 2.3892(5) | 2.4119(5) | 2.4280(2) | 2.4014(5) | 2.3874(6) | 2.3849(8) |
| O(1)–C(1) | 1.339(2) | 1.339(2) | 1.342(2) | 1.339(2) | 1.352(2) | 1.342(3) |
| N(1)–C(7) | 1.281(2) | 1.294(3) | 1.299(2) | 1.289(3) | 1.289(3) | 1.294(3) |
| N(1)–C(2) | 1.398(2) | 1.405(3) | 1.401(2) | 1.409(2) | 1.406(3) | 1.403(4) |
| N(2)–C(12) | 1.338(2) | 1.334(3) | 1.337(2) | 1.331(2) | 1.333(3) | 1.330(4) |
| N(2)–C(8) | 1.361(2) | 1.357(3) | 1.359(2) | 1.360(2) | 1.358(3) | 1.367(3) |
| C(1)–C(2) | 1.419(2) | 1.424(3) | 1.424(2) | 1.416(3) | 1.422(3) | 1.426(4) |
| C(1)–C(6) | 1.424(2) | 1.410(3) | 1.404(2) | 1.402(3) | 1.393(3) | 1.407(4) |
| C(2)–C(3) | 1.401(2) | 1.401(3) | 1.410(2) | 1.401(3) | 1.409(3) | 1.406(4) |
| C(3)–C(4) | 1.379(2) | 1.381(3) | 1.385(2) | 1.376(3) | 1.377(3) | 1.375(4) |
| C(4)–C(5) | 1.416(2) | 1.410(3) | 1.409(2) | 1.401(3) | 1.403(3) | 1.396(4) |
| C(5)–C(6) | 1.382(2) | 1.394(3) | 1.384(2) | 1.389(3) | 1.390(3) | 1.375(4) |
| C(7)–C(8) | 1.465(2) | 1.481(3) | 1.479(2) | 1.482(3) | 1.487(3) | 1.481(4) |
| C(8)–C(9) | 1.384(2) | 1.386(3) | 1.389(2) | 1.386(3) | 1.381(3) | 1.380(4) |
| C(9)–C(10) | 1.393(3) | 1.392(3) | 1.397(2) | 1.392(3) | 1.390(3) | 1.387(4) |
| C(10)–C(11) | 1.381(3) | 1.377(3) | 1.386(2) | 1.380(3) | 1.379(3) | 1.383(4) |
| C(11)–C(12) | 1.386(3) | 1.389(3) | 1.396(2) | 1.386(3) | 1.390(3) | 1.383(4) |
| Углы | ω, град | |||||
| O(1)Sn(1)N(1) | 78.22(5) | 78.63(6) | 79.56(3) | 79.45(6) | 78.98(6) | 79.40(8) |
| O(1)Sn(1)N(2) | 151.84(5) | 152.79(6) | 153.80(3) | 153.94(6) | 154.11(6) | 153.62(8) |
| N(1)Sn(1)N(2) | 73.62(5) | 74.19(6) | 74.48(3) | 74.59(6) | 75.13(6) | 74.42(9) |
| O(1)Sn(1)Cl(1) | 90.38(4) | 91.47(5) | 92.09(3) | 89.93(4) | 92.69(5) | 91.52(6) |
| N(1)Sn(1)Cl(1) | 85.10(4) | 91.76(5) | 84.03(2) | 85.81(5) | 89.82(5) | 83.95(6) |
| N(2)Sn(1)Cl(1) | 87.06(4) | 88.16(5) | 88.72(2) | 86.01(4) | 87.58(5) | 88.95(6) |
| O(1)Sn(1)Cl(2) | 108.42(4) | 105.21(4) | 106.68(2) | 105.79(4) | 102.88(4) | 106.62(6) |
| N(1)Sn(1)Cl(2) | 171.99(4) | 173.94(5) | 172.30(2) | 174.43(5) | 174.38(5) | 172.34(7) |
| N(2)Sn(1)Cl(2) | 99.64(4) | 101.98(4) | 99.48(2) | 100.09(4) | 102.86(5) | 99.74(6) |
| O(1)Sn(1)Cl(3) | 91.33(4) | 91.63(5) | 90.49(3) | 92.35(4) | 91.34(5) | 90.72(6) |
| N(1)Sn(1)Cl(3) | 91.52(4) | 84.81(5) | 90.42(2) | 89.14(5) | 82.90(5) | 90.38(6) |
| N(2)Sn(1)Cl(3) | 89.63(4) | 87.20(5) | 86.27(2) | 89.51(4) | 85.21(5) | 86.30(6) |
| Cl(1)Sn(1)Cl(2) | 90.30(2) | 92.81(2) | 91.157(9) | 92.26(2) | 95.36(2) | 91.08(3) |
| Cl(1)Sn(1)Cl(3) | 175.82(2) | 174.84(2) | 173.352(9) | 173.99(2) | 170.86(2) | 173.42(3) |
| Cl(2)Sn(1)Cl(3) | 92.78(2) | 90.36(2) | 93.971(10) | 92.47(2) | 91.74(2) | 94.21(3) |
Структуры зарегистрированы в Кембриджском банке структурных данных (№ 1849152 (I), 1849153 (VIII), 1849154 (IX), 1849155 (X), 1849156 (XII); ccdc.cam.ac.uk/getstructures).
Квантово-химические расчеты для комплекса I проводили по программе Gaussian 09 [42] методом теории функционала плотности (DFT) в рамках функционала B3LYP [43] c применением полноэлектронного базиса DGDZVP для всех атомов. Отсутствие мнимых частот свидетельствует о том, что оптимизированная молекула находится в минимуме потенциальной энергии.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Методом темплатного синтеза из тетрахлорида олова, различных о-аминофенолов и α-карбонил-замещенных пиридинов получены комплексы олова с основаниями Шиффа, содержащие иминопиридиновую функцию и способную к ковалентному связыванию с металлом фенольную группу. Были получены соединения с заместителями различной природы; в фенолятном фрагменте лиганда и при иминном атоме углерода (схема). Наилучшие выходы достигаются для соединений, содержащих незамещенный атом углерода при иминном азоте, а также включающие донорные алкильные заместители в исходном аминофеноле. Реакция протекает легко при умеренном нагревании в растворе метанола и заканчиваeтся в течение 20–30 мин. Для более полного осаждения образующихся интенсивно окрашенных комплексов олова реакционную смесь дополнительно перемешивали при 50°С несколько часов, а затем охлаждали до комнатной температуры. Образующийся при этом осадок целевого продукта после сушки на воздухе является аналитически чистым и не требует дополнительной перекристаллизации. Полученные соединения устойчивы к кислороду и влаге воздуха как в кристаллическом состоянии, так и в растворе.
Схема.
Полученные производные I–XIX диамагнитные и содержат один тридентатный ONN-лиганд в моноанионном состоянии. Состав и строение соединений подтверждены данными спектроскопии ЯМР, ИК и элементного анализа. Во всех комплексах химический сдвиг в спектре ЯМР 119Sn расположен в интервале –503…–514 м. д., что отвечает шестикоординированному состоянию металла, для которого характерно поглощение в интервале –125…–525 м. д. [44, 45]. Следует отметить, что низкая растворимость некоторых соединений в общедоступных дейтерированных растворителях не позволила выполнить для них мультиядерный ЯМР-анализ. В ИК-спектрах наблюдаются интенсивные полосы поглощения в области 1700–1500 и 1300–1000 см–1, характерные для двойных (С=N) и одинарных связей (С–N, С–O) соответственно [46].
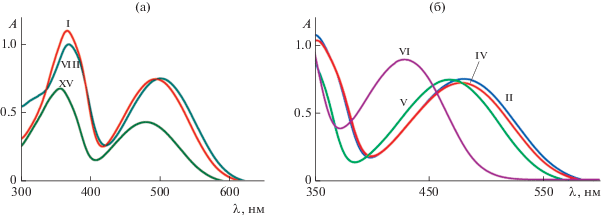
Молекулярное и кристаллическое строение соединений I, VIII–X, XII исследовано методом РСА (рис. 1). В кристаллической ячейке соединения X находятся две независимые молекулы комплекса, незначительно различающиеся распределением длин связей в органическом лиганде, а также две сольватные молекулы метанола.
Рис. 1.
Молекулярная структура комплекса I (а), VIII (б), IX (в), X (г), XII (д). Тепловые эллипсоиды приведены с 50%-ной вероятностью. Атомы водорода не изображены для ясности.
Координационный полиэдр олова во всех пяти комплексах – искаженный октаэдр, в экваториальной плоскости которого лежат гетероатомы органического лиганда и один из галоидных заместителей. Два других хлорных лиганда занимают апикальные положения. Тридентатный лиганд во всех комплексах – практически плоский (среднее отклонение атомов от плоскости лиганда не превышает 0.07 Å), а природа заместителей незначительно сказывается на строении молекулы.
Распределение длин связей в органическом лиганде в соединениях I, VIII–X, XII информативно. Связи С–О в I, VIII–X, XII короче, чем в описанных амидофенолятных комплексах олова(IV) [47–49] и близки по значению к о-иминосемихиноновым производным металла [50–52]. В ароматических фенольных кольцах лигандов наблюдается искажение хиноидного типа. Связи С(3)–С(4) и С(5)–С(6) короче, чем С(1)–С(2), С(2)–С(3), С(4)–С(5) и С(1)–С(6), что также характерно для о-иминосемихиноновых производных [50–52]. Связь N(1)–C(2) короче характерной одинарной связи C–N, а N(1)–C(7) длиннее двойной связи C=N в комплексах олова с координированной нейтральной молекулой иминопиридина [53]. Данный эффект связан с сопряжением π-системы иминопиридинового фрагмента лиганда с π-системой его фенолятной части, в результате чего происходит делокализация отрицательного заряда по всему органическому лиганду и соответствующее перераспределение длин связей.
Для всех пяти изученных структурно комплексов наблюдается распределение длин связей металл–кислород и металл–азот, отвечающее структурной формуле на схеме. Так, расстояния Sn(1)–(1) (2.011(2)–2.041(2) Å) меньше суммы ковалентных радиусов Sn и O (2.11Å) [54] и соответствуют ковалентной связи металл–кислород. Расстояния Sn(1)–N(1) и Sn(1)–N(2) (2.196(2)–2.229(2) Å) несколько больше суммы ковалентных (2.12 Å) [54], но существенно меньше суммы ван-дер-ваальсовых радиусов Sn и N (3.8 Å) [54], что соответствует донорно-акцепторному координационному связыванию указанных элементов. В комплексах I, IX и X(А) cвязи Sn(1)–N(1) (2.196(2)–2.2017(8) Å) с иминными азотами несколько короче связи Sn(1)–N(2) (2.2110(9)–2.229(2) Å) с пиридином, что ранее наблюдалось для аналогичных комплексов олова с такого типа лигандами [34–36].
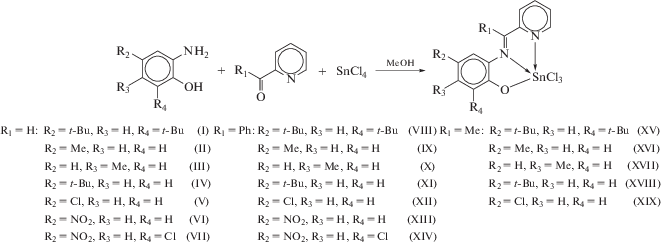
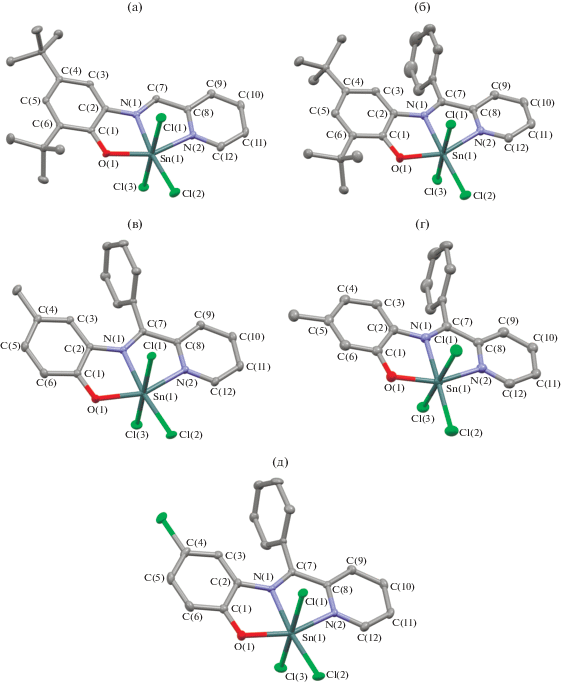
Для того чтобы понять причину существенного изменения частоты полос в ЭСП, а следовательно, и различия в окраске комплексов I–XIX, мы провели квантово-химические расчеты на примере комплекса I методом функционала плотности. Из анализа молекулярных орбиталей оптимизированной молекулы можно сделать вывод о том, что низшая свободная молекулярная орбиталь (НСМО) и высшая занятая молекулярная орбиталь (ВЗМО) практически полностью сосредоточены на органическом лиганде (рис. 2). Таким образом, величина энергетической щели ВЗМО–НСМО определяет положение длинноволнового пика в ЭСП соединения, отвечающего внутрилигандному переносу заряда (ILCT). Энергетическая щель между граничными орбиталями в I, согласно расчетам, составляет 2.57 эВ (λ = 483 нм), что соотносится с экспериментальными данными (λ = 494 нм в ацетонитриле). ВЗМО в комплексе I локализована на донорном амидофенолятном фрагменте лиганда, а НСМО – на акцепторном иминопиридиновом (рис. 2). Введение различных заместителей в органический лиганд влияет на величину энергетической щели между граничными орбиталями, а следовательно, и на расположение пиков в ЭСП полученных соединений. Акцепторные заместители в иминопиридиновом фрагменте должны понижать энергию НСМО и приводить к батохромному сдвигу полосы поглощения. Рассмотрим комплексы I, VIII, XV, содержащие органические лиганды с идентичными заместителями в фенольном фрагменте и разными заместителями (R1) при иминном атоме углерода. Наблюдается однозначный длинноволновый сдвиг при переходе от донорной метильной группы к водороду и фенильной группе (λ = 480 (R1 = = Me), 494 (R1 = Н), 501 (R1 = Ph) нм (рис. 3а)).
Рис. 2.
Вид граничных орбиталей ВЗМО (а) и НСМО (б) комплекса I по данным DFT расчетов. Атомы водорода не показаны.
Обратный эффект наблюдается при усилении акцепторных свойств заместителей в фенольном фрагменте органического лиганда. Электроноакцепторные группы должны понижать энергию ВЗМО и тем самым приводить к гипсохромному сдвигу в ЭСП. На рис. 3б представлены спектры комплексов II, IV–VI. Эти соединения содержат различные заместители (R2) в положении 5 фенольного фрагмента при сохранении неизменного заместителя R1 = H. Введение более акцепторных заместителей R2 смещает пики поглощения в коротковолновую область ЭСП (λ = 480 (R2 = = Me), 478 (R2 = t-Bu), 468 (R2 = Cl), 428 (R2 = = NO2) нм). Схожий гипсохромный сдвиг в ЭСП при усилении электроноакцепторных свойств заместителей в фенольном фрагменте был обнаружен для салицилдииминовых комплексов алюминия [55] и индия [56].
Известно, что для соединений, демонстрирующих внутримолекулярный перенос заряда, характерен эффект сольватохромии [37]. Влияние растворителей на ЭСП был рассмотрен на примере комплекса I. Действительно при переходе от ацетонитрила к толуолу происходит батохромное смещение длинноволновой полосы поглощения на 28 нм. В то же время однозначной корреляции между сдвигом полосы поглощения и эмпирическим параметром полярности растворителя [37] не наблюдается. Данный факт указывает на то, что в растворе имеют место специфические взаимодействия, связанные с сольватацией атома олова молекулами растворителя. Ранее возможность такой сольватации была продемонстрирована в шестикоординационных комплексах олова, содержащих схожий дииминодифенолятный лиганд [57].
Таким образом, в ходе проведенного исследования показана возможность использования метода темплатной сборки для направленного синтеза комплексов металлов с основаниями Шиффа, содержащими иминопиридиновый фрагмент. В ходе одностадийного синтеза получена серия новых шестикоординационных комплексов олова(IV) на основе тридентатных ONN-лигандов. Продемонстрировано влияние электроноакцепторных (электронодонорных) свойств заместителей в различных фрагментах органического лиганда на ЭСП синтезированных соединений. Это дает удобный инструмент для направленного дизайна хромофорных соединений с тонко настраиваемыми фотофизическими характеристиками.
Работа выполнена в рамках государственного задания (тема № 44.1, № АААА-А16-116122110056-2).
Список литературы
Andruh M. // Dalton Trans. 2015. V. 44. P. 16633.
Cozzi P.G. // Chem. Soc. Rev. 2004. V. 33. P. 410
Grusenmeyer T.A., King A.W., Mague J.T. et al. // Dalton Trans. 2014. V. 43. P. 17754.
Kumar S., Nath M. // J. Organomet. Chem. 2018. V. 856. P. 87.
Baula T.S.B., Kehie P., Duthie A. et al. // J. Organomet. Chem. 2017. V. 828. P. 96.
Bhatr P., Sharma J., Sharma R.A., Singh Y. // Appl. Organomet. Chem. 2018. V. 31. P. 3639
Vinayak R., Dey D., Ghosh D. et al. // Appl. Organomet. Chem. 2018. V. 32. P. 4122.
Baul T.S.B, Longkumer I., Duthie A. et al. // DaltonTrans. 2018. V. 47. P. 1993.
Galvan-Hidalgo J.M., Chans G.M., Ramirez-Apan T. et al. // Appl. Organomet. Chem. 2018. V. 31. P. 3704.
Zafarian H., Sedaghat T., Motamedi H. et al. // J. Organomet. Chem. 2017. V. 853. P. 184.
Ahlawat A., Singh V., Asija S. // Chem. Papers. 2017. V. 71. P. 2195.
Devi J., Pachwania S. // Inorg. Chem. Commun. 2018. V. 91. P. 44.
Liu K., Chang G.L, Yan H. et al. // Appl. Organomet. Chem. 2018. V. 32. P. 3973.
Kovala-Demertzi D. // J. Organomet. Chem. 2006. V. 691. P. 1767.
Vinsova J., Cermakova K, Tomeckova A. et al. // Bioorg. Med. Chem. 2006. V. 14. № 17. P. 5850.
Tian L.J, Yao Y.Z, Wang Y.H, Liu J. // J. Mol. Struct. 2018. V. 1156. P. 441.
Enriquez-Cabrera A., Vega-Penaloza A., Alvarez-Venicio V. et al. // J. Organomet. Chem. 2018. V. 855. P. 51.
Hazra S., Martins N.M.R., Kuznetsov M.L. et al. // Dalton Trans. 2017. V. 46. P. 13364.
Martins L.M.D.R.S., Hazra S., da Silva M.F.C.G., Pombeiro A.J.L. // RSC Adv. 2016. V. 6. P. 78225.
Garcia-Lopez M.C., Munoz-Flores B.M., Chan-Navarro R. et al. // J. Organomet. Chem. 2016. V. 806. P. 68.
Majumder A., Rosair G., Mallick A., Chattopadhyay N., Mitra S. // Polyhedron. 2006. V. 25. № 8. P. 1753.
Stefankiewicz A., Wałesa-Chorab M., Szczesniak H. et al. // Polyhedron. 2010. V. 29. № 1. P. 178.
Maheswari P., Hartl F., Quesada M. et al. // Inorg. Chim. Acta. 2011. V. 374. № 1. P. 406.
Ma S., Sun X., Gao S. et al. // Eur. J. Inorg. Chem. 2007. № 6. P. 846.
Qiao X., Ma Z., Xie C. et al. // J. Inorg. Biochem. 2001. V. 105. № 5. P. 728.
Pursche D., Triller M., Reddig N. et al. // Z. Anorg. Allg. Chem. 2003. V. 629. № 1. P. 24.
Qi C., Sun X., Gao S. et al. // Eur. J. Inorg. Chem. 2007. № 23. P. 3663.
Hayami S., Gu Z., Shiro M. et al. // J. Am. Chem. Soc. 2000. V. 122. № 29. P. 7126.
Hayami S., Hiki K., Kawahara T. et al. // Chem. Eur. J. 2009. V. 15. № 14. P. 3497.
Gomez-Blanco N., Fernandez J., Fernandez A. et al. // Eur. J. Inorg. Chem. 2009. № 21. P. 3071.
Epstein D., Choudhary S., Churchill M. et al. // Inorg. Chem. 2001. V. 40. № 7. P. 1591.
Bacchi A., Carcelli M., Pelizzi C. et al. // Eur. J. Inorg. Chem. 2002. № 8. P. 2179.
Ramírez-Jiménez A., Luna-García R., Cortés-Lozada A. et al. // J. Organomet. Chem. 2013. V. 738. P. 10.
Teo S.-B., Teo H.-SH., Chang S.-T. et al. // J. Coord. Chem. 2000. V. 49. P. 269.
Ramírez-Jiménez A., Gómez E., Hernández S. // J. Organomet. Chem. 2009. V. 694. P. 2965.
Пискунов А.В., Трофимова О.Ю., Пискунова М.С. и др. // Коорд. химия. 2018. Т. 44. № 1. С. 50 (Piskunov A.V., Trofimova O.Y., Piskunova M.S. et al. Russ. J. Coord. Chem. 2018. V. 44. P. 138. doi 10.1134/ S1070328418020082).
Райхардт К. Растворители и эффекты среды в органической химии. М: Мир, 1991. С. 763.
SAINT. Madison (WI, USA): Bruker AXS Inc., 2012.
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Agilent. CrysAlis PRO. Yarnton (Oxfordshire, England): Agilent Technologies Ltd, 2014.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 09. Revision D.01. Wallingford (CT, USA): Gaussian, Inc., 2013.
Becke A.D. // J. Chem. Phys. 1986. V. 84. P. 4524.
Wrackmeyer B. // Annu. Rep. NMR Spectrosc. 1985. V. 16. P. 73.
Wrackmeyer B. // Annu. Rep. NMR Spectrosc. 1999. V. 38. P. 203.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 543 с.
Piskunov A.V., Chegerev M.G., Fukin G.K. // J. Organomet. Chem. 2016. V. 803. № 1. P. 51.
Chegerev M.G., Piskunov A.V., Maleeva A.V. et al. // Eur. J. Inorg. Chem. 2016. P. 3813.
Chegerev M.G., Piskunov A.V., Starikova A.A. et al. // Eur. J. Inorg. Chem. 2018. № 9. P. 1087.
Пискунов А.В., Айвазьян И.А., Абакумов Г.А. и др. // Изв. АН. Сер. хим. 2007. № 56. С. 253.
Пискунов А.В., Мещерякова И.Н., Баранов Е.В. и др. // Изв. АН. Сер. хим. 2010. № 2. С. 354.
Piskunov A.V., Mescheryakova I.N., Fukin G.K. et al. // Heteroatom Chem. 2009. V. 20. № 6. P. 332.
Basu B.S., Basu B.T.S., Tiekink E.R.T. // Z. Kristallogr. 1999. V. 214. P. 207.
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015.
Lee S.H., Shin N., Kwak S.W. et al. // Inorg. Chem. 2017. V. 56. P. 2621.
Hwang K.Y., Lee Y.S., Lee M.H., Do Y. // Chem. Eur. J. 2009. V. 15. P. 6478.
Piskunov A.V., Trofimova O.Yu., Fukin G.K. et al. // Dalton Trans. 2012. V. 41. P. 10970.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия