Координационная химия, 2019, T. 45, № 5, стр. 270-275
1-оксипиридил-2-селеноляты кадмия(II) и никеля(II). Синтез, молекулярная и кристаллическая структура
Р. К. Аскеров 1, *, А. М. Магеррамов 1, Ж. В. Мацулевич 2, В. К. Османов 2, Г. Н. Борисова 2, В. Н. Хрусталев 3, С. А. Залепкина 4, В. Ф. Смирнов 4, А. В. Борисов 2
1 Бакинский государственный университет
Баку, Азербайджан
2 Нижегородский государственный технический университет им. Р.Е. Алексеева
Нижний Новгород, Россия
3 Российский университет дружбы народов
Москва, Россия
4 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: rizvankam@bk.ru
Поступила в редакцию 20.06.2018
После доработки 02.08.2018
Принята к публикации 05.09.2018
Аннотация
Реакцией обмена 1-оксипиридил-2-селенолята натрия c хлоридами кадмия(II) и никеля(II) синтезированы соответствующие селеноляты кадмия (C20H16Cd2N4O4Se4) (I) и никеля (C10H8N2NiO2Se2) (II). Методом РСА определена молекулярная и кристаллическая структура комплексов (CIF files CCDC № 1585246 (I) и 1585251 (II)). Комплекс I образует центросимметричный димер, в котором координационный полиэдр атома кадмия имеет искаженное тригонально-бипирамидальное строение, а атомы селена принимают транс-конфигурацию. Комплекс II, включающий сольватную молекулу C2H5OH, имеет квадратное строение и является мономером. В отличие от I в комплексе II атомы селена лигандов имеют цис-конфигурацию. Кристалическая упаковка в I, II формируется слабыми межмолекулярными водородными связями C–H···O и C–H···Se.
Как известно, комплексные соединения на основе 2-меркаптопиридин-1-оксида, такие, например, как цинк и медь пиритион, обладают широким спектром биологической активности и находят коммерческое применение в качестве промышленных фунгицидов и биоцидов в смазочно-охлаждающих жидкостях, производстве лакокрасочных материалов и косметических средств [1–5]. В последние годы наблюдается повышенный интерес к исследованию селенорганических соединений, обусловленный их высоким синтетическим потенциалом и практической ценностью [5, 6]. В частности, установлено, что селенсодержащий аналог цинк пиридинтиона – бис(2-селенопиридин-1-оксид)цинк(II), – как и соответствующие соли никеля, меди и кадмия, характеризуются значительной фунгицидной и бактерицидной активностью [7–11]. Синтез и данные РСА бис(2-селенопиридин-1-оксида)цинка(II) и сольвата бис(2-селенопиридин-1-оксид)никеля(II) с ацетоном описаны в [12, 13].
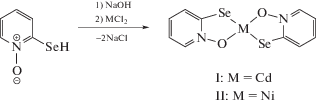
В настоящей работе представлены результаты РСА новых комплексных соединений на основе 2-селенопиридин-1-оксида (HL) – бис(2-селенопиридин-1-оксида)кадмия(II) (C20H16Cd2N4O4Se4) (I)) и никеля (II) (сольват) (C10H8N2NiO2Se2) (II · · 0.5С2H5ОН).
Комплексы I и II синтезированы по следующей схеме:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез комплекса I. К раствору 0.348 г (2 ммоль) HL в 5 мл этанола при комнатной температуре прибавляли раствор 0.08 г (2 ммоль) NaOH в 5 мл воды и раствор 0.183 г (1 ммоль) CdCl2 в 10 мл воды. Через 10 мин образовавшийся белый осадок отфильтровывали. Продукт промывали водой, этанолом, диэтиловым эфиром и высушивали на воздухе. Выход 0.43 г (94%). Тпл = 263–265°С. Использованные для РСА бесцветные кристаллы соединения I получали медленной кристаллизацией его раствора в этаноле при комнатной температуре.
Синтез комплекса II. К раствору 0.348 г (2 ммоль) HL в 5 мл этанола при комнатной температуре прибавляли раствор 0.08 г (2 ммоль) NaOH в 5 мл воды и раствор 0.129 г (1 ммоль) NiCl2 в 10 мл воды. Через 10 мин образовавшийся осадок бурого цвета отфильтровывали. Продукт промывали водой, этанолом, диэтиловым эфиром и высушивали на воздухе. Выход 0.39 г (91%). Тпл = 282–283°С. Использованные для РСА зеленые кристаллы соединения II получали медленной кристаллизацией его раствора в этаноле при комнатной температуре.
РСА. Кристаллографические данные для соединений I и II получены на дифрактометре Bruker Smart Apex (ω-сканирование, МоКα-излучение, λ = 0.71073 Å, T = 100 и 296 К). Экспериментальные наборы интенсивностей отражений собраны и интегрированы с помощью программ SMART [14] и SAINT [15] соответственно. Структуры решены прямым методом и уточнены полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении для неводородных атомов. Атом водорода сольватной молекулы, участвующий в образовании межмолекулярной водородной связи (ВС) O(3)–H(3)···O(1) в соединении II, локализован из разностного синтеза электронной плотности и уточнен в изотропном приближении. Остальные атомы Н в I и II помещены в геометрически рассчитанные положения и уточнены изотропно с фиксированными тепловыми параметрами Uiso(H) = 1.2Uiso(C). Уточнение структуры и учет поглощения проведены по программным пакетам SHELXTL [16] и SADABS [17]. Кристаллографические данные и параметры рентгеноструктурных экспериментов приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для соединений I и II
| Параметры | Значение | |
|---|---|---|
| I | II | |
| М | 917.01 | 427.85 |
| Размеры кристалла, мм | 0.620 × 0.340 × 0.210 | 0.150 × 0.090 × 0.060 |
| Сингония | Моноклинная | Моноклинная |
| Пр. гр. | P21/c | C2/c |
| a, Å | 8.3134(5) | 16.4116(11) |
| b, Å | 10.3852(6) | 7.7854(5) |
| c, Å | 13.8060(8) | 21.8567(15) |
| β, град | 94.2860(10) | 92.4954(11) |
| V, Å3 | 1188.63(12) | 2790.0(3) |
| Z | 2 | 8 |
| ρ(выч.), г/см3 | 2.562 | 2.037 |
| µ, мм–1 | 7.950 | 6.608 |
| F(000) | 856 | 1656 |
| Tmin; Tmax | 0.0073; 0.0524 | 0.7457; 0.3398 |
| Область сбора данных по θ, град | 2.5–33.0 | 1.9–28.0 |
| Измерено отражений | 18 447 | 13 949 |
| Независимых отражений | 4510 | 3446 |
| Число уточняемых параметров | 154 | 181 |
| GOОF | 1.072 | 1.007 |
| R1 (I > 2σ(I)) | 0.0486 | 0.0518 |
| wR2 (все данные) | 0.1432 | 0.1128 |
| Остаточная электронная плотность (Δρmin/Δρmax), e Å–3 | –2.059/2.975 | –1.224/1.457 |
Структуры зарегистрированы в Кембриджском банке структурных данных (CCDC № 1585246 (I), 1585251 (II); ccdc.cam.ac.uk/getstructures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
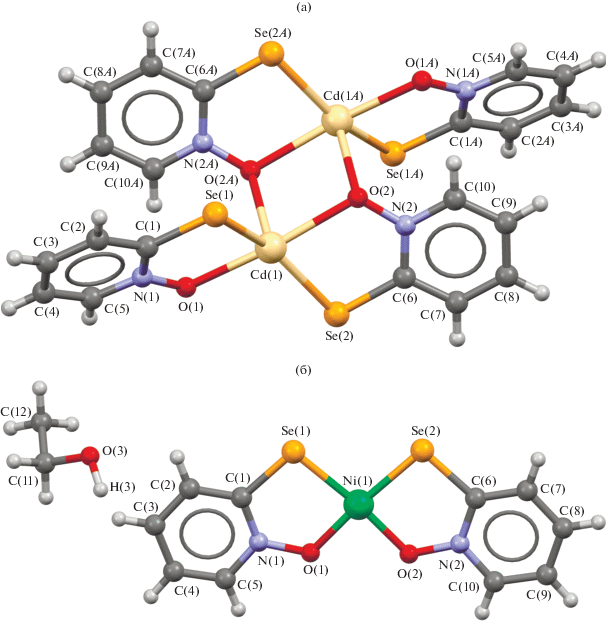
Соединения I и II образуют два принципиально различных структурных типа. Комплекс I – центросимметричный димер состава [М2(SeOPy)4] (рис. 1а). Координационный полиэдр атома кадмия(II) в комплексе I – искаженная тригональная бипирамида с атомами Se(1), Se(2) и O(2A) в экваториальной плоскости, атомами O(1) и O(2) в аксиальных положениях, углом O(1)Cd(1)O(2), равным 167.2(1)°. Молекула I имеет собственную симметрию C2; проходит двойная ось через центр ромба, состоящего из атомов O(2), O(2A), Cd(1), Cd(1A). Расстояние Cd(1)–Cd(1A) в димерном комплексе I 3.680(4) Å, Cd–O 2.269(3)–2.383(3) Å; среднее расстояние Cd···O равно 2.341(3) Å; отклонение индивидуальных значений от среднего не превышает 3σ. Расстояния Cd–Se(1,2) 2.559(5) и 2.563(5) Å соответственно. Длины связей Se(1)–C(1,6) и Se(2)–C(6) 1.879(4) Å и 1.871 Å сопоставимы с суммой ковалентных радиусов атомов Se и C (1.95 Å) [18]. Двугранный угол между плоскостью циклов Cd(1)–Se(1)–C(1)–N(1)–O(1) и Cd(1)–Se(2)–C(6)–N(2)–O(2) равен 32.0(8)°. В комплексе I атомы селена двух лигандов имеют транс-конфигурацию.
В кристалле димеры соединения I укладываются в стопки вдоль кристаллографической оси а. Между соседними молекулами комплекса I вдоль направления оси а существуют межмолекулярные ВС Se···H и O···H. Расстояния Se(2)···H(4A) и Se(2)···H(5A) (–x + 2, y + 1/2, –z + 3/2) 3.01 и 3.04 Å несколько меньше суммы ван-дер-ваальсовых радиусов атомов Se и H (3.15 Å) [17]. Расстояние O(2)···H(9A) (–x + 1, y – 1/2, –z + 1/2) 2.43 Å находится в интервале 2.15–2.45 Å между средним ван-дер-ваальсовым контактом и специфическим (укороченным) взаимодействием O···H [19] (рис. 2).
Рис. 2.
Фрагменты кристаллической упаковки соединения I в проекции на плоскость b0c. Пунктирными линиями показаны контакты Se···H, O···H и С···С. Атомы водорода, не участвующие в межмолекулярных водородных контактах, для наглядности удалены.
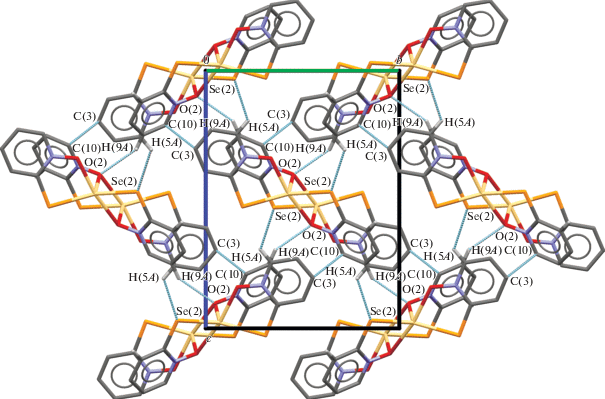
Кроме того, между соседними молекулами вдоль оси а имеется короткий межмолекулярный контакт C(3)···C(10). Расстояние С···С (3.309(6) Ǻ) соответствует слабому вторичному взаимодействию С···С (между 3.27 и 3.42 Å [19]).
Избранные длины связей и валентные углы в соединении I представлены в табл. 2.
Таблица 2.
Избранные длины валентных связей, валентные углы в соединении I и II
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| I | |||
| Cd(1)–O(1) | 2.269(3) | Se(1)–C(1) | 1.879(4) |
| Cd(1)–O(2) | 2.373(3) | Se(2)–C(6) | 1.872(4) |
| Cd(1)–O(2A) | 2.383(3) | O(1)–N(1) | 1.333(4) |
| Cd(1)–Se(1) | 2.5586(5) | O(2)–N(2) | 1.343(4) |
| Cd(1)–Se(2) | 2.5629(5) | ||
| II | |||
| Ni(1)–O(1) | 1.863(3) | Se(2)–C(6) | 1.887(5) |
| Ni(1)–O(2) | 1.875(3) | O(1)–N(1) | 1.359(4) |
| Ni(1)–Se(2) | 2.2473(7) | O(2)–N(2) | 1.346(5) |
| Ni(1)–Se(1) | 2.2495(7) | O(3)–C(11) | 1.426(3) |
| Se(1)–C(1) | 2.5629(5) | C(11)–C(12) | 1.503(3) |
| Угол | ω, град | Угол | ω, град |
| I | |||
| O(2A)Cd(1)Se(1) | 98.56(7) | O(1)Cd(1)O(2) | 167.17(11) |
| O(1)Cd(1)Se(2) | 99.96(7) | O(1)Cd(1)O(2A) | 90.23(11) |
| O(2)Cd(1)Se(2) | 77.65(7) | O(2)Cd(1)O(2A) | 78.58(10) |
| O(2A)Cd(1)Se(2) | 106.85(7) | O(1)Cd(1)Se(1) | 81.26(7) |
| Se(1)Cd(1)Se(2) | 154.536(17) | O(2)Cd(1)Se(1) | 106.41(7) |
| Cd(1)O(2)Cd(1A) | 101.42(10) | ||
| II | |||
| O(1)Ni(1)O(2) | 85.36(13) | Se(2)Ni(1)Se(1) | 94.61(2) |
| O(1)Ni(1)Se(2) | 175.07(9) | C(1)Se(1)Ni(1) | 92.85(12) |
| O(2)Ni(1)Se(2) | 89.91(10) | C(6)Se(2)Ni(1) | 93.21(13) |
| O(1)Ni(1)Se(1) | 90.19(9) | N(1)O(1)Ni(1) | 119.5(2) |
| O(2)Ni(1)Se(1) | 174.58(10) | N(2)O(2)Ni(1) | 119.4(2) |
Мономер соединения II состава [М(SeOPy)2] включает сольватную молекулу C2H5OH (в соотношении 1 : 0.5) (рис. 1б). Атом никеля имеет искаженную квадратную координацию атомами селена Se(1) и Se(2), а также O(1) и O(2) двух лигандов. Среднее отклонение от плоскости квадрата четырех атомов, координированных с атомом никеля(II), составляет 0.038 Å. Углы ONiO 85.4(1)° и SeNiSe 94.61(3)° характеризуют отклонения от идеального квадратного расположения донорных атомов. Молекула II почти плоская; среднее отклонение всех атомов от ее среднеквадратичной плоскости составляет 0.039 Å. Длины связей Ni(1)–O(1, 2) и Ni(1)–Se(1, 2) (1.863(3), 1.875(3) и 2.2473(7), 2.2495(7) Å соответственно) близки к аналогичным расстояниям в изоструктурном комплексе никеля [12]. Расстояния Se(1)–C(1) и Se(2)–C(6) в II (1.894(5) и 1.888(4) Å) сопоставимы с суммой ковалентных радиусов атомов Se и C (1.95 Å) [18]. Двугранный угол между плоскостями Ni(1)–O(1)–Se(1)–N(1)–C(1) и Ni(1)–O(2)–Se(2)–N(6)–C(6) равен 3.54(9)°.
В отличие от комплекса I в II атомы селена лигандов имеют цис-конфигурацию.
В кристалле плоские молекулы II образуют попарно связанные димеры за счет слабых контактов O···H–С (O(2)…H(10A) (–x, y, –z + 1/2)) (C–H 0.93, H···O 2.40 Å, угол C–H···O 162°) (рис. 3а).
Рис. 3.
Фрагмент кристаллической упаковки соединения II в проекции на плоскость a0c. Пунктирными линиями показаны контакты O···H (а) и Se···H (б).
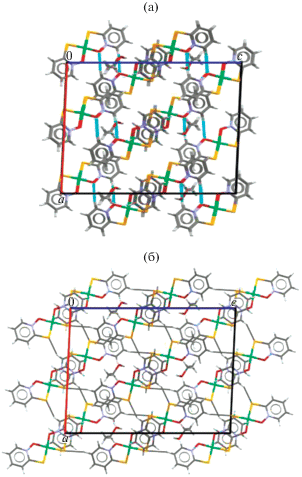
Помимо перечисленных выше межмолекулярных контактов в кристалле комплекса II имеются дополнительные ВС Se···H и O···H с расстояниями на уровне укороченных и ван-дер-ваальсовых взаимодействий. Расстояния Se(2)···H(5A) (x – 1/2, y – 1/2, z) и (Se(1)···H(9A) (x, –y + 2, z – 1/2)) 2.92 и 3.13 Å меньше суммы ван-дер-ваальсовых радиусов атомов Se и H (3.15 Å) [17] (рис. 3б). Расстояния O···H между сольватной молекулой этанола и молекулой комплекса II (О(1)···Н(3А) (–x, –y + 1, –z + 1)) и (О(3)···Н(7А) (–x + 1/2, –y + 3/2, ‒z + 1)) имеют значения 2.15 и 2.42 Å, и находятся в интервале 2.15–2.45 Å между специфическим (укороченным) и средним ван-дер-ваальсовым взаимодействием O···H [19].
Избранные длины валентных связей и валентные углы в соединении II представлены в табл. 2.
Список литературы
Barnett B.L., Kretschmar H.C., Hartman F.A. // Inorg. Chem. 1977. V. 16. № 8. P. 1834.
Chandler C.J., Segel I.H. // Antimicrob. Agents Chemother. 1978. V. 14. № 1. P. 60.
Ermolayeva E., Sanders D. // Appl. Environ. Microbiol. 1995. V. 61. № 9. P. 3385.
Соломон Т., Синклер-Дэй Д.Д., Финни А.Э. Пат. РФ. № 2415168 // Бюл. изобр. 2011. № 9. С. 250.
Dahllöf I., Grunnet K., Haller R. et al. Tema Nord. Nordic Council of Ministers, Copenhagen, 2005. 33 p.
Reeder N.L., Xu J., Youngquist R.S. // Brit. J. Dermatol. 2011. V. 165. № 2. P. 9.
Banerjee B., Koketsu M. // Coord. Chem. Rev. 2017.V. 339. P. 1047.
Handbook of Chalcogen Chemistry / Ed. Devillanova F. Cambridge: RSC Press, 2007. 889 p.
Henderson R., Rothgery, E.F., Schnieder H.A. Pat. USA № 4496559. Washington (DC, USA), Patent and Trademark Office, 1985.
Залепкина С.А., Смирнов В.Ф., Борисов В.А. и др. // Фундаментальные исследования. 2015. № 10. С. 25.
Залепкина С.А., Артемьева М.M., Безруков М.Е. и др. // Экология и промышленность России. 2018. Т. 22. № 1. С. 56.
Ma D.-L., Zhang H.-J., Shen Z., Niu D.-Z. // Crystal Z. Kristallogr. 2009. V. 224. P. 327.
Niu D.-Z., Ma D.-L., Gao F., Xie L.-Y. // Z. Kristallogr. 2009. V. 224. P. 283.
SMART. Bruker Molecular Analysis Research Tool. Version 5.632. Madison (WI, USA): Bruker AXS, 2005.
SAINT. Data Reduction and Correction Program. Version 8.34A. Madison (WI, USA): Bruker AXS Inc., 2014.
Sheldrick G.M. SADABS. Program for Absorption Correction. Göttingen (Germany): Univ. of Göttingen, 1996.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015.
Зефиров Ю.В., Зоркий П.М. // Успехи химии. 1995. Т. 64. № 4. С. 446.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия