Координационная химия, 2019, T. 45, № 5, стр. 290-296
Оптические стереоизомеры геометрических изомеров октаэдрического комплекса TiF4[Ph2P(O)CH2CH(OH)Me)]2 в CH2Cl2
Е. Г. Ильин 1, *, А. С. Паршаков 1, В. В. Данилов 1, Е. И. Горюнов 2, Э. Е. Нифантьев 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганической химии им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: eg_ilin@mail.ru
Поступила в редакцию 05.07.2018
После доработки 16.08.2018
Принята к публикации 24.08.2018
Аннотация
Установлены особенности влияния энантиомеров монодентатного лиганда на стереоизомерию смешанных октаэдрических тетрафторокомплексов d0-переходных металлов на примере изучения методами ЯМР 19F{1Н} и 31Р{1Н} комплексообразования TiF4 с Ph2P(O)CH2CH(OH)Me (L), имеющем ассиметрический атом углерода в алифатическом углеводородном радикале и представляющем собой рацемическую смесь энантиомеров, в СН2Сl2. Определен состав образующихся в растворе комплексов и на основе анализа спектров ЯМР 19F, с применением концепции гетеротропности, сделано заключение об относительной стереохимической конфигурации хиральных и мезо-стереоизомеров геометрических изомеров октаэдрического комплекса TiF4L2.
Ранее методом ЯМР 19F{1Н} и 31Р{1Н} мы изучили реакции TiF4 с простейшими представителями нового класса фосфорорганических лигандов – дифенилфосфорилалканонов Ph2P(O)CH2C(O)Me (L1) [1] и Ph2P(O)(CH2)2C(O)Me (L2) [2] в CH2Cl2. Было показано, что при введении в раствор двукратного избытка лигандов последние координируются к центральному иону через группу Р=О с образованием октаэдрических тетрафторокомплексов, имеющих цис-конфигурацию. В эквимолярном растворе TiF4 : L2 образуются димерные и полиядерные комплексы, содержащие фрагменты с тремя концевыми цис-атомами фтора, а в качестве мостиков выступают ионы фтора. При двукратном избытке TiF4 в качестве мостиков, наряду с ионами F–, выступает L2, использующий группы Р=О и С=О. Рассчитана термодинамическая стабильность и структура изомеров TiF4L22 и ${{\left[ {({\mu - F})\left( {{\mu - L}_{{\text{2}}}^{{\text{2}}}} \right){{{({\text{Ti}}{{{\text{F}}}_{{\text{3}}}})}}_{{\text{2}}}}} \right]}^{ + }}$ [2]. Что касается близкого к ним класса соединений – карбамоилфосфиноксидов, то методами ЯМР 19F и 31Р было исследовано взаимодействие TiF4 с Ph2P(O)CH2C(O)NBu2 (L3) в толуоле и хлористом метилене [3] и установлено, что TiF4 может координировать одну молекулу этого лиганда хелатно с образованием (η2-L3)TiF4 или две монодентатно через более сильную по основности группу Р=О с образованием цис-Ti(L3)2F4. Наряду с молекулярными комплексами, были обнаружены стереоизомеры димерного катиона {(μ-F)[(η2-L3)TiF3]2}+, представляющие собой два фрагмента [(η2-L3)TiF3]+ с лигандом, координированным хелатно, связанные мостиковым ионом фтора [3]. С увеличением длины углеводородного мостика при переходе к Ph2P(O) (CH2)2C(O)NМе2 (L4) высокая хелaтирующая способность лиганда сохранялась. Методами ЯМР 19F{1Н} и 13Р{1Н} удалось наблюдать в растворе конформационную изомерию семичленного гетероцикла TiOPCCCO в комплексе (η2-L4)TiF4 при низких температурах [4], что подтверждено кристаллической структурой [5]. В монокристалле обнаружены четыре кристаллографически независимых молекулы (η2-L4)TiF4, незначительно отличающиеся длинами связей лигандов с ионом Ti4+, различающиеся геометрией семичленного металлоцикла TiOPCCCO. Анализ отклонений металлоцикла от плоскости OTiO показал, что в парах молекул геометрия хелатных циклов практически совпадает и, следовательно, в кристалле, как и в растворе, существуют два конформационных изомера. Квантово-химические расчеты относительной термодинамической стабильности и оптимизация структур всех четырех молекул привели к одной теоретической структуре, практически совпадающей с одним из конформеров [5].
Цель настоящей работы – изучение влияния на стереоизомерию смешанных фторокомплексов d0-переходных металлов, наличия в алифатическом углеводородном радикале координированного лиганда хирального центра и установление возможности идентификации оптических изомеров фторидных комплексов на примере комплексообразования TiF4 с 1-дифенилфосфорилпропан-2-олом Ph2P(O)CH2CH(OH)Me (L), имеющим в углеводородном радикале ассиметрический атом углерода. Поскольку преимущественное образование молекулярных комплексов ${\text{Ti}}{{{\text{F}}}_{{\text{4}}}}{\text{L}}_{{\text{2}}}^{{{\text{1,2}}}}$ в СН2Сl2 наблюдается при введении двух лигандов на моль тетрафторида [1, 2], соответствующий раствор с незначительным избытком лиганда L был приготовлен и изучен.
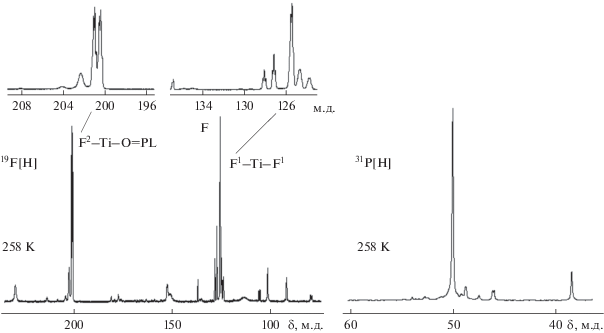
В спектре ЯМР 19F{1Н} этого раствора при 258 К (рис. 1) основные сигналы – две группы линий в областях 123–129 и 200–201.5 м.д., проявляющие тонкую структуру. Положение этих сигналов [1, 2] и равенство их суммарных относительных интенсивностей, по нашему мнению, указывает на присутствие различных цис-тетрафторокомплексов титана TiF4L2. На основании сопоставления областей химических сдвигов с полученными ранее данными [1, 2] мы отнесли линии в сильном поле к резонансным сигналам атомов фтора F1, расположенных в транс-положении друг к другу, на ординате F–Ti–F. Сигналы в более слабом поле области 200-201.5 м.д. – к атомам фтора F2, находящимся в транс-положении к группам Р=О на ординатах F–Ti–OP…L. В спектре ЯМР 31Р{1Н} при 258 К (рис. 1) атомам фосфора лигандов, координированным в комплексах цис-TiF4L2, отвечала интенсивная синглетная линия при 50 м.д.
Обычно, спектры ЯМР 19F первого порядка цис-тетрафторокомплексов с монодентатными лигандами TiF4Х2 представляют собой два триплета равной интенсивности, отвечающие двум парам неэквивалентных атомов фтора – на ординатах F1–Ti–F1 и F2–Ti–Х октаэдра [1, 2, 5]. Появление большего числа мультиплетных резонансных линий в областях, отвечающих неэквивалентным атомам фтора, по нашему мнению, указывает на присутствие в растворе стереоизомеров тетрафторокомплекса цис-TiF4L2. Их образование может быть связано с существованием лиганда L, имеющего ассимметрический атом углерода, в виде рацемической смеси R- и S-энантиомеров. Нельзя исключить также и возможность присутствия конформационных изомеров комплекса вследствие заторможенного вращения координированных лигандов. Для отнесения наблюдаемых резонансных линий и установления природы появления необычных групп резонансных сигналов представлялось целесообразным изучить температурную зависимость спектров ЯМР 19F этого раствора (рис. 2).
Рис. 2.
Температурная зависимость спектров ЯМР 19F{1Н} раствора с отношением L : TiF4 > 2 в CH2Cl2: А, А', А" – F2, F1, F1' от цис-TiF4LRLS; Б, Б' – F2, F1 от цис-TiF4LRLR и цис-TiF4LSLS; В – F1 от транс-TiF4LRLS, В' – F1 от транс-TiF4LRLR и транс-TiF4LSLS.
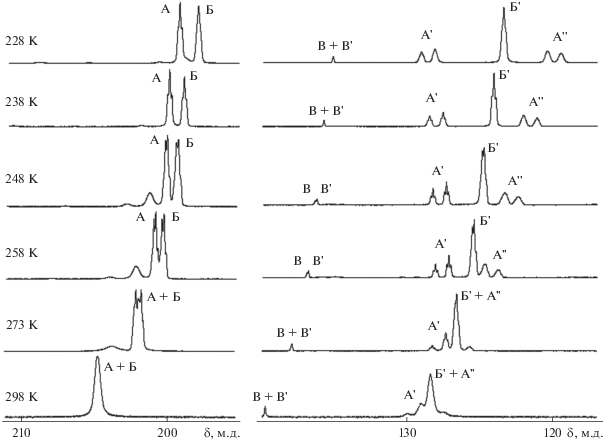
При комнатной температуре, в области резонансных линий ЯМР 19F атомов фтора F1, находящихся в транс-положении друг к другу, комплексов цис-TiF4L2, наблюдалась группа широких перекрывающихся резонансных линий А', Б' и А'', в области сигналов атомов фтора F2, находящихся в транс-положении к группам Р=О – широкий обменный сигнал при 204.8 м.д. (рис. 2). Это указывало на протекание в растворе процессов внутримолекулярного обмена лигандов. При снижении температуры до 273 К резонансные линии начинали разделяться и некоторые из них проявлять тонкую структуру (рис. 2).
При 258 К и дальнейшем снижении температуры в области сигналов атомов фтора F1 проявились пять мультиплетных резонансных линий: две пары мультиплетов А' и А'' равной интенсивности и мультиплет Б', интенсивность которого в пределах погрешности была равна сумме интенсивностей А' и А" (рис. 2). Мультиплеты А' представляли собой триплеты (или дублеты дублетов) в результате спин-спинового взаимодействия ядер фтора F1 с ядрами двух атомов фтора F2 (${{J}_{{{\text{F1F2}}}}}$ = = 39.0 Гц), а мультиплеты А'' претерпевали дополнительное дублетное расщепление (${{J}_{{{\text{F1F2}}}}}$ = = 36.6 Гц). Обращают внимание особенности температурного поведения пар сигналов А' и А": сдвиг в противоположных направлениях с понижением температуры при сохранении величины разности резонансных частот Δν = 260.1 Гц между мультиплетами в парах А' и А" и уменьшение различий в их относительной интенсивности. Эти факторы, а также равенство суммарных интегральных интенсивностей пар линий А' и А" позволяют отнести их к резонансным линиям компонент ХY спектров ЯМР 19F второго порядка типа А2ХY или АВХY октаэдрического тетрафторокомплекса цис-TiF4L2, в котором атомы фтора, находящиеся в транс-положении друг к другу неэквивалентны F1–Ti–F1'. Мы гипотетически обозначили его как стереоизомер I комплекса цис-TiF4L2. Отнесение пар мультиплетов А' и А" к компонентам спектра второго порядка подтверждается также наблюдаемым уменьшением различий (выравниванием) относительной интенсивности “внешних” и “внутренних” компонент пар мультиплетов А' и А" с увеличением разности химических сдвигов между ними, т.е. приближение к спектру первого порядка – двум дублетам равной интенсивности. Не меняющуюся при снижении температуры величину разности резонансных частот между мультиплетами в парах А' и А", мы отнесли к константе спин-спинового взаимодействия (КССВ) ядер неэквивалентных атомов фтора, расположенных на одной ординате ${{J}_{{{\text{F1F1'}}}}}$ = 260.1 Гц. Таким образом, две пары мультиплетов А' и А" мы отнесли к неэквивалентным атомам фтора F1 и F1' стереоизомера I комплекса цис-TiF4L2.
К атомам фтора F2 стереоизомера I, находящимся в транс-положении к группам Р=О лигандов L, из двух сигналов в слабом поле А и Б, равной интенсивности и одинаковой мультиплетности, на основании изучения температурного поведения резонансных линий (рис. 2), был отнесен сигнал А. Этот мультиплет представляет собой, по нашему мнению, дублет дублетов дублетов, вместо предполагаемого дублета дублетов в результате спин-спинового взаимодействия ядер атомов фтора F2 с ядрами F1 и F1' (${{J}_{{{\text{F2F1}}}}}$ = ${{J}_{{{\text{F2F1'}}}}}$ = = 39.0 Гц). Дополнительное расщепление линии А (${{J}_{{{\text{F2F2'}}}}}$ = 39.0 Гц), указывает на стерическую неэквивалентность атомов фтора F2 и F2', находящихся в транс-положении к лигандам L, что может быть связано с конформационной изомерией L вследствие возможности заторможенного вращения, либо с различиями в геометрии хиральных центров LR или LS. Поскольку атомы фтора F2 и F2' находятся в цис-положении друг к другу и по отношению к атомам фтора F1 и F1', КССВ между ними – ${{J}_{{{\text{F2F2'}}}}}$, ${{J}_{{{\text{F2F1}}}}}$, ${{J}_{{{\text{F2F1'}}}}}$, ${{J}_{{{\text{F2'F1'}}}}}$ и ${{J}_{{{\text{F2'F1'}}}}}$ – существенно ниже, чем между концевыми неэквивалентными атомами фтора, находящимися на одной ординате – ${{J}_{{{\text{F1F1'}}}}}$. Последняя существенно превышает КССВ, наблюдаемые между мостиковым и расположенными к нему в транс-положении концевыми атомами фтора в спектрах ЯМР 19F димерных комплексоов [M2F11]– (M = Nb, Ta, Sb, Ti) [6–9] и M2F10L (M = Nb, Ta) [10], величины которых лежат в интервале 150–175 Гц. Это подтверждает преимущественный характер межлигандных взаимодействий в октаэдрических комплексах d0-переходных металлов между лигандами, находящимися в транс-положении друг к другу, через центральный атом [11].
К стереоизомеру II комплекса цис-TiF4L2 мы отнесли две мультиплетные линии Б и Б' равной интенсивности и одинаковой мультиплетности, представляющие собой дублеты дублетов дублетов (дублеты триплетов). Мультиплет Б в слабом поле отвечает атомам фтора F2 в транс-положении к группе Р=О лиганда F2–Ti–OP…L, а Б' – атомам F1 на ординате F1–Ti–F1. Дополнительное расщепление линий Б и Б' вместо предполагаемых двух триплетов в результате спин-спинового взаимодействия между ядрами неэквивалентных атомов F1 и F2 может быть связано, как уже отмечалось выше, с конформационной изомерией L, возможностью их заторможенного вращения, либо с образованием группой ОН лиганда водородной связи с атомoм фтора. Образование в растворе стереоизомеров I и II комплекса цис-TiF4L2, по нашему мнению, связано с существованием лиганда L в виде рацемической смеси двух оптических активных R- и S-изомеров.
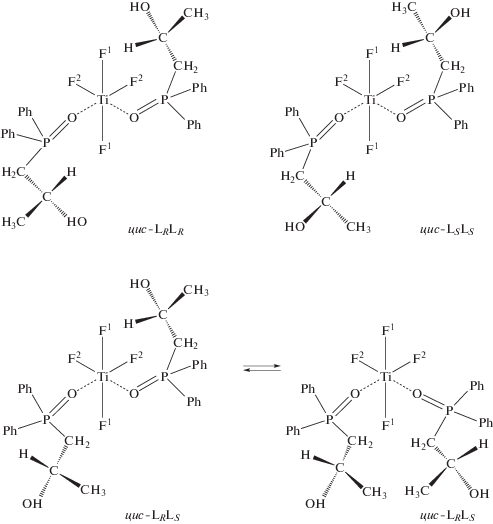
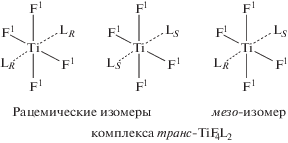
Комплекс цис-TiF4L2 может образовывать три оптических стереоизомера: цис-TiF4LRLR, цис-TiF4LSLS и цис-TiF4LRLS (cхема 1). Принимая во внимание присутствие лиганда как рацемической смеси энантиомеров, наблюдаемое равенство суммарных интенсивностей резонансных линий в спектре ЯМР 19F изомеров I и II, а следовательно, и равенство их концентраций, является косвенным подтверждением существования в растворе трех стереоизомеров комплекса цис-TiF4L2. В соответствии с теорией равновероятного распределения лигандов [12], статистическая вероятность образования оптических стереоизомеров, содержащих две правовращающие или левовращающие молекулы лиганда, цис-TiF4LRLR и цис-TiF4LSLS в два раза ниже, чем цис-TiF4LRLS, и, следовательно, суммарная концентрация первых двух должна быть равной концентрации последнего, что и наблюдается экспериментально (рис. 2).
Схема 1.
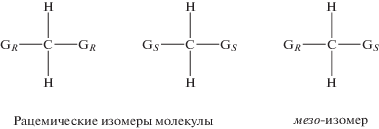
Для отнесения групп линий А, А', А" и Б, Б' в спектрах ЯМР 19F к возможным стереоизомерам комплекса цис-TiF4L2 мы взяли за основу фундаментальные работы по определению стереохимической конфигурации хиральных молекул органических соединений методом спектроскопии ЯМР [13, 14], в частности, рассмотрение органических молекул, имеющих два ассиметрических центра, разделенных одним атомом углерода. Молекулы, содержащие симметрично расположенные хиральные группы (GR, GS), могут существовать в двух формах, называемых мезо- или оптически неактивным изомером и рацемическими изомерами (схема 2) [13]. Для таких молекул предполагалось [15], что соотношения симметрии между протонами позволят различать мезо- и рацемические изомеры методом ЯМР.
Схема 2.
В рацемических изомерах две хиральные группы (GR или GS) имеют одинаковую абсолютную конфигурацию, тогда как в мезо-форме они имеют противоположную конфигурацию [13]. Из этого следует, что в рацемических изомерах два протона мостикового атома углерода могут поменяться операцией симметрии С2 и поэтому должны быть изохронными [13].
В мезо-изомере протоны у мостикового атома углерода не могут быть совмещены никакой операцией симметрии, они являются диастереотопными и должны быть анизохронными [13].
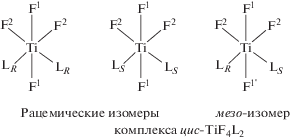
По нашему мнению, такое рассмотрение можно применить и к возможным оптическим стереоизомерам I и II октаэдрических комплексов цис-TiF4L2, если атом углерода заменен на атом титана, а атомы водорода – на аксиальные атомы фтора F1 (схема 3).
Схема 3.
В рацемических стереоизомерах октаэдрического комплекса цис-TiF4LRLR и цис-TiF4LSLS, содержащих симметрично расположенные лиганды LR или LS, аксиальные атомы фтора можно совмещать путем вращения вокруг оси С2 – биссектрисы угла OTiO (схема 1), лежащей в экваториальной плоскости октаэдра перпендикулярно ординате F1–Ti–F1. Из этого следует, что в рацемических изомерах при условии одинаковой абсолютной конфигурации координированных лигандов L атомы фтора F1 должны быть изохронными и их химические сдвиги в спектрах ЯМР не различаются.
В мезо-стереоизомере октаэдрического комплекса цис-TiF4LRLS лиганды, координированные к центральному иону, имеют противоположные конфигурации и аксиальные атомы фтора не связаны никакой операцией симметрии, поэтому анизохронны и могут различаться по химическим сдвигам.
Учитывая вышесказанное, стереоизомер I, в котором аксиальные атомы фтора F1 и F1', находящиеся в транс-положении друг к другу стерически неэквивалентны и различаются по химическим сдвигам и которому в спектре ЯМР 19F отвечают линии А, А', А", по нашему мнению, является мезо-стереоизомером октаэдрического тетрафторокомплекса цис-TiF4LRLS (схема 3).
Два мультиплета Б и Б' равной интенсивности и одинаковой мультиплетности мы отнесли к атомам фтора F1 и F2 рацемических стерео-изомеров II. Поскольку аксиальные атомы F1 эквивалентны и геометрическое расположение лигандов L относительно них симметрично, они изохронны и в спектре ЯМР 19F не различаются. По нашему мнению, мультиплеты Б и Б' отвечают атомам F1 и F2 оптически активных рацемических стереоизомеров цис-TiF4LRLR и цис-TiF4LSLS, присутствующих в растворе в равных концентрациях, т.е. в виде рацемической смеси. Их суммарная концентрация, в соответствии с теорией статистического распределения лигандов [12], должна быть равна концентрации мезо-цис-TiF4LRLS, что и наблюдается.
Малоинтенсивный узкий при комнатной температуре сигнал В при 139.4 м.д. (рис. 2) мы отнесли к присутствию в незначительной концентрации транс-TiF4L2. При снижении температуры этот сигнал разделяется на две перекрывающиеся резонансные линии: при 248 К наблюдаются узкая (136.12 м.д.) и широкая (136.24 м.д.) компоненты, которые мы отнесли к присутствию в растворе возможных стереоизомеров – рацемической смеси транс-TiF4LRLR и транс-TiF4LSLS и мезо-транс-TiF4LRLS соответственно (схема 4).
Схема 4.
Неэквивалентность экваториальных атомов фтора в спектрах ЯМР 19F стереоизомеров транс-TiF4L2, присутствующего в растворе лишь в незначительной концентрации, наблюдать не удалось. Это может быть связано с высокой скоростью вращения хиральных лигандов L при их геометрическим расположении на одной ординате октаэдра в транс-положении друг к другу.
Таким образом, на основе анализа спектров ЯМР 19F с применением концепции гетеротропности сделано заключение об относительной стереохимической конфигурации присутствующих в растворе хиральных и оптических мезо-стереоизомеров геометрических изомеров октаэдрического комплекса TiF4L2. В мезо-стереоизомере цис-TiF4LRLS (I), атомы фтора, расположенные на одной ординате октаэдра, в транс-положении друг к другу – F1 и F1' стерически неэквивалентны, различаются по величинам химических сдвигов и между ними наблюдается КССВ ${{J}_{{{\text{F1F1'}}}}}$.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
TiF4 получали фторированием порошка металла элементарным фтором в кварцевой системе. 1-Дифенилфосфорилпропан-2-ол, Ph2P(O)CH2CН(ОН)Ме (L) синтезировали в ИНЭОС РАН. Для исследования готовили раствор с отношением L : TiF4 > 2 : 1 в CH2Cl2, чтобы основной формой в растворе был комплекс TiF4L2. Расчетное количество TiF4 вводили в раствор L в CH2Cl2 и затем перемешивали на магнитной мешалке в течение 30 мин при комнатной температуре. При этом наблюдали полное растворение TiF4. Все операции проводили в атмосфере сухого азота. Спектры ЯМР 19F{1Н} и 31Р{1Н} в области 298–213 К регистрировали на спектрометре “Bruker” AVANCE 300 (ЦКП ИОНХ РАН). Химические сдвиги ЯМР 19F и 31Р измеряли относительно CCl3F и 85%-ной H3PO4 соответственно.
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований (номер государственной регистрации 01201353365).
Список литературы
Ильин Е.Г., Паршаков А.С., Яржемский В.Г. и др. // Докл. РАН. 2015. Т. 465. № 3. С. 314.
Ильин Е.Г., Паршаков А.С., Данилов В.В. и др. // Докл. РАН. 2016. Т. 471. № 2. С. 163.
Ильин Е.Г., Ковалев В.В., Нестерова Н.П. // Докл. Акад. наук. 2008. Т. 423. № 4. С. 493.
Ильин Е.Г., Паршаков А.С., Александров Г.Г. и др. // Докл. РАН. 2016. Т. 470. № 2. С. 176.
Игнатов М.Е., Ильин Е.Г., Ягодин В.Г., Буслаев Ю.А. // Докл. АН СССР. 1978. Т. 243. № 7. С. 1179.
Edwards A.J., Jones G.R. // J. Chem. Soc. A. 1970. P. 1491.
Brownstein S. // Inorg. Chem. 1973. V. 12. P. 584.
Dean P.A.W., Fergusson B.J. // Canad. J. Chem. 1974. V. 52. P. 667.
Ilyin E.G., Buslaev Yu.A. // J. Fluor. Chem. 1984. V. 25. № 1. P. 57.
Ilyin E.G., Buslaev Yu.A., Ignatov M.E. et al. // J. Fluor. Chem. 1978. V. 12. P. 381.
Buslaev Yu.A., Ilyin E.G. // Soviet Sci. Rev. B. 1987. V. 1. P. 1.
Calingaert G., Beatty H.A. // J. Am. Chem. Soc. 1939. V. 61. P. 2748.
Stereochemistry Fundamentals and Methods. V. 1 / Ed. Kagan H.B. Stuttgart GTB, 1977. P. 73.
Eliel E.L., Wilen S.H., Doile M.P. Basic Organic Stereochemistry. N.Y.: John Wiley & Sons, 2001. 704 p.
Mislow K., Raban M. Topics in Stereochemistry. V. I. N.Y.: Interscience Puplishers, 1967. P. 73.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия