Координационная химия, 2019, T. 45, № 5, стр. 297-305
Магнитно-активные комплексы 3d-металлов с 3-амино-4-этоксикарбонилпиразолом
Л. Г. Лавренова 1, 2, *, А. Д. Иванова 1, 2, А. С. Богомяков 2, 3, В. Ю. Комаров 1, 2, Л. А. Шелудякова 1, 2
1 Институт неорганической химии им. А.В. Николаева СО РАН,
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
3 Международный томографический центр СО РАН
Новосибирск, Россия
* E-mail: ludm@niic.nsc.ru
Поступила в редакцию 03.08.2018
После доработки 16.11.2018
Принята к публикации 19.11.2018
Аннотация
Синтезированы координационные соединения железа(II) и никеля(II) с 3-амино-4-этоксикарбонилпиразолом (L) состава FeL2A2 (A = Cl– (I), ${{{\text{C}}}_{{\text{2}}}}{\text{N}}_{{\text{3}}}^{-}$ (II)), [FeL2(NCS)2(H2O)2] (III), NiL2Br2 (IV). Соединения изучены методами РФА, ИК- и электронной спектроскопии (спектры диффузного отражения, СДО). Для комплекса III получен монокристалл и методом РСА (СIF file CCDC № 1857220) определена кристаллическая структура. Показано, что L координируется к металлу монодентатно атомом N(2) пиразольного цикла. Изучение температурной зависимости µэфф(Т) в диапазоне 2–300 K показало, что в комплексах между ионами M2+ наблюдаются обменные взаимодействия антиферро- или ферромагнитного характера. Тип обменных взаимодействий зависит от состава соединения.
Координационные соединения, обладающие откликом на изменение внешних условий, привлекают внимание исследователей. К этому классу относятся комплексы металлов с азотсодержащими гетероциклическими лигандами. В комплексах 3d-металлов с электронной конфигурацией d4–d7 октаэдрического или псевдооктаэдрического строения координационного полиэдра наблюдается спин-кроссовер 1А1 → 5Т2. Изменение спиновой мультиплетности в данных соединениях происходит при определенной силе поля лигандов под влиянием температуры, давления или света определенной длины волны [1–3]. В комплексах Co(II), Ni(II) и Cu(II) с азотсодержащими лигандами, имеющих олиго- или полиядерное строение, проявляются обменные взаимодействия между неспаренными электронами ионов металлов антиферромагнитного или ферромагнитного характера.
Необходимым условием для реализации магнитных фазовых переходов являются кооперативные взаимодействия, наблюдающиеся в твердой фазе комплексов. Для получения соединений, обладающих такими свойствами, необходимо соединить парамагнитные центры мостиками – цепочкой атомов или одним мостиковым атомом (ионом). Эти цепочки (обменные каналы) не должны быть очень длинными, чтобы расстояние между ионами металла было не слишком велико [4–6]. Поиск новых молекулярных ферромагнетиков является важной задачей современной химии. По мнению А.Л. Бучаченко, “ферромагнетики принадлежат к числу материалов, составляющих фундамент современной цивилизации” [7]. В работах Р.З. Сагдеева и В.И. Овчаренко [6] развивается направление синтеза и исследования магнитно-активных комплексов металлов с парамагнитными лигандами. Мы проводили поиск новых комплексов переходных металлов, обладающих магнитной активностью, с диамагнитными полиазотсодержащими лигандами.
Полиазотсодержащие гетероциклы – перспективный класс лигандов для синтеза магнитно-активных соединений. В частности, синтезированы и исследованы представительные ряды комплексов 3d-металлов с 1,2,4-триазолами. 1,2,4-Триазол и его производные, не имеющие в боковой цепочке способных к координации заместителей, присоединяются к металлу преимущественно по бидентатно-мостиковому типу, благодаря чему образуются олиго- и/или полиядерные соединения [3, 8, 9]. В комплексах железа(II) с данной группой лигандов наблюдается спин-кроссовер [1, 3, 8], а в полиядерных комплексах кобальта(II), никеля(II) и меди(II) проявляются обменные взаимодействия [6, 9]. Наиболее часто эти взаимодействия антиферромагнитные. Вместе с тем в ряде соединений, в частности в комплексах Cu(II) и Ni(II) с незамещенным 1,2,4-триазолом, 4-этил-, 3,5-дифенил-4-амино-, 4-(3,4-дихлорфенил-1,2,4-триазолами обнаружены обменные взаимодействия ферромагнитного характера [10–13].
Пиразолы, не имеющие заместителей, способных к координации, присоединяются к металлу преимущественно монодентатно атомом N(2) гетероцикла (в отличие от пиразолат-ионов, которые, подобно 1,2,4-триазолам, координируются по бидентатно-мостиковому типу). Таким образом, для получения олиго- и полиядерных соединений металлов с пиразолами необходимо использовать атомы или группы атомов, которые потенциально могут проявлять мостиковую функцию. В [14] сообщалось о синтезе и исследовании ди- и тетраядерных комплексов меди(II) с производными пиразола, в которых обнаружены антиферромагнитные обменные взаимодействия. Ранее мы синтезировали и исследовали соединения хлоридов с 3-амино-4-этоксикарбонилпиразолом (L) состава ML2Cl2 (M = Co(II), Ni(II), Cu(II)) и CuL2Br2 [15, 16]. Комплексы имеют полиядерное цепочечное строение за счет мостиковой функции хлорид- и бромид-ионов. Изучение зависимости µэфф(Т) в диапазоне 2–300 K показало, что в комплексах хлоридов состава ML2Cl2 между парамагнитными ионами M2+ проявляются ферромагнитные обменные взаимодействия, а для CoL2Cl2 и NiL2Cl2, обнаружен переход в магнитно-упорядоченное состояние с температурой Кюри Тс ~ 10–12 K. Замена в составе комплекса CuL2Hal2 хлорид-иона на бромид-ион приводит к изменению характера обменных взаимодействий с ферромагнитного в CuL2Cl2 на антиферромагнитный в CuL2Br2.
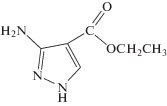
Представлялось целесообразным продолжить исследования в этом направлении. С этой целью мы синтезировали и изучили магнитные свойства новых комплексов Fe(II) и Ni(II) с 3-амино-4-этоксикарбонилпиразолом:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза комплексов использовали NiBr2 ∙ ∙ 3H2O и KNCS квалификации “х. ч.”, FeCl2 · 4H2O и FeSO4 · 7H2O фирмы Acros Organics, 3-амино-4-этоксикарбонилпиразол (L) и NaC2N3 фирмы Aldrich, этанол “ректификат”.
Синтез FeL2Cl2 (I). 0.001 моля (0.20 г) FeCl2 · · 4H2O и 0.2 г аскорбиновой кислоты растворяли совместно в смеси 5 мл этанола и 2 мл воды, раствор подкисляли 2 каплями концентрированной HCl. 0.002 моля (0.31 г) L растворяли в 5 мл этанола и прибавляли раствор лиганда к раствору FeCl2. Полученный раствор упаривали на водяной бане до начала выпадения осадка и охлаждали в кристаллизаторе со льдом. Выпавший белый осадок отфильтровывали на фильтре Шотта (16 пор), промывали 2 раза небольшими порциями этанола и высушивали на воздухе. Аналогично отфильтровывали и высушивали остальные осадки. Выход 0.36 г (82%).
Синтез FeL2(C2N3)2 (II). 0.001 моля (0.28 г) FeSO4 · 7H2O и 0.2 г аскорбиновой кислоты растворяли совместно в 8 мл воды при нагревании. К этому раствору прибавляли 0.006 моля (0.53 г) NaC2N3 и перемешивали до его полного растворения. Затем приливали раствор 0.002 моля (0.32 г) L в 6 мл этанола. Раствор упаривали до половины первоначального объема на водяной бане, затем охлаждали в кристаллизаторе со льдом. Выпавший белый осадок отфильтровывали и промывали водой и этанолом. Выход 0.44 г (88%).
Синтез [FeL2(NCS)2(H2O)2] (III). 0.0005 моля (0.14 г) FeSO4 · 7H2O и 0.2 г аскорбиновой кислоты растворяли совместно в 5 мл воды при нагревании. К этому раствору прибавляли 0.003 моля (0.29 г) KNCS, перемешивали до полного его растворения и затем приливали раствор 0.003 моля (0.47 г) L в 6 мл этанола. Раствор упаривали до половины первоначального объема и охлаждали в кристаллизаторе со льдом. Выпавший белый осадок отфильтровывали и промывали водой и этанолом. Выход 0.27 г (52%). Монокристаллы комплекса получали из маточного раствора при медленном испарении растворителя.
Синтез NiL2Br2 (IV). 0.003 моля (0.82 г) NiBr2 · 3H2O растворяли в 7 мл этанола, 0.003 моля (0.47 г) L – в 5 мл этанола при нагревании. Растворы смешивали и удаляли избыток растворителя упариванием до 1/3 от первоначального объема на водяной бане. Выпавший жeлто-зелeный осадок отфильтровывали и промывали водой и этанолом. Выход 0.24 г (43%).
Элементный анализ комплексов выполняли в аналитической лаборатории ИНХ СО РАН на приборе EURO EA 3000 фирмы EuroVector (Италия).
Рентгенографию поликристаллических образцов выполняли на дифрактометре Shimadzu XRD 7000 (CuKα-излучение, Ni-фильтр, сцинтилляционный детектор) при комнатной температуре. Образцы растирали в гептане и наносили на полированную сторону кварцевой кюветы. Съемку проводили в диапазоне углов 5°–60° с шагом 0.03° и экспозицией 1 с/точку. На всех дифрактограммах наблюдаются острые дифракционные пики, свидетельствующие о наличии кристаллических фаз. Положения наблюдаемых рефлексов в интервале 2θ от 5° до 20° приведены в табл. 1. В программе Topas–Academic version 6 [17] сравниваются экспериментальные дифрактограммы и ряд дифрактограмм, рассчитанных по известным структурным моделям. На всех дифрактограммах отсутствуют дифракционные рефлексы от структурно охарактеризованных исходных реагентов (CCDC № 631805 (L), 143569 (NaC2N3); ICSD № 16589 (FeSO4 · 7H2O), 9198 (FeCl2 · 4H2O)) и возможных неорганических продуктов реакций ионного обмена и изменения гидратного числа (ICSD № 15597 (FeCl2 · 2H2O), 249781 (Na2SO4 · 7H2O), 249782 (Na2SO4 · 8H2O), 30505 (Na2SO4 · 10H2O). Дифрактограмма III согласуется с рассчитанной для структуры FeL2(NCS)2(H2O)2, описанной в данной статье, с параметрами элементарной ячейки a = 22.459(7), b = 7.041(2), c = 14.912(4) Å; β = 105.63(3)°; V = 2271(1) Å3.
Таблица 1.
Положения наблюдаемых рефлексов на дифрактограммах поликристаллических образцов I–IV в диапазоне углов 2θ 5°–20° (CuKα)*
| Oбразец | 2θ, град |
|---|---|
| I | <5.00; 9.56; 14.12; 14.36; 16.32; 16.61; 19.85 |
| II | 12.59; 13.08; 13.48; 14.53; 15.80; 16.56; 17.14; 18.52 |
| III | 12.34; 14.12; 15.09; 16.42; 17.55; 18.88; 19.76 |
| IV | 5.08; 9.64; 10.20; 13.04; 13.20; 13.70; 14.48; 15.36; 16.58; 19.10; 19.97 |
РСА кристаллa III выполнен по стандартной методике на автоматическом четырехкружном дифрактометре Bruker APEX Duo с двухкоординатным CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор). Основные кристаллографические данные и детали уточнения приведены в табл. 2. Обработка данных проведена с использованием пакета программ APEX II [18]. Поглощение учтено эмпирически по интенсивностям эквивалентных отражений (SADABS). Структура расшифрована прямым методом и уточнена полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов с использованием комплекса программ SHELXTL [18, 19] и графической оболочки OLEX2 [20]. Атомы водорода 2-метил-1,2,4-триазоло[1,5-а]бензимидазола заданы геометрически и уточнены по модели “наездника”. Атомы Н молекул воды локализованы из разностного синтеза Фурье и уточнены в изотропном приближении с фиксированными значениями Uiso(H) = 1.5Ueq(O). Координаты атомов и величины тепловых параметров депонированы в Кембриджском банке структурных данных (ССDС № 1857220; http:// www.ccdc.cam.ac.uk/data_request/cif).
Таблица 2.
Основные кристаллографические данные эксперимента для структуры III
| Параметр | Значение |
|---|---|
| М | 518.36 |
| a, Å | 22.411(10) |
| b, Å | 7.0325(3) |
| c, Å | 14.7646(8) |
| β, град | 104.611(2) |
| Пр. гр. | С2/c |
| Z | 4 |
| Размер кристалла, мм | 0.32 × 0.16 × 0.10 |
| V, Å3 | 2251.7(2) |
| ρ(выч.), г/см3 | 1.529 |
| μ, мм–1 | 0.903 |
| Число измеренных/ независимых рефлексов |
7417/2907 |
| Число уточняемых параметров | 157 |
| Rint/Rσ | 0.0234/0.0309 |
| GООF | 1.079 |
| R1/wR2 для I > 2σ(I) | 0.0362/0.0794 |
| R1/wR2 по всем данным | 0.0486/0.0856 |
| Остаточная электронная плотность (min/max), e Å–3 | –0.30/0.54 |
ИК-спектры поглощения снимали на спектрометрах Scimitar FTS 2000 и Vertex 80 в области 4000–100 см–1. Образцы готовили в виде суспензий в вазелиновом и фторированном маслах и полиэтилене. Спектры диффузного отражения регистрировали на сканирующем спектрометре UV-3101 PC фирмы Shimadzu при комнатной температуре.
Магнитные свойства поликристаллических образцов изучали на SQUID-магнетометре MPMS-XL фирмы Quantum Design в интервале 2–300 K и в магнитном поле 5 кЭ. При вычислении парамагнитной составляющей молярной магнитной восприимчивости (χ) вводили диамагнитные поправки согласно аддитивной схеме Паскаля. В парамагнитной области определяли эффективный магнитный момент (µэфф) по формуле
где k – постоянная Больцмана, NA – число Авогадро, µB – магнетон Бора.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплексы I–IV выделяли из водно-этанольных растворов при различных соотношениях M : L (в зависимости от металла и аниона). Соединения железа(II) получали в присутствии аскорбиновой кислоты в качестве восстановителя и слабо подкисляющего реагента.
Согласно данным РСА, в молекулярном комплексе [FeL2(NCS)2(H2O)2] (рис. 1), ион железа(II) находится в центре инверсии. Координационный узел FeN4O2 с геометрией слабо-искаженного октаэдра образован атомами азота двух пиразольных лигандов (N(11), N(1) пиразольного цикла по нумерации ИЮПАК), атомами азота роданид-ионов N(1) и двумя атомами кислорода молекул воды O(1). В соответствии с симметрией все однотипные лиганды находятся в транс-положениях. В табл. 3 приведены некоторые длины связей и валентные углы в структуре III и их сравнение с данными из CCDC [21]. Средние значения и стандартные отклонения длин связей приведены для поисков по комплексам Fe(II) с пиразолсодержащими лигандами (Fe–N(L)), соединениям Fe(II) с NCS, координированным атомом азота (Fe–N(NCS)) и комплексам Fe(II) с аквалигандами (Fe–O). Расстояниe Fe–O в III типичнo для комплексов Fe(II) с аквалигандами. Расстояние Fe–N(NCS) немного больше известных на данный момент. Pасстояние Fe–N(L) попадает на второй максимум бимодального распределения, что свидетельствует о высокоспиновoм состоянии Fe(II) в комплексе III. Геометрические характеристики лиганда L имеют значения, близкие с определенными ранее для комплексов с другими центральными атомами [22]. Удлинение эллипсоида атомного смещения для азота аминогруппы указывает на отсутствие полного сопряжения с ароматической системой, что характерно для других исследованных структур с похожими фрагментами [22] и подтверждается квантово-химическими расчетами [23]. Конформация лиганда L в III стабилизирована внутримолекулярной водородной связью между аминогруппой и карбоксильным атомом кислорода (рис. 2а).
Рис. 1.
Структура комплекса [FeL2(H2O)2(NCS)2]. Эллипсоиды атомных смещений приведены для 50%-ной вероятности.
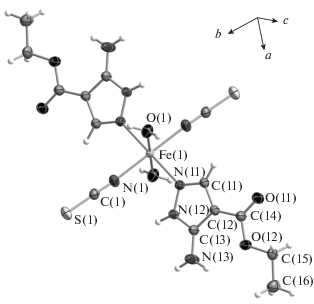
Таблица 3.
Некоторые длины связей и валентные углы в структуре III и их сравнение с литературными данными [21]
| Длина связи/угол | d, Å/ω, град | Pаспределения по CCDC (в фигурных скобках – количество соответствий) |
|---|---|---|
| Fe–N(L) | 2.151(2) | 1.98(3) и 2.18(4) {603} |
| Fe–N(NCS) | 2.140(2) | 1.90–2.12 {3} |
| Fe–O | 2.142(2) | 2.11(6) {267} |
| N(L)FeN(NCS) | 90.33(6)/89.67(6) | |
| N(L)FeO | 92.47(6)/87.53(6) | |
| N(NCS)FeO | 92.20(7)/87.80(7) |
Рис. 2.
Водородно-связанные цепочки вдоль направления b (а) и различия в межмолекулярных контактах между органическими лигандами из разных цепочек: вид вдоль водородно-связанных цепочек (б), контакты –NH2…–COO– между цепочками из одного “слоя” (в) и контакты –NH2…–NH2 и –COO–…–COO– между цепочками из разных слоев (г).
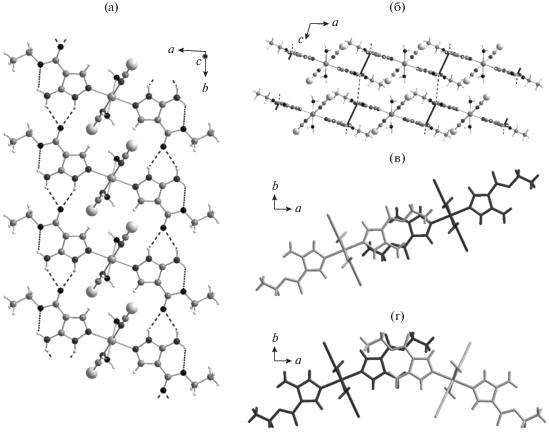
В структуре III имеются цепочки, образованные водородными связями (ВС), между карбоксильным кислородом и атомами водорода аминогруппы и пиразольного кольца, расположенными вдоль кристаллографического направления b (рис. 2а). Можно предположить наличие сильного межмолекулярного взаимодействия между аминогруппами одной цепочки и карбоксильными группами другой, приводящего к формированию слоев, параллельных плоскости ab, состоящих из водородно-связанных цепочек (рис. 2б). Кратчайшие расстояния между неводородными атомами двух соседних молекул A и B из одного слоя C(14A)–N(13B) 3.459(4) и O(12A)–N(13B) 3.574(3) Å (рис. 2в). Аналогичные взаимодействие между молекулами из разных слоев, по-видимому, носят менее выгодный характер из-за сближения двух амино- и двух карбоксильных групп N(13A)–N(13B) 4.111(4), O(12A)–O(12B) 3.838(3) и O(12A)–C(14B) 3.793(3) Å (рис. 2г).
В табл. 4 представлены колебательные частоты и их отнесение для функциональных групп лиганда L и комплексов I–IV. В ИК-спектре L в высокочастотной области, кроме узкой полосы ν(NH2) при 3480 см–1, присутствует широкая структурированная полоса в интервале 3300–2400 см–1, указывающая на наличие ВС, в образовании которых могут участвовать группы NH, NH2 и C=O. В спектрах всех комплексов полосы ν(NH) смещаются в высокочастотную область по сравнению с их положением в спектре лиганда L. По-видимому, это связано с изменением характера ВC при комплексообразовании. Полосы ν(C=O) также сдвигаются в область высоких энергий, что свидетельствует об отсутствии координации групп C=O к иону металла. Характер спектров в диапазоне колебаний кольца и появление полос в низкочастотной области, отсутствующих в спектре лиганда L (табл. 4), которые можно отнести к ν(M–N), указывают на координацию атомов азота пиразольного кольца к металлу. В ИК-спектре комплекса II полосы аниона $\nu ({\text{N}}\left( {{\text{CN}}} \right)_{{\text{2}}}^{--}$)сдвигаются как в низкочастотную, так и в высокочастотную область, что говорит о вхождении этого аниона в состав координационного узла иона Fe2+. В ИК-спектре III наблюдается расщепление полосы ν(NCS–) и ее заметный сдвиг по сравнению со спектром соли KNCS [24] в область высоких энергий. Это свидетельствует о координации роданид-иона к Fe2+, что согласуется с данными РСА.
Таблица 4.
Основные колебательные частоты в спектрах L, комплексов I–IV, Na(N(CN)2) и KNCS
| ν, см–1 | |||||||
|---|---|---|---|---|---|---|---|
| L | I | II | III | IV | NaN(CN)2 | KNCS | Отнесение |
| 3480 3295 пл. 3238 3203 |
3483 3461 3355 3335 |
3496 3376 3344 3280 |
3491 3371 ш. 3322 пл. 3211 |
3457 3424 3353 3314 |
ν(NH2) ν(NH) ν(OH) + ν(NH) (для 3) |
||
| 3049 2980 2905 2861 |
3088 2978 2925 2859 |
3080 2995 2959 2901 |
3074 2997 2964 2899 |
3079 2989 2934 2857 |
ν(CH)кольцо $\nu {{({\text{CH}})}_{{{\text{O}}{{{\text{C}}}_{2}}{{{\text{H}}}_{5}}}}}$ |
||
| 2292 2237 2175 |
2287 2233 2182 |
νs+ νas(C–N) νas(C≡N) νs(C≡N) |
|||||
| 2106 2057 |
2053 | ν(NCS–) | |||||
| 1672 1621 |
1694 1623 |
1686 1627 |
1667 1628 |
1685 1619 |
ν(C=O) δ(NH2) |
||
| 1557 1521 1502 |
1571 | 1561 1545 |
1562 1548 |
1561 | Rкольца | ||
| 229 | 247 | 234, 255 | 246 | ν(M–N) | |||
| 173 | 145 | ν(M–Hal) | |||||
В низкочастотной области спектров комплексов I и IV проявляются полосы 173 и 145 см–1, отнесенные к колебаниям ν(M–Cl) и ν(M–Br) соответственно. Положение этих полос позволяет предполагать мостиковую координацию галогенид-ионов к ионам металла и образование цепочечных полиядерных соединений I и IV. Об этом свидетельствует существенный сдвиг полос ν(M–Cl) и ν(M–Br) в ИК-спектрах I, IV в диапазоне 600–100 см–1 в область малых энергий по сравнению с их положением в спектрах комплексов, содержащих координированные концевые галогенид-ионы.
В СДО комплексов железа(II) I–III наблюдаются полосы, которые можно отнести к d–d-переходу 5Т2 → 5Е в слабом искаженно-октаэдрическом поле лигандов (табл. 5). Положение максимумов этих полос 10 638 (I), 11 669 (II), 11 933 см–1 (III) согласуется с литературными данными для высокоспиновых октаэдрических комплексов железа(II) с азотсодержащими лигандами [3, 25]. Полученные нами ранее данные для комплексов M(II) с L (в том числе данные РСА [16]), а также определение кристаллической структуры комплекса III в настоящей работе и анализ ИК-спектров I–IV свидетельствуют о монодентатной координации L во всех соединениях. Координационные узлы в I, II и IV дополняются до октаэдрических за счет мостиковой функции анионов Cl–, ${\text{N}}\left( {{\text{CN}}} \right)_{{\text{2}}}^{--}$ и Br– соответственно.
Таблица 5.
Параметры СДО комплексов I–IV
| Соединение | λmax, нм | Отнесение полос |
|---|---|---|
| FeL2Cl2 (I) | 940 | 5T2 → 5E |
| FeL2(C2N3)2 (II) | 857 | 5T2 → 5E |
| [FeL2(H2O)2(NCS)2] (III) | 838 | 5T2 → 5E |
| NiL2Br2 (IV) | 722 1292 |
3A2 → 3T1(F) 3A2 → 3T2 |
Анализ спектров NaN(CN)2 и комплекса II, а также сравнение с литературными данными для комплексов с азотсодержащими лигандами и дицианамид-ионами, в которых анион координируется к металлу по бидентатно-мостиковому типу [26–29], показывает, что характер смещения полос при координации аниона к металлу свидетельствует о бидентатно-мостиковой координации этого аниона.
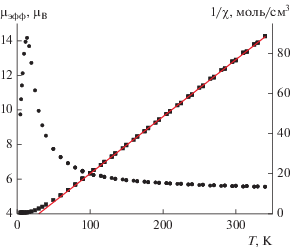
Зависимости µэфф(T) и 1/χ(T) для I представлены на рис. 3. При 300 K значение µэфф составляет 5.55 µB и при понижении температуры постепенно возрастает до 14.15 µB при 14 K, после чего резко уменьшается до 9.73 µB при 5 K. Зависимость 1/χ(T) в интервале 300–50 K описывается законом Кюри–Вейсса с оптимальными значениями постоянных Кюри C и Вейсса θ, равными 3.51 K см3/моль и 29.7 K. Высокотемпературное значение µэфф и константа Кюри несколько выше теоретических чисто спиновых значений 4.90 µB и 3.00 см3/моль для иона Fe2+. Увеличение величины µэфф при понижении температуры и положительное значение константы Вейсса свидетельствуют о том, что в соединении I наблюдаются обменные взаимодействия ферромагнитного характера. Уменьшение µэфф ниже 14 K может быть связано с эффектами насыщения в магнитном поле и/или наличием более слабых обменных взаимодействий антиферромагнитного характера.
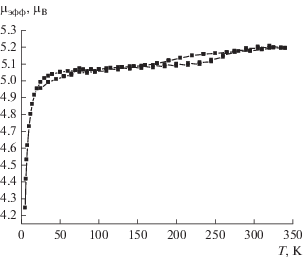
Зависимость µэфф(T) для комплекса III представлена на рис. 4. Значение µэфф при 340 K составляет 5.19 µB и при понижении температуры до 290 K практически не изменяется, после чего наблюдается небольшое уменьшение (до 5.10 µB) при 230 K. При дальнейшем охлаждении µэфф не изменяется вплоть до 50 K, после чего уменьшается до 4.25 µB при 5 K. Высокотемпературное значение µэфф согласуется с теоретической чисто спиновой величиной 4.97 µB для одного иона Fe2+ со спином S = 2 при g-факторе, равном 2.
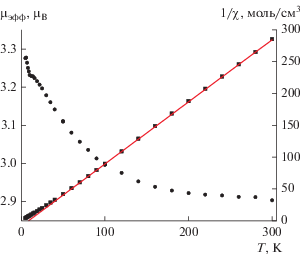
Зависимости µэфф(T) и 1/χ(T) для IV представлены на рис. 5. При 300 K значение µэфф составляет 2.90 µB и при понижении температуры постепенно возрастает до 3.27 µB при 5 K. Зависимость 1/χ(T) в интервале 300–50 K описывается законом Кюри–Вейсса с оптимальными значениями постоянных Кюри C и Вейсса θ, равными 1.02 K см3/моль и 8.4 K. Высокотемпературное значение µэфф и константа Кюри хорошо согласуются с теоретическими чисто спиновыми значениями 2.83 µB и 1.00 см3/моль для иона Ni2+.
Увеличение µэфф(T) при понижении температуры и положительное значение постоянной Вейсса указывают на доминирование обменных взаимодействий ферромагнитного характера между спинами ионов Ni2+.
Таким образом, мы синтезировали и охарактеризовали ряд новых комплексов Fe(II) и Ni(II) c 3-амино-4-этоксикарбонилпиразолом. Показано, что в комплексе III между ионами Fe2+ наблюдаются обменные взаимодействия антиферромагнитного характера, а в комплексах I и IV между ионами Fe2+ и Ni2+, соответственно, проявляются обменные взаимодействия ферромагнитного характера.
Авторы выражают благодарность И.В. Юшиной за съемку СДО и Н.П. Короткевич – за получение дифрактограмм.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (гранты № 16-53-00020 Bel_a и № 18-53-00006 Bel_а).
Список литературы
Spin Crossover in Transition Metal Compounds I–III / Eds. Gutlich P., Goodwin H. Top Curr. Chem. Springer Verlag, 2004. V. 233–235.
Halcrow M.A. Spin-Crossover Materials Properties and Applications. U.K: J. Wiley & Sons Ltd., 2013. 562 p.
Lavrenova L.G., Shakirova O.G. // Eur. J. Inorg. Chem. 2013. № 5–6. P. 670.
Inoue M., Kubo M. // Coord. Chem. Rev. 1976. V. 21. № 1. P. 1.
Бучаченко А.Л. // Успехи химии. 1990. Т. 59. № 4. С. 529.
Овчаренко В.И., Сагдеев Р.З. // Успехи химии. 1999. Т. 68. С. 381.
Бучаченко А.Л. // Изв. АН. Сер. хим. 2011. № 12. С. 2393.
Лавренова Л.Г., Ларионов С.В. // Коорд. химия. 1998. Т. 24. № 6. С. 403.
Haasnoot J.G. // Coord. Chem. Rev. 2000. V. 200–202. P. 131.
Engelfried D.W., Groeneveld W.L., Nap G.M. // Z. Naturforsch. A. 1980. V. 35. P. 1382.
Vos G., Haasnoot J.G, Verschoor C.C. et al. // Inorg. Chim. Acta. 1985. V. 105. P. 31.
Бушуев М.Б., Вировец А.В., Наумов Д.Ю. и др. // Коорд. химия. 2006. V. 32. № 5. С. 323. (Bushuev M.B., Virovets A.V., Naumov D.Yu. et al. // Russ. J. Coord. Chem. 2006. V. 32. № 5. P. 309. doi https://doi.org/10.1134/ S1070328406050010).
Лидер Е.В., Лавренова Л.Г., Шведенков Ю.Г. и др. // Коорд. химия. 2007. Т. 33. № 1. С. 39. (Lider E.V., Lavrenova L.G., Shvedenkov Yu.G. et al. // Russ. J. Coord. Chem. 2007. V. 33. № 1. P. 37. doi https://doi.org/10.1134/ S107032840701006X).
Keij F.S., Haasnoot J.G., Oosterling A.J. et al. // Inorg. Chim. Acta. 1991. V. 181. P. 185.
Лавренова Л.Г., Жилин А.С., Богомяков А.С. и др. // Журн. структур. химии. 2013. Т. 54. № 4. С. 668.
Лавренова Л.Г., Иванова А.Д., Богомяков А.С. и др. // Коорд. химия. 2015. Т. 41. № 2. С. 85.
Coelho A.A. // J. Appl. Cryst. 2018. V. 51. P. 210.
APEX2 (version 1.08), SAINT (version 7.03), SA-DABS (version 2.11), SHELXTL (version 6.12). Madison (WI, USA): Bruker AXS Inc., 2004.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Groom C.R., Bruno I.J., Lightfoot M.P., Ward S.C. // Acta Crystallogr. B. 2016. V. 72. P. 171.
Berezin A.S., Ivanova A.D., Komarov V.Yu. et al. // New J. Chem. 2018. V. 42. P. 4902.
Sukhikh T.S., Komarov V.Yu., Konchenko S.N., Benassi E. // Polyhedron. 2018. V. 139. P. 33.
Накамото К. ИК спектры и спектры КР неорганических и координационных соединений. М: Мир, 1991.
Ливер Э. Электронная спектроскопия неорганических соединений. Т. 2. М.: Мир, 1987. 443 с.
De La Pinta N., Martin S., Urtiaga M. K. // Inorg. Chem. 2010. V. 49. № 22. P. 10445.
Kohler Von H., Kolbe A., Lux G. // Z. Anorg. Allg. Chem. 1977. V. 428. P. 103.
Mautner F.A., Traber M., Fischer R.C. et al. // Polyhedron. 2017. V. 138. P. 13.
Vangdal B., Carranza J., Lloret F. et al. // Dalton Trans. 2002. P. 566.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия