Координационная химия, 2019, T. 45, № 7, стр. 387-391
Синтез, кристаллическая структура и люминесцентные свойства молекулярного комплекса трифторацетата кадмия(II) c трифенилфосфином
Ю. В. Кокунов 1, В. В. Ковалев 1, *, Ю. Е. Горбунова 1, А. В. Чураков 1, С. А. Козюхин 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: kovavlad@igic.ras.ru
Поступила в редакцию 03.12.2018
После доработки 29.01.2019
Принята к публикации 11.02.2019
Аннотация
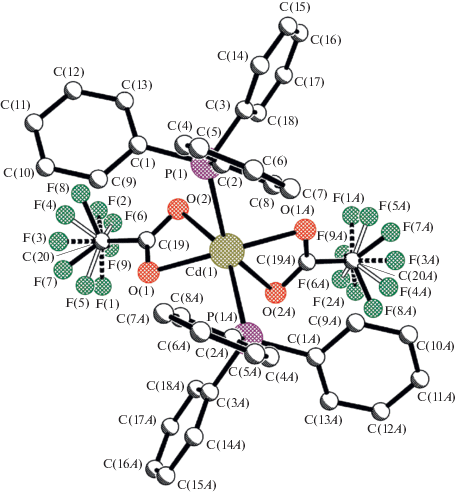
Синтезировано соединение кадмия [Cd(CF3COO)2(Ph3P)2] и определена его кристаллическая структура. Кристаллы моноклинные: пр. гр. C2/c, a = 20.318(4), b = 10.432(2), c = 18.661(4) Å, β = 104.18(1)°, V = 3834.8(13) Å3, Z = 4, ρ(выч.) = 1.495 г/см3. Атом Cd, расположенный на кристаллографической оси второго порядка, имеет искаженную октаэдрическую координацию за счет четырех атомов кислорода кристаллографически эквивалентных лигандов трифторацетата и двух атомов фосфора трифенилфосфина. Атомы фтора трифторацетатных групп статистически разупорядочены по трем равновероятным позициям каждый. Соединение обладает люминесцентными свойствами.
Фосфиновые лиганды продолжают играть большую роль в координационной и элементорганической химии переходных d-металлов, которые широко используются в катализе [1]. Элементы главных подгрупп также образуют комплексные соединения с фосфинами, хотя их исследования встречаются заметно реже [2]. Фосфиновые комплексы Zn(II), Cd(II) и Hg(II) известны давно. Однако более поздние работы в основном касались соединений Zn(II) и Hg(II). Основные типы комплексов кадмия с фосфинами были установлены ранее, но только небольшое число работ появилось в последнее время [2]. Из-за широкого применения кадмия в промышленных изделиях и его токсических свойств удалению Cd из водных сред уделяется большое внимание, в частности с использованием органофосфорных производных [3]. С этими лигандами соли кадмия образуют как дискретные, так и димерные соединения c тетраэдрическим и пятикоординационным окружением Cd(II) [4–10].
Известно, что состав и строение фосфиновых комплексов Cd(II) зависят от природы противоионов и объемных характеристик фосфинов. Галогенидные комплексы имеют, как правило, составы CdHal2(Ph3P)2 и Cd2Hal4(Ph3P)2 с искаженным тетраэдрическим окружением иона металла. Ион Cd2+ имеет октаэдрическое строение в Cd[P(цикло-C6H11)3]2(NO3)2 ⋅ CH2Cl2 с алифатическим фосфином и NO3-группой. Полимерное строение наблюдается в соединении CdCl2(PhMe2P) с мостиковыми атомами хлора и пятикоординационным окружением центрального атома в форме тригональной бипирамиды. При использовании хелатного аниона в соединении Cd(Et2NCS2)2PEt3 у иона Cd2+ реализуется искаженная тетрагональная пирамида. Сведения о комплексах Cd(II), содержащих одновременно трифенилфосфин и карбоксилатные группы ограничены только данными о синтезе и структуре [Cd(CF3COO)2(Ph3P)]2 – димерного соединения благодаря мостиковой функции трифторацетатных анионов [11, 12]. Известно, что характер координации карбоксилатных анионов зависит от природы донорных лигандов, сосуществующих во внутренней сфере металла. Можно полагать, что изменение условий реакции трифторацетата Cd(II) c PPh3 приведет к образованию комплекса с другим типом координации трифторацетатных анионов.
Соединение [Cd(CF3COO)2(Ph3P)]2 получали в среде этилового спирта при эквимолярном соотношении трифторацетата кадмия и Ph3P [11, 12]. В настоящей работе взаимодействием трифторацетата кадмия с Ph3P в среде ацетонитрила при соотношении Cd(II) : PPh3 = 1 : 2 синтезирован комплекс [Cd(CF3COO)2(Ph3P)2] (I), изученный методами РСА и фотолюминесценции (ФЛ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали гидроокись кадмия, трифенилфосфин квалификации “х. ч.” и 99%‑ную трифторуксусную кислоту фирмы M-erck. Трифторацетат кадмия получали нагреванием на водяной бане суспензии Cd(OH)2 c CF3COOH (соотношение 1 : 2) в водно-спиртовом растворе (1 : 1) до растворения гидроокиси с последующей фильтрацией и упариванием фильтрата до консистенции сиропа. После охлаждения последнего закристаллизованный продукт растирали, нагревали в вакууме при 110–120°C в течение часа и затем анализировали. Полученное соединение отвечает составу Cd(CF3CO2)2 ⋅ ⋅ 0.25H2O (найдено, %: С 14.08; вычислено, %: С 14.08).
Синтез I. Растворяли 0.30 г (0.88 ммоль) трифтор-ацетата в 10 мл ацетонитрила и 0.46 г (1.75 ммоль) трифенилфосфина в 10 мл CH3CN, растворы смешивали и выдерживали смесь в течение 1.5 ч. Затем декантацией отделяли от раствора первую порцию выделившейся твердой фазы, которую в дальнейшем не изучали из-за непригодности для проведения РСА. Из маточника при медленном испарении растворителя получали кристаллы, отделяли их от раствора, промывали ацетонитрилом и высушивали на воздухе. Выход I 40%. Кристаллы отвечают составу [Cd(CF3COO)2(Ph3P)2].
РСА I получен на автоматическом дифрактометре Enraf-Nonius CAD-4. Структура расшифрована прямым методом (SHELXS-97) [13] и уточнена МНК в полноматричном анизотропном приближении для всех неводородных атомов (SHELXL-97) [14]. Позиции атомов водорода рассчитаны геометричеcки и включены в уточнение по модели “наездника” с фиксированными изотропными температурными параметрами. Основные характеристики эксперимента и параметры элементарной ячейки приведены в табл. 1, основные длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные и основные характеристики эксперимента для структуры I
| Параметр | Значение |
|---|---|
| M | 862.98 |
| Цвет, габитус | Желтый, блок |
| Размер кристалла, мм | 0.18 × 0.16 × 0.09 |
| Сингония; пр. гр. | Моноклинная; С2/c |
| Параметры ячейки: | |
| a, Å | 20.318(4) |
| b, Å | 10.432(2) |
| c, Å | 18.661(4) |
| β, град | 104.18(3) |
| V, Å3 | 3834.8(13) |
| Z | 4 |
| ρ(выч.), г/см3 | 1.495 |
| μMo, мм–1 | 0.722 |
| F(000) | 1736 |
| Т, K | 293(2) |
| Излучение (λ, Å) | MoKα (1.71073) |
| Тип сканирования | ω |
| Область θ, град | 2.07–26.96 |
| Интервалы индексов | –24 ≤ h ≤ 24, –12 ≤ k ≤ 1, –22 ≤ l ≤ 1 |
| Общее число отражений/независимых (Rint) | 4588/3768 (0.0291) |
| Полнота по θ = 26о, % | 100 |
| Число отражений с I ≥ 2σ(I) | 2362 |
| Поправка на поглощение | Полуэмпирическая, по эквивалентам |
| Тmin/Тmax | 0.8811/0.9313 |
| Число уточняемых параметров | 252 |
| GOOF по F 2 | 1.031 |
| R (I ≥ 2σ(I)) | R1 = 0.0356, wR2 = 0.0899 |
| R (все данные) | R1 = 0.0917, wR2 = 0.1053 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.612, –0.548 |
Таблица 2.
Основные длины связей (Å) и валентные углы (град) в структуре I*
| Cвязь | d, Å | Связь | d, Å |
|---|---|---|---|
| Cd(1)–O(1) | 2.293(3) | Cd(1)–O(2) | 2.613(4) |
| Cd(1)–P(1) | 2.590(1) | ||
| Угол | ω, град | Угол | ω, град |
| O(1)Cd(1)O(1)#1 | 139.6(2) | P(1)Cd(1)O(2)#1 | 146.18(9) |
| O(1)Cd(1)P(1)#1 | 97.64(9) | O(1)Cd(1)O(2) | 52.50(12) |
| O(1)Cd(1)P(1) | 101.61(9) | P(1)#1Cd(1)O(2) | 146.18(9) |
| P(1)#1Cd(1)P(1) | 122.12(5) | P(1)Cd(1)O(2) | 83.54(10) |
| O(1)Cd(1)O(2)#1 | 95.52(13) | O(2)#1Cd(1)O(2) | 84.15(18) |
Кристаллографические данные структуры I депонированы в Кембриджском банке структурных данных: (CCDC № 1879877; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Спектры ФЛ соединения I записывали при комнатной температуре на спектрометре PE LS-55 (разрешение 0.5 нм, щель варьировали в диапазоне от 7 до 10 нм) с использованием приставки для твердотельных образцов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В структуре I атом Cd, расположенный на кристаллографической оси второго порядка, имеет октаэдрическую координацию за счет четырех атомов кислорода эквивалентных хелатных лигандов трифторацетата и двух кристаллографически эквивалентных атомов фосфора трифенилфосфина (Сd(1)–O(1) 2.293(1), Сd(1)–O(1)#1 2.293(1), Сd(1)–O(2) 2.613(4), Сd(1)–O(2)#1 2.613(4), Сd(1)–P(1) 2.590(1), Сd(1)–P(1)#1 2.590(1), углы при атоме Сd(II) – табл. 2). В результате такого взаимодействия лигандов образуется искаженный октаэдрический комплекс I (рис. 1). Атомы фтора трифторацетата статистически разупорядочены по трем позициям каждый (С(20)–Fсредн. 1.35 ± 0.01 Å). Отметим также, что трифторацетатный ион слабо связан с ионами Cd2+ (Cd−O(2) 2.613(4) Å). Минимальный угол O(1)Cd(1)O(2) 52.5(1)°, максимальный − P(1)Cd(1)O(2)#1 146.18(9)° (табл. 2). Вероятно, такая ориентация лигандов вызывает заметное искажение координационного полиэдра (КП) иона Cd2+.
Отметим, что структура I с ароматическим фосфином и Cd[P(с-C6H11)3]2(NO3)2 · CH2Cl2 (II) с алифатическим, несмотря на различный состав, имеют сходные кристаллографические характеристики и строение КП иона Cd2+. В II ион Cd2+ также расположен на кристаллографической оси второго порядка и имеет октаэдрическое окружение за счет четырех атомов О двух эквивалентных бидентатных нитрат-ионов (Cd−O(1) 2.575(8) Å и Cd−O(2) 2.405(9) Å) и двух эквивалентных атомов P алифатических фосфинов (Cd−P 2.602(2) Å). Расстояния Cd−P имеют близкие значения 2.590(1) Å (I) и 2.602(2) Å (II). Углы PCdP 122.12(5)° (I) и 139.56(9)° (II).
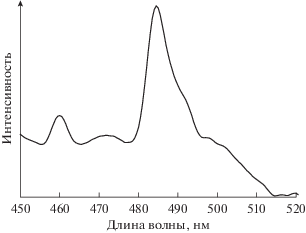
Спектр ФЛ соединения I имеет интенсивный пик при 485 нм, обусловленный электронными переходами внутри трифенилфосфинового лиганда (рис. 2). Свободный PPh3 люминесцирует при 500 [15 ] , 447 нм [16 ] . При координации PPh3 к ионам металлов в спектрах ФЛ Ag(PPh3)2L (L = п‑толуолсульфонат) [ 16] , Au(PPh3)2L [15 ] и Cd(PPh3)2Cl2 [17] появляются полосы при 487, 513 и 455 нм соответственно.
Таким образом, мы получили второе соединение кадмия, содержащее во внутренней сфере одновременно карбоксилатный анион и трифенилфосфин состава [Cd(CF3COO)2(Ph3P)2] (Cd : P = 1 : 2). В этом соединении карбоксилатный анион проявляет хелатные свойства в отличие от [Cd(CF3COO)2-(Ph3P)]2 (Cd : P = 1 : 1) [11, 12], где карбоксилатный анион – мостиковый лиганд.
Список литературы
Grabtree R.H. The Organometallic Chemistry of the Transition Metals. John Willey and Sons, 2005.
Bart J., Levason W., Reid G. // Coord. Chem. Rev. 2014. V. 260. P. 65.
Parus A., Wieszczycka K., Olszanowski A. // Hydrometallurgy. 2011. V. 105. P. 284.
Kessler J.M., Reeder J.H., Vac R. et al. // Magn. Reson. Chem. 1991. V. 29. P. 94.
Dakternieks D., Hoskins B., Rolls C., Tielink E. // Aust. J. Chem. 1986. V. 39. P. 713.
Cameron A.F., Forrest K.P., Ferguson G. // J. Chem. Soc. A. 1971. P. 1286.
Bell N.A., Dee T.D., Goldstein M., Nowell I.W. // Inorg. Chim. Acta. 1980. V. 38. P. 191.
Zeng D., Hampden-Smith M.J., Alam T.M., Rheingold A.L. // Polyhedron. 1994. V. 13. P. 2715.
Darensbourg D.J., Rainey P., Larkins D.L., Reibenspies H. // Inorg. Chem. 2000. V. 39. P. 473.
Goel R.G., Henry W.P., Oliver M.J., Beauchamp A.L. // Inorg. Chem. 1981. V. 20. P. 3924.
Goel R.G., Jha N.K. // Can. J. Chem. 1981. V. 59. P. 3267.
Allman T., Goel R.G., Jha N.K., Beauchamp A.L. // Inorg. Chem. 1984. V. 23. № 7. P. 914.
Sheldrick G.M. SHELXS-97. Program for the Solution of Crystal Structures. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // SHELXL-97. Program for the Refinement of Structures. Göttingen (Germany): Univ. of Göttingen, 1997.
King C., Khan M.N.I., Staples R.J., Facker J.P. // Inorg.Chem. 1992. V. 31. P. 3236.
Li F.-F., Ma J.-F., Yang J. et al. // J. Mol. Strct. 2006. V. 787. P. 106.
Prida E., Bonometti E., Rabezzana R. et al. // Inorg. Chem. Commun. 2016. V. 70. P. 35.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия