Координационная химия, 2019, T. 45, № 8, стр. 468-475
Молекулярные и кристаллические структуры 4-(2-метоксифенил)-5-(тиофен-2-илметил)-2,4-дигидро-1H-1,2,4-триазол-3-тиона и его комплекса с хлоридом кадмия
Р. К. Аскеров 1, *, А. М. Магеррамов 1, В. К. Османов 2, Е. В. Баранов 3, Г. Н. Борисова 2, А. В. Борисов 2
1 Бакинский государственный университет
Баку, Азербайджан
2 Нижегородский государственный технический университет им. Р.Е. Алексеева
Нижний Новгород, Россия
3 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
* E-mail: rizvankam@bk.ru
Поступила в редакцию 03.10.2018
После доработки 22.01.2019
Принята к публикации 12.02.2019
Аннотация
Синтезированы соединение 4-(2-метоксифенил)-5-(тиофен-2-илметил)-2,4-дигидро-1H-1,2,4-триазол-3-тион (LН) и его комплекс с кадмием(II) C42.12H39.50N9O3.12S6Cl2Cd (I). Методом РСА определены их молекулярные и кристаллические структуры (СIF files CCDC № 1835776 (LН), 1547251 (I)). Свободный лиганд LН является тионом и образует в кристалле H-связанные центросимметричные димеры посредством двух водородных связей N–H···S. Комплекс I имеет искаженное тригонально-бипирамидальное строение; в основании расположены атомы серы, аксиальные позиции занимают атомы хлора. Cоединение LН при образовании комплекса I проявляет себя как монодентатный лиганд (S), сохраняя тионную форму. Молекула комплекса I стабилизируется за счет сильных внутримолекулярных контактов N–H···Cl. Кристаллическая упаковка соединений LН и I формируется за счет межмолекулярных контактов C–H···π, H···S, H···O и H···N.
Как известно из литературных данных, 1,2,4-триазол-3-тионы и их производные обладают широким спектром биологической активности и находят применение в качестве антибактериальных, противовирусных, противоопухолевых, болеутоляющих и фунгицидных препаратов [1–3]. Эти соединения представляют научный интерес и с точки зрения координационной химии, так как могут образовывать различные комплексы с ионами металлов. Соединения такого типа имеют несколько потенциальных активных центров, которые могут проявлять себя как монодентатные (S или N) либо как бидентатные (S,N или N,N) лиганды, формируя полимерные комплексы или взаимодействуя с ионами металлов через их π‑электронную плотность [4, 5].
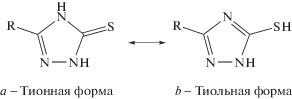
Подобные гетероциклические соединения могут существовать как в тионной, так и в тиольной форме. Однако более устойчивой для меркаптотриазолов является тионная форма [6, 7]:
В настоящей работе изучено соединение 4-(2-метоксифенил)-5-(тиофен-2-илметил)-2,4-дигидро-1H-1,2,4-триазол-3-тион (LН) и его комплекс с кадмием(II) C42.12H39.50N9O3.12S6Cl2Cd (I). Строение полученных соединений установлено методом РСА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали NaOH, CdCl2 квалификации “х. ч.”, гидразид 2-тиофенуксусной кислоты и o-метоксифенилизотиоцианат “Acros Organics”, Бельгия) без дополнительной очистки.
Температуры плавления (разложения) определяли в вакуумированных запаянных капиллярах (приводятся без поправки).
ИК-спектры образцов регистрировали на приборе Shimadzu IR Prestige-21 в области 4000–400 см–1 (таблетки KBr, образцы соединений готовили прессованием таблеток; соотношение вещество : : KBr равно 1 : 200).
Спектры ЯМР 1H записывали на спектрометре Agilent DD2 400 с рабочей частотой 400 МГц в режиме внутренней стабилизации полярно-резонансной линии 2Н в CDCl3 при 20°С. Отнесение сигналов проводили с использованием градиентной 2D-спектроскопии – протон-протонной корреляции (GE-COSY). Хим. сдвиги указаны в миллионных долях (м.д.) относительно тетраметилсилана в качестве внутреннего стандарта.
Синтез LН. К раствору 1.56 г (10 ммоль) гидразида 2-тиофенуксусной кислоты в 50 мл этанола при 20°С прибавляли 1.65 г (10 ммоль) o-метоксифенилизотиоцианата. Реакционную смесь кипятили 4 ч и охлаждали до 20°С. Растворитель упаривали в вакууме и к полученному остатку приливали 50 мл 10% водного раствора NaOH. Реакционную смесь кипятили 6 ч, охлаждали до 20°С и отфильтровывали от нерастворившихся примесей. К фильтрату прибавляли по каплям 10% водный раствор HCl до кислой реакции (рН = 2). Выпавший осадок соединения LН отфильтровывали, промывали 200 мл H2O и сушили при 353 К. Вещество для РСА перекристаллизовывали из этанола. Выход 1.957 г (64.50%), белые кристаллы, Тпл = 175–176°С.
Cинтез лиганда LН протекает по следующей схеме:
ИК-спектр (ν, см–1): 3439 (N–H), 1601 (Ph), 1574 (C=N), 1342 (C=S), 1022 (Ph–O–CH3). Спектр ЯМР 1Н (СDCl3; δ, м.д.): 13.73 (с., 1Н, NH), 7.48 (м., 1Н, Н6), 7.32 (д., 1Н, J = 5.4 Гц, Н1), 7.17 (д., 1Н, J = 8.4 Гц, Н4), 7.13 (д., 1Н, J = 7.7 Гц, Н7), 7.03 (м., 1Н, Н5), 6.82 (д. д., 1Н, J = 5.4, 3.2 Гц, Н2), 6.53 (д. д., 1Н, J = 3.2, 1.2 Гц, Н3), 3.94 (к., 2Н, СН2), 3.65 (с., 3Н, ОСН3).
Синтез комплекса I. К раствору 0.607 г (2 ммоль) тиона LН в 25 мл абсолютного этанола прибавляли раствор 0.184 г (1 ммоль) CdCl2 в 15 мл абсолютного этанола. Реакционную смесь кипятили 5 ч и охлаждали до 20°С. Выпавший осадок соединения I отфильтровывали, промывали 50 мл этанола и сушили при 353 К. Вещество для РСА перекристаллизовывали из смеси ДМСО–этанол (1 : 1). Выход 0.638 г (87.43%), белые кристаллы, Тпл = = 151–152°С.
ИК-спектр (ν, см–1): 3549 (N–H), 1603 (Ph), 1570 (C=N), 1342 (C=S), 1021 (Ph–O–CH3). Спектр ЯМР 1Н (СDCl3; δ, м.д.): 13.74 (с., NH), 7.49 (м., 1Н, Н6), 7.32 (д., 1Н, J = 5.4 Гц, Н1), 7.17 (уш. д., 1Н, J = 8.4 Гц, Н4), 7.13 (уш. д., 1Н, J = 7.7 Гц, Н7), 7.02 (м., 1Н, Н5), 6.82 (д. д., 1Н, J = 5.4, 3.2 Гц, Н2), 6.53 (уш. д., 1Н, J = 3.2 Гц, Н3), 3.94 (к., 2Н, СН2), 3.65 (с., 3Н, ОСН3).
| Найдено, %: | C 46.23; | H 3.48; | N 11.67. |
| Для C42.12H39N9O3.12S6Cl2Cd (I) | |||
| вычислено, %: | C 46.07; | H 3.56; | N 11.52. |
Кристаллы, пригодные для РСА, получали кристаллизацией Н2L и I из этанола.
РСА Н2L и I проведен на дифрактометре Bruker Smart Apex (ω-сканирование, МоКα-излучение, λ = 0.71073 Å, T = 296 K). Экспериментальные наборы интенсивностей отражений собраны и интегрированы по программе SMART [8] и SAINT [9]. Структуры решены прямым методом и уточнены полноматричным МНК по $F_{{hkl}}^{{\text{2}}}$ в анизотропном приближении для неводородных атомов. Разностный синтез электронной плотности позволил обнаружить, что атом С(9) метиленовой группы в структуре лиганда L и один из тиофеновых фрагментов в молекулах А и В комплекса I разупорядочены по двум положениям в соотношениях заселенностей 0.70 : 0.30 (L) и 0.65 : 0.35 (A), 0.50 : 0.50 (B) (I). Атомы водорода, участвующие в межмолекулярных водородных связях (BC) N–H···S и N–H···Cl в лиганде L и I, локализованы из разностного синтеза электронной плотности и уточнены в изотропном приближении. Координаты остальных атомов водорода в лиганде L и I рассчитаны из геометрических соображений и уточнены с фиксированными позиционными (модель “наездника”) и тепловыми параметрами (1.5Uизо(C) для метильных групп и Uизо(H) = = 1.2Uизо(C) для всех остальных групп). Уточнение структуры и учет поглощения проведены с использованием программных пакетов SHELXTL [10] и SADABS [11]. Кристаллографические данные и параметры рентгеноструктурных экспериментов лиганда L и I приведены в табл. 1, избранные длины валентных связей и валентные углы – в табл. 2 и 3 соответственно.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для соединений LH и I
| Параметр | Значение | |
|---|---|---|
| LН | I | |
| М | 208.24 | 1097.48 |
| Температура, K | 296 | 296 |
| Размеры кристалла, мм | 0.89 × 0.79 × 0.43 | 0.17 × 0.15 × 0.14 |
| Сингония | Моноклинная | Триклинная |
| Пр. гр. | P21/c | P1 |
| a, Å | 7.4596(4) | 12.7815(5) |
| b, Å | 12.8917(8) | 18.4884(6) |
| c, Å | 15.6803(9) | 21.4836(8) |
| α, град | 90 | 86.2509(6) |
| β, град | 100.0439(9) | 74.6971(6) |
| γ, град | 90 | 86.1703(7) |
| V, Å3 | 1484.82(15) | 48798(3) |
| Z | 4 | 4 |
| ρ(выч.), г/см3 | 1.357 | 1.494 |
| µ, мм–1 | 0.357 | 0.862 |
| F(000) | 632 | 2233 |
| Область сбора данных по θ, град | 28 | 28 |
| Измерено отражений | 14 686 | 51 033 |
| Независимых отражений | 3573 | 24 019 |
| Число уточняемых параметров | 197 | 1258 |
| R1, wR2 (I > 2σ(I)) | 0.0462, 0.1298 | 0.0557, 0.1269 |
| R1, wR2 (все данные) | 0.0522, 0.1353 | 0.1195, 0.1518 |
| GOОF | 1.005 | 1.000 |
| Tmin, Tmax | 0.742, 0.862 | 0.867, 0.889 |
| Остаточная электронная плотность (Δρmin/Δρmax), e Å–3 | –0.498/0.334 | –0.886/0.888 |
Таблица 2.
Избранные длины связей, значения валентных и торсионных углов в соединении LН
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| S(1)–C(1) O(1)–C(4) O(1)–C(14) N(1)–C(1) N(2)–C(2) N(2)–N(3) N(3)–C(2) N(1)–C(3) C(2)–C(9) C(2)–C(9') C(9)–C(10) C(9')–C(10) |
1.677(2) 1.356(2) 1.417(3) 1.366(2) 1.376(2) 1.376(2) 1.297(2) 1.437(2) 1.518(2) 1.519(3) 1.515(2) 1.524(3) |
S(1)C(1)N(1) S(1)C(1)N(2) C(1)N(1)C(2) C(1)N(2)N(3) N(1)C(2)N(3) N(1)C(3)C(4) N(1)C(3)C(8) C(2)C(9)C(10) C(3)C(4)O(1) C(4)O(1)C(14) |
127.26(12) 129.10(12) 107.76(12) 113.72(13) 111.31(13) 117.71(15) 108.52(16) 112.9(2) 115.74(14) 118.57(17) |
| Торсионный угол |
γ, град | ||
| S(1)C(1)N(1)C(3) N(3)C(2)C(9)C(10) C(1)N(1)C(3)C(8) C(1)N(1)C(3)C(4) C(5)C(4)O(1)C(14) |
3.7(3) 26.7(7) 76.6(2) 102.33(2) 10.5(3) |
Таблица 3.
Избранные длины связей, значения валентных и торсионных углов в соединении I
| Связь | d, Å | Угол | ω, град | ||
|---|---|---|---|---|---|
| A | В | A | В | ||
| Cd(1)–Cl(1) Cd(1)–Cl(2) Cd(1)–S(1) Cd(1)–S(3) Cd(1)–S(5) S(1)–C(1) S(3)–C(15) S(5)–C(29) O(1)–C(4) O(1)–C(14) O(2)–C(18) O(2)–C(28) O(3)–C(32) O(3)–C(42) N(1)–C(3) N(4)–C(17) N(7)–C(31) C(2)–C(9) C(9)–C(10) C(16)–C(23) C(23)–C(24) C(30)–C(37) C(37)–C(38) |
2.7270(11) 2.6292(11) 2.5786(12) 2.5609(11) 2.5755(11) 1.692(4) 1.692(4) 1.695(4) 1.363(5) 1.433(5) 1.348(7) 1.428(7) 1.354(3) 1.415(6) 1.439(5) 1.423(5) 1.432(5) 1.490(6) 1.504(6) 1.486(6) 1.496(7) 1.473(6) 1.474(5) |
2.5940(11) 2.7492(11) 2.5536(12) 2.5879(12) 2.6149(11) 1.693(4) 1.697(4) 1.688(4) 1.382(5) 1.444(6) 1.343(5) 1.423(6) 1.354(5) 1.450(5) 1.436(5) 1.427(5) 1.438(5) 1.493(7) 1.489(6) 1.487(6) 1.486(7) 1.497(6) 1.505(6) |
Cl(1)Cd(1)Cl(2) S(1)Cd(1)Cl(1) S(1)Cd(1)Cl(2) S(3)Cd(1)Cl(1) S(3)Cd(1)Cl(2) S(5)Cd(1)Cl(1) S(5)Cd(1)Cl(2) S(1)Cd(1)S(3) S(1)Cd(1)S(5) S(3)Cd(1)S(5) |
179.14(3) 81.00(3) 99.83(4) 98.24(3) 81.14(3) 98.31(3) 81.44(4) 124.41(4) 120.83(4) 114.30(4) |
176.11(4) 100.78(4) 76.04(4) 84.93(4) 98.79(4) 85.03(4) 94.50(3) 128.08(5) 118.54(4) 113.35(4) |
| Торсионный угол |
γ, град | ||||
| A | В | ||||
| Cd(1)S(1)C(1)N(2) Cd(1)S(3)C(15)N(5) Cd(1)S(5)C(29)N(8) |
27.1(5) 18.0(5) 0.2(4) |
4.1(5) 4.8(5) 23.0(5) |
|||
Структуры зарегистрированы в Кембриджском банке структурных данных (CCDC № 1835776 (Н2L), 1547251 (I); ccdc.cam.ac.uk/getstructures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
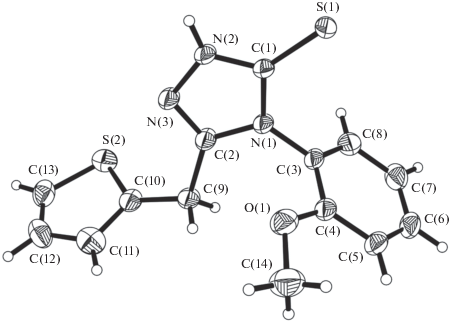
Лиганд LН состоит из трех плоских циклов – триазольного А (N(1)–C(1)–N(2)–N(3)–C(2)), фенильного В (С(3)–С(8)) и тиофенового С (С(10)–С(11)–С(12)–С(13)–S(2)) (рис. 1). Плоскости циклов В почти перпендикулярны плоскости триазольного цикла А. Двугранные углы между циклами А/B равны 73.57°, A/C 72.23° и B/C 43.75°. Триазольный фрагмент почти плоский (±0.0067 Å).
Рис. 2.
Строение H-связанных димеров в кристалле соединения LН. Тепловые эллипсоиды приведены с 30%-ной вероятностью.
Длины связей N(1)–C(1) 1.366(2), N(1)–C(2) 1.376(2), N(2)–C(1) 1.330(2) и N(2)–N(3) 1.376(2) Å в меркаптотриазольном фрагменте соответствуют одинарному характеру, тогда как связи С(1)=S(1) 1.687(3) и C(2)=N(3) 1.297(2) Å двойные.
Молекулы L в кристалле стабилизируются сильными межмолекулярными водородными связями (ВС), образуя центросимметричные димеры посредством двух ВС N(2)–H(2)···S(1) (–x, 1 – y, –z), N–H 0.86(2), H···S 2.38(3) Å, угол N–H···S 179(2)° [7] (контакты S···H короче, чем сокращенные контакты 2.62 Å [12]) (pис. 2). Димеры включают центральный плоский восьмичленный цикл {S=C–N–H···S=C–N–H··· (±0.016 Å)}.
Димеры соединения L в кристалле образуют стопки вдоль направления оси а. Между димерами атомы водорода метиленовой группы располагаются практически с небольшим смещением напротив центра тиофеного фрагмента. Расстояние от атома водорода H(9A) метиленовой группы к плоскости тиофенового цикла составляет 2.620 Å. Кратчайшие расстояния С···Н между атомами С(11) и Н(9А) (2.75 Å) указывают на слабые центросимметричные стэкинг-взаимодействия С–Н···π [13], распространяющиеся по диагонали ab (рис. 3).
Рис. 3.
Кристаллическая упаковка соединения LН. Пунктирными линиями указаны центросимметричные ВС N–H···S и стэкинг-взаимодействия С–H···π по диагонали ab.
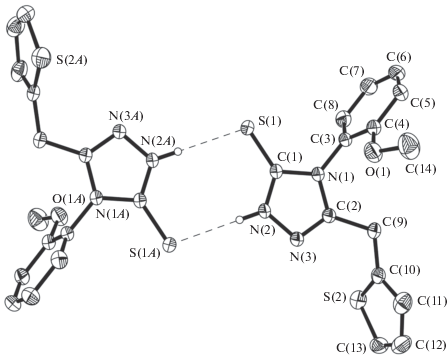
В монокристаллическом образце комплекса I, полученном после кристаллизации соединения из метанола, в асимметричной части кристаллической ячейки расположены две кристаллографически независимые молекулы комплекса А и B. В кристалле I присутствует сольватная молекула метанола в соотношении 1 : 8 к комплексу кадмия. Таким образом, в ячейке кристалла содержатся четыре молекулы комплекса I (две пары молекул А и В). Молекулы A и B имеют идентичное строение (табл. 3); при обсуждении структуры комплекса I приводятся геометрические характеристики молекулы A.
В комплексе I атом кадмия, связанный с двумя атомами хлора, дополнительно координирует три нейтральные молекулы лиганда L. Координационный полиэдр атома Cd – искаженная тригональная бимирамида, в основании которой расположены атомы серы, аксиальные позиции занимают атомы хлора (рис. 4). Длины связей Cd(1)–Cl(1,2) равны 2.629(1) и 2.729(1) Å соответственно. Аксиальный угол Cl(1)Cd(2)Cl(2) 179.14(4)°. Длины связей Cd–S лежат в интервале 2.561(1)–2.579(1) Å (средн. 2.572(1) Å). Экваториальные углы SCdS лежат в интервале 114.30(4)°–124.41(4)° (средн. 119.85(4)°). Выход атома кадмия из экваториальной плоскости для молекул A и B составляет 0.075 и 0.020 Å соответственно. Двугранный угол между плоскими циклами (A, B, C) в комплексе I лежит в интервалах А/B 71.56°–85.50°, A/C 64.32°–76.19°, B/C 30.02°–46.55°. Двугранные углы между триазольными фрагментами A/A в комплексе I находятся в интервале 46.32°–87.89°.
Рис. 4.
Молекулярное строение комплекса I. Атомы водорода, не участвующие во внутримолекулярных ВС, для наглядности удалены. Тепловые эллипсоиды приведены с 30%-ной вероятностью.
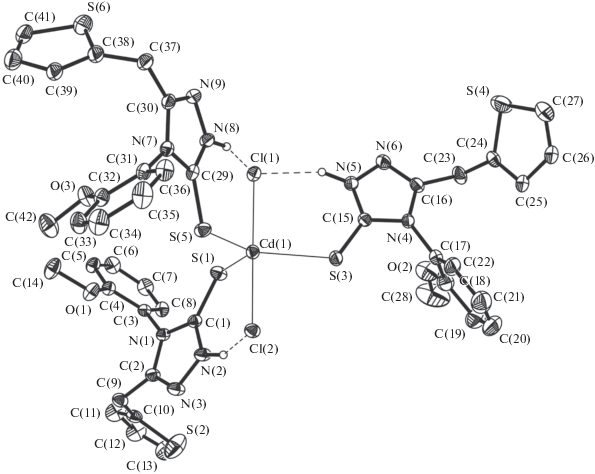
Следует заметить, что соединение LН при образовании комплекса I проявляет себя как монодентатный лиганд (S), при этом сохраняя тионную форму.
В кристалле I молекулы A и B стабилизируются сильными внутримолекулярными ВС N–H···Cl, для A N–H 0.98, H···Cl 2.09–2.14 Å, углы N–H···Cl 155°–164° и для B N–H 0.98, H···Cl 2.08–2.18 Å, углы N–H···Cl 155°–164° (контакты Cl···H в I существенно меньше сокращенных взаимодействий атомов Cl и H (2.67 Å) [12].
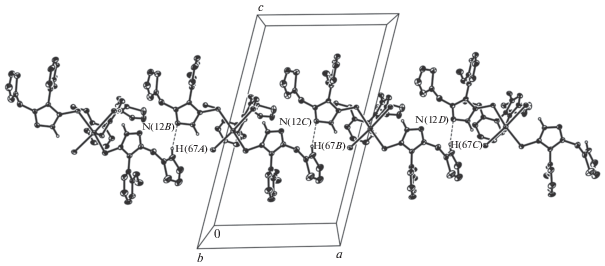
Таким образом, атом хлора Cl(1) участвует в двух внутримолекулярных N–H···Cl контактах от двух триазольных лигандов, а атом Cl(2) – в одном аналогичном контакте от третьего триазольного заместителя.
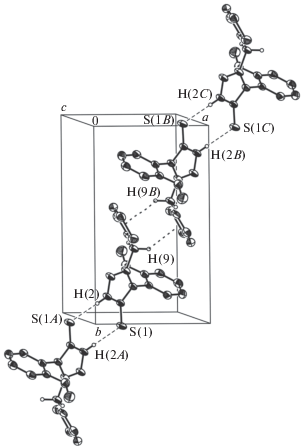
Молекулы комплекса I в кристалле укладываются в стопки вдоль кристаллографической оси a. В этих стопках между молекулами наблюдаются контакты C(67)–H(67A)···N(12), коды: x + 1, y, z (С–H 0.93, H···N 2.49 Å, углы C–H···N 164° с промежуточным расстоянием между сокращенным и ван-дер-ваальсовым взаимодействиями (между 2.64 и 2.34 Å [12])) (рис. 5). Расстояние Cd···Cd в стопке равно 12.782 Å. Между параллельными стопками вдоль оси с существуют слабые контакты: C(5)–H(5A)···S(7), (C–H 0.93, H···S 2.93, угол C–H···S 156°, несколько больше ван-дер-ваальсовых взаимодействий атомов S и H (2.92 Å [12]) и C(34)–H(34A)···O(1) (C–H 0.93, H···O 2.45 Å, угол C–H···O 134°, сопоставимо с ван-дер-ваальсовым взаимодействием атомов O и H (2.45 Å [12])).
Рис. 5.
Фрагмент кристаллической упаковки комплекса I в проекции на плоскость a0c. Пунктирными линиями показаны контакты H···N.
Таким образом, методом РСА было установлено, что лиганд L в кристалле находится в тионной форме и образует Н-связанные димеры. Взаимодействие LН с хлоридом кадмия(II) приводит к образованию комплекса I, имеющего искаженную тригонально-бипирамидальную координацию атома Cd. Молекулы лиганда L при координации на атоме кадмия в комплексе I проявляют себя как монодентатный лиганд (S) и сохраняют тионную форму. В кристалле молекулы лигaнда L и I стабилизируются за счет сильных как меж-, так и внутримолекулярных Н···S и H···Cl контактов.
Список литературы
Bayrak H., Demirbas A., Karaoglu S.A. et al. // Eur. J. Med. Chem. 2009. V. 44. P. 1057.
Калдрикян М.А., Григорян Л.А., Мелик-Огаджанян Р.Г. и др. // Хим.-фарм. журн. 2011. Т. 45. № 4. С. 15.
Wang B.-L., Shi Y.-X., Ma Y. et al. // J. Agric. Food Chem. 2010. V. 58. P. 5515.
Akrivos P.D. // Coord. Chem. Rev. 2001. V. 213. P. 181.
Jiang Y.-L., Wang Y.-L., Lin J.-X. // CrystEngComm. 2011. V. 13. P. 1697.
Штефан Е.Д., Введенский В.Ю. // Успехи химии. 1995. Т. 65. № 4. С. 326.
Akkurt M., Ozturk S., Servi S. et al. // Acta Crystallog. E. 2004. V. 60. P. 1507.
SMART. Bruker Molecular Analysis Research Tool. Version 5.632. Madison (WI, USA): Bruker AXS, 2005.
SAINT. Data Reduction and Correction Program. Version 8.34A. Madison (WI, USA): Bruker AXS, 2014.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Sheldrick G.M. SADABS. Program for Absorption Correction, Göttingen (Germany): Univ. of Göttingen, 1996.
Зефиров Ю.В., Зоркий П.М. Новые применения ван-дер-ваальсовых взаимодействий в химии // Успехи химии. 1995. Т. 64. № 4. С. 446.
Christoph J. // Dalton Trans. 2000. P. 3885.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия