Координационная химия, 2019, T. 45, № 8, стр. 481-484
Структура гептагидрата барбитурато-бис-(2,2'-дипиридил)-меди(II)
Н. Н. Головнев 1, *, М. С. Молокеев 1, 2, 3, И. В. Стерхова 4, М. К. Лесников 1
1 Сибирский федеральный университет
Красноярск, Россия
2 Институт физики им. Л.В. Киренского СО РАН
Красноярск, Россия
3 Дальневосточный государственный университет путей сообщения
Хабаровск, Россия
4 Институт химии им. А.Е. Фаворского СО РАН
Иркутск, Россия
* E-mail: ngolovnev@sfu-kras.ru
Поступила в редакцию 28.12.2018
После доработки 11.03.2019
Принята к публикации 28.03.2019
Аннотация
Определена структура (CIF file CCDC № 1887338), изучены термическое разложение и ИК-спектр комплекса [Cu(Bipy)2(BA)] ⋅ 7H2O (I), где Bipy – 2,2'-дипиридил, BA2– – анион барбитуровой кислоты (H2BA). Кристаллы ромбические: a = 26.118(3), b = 27.685(3), c = 15.683(2) Å, V = 11 370(2) Å3, пр. гр. Fdd2, Z = 16. Островная структура полярного кристалла состоит из нейтральных частиц [Cu(Bipy)2(BA)] и молекул кристаллизационной воды. Ион Cu2+ связан с атомами N двух бидентатных молекул Bipy и атомом N иона BA2− по вершинам тригональной бипирамиды CuN5. Соединение I – первый пример комплекса металла только с N-координированными анионами барбитуровой кислоты (BA2−, НBA−). Структура стабилизирована водородными связями O−H⋅⋅⋅O и N−H⋅⋅⋅O с образованием трехмерной сетки и π–π-взаимодействием между молекулами Bipy. Соединениe начинает терять воду при ~50°С и полностью дегидратируется выше 200°С.
Барбитуровая кислота (C4H4N2O3, H2BA) – ключевое соединение важного класса успокоительных и гипнотических лекарств, именуемого “барбитуратами”. Важное значение в химии барбитуратов имеет комплексообразование и нековалентные взаимодействия, такие как водородные связи (ВС) и π–π-взаимодействие [1]. Во всех структурно охарактеризованных комплексах анион HBA– координирован к ионам металлов через атомы О [2–13]. В соединении [Pd(Еn-N,N')(μ2-BA−C,N)]2 ⋅ 4H2O (Еn = этилендиамин) [14] ион BA2− выступает как мостиковый лиганд μ2-C,N. Другие комплексы металлов с ионами BA2– неизвестны, хотя они могут иметь необычное строение и обладать потенциально полезными свойствами. Мы синтезировали гептагидрат барбитурато-бис(2,2'-дипиридил)меди(II), [Cu(Bipy)2(BA)] ⋅ ⋅ 7H2O (I), где Bipy – 2,2'-дипиридил, изучили его структуру, ИК-спектр и термическое разложение. Характеристика соединения I может представлять практический интерес, так как ионы Cu2+ могут влиять на лекарственную активность барбитуратов [2, 15], а дипиридильные комплексы Cu(II) каталитически активны [16].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез I. К 0.10 г (0.78 ммоль) H2BA (“х. ч.”) добавляли 5 мл воды, 0.038 г (0.39 ммоль) свежеприготовленного Cu(OH)2 и 0.122 г (0.78 ммоль) Bipy (Aldrich, 98%). Смесь нагревали при постоянном перемешивании и выдерживали при 80°С до полного растворения реагентов. Полученный темно-зеленый раствор охлаждали до комнатной температуры, доводили 0.1 М NaOH до рН 10–11 и оставляли на воздухе в течение 5 сут. Полученный темно-зеленый кристаллический осадок отфильтровывали и сушили на воздухе. Выход I 0.082 г. (33% по меди). Монокристалл, пригодный для РСА, выбирали непосредственно из общей массы осадка. Соединение устойчиво на воздухе не менее 2 мес.
ИК-спектр I (ν, см–1): 1680, 1579 ν(CO) BA2−, 1597 ν(CC)/ν(CN) Bipy, 3026, 3054, 3094, 2923 ν(NH) и ν(CH), 3373 ν(OH). Полосы отнесены согласно [17, 18].
РСА. Интенсивности рентгеновских отражений от темно-зеленого кристалла размером 0.40 × × 0.35 × 0.25 мм измерены при 100 K на монокристальном дифрактометре D8 Venture c CCD детектором (Bruker AXS, MoKα-излучение). Поправки на поглощение введены по программе SADABS. Структура решена прямыми методами (SHELXS) [19] и уточнена по программе SHELXL с учетом анизотропии тепловых параметров всех неводородных атомов. Все атомы водорода локализованы на разностной карте электронной плотности. В дальнейшем атомы Н, связанные с атомами C, N в ионах BA2– и молекулах Bipy, размещались геометрически в модели “наездника” с ограничениями на длины связей C−H 0.93−0.98, N−H 0.86−0.89 Å в зависимости от геометрии и с тепловыми параметрами Uизо(H) = 1.2Uэкв(C,N). Все координаты атомов водорода в молекулах H2O и ионах OH– уточнены с мягким ограничением на длины связей O−H 0.9 Å и с тепловыми параметрами Uизо(H) = 1.2Uэкв(O). Проверка структуры на пропущенные элементы симметрии и возможные пустоты проведена по программе PLATON [20]. Основные кристаллографические характеристики и параметры эксперимента: M = = 628.09, a = 26.118(3), b = 27.685(3), c = 15.683(2) Å, V = 11 370(2) Å3, пр. гр. Fdd2, Z = 16, ρ(выч.) = = 1.468 г/см3, μ = 0.833 мм−1, 2θmax = 60.15°, число измеренных рефлексов 36 971, число независимых рефлексов 8323, Rint = 0.0587, параметр Флэка 0.04(1), R1 = 4.08%, wR(F 2) = 8.58%, ∆ρmax/∆ρmin = = 0.304/–0.391 e/Å3.
Порошковая рентгенограмма поликристаллического образца I при комнатной температуре (дифрактометр D8 ADVANCE фирмы Bruker (ЦКП ИФ СО РАН), линейный детектор VANTEC, CuKα-излучение) совпала с вычисленной из монокристальных данных, что подтвердило идентичность поликристаллов и исследованного монокристалла I.
Графическое представление кристаллической структуры и молекул построено по программе DIAMOND [21].
Структура депонирована в Кембриджском банке структурных данных (№ 1887338; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В комплексе I двухзарядный анион BA2− координирован к меди(II) через депротонированный атом N. При ионизации H2BA по первой ступени (рКа1 = 3.89) отрывается протон от группы −С5H2, а ионизация по второй ступени иминной группы иона HBA– происходит только в сильнощелочных средах (рКа2 = 11.9) [15]. Это объясняет кристаллизацию соединения I из водного раствора при рН 10–11.
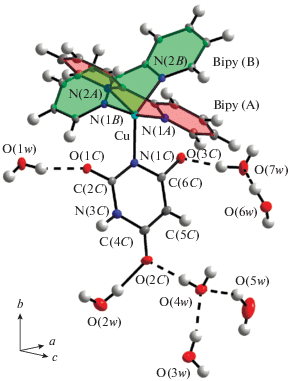
Независимая часть ячейки соединения I содержит ион Cu2+, ион BA2−, две молекулы Bipy и семь молекул H2O (рис. 1). Катион Cu2+ связан c двумя N,N'-бидентатными молекулами Bipy (Cu−N 1.997(3)−2.199(3) Å) и одним ионом BA2− через атом N(1) (Cu−N 1.990(3) Å) с образованием тригональной бипирамиды CuN5. Бипирамиды связаны между собой только ВС (рис. 2). Ионы BA2– и молекулы Bipy практически плоские.
Рис. 1.
Независимая часть ячейки I. Bipy (A) и Bipy (B) обозначены две независимые молекулы 2,2'-дипиридила.
Ранее координация HBA–, BA2– и тиобарбитурат-ионов (HTBA–, TBA2–) только через атом азота не была установлена ни в одном соединении [22]. В димерном комплексе [Pd(Еn-N,N')(μ2-BA-C,N)]2 ⋅ 4H2O (II) [14] μ2-мостиковый ион BA2– координирован к одному Pd(II) через атом азота, а к другому через атом углерода (С(5)). Расстояния С−О в I (1.252(4)–1.263 (5) Å) на ~0.02 Å больше, чем в II, на 0.04 Å длиннее, чем в кетоизомере H2BA [23]. Это можно отнести к большей делокализации электронной плотности в циклической структуре лиганда BA2– для I. В атомной группе O(2)C=C(4)C–C(5)C(H)–C(6)C=O(3)C (рис. 1) иона BA2− в I, а также лигандов HBA− [2–13] и HTBA− [24] имеет место выравнивание электронной плотности, проявляющееся в увеличении длин связей C–О и уменьшении C(4)–C(5) и C(5)–C(6). Координация BA2– к Pd(II) через атом углерода С(5) приводит к другому распределению электронной плотности в циклическом лиганде. Например, длины связей C(4)C−C(5)C (1.45 Å) и C(5)C−C(6)C (1.47 Å) в комплексе Pd(II) значительно превышают соответствующие значения в I, равные соответственно 1.38 и 1.39 Å, и в комплексах с лигандами HBA− [2–13] и HTBA− [24]. Угол C(4)C(5)C)6 в I (121.7(4)°) заметно больше, чем в комплексе палладия (116.7(2)°) и кетонной форме H2BA [23]. Его значение ближе к полученному для координированного иона HBA− [2–13]. Таким образом, дополнительная к атому N координация BA2– через атом С(5) изменяет геометрические параметры в атомной группе O(2)=C(4)–C(5)H–C(6)=O(3), но угол C(2)C–N(1)C−C(6)C (121.2(3)°) в I совпадает с аналогичным углом в [Pd(Еn-N,N')(μ2-HBA−C,N)]2 ⋅ 4H2O (121.6(2)°). Другие примеры координации анионов барбитуровой кислоты к ионам металлов через атом азота неизвестны [22].
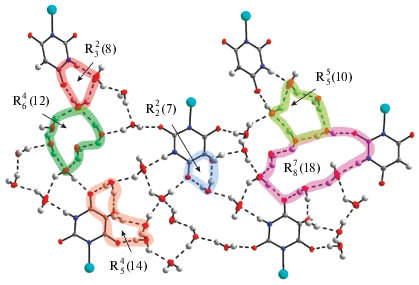
Тринадцать межмолекулярных водородных связей O−H⋅⋅⋅O, N−H⋅⋅⋅O в структуре I (табл. 1) образуют трехмерную сеть, в которой можно выделить слой 2D и супрамолекулярные мотивы [25]: ${\text{R}}_{2}^{2}$(7), ${\text{R}}_{3}^{2}$(8), ${\text{R}}_{5}^{5}$(10), ${\text{R}}_{6}^{4}$(12), ${\text{R}}_{5}^{4}$(14) и ${\text{R}}_{8}^{7}$(18) (рис. 2). К особенности поведения координированного иона BA2– по сравнению с HBA− и HTBA− можно отнести отсутствие его самоассоциации с помощью ВС N−H⋅⋅⋅O. В π−π-взаимодействии с расстояниями между центрами колец 3.47−3.68 Å участвуют только молекулы Bipy.
Таблица 1.
Геометрические параметры водородных связей в структуре I
| D–H···A | Расстояние, Å | Угол D–H···A, град |
Преобразования для атома A | ||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| O(1w)–H(1wA)···O(1C) | 0.89(3) | 1.90(3) | 2.750(4) | 159(4) | x, y, z |
| O(1w)–H(1wB)···O(6w) | 0.89(3) | 1.95(3) | 2.815(5) | 164(4) | 1 – x, 3/2 – y, z – 1/2 |
| O(2w)–H(2wA)···O(5w) | 0.93(4) | 2.02(5) | 2.795(7) | 140(3) | х – 1/4, y – 5/4, z – 1/4 |
| N(3C)–H(3C)···O(5w) | 0.88 | 1.98 | 2.857(6) | 177 | x – 1/4, y – 5/4, z – 1/4 |
| O(2w)–H(2wB)···O(2C) | 0.91(5) | 1.73(5) | 2.638(5) | 172(5) | x,y, z |
| O(3w)–H(3wB)···O(4w) | 0.88(3) | 1.94(3) | 2.806(5) | 168(6) | x,y, z |
| O(4w)–H(4wA)···O(2C) | 0.90(3) | 1.80(4) | 2.672(5) | 163(5) | x,y, z |
| O(4w)–H(4wB)···O(1w) | 0.91(4) | 1.91(4) | 2.798(5) | 165(5) | 1 – x, 3/2 – y, 1/2 + z |
| O(5w)–H(5wA)···O(4w) | 0.92(5) | 1.98(5) | 2.801(6) | 148(5) | x,y, z |
| O(6w)–H(6wA)···O(7w) | 0.89(3) | 2.06(4) | 2.757(5) | 135(4) | x,y, z |
| O(6w)–H(6wB)···O(2w) | 0.89(3) | 1.94(4) | 2.814(5) | 167(4) | 1/4 + x, 5/4 – y, 1/4 + z |
| O(7w)–H(7wA)···O(2w) | 0.90(4) | 1.99(5) | 2.697(6) | 134(4) | 5/4 – x, 1/4 + y, 1/4 + z |
| O(7w)–H(7wB)···O(3C) | 0.90(4) | 1.71(4) | 2.606(4) | 171(4) | x, y, z |
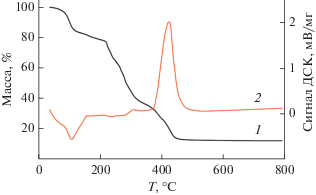
Кривые ТГ и ДСК для I показаны на рис. 3. По данным ИК-спектроскопического анализа отходящих газов ниже 200°С удаляется только вода. При 200°С потеря массы веществом (Δmэксп = = 20.3%) удовлетворительно совпадает с теоретически вычисленной в предположении полной дегидратации соединения (−7H2O, Δmвыч = 20.1%). Дегидратация сопровождается эндоэффектом при 107°С. В диапазоне 200–450°С можно выделить три стадии окислительного разложения координированных молекул Bipy и иона HBA−. Последней стадии соответствует сильный экзо-эффект при 422°С. Конечным продуктом термолиза выше 470°С является CuO (Δmэксп = 12.4%, Δmвыч = 12.7%).
Список литературы
Mahmudov K.T., Kopylovich M.N., Maharramov A.M. et al. // Coord. Chem. Rev. 2014. V. 265. P. 1.
Xiong Y., He C., An N.-C. et al. // Transition Met. Chem. 2003. V. 28. № 1. P. 69.
Gryl M. // Acta Crystallogr. B. 2015. V. 71. № 4. C. 392.
Chu J., Liu Z.Y., Zhao X.J., Yang E.C. // Russ. J. Coord. Chem. 2010. V. 36. № 12. P. 901. https://doi.org/10.1134/S1070328410120067
Golovnev N.N., Solovyov L.A., Lesnikov M.K. et al. // Inorg. Chim. Acta. 2017. V. 467. P. 39.
Braga D., Grepioni F., Lampronti G.I. et al. // Cryst. Growth Des. 2011. V. 11. № 12. P. 5621.
Braga D., Grepioni F., Maini L. et al. // CrystEngComm. 2012. V. 14. P. 3521.
Solovyov L.A., Golovnev N.N., Molokeev M.S., Lesnikov M.K. // J. Coord. Chem. 2017. V. 70. P. 1884.
Головнев Н.Н., Молокеев М.К., Лесников М.К. и др. // Журн. неорган. химии. 2017. Т. 62. № 6. С. 761 (Golovnev N.N., Molokeev M.S., Lesnikov M.K. et al. // Russ. J. Inorg. Chem. 2017. V. 62. P. 746. https://doi.org/10.1134/S0036023617060092).
Chierotti M.R., Gaglioti K., Gobetto R. et al. // Cryst-EngComm. 2013. V. 15. P. 7598.
Gryl M., Stadnicka K. // Acta Crystallogr. E. 2011. V. 67. P. m571.
Braga D., Grepioni F., Maini L., Prosperi S. et al. // Chem. Commun. 2010. V. 46. P. 7715.
Golovnev N.N., Molokeev M.S., Sterkhova I.V., Lesnikov M.K. // Inorg. Chem. Commun. 2018. V. 97. P. 88.
Sinn E., Flynn C.M., Jr., Martin R.B. // J. Am. Chem. Soc. 1978. V. 100. № 2. P. 489.
Türkel N., Aksoy M. S. // ISRN Anal. Chem. 2014. V. 2014. P. 1.
Korpi H., Sippola V., Filpponen I. et al. // Appl. Catal. A. 2006. V. 302. № 2. P. 250.
Garcia H.C. // J. Coord. Chem. 2011. V. 64. P. 1125.
Gerasimova T.P., Katsyuba S.A. // Dalton Trans. 2013. V. 42. P. 1787.
Sheldrick G.M. // Acta. Crystallogr. A. 2008. V. 64. № 1. P. 112.
PLATON. A Multipurpose Crystallographic Tool. Utrecht (Netherlands): Univ. of Utrecht, 2008.
Brandenburg K., Berndt M. DIAMOND – Visual Crystal Structure Information System CRYSTAL IMPACT. Postfach, 2005. P. 1251.
Cambridge Structural Database. Version 5.36. Cambridge (UK): Univ. of Cambridge, 2018.
Lewis T.C., Tocher D.A., Price S.L. // Cryst. Growth Des. 2004. V. 4. № 5. P. 979.
Головнев Н.Н., Молокеев М.С. 2-Тиобарбитуровая кислота и ее комплексы с металлами: синтез, структура и свойства. Красноярск: Сиб. федер. ун-т, 2014. 252 с.
Стид Дж.В., Этвуд Дж.Л. Супрамолекулярная химия. Ч. 1–2. М.: Академкнига, 2007. 895 с.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия