Координационная химия, 2020, T. 46, № 1, стр. 40-44
Кристаллическая структура гетеролигандного комплекса [(2-Br-5-MePy)2CoCl2] · (2-Br-5-MePy): образование супрамолекулярных ассоциатов за счет галогенной связи
С. А. Адонин 1, 2, 3, 4, *, А. С. Новиков 5, В. П. Федин 1, 4
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
2 Тюменский индустриальный университет, Тобольский индустриальный институт (филиал)
Тобольск, Россия
3 Южно-Уральский государственный университет
Челябинск, Россия
4 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
5 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: adonin@niic.nsc.ru
Поступила в редакцию 31.07.2019
После доработки 09.08.2019
Принята к публикации 15.08.2019
Аннотация
Реакцией CoCl2 с 2-бром-5-метилпиридином (2-Br-5-MePy) в этаноле получен гетеролигандный комплекс [(2-Br-5-MePy)2CoCl2] · (2-Br-5-MePy) (I), строение которого определено методом РСА (СIF file ССDС № 1921405). В кристаллической структуре наблюдаются специфические нековалентные взаимодействия Cl···Br (галогенная связь), ведущие к образованию одномерных супрамолекулярных полимеров. Энергии данных контактов определены с помощью квантовохимических методов.
Галогенная связь (ГС) представляет собой специфический тип нековалентных взаимодействий, привлекающий особое внимание специалистов в области супрамолекулярной химии на протяжении последних лет [1–4]. Помимо чисто фундаментального интереса, направленный дизайн “строительных блоков”, способных к формированию ГС, актуален в контексте использования данного свойства при разработке функциональных материалов, в особенности сенсоров [5, 6]. В качестве кандидатов на эту роль рассматриваются многие галогенсодержащие структурные фрагменты и индивидуальные вещества, в частности галогеналканы [7–9], полигалогениды [10–15], перфторированные иодарены [16–18] и т.д. Особый интерес вызывают металлокомплексы, содержащие галогензамещенные N-донорные лиганды, в частности производные пиридина: ранее было показано, что подобные фрагменты могут быть легко вовлечены в образование ГС, что приводит к сборке необычных супрамолекулярных ассоциатов в твердом теле [19–25]. Среди наиболее привлекательных “строительных блоков” данного типа следует выделить семейство комплексов типа [MIIL2X2] (M = Cu [23, 26], Ni [27], Cd [22], Co [28], Pd [29, 30] и т.д., X = Cl, Br, I, L = галогензамещенный пиридин). Отличаясь простотой синтеза, они представляют собой практически идеальные объекты с точки зрения ГС. Отметим, что химия и строение подобных соединений с 2-галогенпиридинами изучены слабее, чем с 3- и особенно 4-галогенпиридинами. Так, подобные комплексы неизвестны для Ni(II) и Zn(II); для Co(II) ранее была описана структура лишь [Co(2-BrPy)2Br2] [31]. Несмотря на то что многие иные 2-галогенпиридины, например 2-бром-5-метил- и 2-бром-4-метилпиридин, представляют собой коммерчески доступные реагенты, их способность выступать в качестве лигандов практически не описана в литературе.
В настоящей работе мы получили гетеролигандный комплекс [Co(2-Br-5-MePy)2Cl2] · (2-Br-5-MePy) (I), строение которого определено методом РСА. Энергии галогенной связи (Cl···Br) оценены с помощью квантовохимических расчетов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез проводили на воздухе. Исходные реагенты получали из коммерческих источников; этанол подвергали очистке согласно стандартной процедуре.
Синтез I. Навеску CoCl2 · 6H2O (100 мг, 0.42 ммоль) растворяли в 5 мл этанола и добавляли раствор 2‑бром-5-метилпиридина (145 мг, 0.84 ммоль) в 2 мл этанола. Постепенное упаривание растворителя (до ~3 мл) приводило к образованию синих кристаллов I, пригодных для РСА. Выход 62% (при расчете на лиганд).
РCA. Дифракционные данные для монокристалла соединения I получены при 130 K на автоматическом дифрактометре Agilent Xcalibur, оснащенном двухкоординатным детектором AtlasS2 (графитовый монохроматор, λ(MoKα) = 0.71073 Å, ω-сканирование). Интегрирование, учет поглощения, определение параметров элементарной ячейки проводили с использованием пакета программ CrysAlisPro. Кристаллические структуры расшифрованы с использованием программы SHELXT и уточнены полноматричным МНК в анизотропном (за исключением атомов водорода) приближении с использованием программы SHELXL [32]. Позиции атомов водорода органических лигандов рассчитаны геометрически и уточнены по модели “наездника”. Кристаллографические данные и детали дифракционных экспериментов приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры I
| Параметр | Значение |
|---|---|
| M | 645.91 |
| Сингония | Моноклинная |
| Пр. гр. | P21/c |
| a, Å | 12.4449(6) |
| b, Å | 13.7541(6) |
| c, Å | 14.0515(7) |
| β, град | 112.892(6) |
| V, Å3 | 2215.7(2) |
| Z | 4 |
| ρ(выч.), г/см3 | 1.936 |
| μ, mm−1 | 6.44 |
| F(000) | 1252 |
| Размер кристалла, мм | 0.21 × 0.20 × 0.18 |
| Область сканирования по θ, град | 3.4–29.1 |
| Диапазон индексов hkl | −17 ≤ h ≤ 13, −13 ≤ k ≤ 18, −13 ≤ l ≤ 19 |
| Nhkl измеренных/независимых | 11 229/4944 |
| Rint | 0.029 |
| Nhkl с I > 2σ(I) | 4038 |
| Добротность по F 2 | 1.01 |
| R-факторы (I > 2σ(I)) | R1 = 0.0292, wR2 = 0.0555 |
| R-факторы (по всем отражениям) | R1 = 0.0418, wR2 = 0.0597 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.50/−0.58 |
Полные таблицы межатомных расстояний и валентных углов, координаты атомов и параметры атомных смещений депонированы в Кембриджском банке структурных данных (CCDC № 1921405; https://www.ccdc.cam.ac.uk/structures/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Геометрические параметры I сходны с иными представителями комплексов семейства [CoL2Cl2] [33–41]. Расстояния Co–Cl и Co–N в I составляют 2.247–2.254 и 2.056–2.059 Å соответственно, что согласуется с литературными данными (табл. 2). Можно отметить, что корреляции между длинами данных связей и основностью замещенного пиридина, выступающего в роли лиганда, по-видимому, отсутствуют, что, вероятно, объясняется влиянием не только стерических факторов, но и совокупности нековалентных взаимодействий в кристаллических упаковках (как правило, водородной связи).
Таблица 2.
Длины связей Co–Cl и Co–N в комплексах типа [CoL2Cl2]
| Лиганд | Co–N, Å | Co–Cl, Å | Литература |
|---|---|---|---|
| 4-MePy | 2.034–2.068 | 2.230–2.235 | 34 |
| 4-(NH2COCH2)Py | 2.046 | 2.242 | 35 |
| 3-MePy | 2.022–2.033 | 2.223–2.242 | 36 |
| 2-NH2-3-MePy | 2.034–2.039 | 2.230–2.264 | 37 |
| 2-NH2-4-MePy | 2.030–2.035 | 2.248–2.251 | 38 |
| 2-CH3NHPy | 2.042–2.049 | 2.244–2.249 | 39 |
| 2-(Ph3C)NHPy | 2.051–2.054 | 2.239–2.242 | 40 |
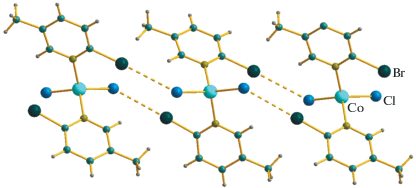
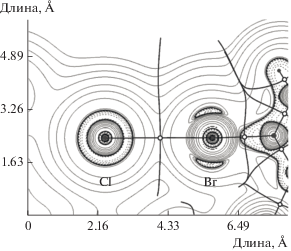
Комплекс I представляет собой сокристаллизат, включающий по одной молекуле 2-бром-5-метилпиридина и [Co(2-Br-5-MePy)2Br2]. Интересно, что как водородные, так и галогенные связи между данными фрагментами отсутствуют (во всех случаях расстояния существенно превышают суммы соответствующих ван-дер-ваальсовых радиусов). Единственным исключением можно считать слабый (2.551 Å) контакт между атомами азота свободного 2-Br-5-MePy и м-протоном одного из соответствующих лигандов. Анализ межатомных расстояний показывает наличие специфических взаимодействий между хлоридными лигандами и атомами брома координированных 2-Br-5-MePy (3.295–3.349 Å, что существенно меньше суммы соответствующих ван-дер-ваальсовых радиусов (3.58 Å [42, 43])). Каждый из фрагментов [Co(2-Br-5-MePy)2Br2] участвует в образовании четырех таких контактов, что приводит к построению бесконечных супрамолекулярных цепочек (рис. 1). С целью установления природы данных взаимодействий (а они могут быть классифицированы как типичные галогенные связи [4]), мы провели квантово-химические расчеты в рамках теории функционала плотности (M06/DZP-DKH) [44–46] с помощью программного пакета Gaussian-09 и топологический анализ распределения электронной плотности по методу QTAIM (квантовая теория атомов в молекулах, предложенная Р. Бейдером [47]) с помощью программы Multiwfn [48]. Данный подход мы успешно применили ранее для изучения свойств различных нековалентных взаимодействий [8, 49–52] в комплексных соединениях переходных металлов. Результаты представлены в табл. 3. Диаграмма контурных линий распределения лапласиана электронной плотности ∇2ρ(r), связевые пути и поверхности нулевого потока, соответствующие нековалентным взаимодействиям Br···Cl в кристалле I, представлены на рис. 2. Значения электронной плотности, лапласиана электронной плотности, суммарной плотности энергии, плотности потенциальной энергии и лагранжиана кинетической энергии в критических точках связей (3, –1), соответствующих нековалентным взаимодействиям Br···Cl в I, вполне типичны для такого рода супрамолекулярных контактов с участием атомов галогенов [53]. Оценочные значения энергии нековалентных взаимодействий Br···Cl в кристалле I варьируются в диапазоне 1.9–2.9 ккал/моль в зависимости от способа оценки. Соотношение плотности потенциальной энергии и лагранжиана кинетической энергии в критических точках связей (3, –1), соответствующих нековалентным взаимодействиям Br···Cl в кристалле I, свидетельствует об отсутствии существенной доли ковалентной компоненты в данных супрамолекулярных контактах.
Таблица 3.
Значения электронной плотности (ρ(r)), лапласиана электронной плотности (∇2ρ(r)), суммарной плотности энергии (Hb), плотности потенциальной энергии (V(r)) и лагранжиана кинетической энергии (G(r)) (ат. ед.) в критических точках связей (3, –1), соответствующих нековалентным взаимодействиям Br···Cl в кристалле I, длины данных контактов (l, Å) и их энергии (E, ккал/моль), оцененные с помощью различных предложенных в литературе корреляций
| ρ(r) | ∇2ρ(r) | Hb | V(r) | G(r) | E а | E б | E в | E г | Lд |
|---|---|---|---|---|---|---|---|---|---|
| 0.010 | 0.033 | 0.001 | –0.006 | 0.007 | 1.9 | 1.9 | 2.2 | 2.5 | 3.349 |
| 0.011 | 0.037 | 0.002 | –0.006 | 0.008 | 1.9 | 2.2 | 2.2 | 2.9 | 3.295 |
а E = –V(r)/2 (корреляция разработана для оценки энергии водородных связей) [54]. б E = 0.429G(r) (корреляция разработана для оценки энергии водородных связей) [55]. в E = 0.58(−V(r)) (корреляция разработана специально для оценки энергии нековалентных взаимодействий с участием атомов брома) [56]. г E = 0.57G(r) (корреляция разработана специально для оценки энергии нековалентных взаимодействий с участием атомов брома) [56]. д Наименьшие ван-дер-ваальсовы радиусы для атомов брома и хлора 1.83 и 1.75 Å соответственно [42].
Рис. 2.
Диаграмма контурных линий распределения лапласиана электронной плотности ∇2ρ(r), связевые пути и поверхности нулевого потока, соответствующие нековалентным взаимодействиям Br···Cl в кристалле I. Критические точки связи (3, –1) – белые круги, критические точки ядер (3, –3) – серые круги. Единицы измерения длины по осям X и Y указаны в Å.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Metrangolo P., Murray J.S., Pilati T. et al. // Cryst. Growth Des. 2011. V. 11. P. 4238.
Amendola V., Bergamaschi G., Boiocchi M. et al. // RSC Adv. 2016. V. 6. P. 67540.
Cavallo G., Metrangolo P., Pilati T. et al. // Chem. Soc. Rev. 2010. V. 39. P. 3772.
Cavallo G., Metrangolo P., Milani R. et al. // Chem. Rev. 2016. V. 116. P. 2478.
Weis J.G., Ravnsbæk J.B., Mirica K.A., Swager T.M. // ACS Sensors. 2016. V. 1. P. 115.
Mullaney B.R., Thompson A.L., Beer P.D. // Angew. Chem. Int. Ed. 2014. V. 53. P. 11458.
Kinzhalov M.A., Kashina M.V., Mikherdov A.S. et al. // Angew. Chem. Int. Ed. 2018. V. 57. P. 12785.
Novikov A.S., Ivanov D.M., Avdontceva M.S., Kukushkin V.Y. // CrystEngComm. 2017. V. 19. P. 2517.
Zelenkov L.E., Ivanov D.M., Avdontceva M.S. et al. // Z. Kristallogr. – Cryst. Mater. 2019. V. 234. P. 9.
Adonin S.A., Sokolov M.N., Fedin V.P. // Coord. Chem. Rev. 2018. V. 367. P. 1.
Torubaev Y.V., Skabitskiy I.V., Pavlova A.V., Pasynskii A.A. // New J. Chem. 2017. V. 41. P. 3606.
Wolff M., Okrut A., Feldmann C. // Inorg. Chem. 2011. V. 50. P. 11683.
Brückner R., Haller H., Steinhauer S. et al. // Angew. Chem. Int. Ed. 2015. V. 54. P. 15579.
Haller H., Hog M., Scholz F. et al. // Z. Naturforsch. B. 2013. V. 68. P. 1103.
Bulatova M., Melekhova A.A., Novikov A.S. et al. // Z. Kristallogr. – Cryst. Mater. 2018. V. 233. P. 371.
Torubaev Y.V., Skabitskiy I.V., Rusina P. et al. // Crys-tEngComm. 2018. V. 20. P. 2258.
Brown J.J., Brock A.J., Pfrunder M.C. et al. // Aust. J. Chem. 2017. V. 70. P. 594.
Sivchik V.V., Solomatina A.I., Chen Y.-T. et al. // Angew. Chem. Int. Ed. 2015. V. 54. P. 14057.
Awwadi F., Haddad S.F., Willett R.D., Twamley B. // Cryst. Growth Des. 2010. V. 10. P. 158.
Awwadi F.F., Taher D., Haddad S.F., Turnbull M.M. // Cryst. Growth Des. 2014. V. 14. P. 1961.
Awwadi F.F., Taher D., Maabreh A. et al. // Struct. Chem. 2013. V. 24. P. 401.
Brammer L., Mínguez Espallargas G., Adams H. // Cry-stEngComm. 2003. V. 5. P. 343.
Mínguez Espallargas G., Florence A.J., van de Streek J., Brammer L. // CrystEngComm. 2011. V. 13. P. 4400.
Zordan F., Purver S. L., Adams H., Brammer L. // Cry-stEngComm. 2005. V. 7. P. 350.
Mínguez Espallargas G., Zordan F., Arroyo Marín L. et al. // Chem. Eur. J. 2009. V. 15. P. 7554.
Espallargas G.M., Brammer L., van de Streek J. et al. // J. Am. Chem. Soc. 2006. V. 128. P. 9584.
Amombo Noa F.M., Bourne S.A., Su H., Nassimbeni L.R. // Cryst. Growth Des. 2017. V. 17. P. 1876.
Clemente-Juan J.M., Coronado E., Mínguez Espallargas G. et al. // CrystEngComm. 2010. V. 12. P. 2339.
Zordan F., Brammer L. // Cryst. Growth Des. 2006. V. 6. P. 1374.
Zordan F., Brammer L., Sherwood P. // J. Am. Chem. Soc. 2005. V. 127. P. 5979.
Hiltunen L., Niinistö L., Kenessey G. et al. // Acta Chem. Scand. 1994. V. 48. P. 456.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Trofimov B.A., Gusarova N.K., Artem’ev A.V. et al. // Mendeleev Commun. 2012. V. 22. P. 187.
Laing M., Carr G. // Acta Crystallogr. B. 1975. V. 31. P. 2683.
Ma Z., Han S., Kravtsov V.C., Moulton B. // Inorg. Chim. Acta. 2010. V. 363. P. 387.
Wyrzykowski D., Styczeń E., Warnke Z., Kruszyński R. // Transition. Met. Chem. 2006. V. 31. P. 860.
Tadjarodi A., Bijanzad K., Notash B. // Acta Crystallogr. E. 2010. V. 66. P. m1293.
Ahmadi R.A., Safari N., Khavasi H.R., Amani S. // J. Coord. Chem. 2011. V. 64. P. 2056.
Domide D., Walter O., Behrens S. et al. // Eur. J. Inorg. Chem. 2011. V. 2011. P. 860.
Fang Y., Huang C.-Y., Zhu Z.-M. et al. // Acta Crystallogr. E. 2006. V. 62. P. m3347.
Artem’ev A.V., Kashevskii A.V., Bogomyakov A.S. et al. // Dalton. Trans. 2017. V. 46. P. 5965.
Bondi A. // J. Phys. Chem. 1966. V. 70. P. 3006.
Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113. P. 5806.
Zhao Y., Truhlar D.G. // Theor. Chem. Acc. 2008. V. 120. P. 215.
Canal Neto A., Jorge F.E. // Chem. Phys. Lett. 2013. V. 582. P. 158.
Barros C.L., de Oliveira P.J.P., Jorge F.E. et al. // Mol. Phys. 2010. V. 108. P. 1965.
Bader R.F.W. // Chem. Rev. 1991. V. 91. P. 893.
Lu T., Chen F. // J. Comput. Chem. 2012. V. 33. P. 580.
Novikov A.S., Ivanov D.M., Bikbaeva Z.M. et al. // Cryst. Growth Des. 2018. V. 18. P. 7641.
Kinzhalov M.A., Novikov A.S., Chernyshev A.N., Suslonov V.V. // Z. Kristallogr. – Cryst. Mater. 2017. V. 232. P. 299.
Mikherdov A.S., Novikov A.S., Kinzhalov M.A. et al. // Inorg. Chem. 2018. V. 57. P. 3420.
Baykov S.V., Dabranskaya U., Ivanov D.M. et al. // Cryst. Growth Des. 2018. V. 18. P. 5973.
Adonin S.A., Gorokh I.D., Abramov P.A. et al. // Eur. J. Inorg. Chem. 2017. V. 42. P. 4925.
Espinosa E., Molins E., Lecomte C. // Chem. Phys. Lett. 1998. V. 285. P. 170.
Vener M.V., Egorova A.N., Churakov A.V., Tsirelson V.G. // J. Comput. Chem. 2012. V. 33. P. 2303.
Bartashevich E.V., Tsirelson V.G. // Russ. Chem. Rev. 2014. V. 83. P. 1181.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия