Координационная химия, 2020, T. 46, № 1, стр. 45-55
µ2-ОКСО-бис[(2,5-динитрофеноксо)триарилсурьма]. Синтез, строение, реакции с пентаарилсурьмой
В. В. Шарутин 1, *, О. К. Шарутина 1, А. Н. Ефремов 1
1 Южно-Уральский государственный университет
Челябинск, Россия
* E-mail: vvsharutin@rambler.ru
Поступила в редакцию 03.04.2019
После доработки 18.07.2019
Принята к публикации 22.07.2019
Аннотация
Окислением триарилсурьмы трет-бутилгидропероксидом в присутствии 2,5-динитрофенола получены ароксиды сурьмы [Ph3SbOC6H3(NO2)2-2,5]2O (I) и [(4-MeC6H4)3SbOC6H3(NO2)2-2,5]2O (II). Фрагменты SbOSb в I и II изогнуты (соответствующие углы составляют 139.70(10)° и 142.32(12)°). Длины связей Sb−Омост (1.973(3), 1.980(3) Å в I; 1.975(2), 1.977(2) Å в II) существенно короче, чем Sb−Oтерм (2.211(3), 2.213(3) и 2.191(2), 2.191(2) Å в I и II соответственно). Из Ar5Sb и I, II в присутствии кислорода и углекислого газа воздуха образуются ароксиды Ar4SbOC6H3(NO2)2-2,5, Ar = Ph (III), 4-MeC6H4 (IV) и карбонаты (Ar4Sb)2CO3, Ar = Ph (V), 4-MeC6H4 (VI). В тригонально-бипирамидальных молекулах III и IV аксиальные углы СSbO составляют 175.80(7)° и 176.86(10)° (Sb−O 2.290(2) и 2.342(2) Å соответственно). Один из атомов сурьмы в V и двух типах кристаллографически независимых молекул VI пентакоординирован (связи Sb−Oакс 2.245(6) Å в V и 2.263(3), 2.263(3) Å в VIа, VIb), а второй атом сурьмы − гексакоординирован (Sb−O 2.249(6), 2.273(5) Å в V и 2.216(2), 2.251(2) Å; 2.217(2), 2.251(2) Å в VIа,VIb). СIF files ССDС № 1890704 (I), 1890706 (II), 1890713 (III), 1890714 (IV), 994519 (V), 994177 (VI).
В настоящее время интерес исследователей вызывают арильные соединения сурьмы из-за их биологической [1, 2] и фотокаталитической активности [3], а также эффективного использования в тонком органическом синтезе [4]. Наиболее известные сурьмаорганические соединения – производные сурьмы Ar3SbX2 и (Ar3SbX)2O, получаемые, в основном окислением триарилсурьмы. Известно, что синтез соединений Ar3Sb(OAr)2 или (Ar3SbOAr)2O имеет место при добавлении пероксида к смеси триарилсурьмы, кислоты HX и диэтилового эфира [5, 6], однако в некоторых случаях образуются только мостиковые соединения. Так, трифенилсурьма реагирует с пикриновой кислотой и пероксидом водорода до соединения сурьмы с фрагментом SbOSb [7]. Невозможность синтеза Ph3Sb(OAr)2 обусловлена, по-видимому, стерическими затруднениями, вызываемыми присутствием при центральном атоме двух больших по объему ароксильных заместителей. В этой связи исследование синтеза производных сурьмы, содержащих группировку Sb−O−Sb, весьма актуально.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез µ2-оксо-бис[(2,5-динитрофеноксо)трифенилсурьмы] (I) проводили по методике, описанной в [5]. Выход красно-коричневых кристаллов 92%, Тпл = 172°С. ИК-спектр (ν, см−1): 3072, 3055 (Ar), 1533, 1346 (NO2), 1280 (C–O), 734, 690 (Ph), 463 (Sb–C).
Аналогично получали соединение µ2-оксо-бис[(2,5-динитрофеноксо)три-пара-толилсурьмы] (II). Выход красно-коричневых кристаллов 89%, Тразл = 217°С. ИК-спектр (ν, см−1): 3107, 3018 (Ar), 2922 (Me), 1533, 1346 (NO2), 1298 (C–O), 734, 698 (Ph), 486 (Sb–C).
Синтез Ar4SbOC6H3(NO2)2-2,5 (III) и (Ar4Sb)2СO3 (V) проводили из реакционной смеси, содержащей пентафенилсурьму (101 мг, 0.2 ммоль), соединение I (109 мг, 0.2 ммоль) и 10 мл бензола, дробной кристаллизацией из раствора бензол–октан (2 : 1 объемн.). Выход красно-коричневых кристаллов 88 мг (72%), Тпл = 199°С. ИК-спектр (ν, см−1): 3078, 3066 (Ar), 1530, 1346(NO2), 1288 (C–O), 733, 690 (Ph), 457 (Sb–C).
Вторым продуктом реакции являлись бесцветные кристаллы V (60 мг, 65%), Тпл = 227°С. ИК‑спектр (ν, см−1): 3433, 3138, 3062, 3049, 2987, 2951, 2902, 2837, 2640, 2596, 2519, 1953, 1886, 1815, 1631, 1577, 1479, 1471, 1433, 1429, 1382, 1332, 1305, 1263, 1186, 1157, 1099, 1066, 1022, 997, 972, 918, 850, 831, 729, 692, 663, 653, 464, 457, 449.
Аналогично получали соединения IV и VI: IV (68%), красно-коричневые кристаллы, Тпл = 185°С. ИК-спектр (ν, см−1): 3078, 3066 (Ar), 1530, 1346 (NO2), 1302 (C–O), 733, 691 (Ph), 486 (Sb–C).
VI (65%), Тпл = 236°С. ИК-спектр (ν, см−1): 3431, 3064, 3028, 3008, 2962, 2918, 2864, 2729, 2605, 2524, 2077, 1909, 1809, 1743, 1641, 1593, 1562, 1492, 1473, 1394, 1311, 1261, 1211, 1188, 1143, 1114, 1099, 1058, 1039, 1016, 989, 966, 947, 831, 796, 750, 702, 684, 636, 582, 572, 487, 408.
ИК-спектры комплексов I−VI записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетках KBr в области 4000−400 см−1.
РСА кристаллов I−VI провeден на дифрактометре D8 Quest фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 293 К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [8]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [9] и OLEX2 [10]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Основные кристаллографические данные и результаты уточнения структур I−VI приведены в табл. 1, основные длины связей и валентные углы − в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I−VI
| Параметр | I | II | III | IV | V | VI |
|---|---|---|---|---|---|---|
| М | 1088.31 | 1172.46 | 613.25 | 669.36 | 920.31 | 1032.54 |
| Сингония | Триклинная | Моноклинная | Моноклинная | Моноклинная | Ромбическая | Моноклинная |
| Пр. группа | P1 | P21/c | P21/c | P21/c | Pbca | P21/n |
| a, Å | 12.675(10) | 15.005(8) | 10.858(4) | 10.090(8) | 20.5819(16) | 11.2249(4) |
| b, Å | 13.436(16) | 14.320(6) | 14.490(6) | 18.101(11) | 11.4595(8) | 16.5244(7) |
| c, Å | 15.462(12) | 25.684(13) | 17.086(8) | 18.204(12) | 34.417(3) | 27.6426(11) |
| α, град | 105.92(4) | 90.00 | 90.00 | 90.00 | 90.00 | 90.00 |
| β, град | 98.65(4) | 102.66(3) | 95.78(2) | 103.90(3) | 90.00 | 96.1559(13) |
| γ, град | 112.57(4) | 90.00 | 90.00 | 90.00 | 90.00 | 90.00 |
| V, Å3 | 2239(4) | 5385(5) | 2674.5(19) | 3228(4) | 8117.6(11) | 5097.7(3) |
| Z | 2 | 4 | 4 | 4 | 8 | 4 |
| ρ(выч.), г/см3 | 1.614 | 1.446 | 1.523 | 1.378 | 1.506 | 1.345 |
| μMo, мм−1 | 1.273 | 1.064 | 1.074 | 0.896 | 1.372 | 1.101 |
| F(000) | 1084.0 | 2360.0 | 1232.0 | 1360.0 | 3680.0 | 2096.0 |
| Размер кристалла, мм | 0.22 × 0.19 × 0.07 | 0.52 × 0.51 × 0.31 | 0.44 × 0.2 × 0.12 | 1 × 0.51 × 0.32 | 0.47 × 0.26 × 0.11 | 0.59 × 0.29 × 0.16 |
| 2θ, град | 6.28−65.34 | 5.8−65.22 | 6.4−56.68 | 5.68−71.38 | 3.12−26.4 | 2.99−26.07 |
| Интервалы индексов отражений | −19 ≤ h ≤ 19, −20 ≤ k ≤ 20, −23 ≤ l ≤ 23 |
−22 ≤ h ≤ 22, −21 ≤ k ≤ 21, −38 ≤ l ≤ 38 |
−14 ≤ h ≤ 14, −19 ≤ k ≤ 19, −22 ≤ l ≤ 22 |
−16 ≤ h ≤ 16, −29 ≤ k ≤ 29, −29 ≤ l ≤ 29 |
−25 ≤ h ≤ 25, −14 ≤ k ≤ 11, −43 ≤ l ≤ 42 |
−13 ≤ h ≤ 13, −20 ≤ k ≤ 20, −34 ≤ l ≤ 34 |
| Всего отражений | 112 727 | 247 088 | 43 963 | 133 239 | 86 607 | 148 451 |
| Независимых отражений (Rint) | 16 320 (0.0540) | 19 466 (0.0459) | 6642 (0.0250) | 14 847 (0.0491) | 8258 (0.0834) | 20 073 (0.0267) |
| Число отражений с F 2 > 2σ(F 2) | 16 320 | 19 466 | 6642 | 14847 | 5198 | 16 608 |
| Число уточняемых параметров | 586 | 646 | 343 | 383 | 487 | 1133 |
| GOOF | 1.018 | 1.163 | 1.108 | 1.114 | 1.087 | 1.184 |
| R-факторы по F 2 > 2σ(F 2) |
R1 = 0.0387, wR2 = 0.0855 |
R1 = 0.0494, wR2 = 0.0848 | R1 = 0.0256, wR2 = 0.0604 |
R1 = 0.0649, wR2 = 0.1325 |
R1 = 0.0642, wR2 = 0.1557 | R1 = 0.0373, wR2 = 0.0782 |
| R-факторы по всем отражениям | R1 = 0.0732, wR2 = 0.1016 |
R1 = 0.0886, wR2 = 0.1036 |
R1 = 0.0338, wR2 = 0.0655 |
R1 = 0.1222, wR2 = 0.1587 |
R1 = 0.1147, wR2 = 0.1803 | R1 = 0.0494, wR2 = 0.0883 |
| Остаточная электронная плотность (max/min), e/Å3 | 1.84/−1.41 | 2.01/−1.10 | 0.42/−0.85 | 0.83/−0.87 | 1.80/−0.67 | 1.04/−0.54 |
Таблица 2.
Основные межатомные расстояния и валентные углы в структурах I−VI
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| I | |||
| Sb(1)−O(1) | 1.973(3) | O(1)Sb(1)O(2) | 175.31(8) |
| Sb(1)−O(2) | 2.211(3) | O(1)Sb(1)C(1) | 93.67(11) |
| Sb(1)−C(1) | 2.109(3) | O(1)Sb(1)C(11) | 94.58(12) |
| Sb(1)−C(11) | 2.093(3) | O(1)Sb(1)C(21) | 92.90(12) |
| Sb(1)−C(21) | 2.097(3) | C(1)Sb(1)O(2) | 90.36(11) |
| Sb(2)−O(1) | 1.980(2) | C(11)Sb(1)O(2) | 81.63(12) |
| Sb(2)−O(7) | 2.213(3) | C(11)Sb(1)C(1) | 112.87(11) |
| Sb(2)−C(51) | 2.107(3) | C(11)Sb(1)C(21) | 129.87(12) |
| Sb(2)−C(61) | 2.102(3) | C(21)Sb(1)O(2) | 87.48(12) |
| Sb(2)−C(41) | 2.101(3) | C(21)Sb(1)C(1) | 115.99(12) |
| O(7)−C(71) | 1.312(4) | O(1)Sb(2)O(7) | 176.80(8) |
| O(2)−C(31) | 1.307(3) | O(1)Sb(2)C(51) | 92.54(12) |
| C(75)−N(4) | 1.475(5) | O(1)Sb(2)C(61) | 92.52(11) |
| C(72)−N(3) | 1.453(4) | O(1)Sb(2)C(41) | 97.31(12) |
| C(35)−N(2) | 1.475(5) | C(51)Sb(2)O(7) | 90.59(12) |
| C(32)−N(1) | 1.459(4) | C(61)Sb(2)O(7) | 85.61(11) |
| N(3)−O(8) | 1.219(5) | C(61)Sb(2)C(51) | 113.59(12) |
| O(9)−N(3) | 1.205(4) | C(41)Sb(2)O(7) | 82.04(12) |
| O(10)−N(4) | 1.206(5) | C(41)Sb(2)C(51) | 113.47(13) |
| O(6)−N(2) | 1.205(4) | C(41)Sb(2)C(61) | 131.28(12) |
| O(3)−N(1) | 1.215(4) | Sb(1)O(1)Sb(2) | 139.70(10) |
| II | |||
| Sb(1)−O(2) | 2.191(2) | O(1)Sb(1)O(2) | 178.17(9) |
| Sb(1)−O(1) | 1.975(2) | O(1)Sb(1)C(1) | 96.15(11) |
| Sb(1)−C(1) | 2.112(3) | O(1)Sb(1)C(21) | 96.46(11) |
| Sb(1)−C(21) | 2.105(3) | O(1)Sb(1)C(11) | 90.97(11) |
| Sb(1)−C(11) | 2.113(3) | C(1)Sb(1)O(2) | 85.68(11) |
| Sb(2)−O(1) | 1.977(2) | C(1)Sb(1)C(11) | 118.10(12) |
| Sb(2)−O(7) | 2.191(2) | C(21)Sb(1)O(2) | 82.41(10) |
| Sb(2)−C(61) | 2.111(3) | C(21)Sb(1)C(1) | 126.00(13) |
| Sb(2)−C(41) | 2.104(3) | C(21)Sb(1)C(11) | 113.92(12) |
| Sb(2)−C(51) | 2.115(4) | C(11)Sb(1)O(2) | 88.17(10) |
| O(2)−C(31) | 1.303(4) | O(1)Sb(2)O(7) | 177.51(10) |
| O(7)−C(71) | 1.317(4) | O(1)Sb(2)C(61) | 92.94(11) |
| C(75)−N(4) | 1.495(5) | O(1)Sb(2)C(41) | 98.93(11) |
| C(72)−N(3) | 1.477(5) | O(1)Sb(2)C(51) | 92.34(12) |
| C(32)−N(1) | 1.460(5) | C(61)Sb(2)O(7) | 88.46(11) |
| C(35)−N(2) | 1.481(5) | C(61)Sb(2)C(51) | 116.60(14) |
| O(3)−N(2) | 1.204(4) | C(41)Sb(2)O(7) | 82.27(10) |
| O(5)−N(1) | 1.236(4) | C(41)Sb(2)C(61) | 116.09(13) |
| O(10)−N(4) | 1.206(5) | C(41)Sb(2)C(51) | 125.23(14) |
| O(8)−N(3) | 1.231(5) | C(51)Sb(2)O(7) | 85.19(12) |
| O(4)−N(2) | 1.220(4) | Sb(1)O(1)Sb(2) | 142.32(12) |
| III | |||
| Sb(1)−O(1) | 2.2902(16) | C(21)Sb(1)O(1) | 81.62(6) |
| Sb(1)−C(21) | 2.118(2) | C(21)Sb(1)C(31) | 98.21(8) |
| Sb(1)−C(11) | 2.111(2) | C(11)Sb(1)O(1) | 80.16(7) |
| Sb(1)−C(1) | 2.109(2) | C(11)Sb(1)C(21) | 123.56(8) |
| Sb(1)−C(31) | 2.157(2) | C(11)Sb(1)C(31) | 96.54(8) |
| O(1)−C(41) | 1.300(2) | C(1)Sb(1)O(1) | 85.16(7) |
| C(45)−N(2) | 1.475(3) | C(1)Sb(1)C(21) | 111.91(9) |
| C(42)−N(1) | 1.467(3) | C(1)Sb(1)C(11) | 119.07(8) |
| O(3)−N(1) | 1.223(3) | C(1)Sb(1)C(31) | 98.76(8) |
| O(2)−N(1) | 1.212(3) | C(31)Sb(1)O(1) | 175.80(7) |
| IV | |||
| Sb(1)−O(1) | 2.342(2) | C(1)Sb(1)O(1) | 83.67(12) |
| Sb(1)−C(1) | 2.120(3) | C(1)Sb(1)C(31) | 99.37(14) |
| Sb(1)−C(11) | 2.115(3) | C(11)Sb(1)O(1) | 79.33(11) |
| Sb(1)−C(21) | 2.106(3) | C(11)Sb(1)C(1) | 113.03(13) |
| Sb(1)−C(31) | 2.159(3) | C(11)Sb(1)C(31) | 98.68(12) |
| O(1)−C(41) | 1.299(4) | C(21)Sb(1)O(1) | 81.38(9) |
| C(45)−N(2) | 1.476(6) | C(21)Sb(1)C(1) | 114.71(11) |
| C(42)−N(1) | 1.460(5) | C(21)Sb(1)C(11) | 125.55(12) |
| O(4)−N(2) | 1.187(6) | C(21)Sb(1)C(31) | 97.96(11) |
| N(2)−O(5) | 1.213(5) | C(31)Sb(1)O(1) | 176.86(10) |
| V | |||
| Sb(1)−O(1) | 2.245(6) | C(21)Sb(1)C(1) | 118.4(3) |
| Sb(1)−C(1) | 2.126(8) | C(31)Sb(1)C(1) | 113.6(3) |
| Sb(1)−C(21) | 2.112(10) | C(31)Sb(1)C(21) | 124.7(4) |
| Sb(1)−C(11) | 2.181(9) | C(51)Sb(2)O(2) | 163.1(3) |
| Sb(1)−C(31) | 2.103(9) | C(51)Sb(2)O(3) | 105.2(3) |
| Sb(2)−O(2) | 2.273(5) | C(51)Sb(2)C(8) | 133.9(3) |
| Sb(2)−O(3) | 2.249(6) | C(61)Sb(2)C(8) | 79.2(3) |
| Sb(2)−C(8) | 2.656(9) | C(61)Sb(2)C(41) | 161.6(3) |
| Sb(2)−C(41) | 2.179(9) | C(71)Sb(2)O(3) | 152.8(3) |
| Sb(2)−C(51) | 2.177(9) | C(71)Sb(2)C(8) | 124.2(3) |
| Sb(2)−C(61) | 2.169(9) | C(71)Sb(2)C(51) | 101.9(4) |
| Sb(2)−C(71) | 2.152(9) | C(71)Sb(2)C(61) | 95.6(3) |
| O(1)−C(8) | 1.260(10) | C(8)O(1)Sb(1) | 124.1(6) |
| O(2)−C(8) | 1.302(10) | C(8)O(2)Sb(2) | 91.9(5) |
| O(3)−C(8) | 1.278(10) | C(8)O(3)Sb(2) | 93.6(5) |
| VI | |||
| Sb(1)−C(21) | 2.159(4) | C(21)Sb(1)C(1) | 96.17(15) |
| Sb(1)−C(1) | 2.166(4) | C(21)Sb(1)C(11) | 95.32(15) |
| Sb(1)−C(11) | 2.165(4) | C(21)Sb(1)O(2) | 151.82(11) |
| Sb(1)−O(2) | 2.216(2) | C(21)Sb(1)O(3) | 92.88(11) |
| Sb(1)−O(3) | 2.251(2) | C(21)Sb(1)C(8) | 122.16(12) |
| Sb(1)−C(8) | 2.611(3) | C(21)Sb(1)C(31) | 104.22(14) |
| Sb(1)−C(31) | 2.178(3) | C(1)Sb(1)O(2) | 82.35(13) |
| Sb(4)−O(4) | 2.263(2) | C(1)Sb(1)O(3) | 85.63(12) |
| Sb(4)−C(121) | 2.119(4) | C(1)Sb(1)C(8) | 83.64(13) |
| Sb(4)−C(151) | 2.170(3) | C(1)Sb(1)C(31) | 93.15(15) |
| Sb(4)−C(141) | 2.117(4) | C(11)Sb(1)C(1) | 165.55(15) |
| Sb(4)−C(131) | 2.127(3) | C(11)Sb(1)O(2) | 83.39(14) |
| Sb(3)−O(5) | 2.217(2) | C(11)Sb(1)O(3) | 85.08(12) |
| Sb(3)−C(101) | 2.157(4) | C(11)Sb(1)C(8) | 82.84(13) |
| Sb(3)−C(8) | 2.166(4) | C(11)Sb(1)C(31) | 92.48(15) |
| Sb(3)−O(6) | 2.251(2) | O(2)Sb(1)O(3) | 58.94(8) |
| Sb(3)−C(9) | 2.609(3) | O(2)Sb(1)C(8) | 29.67(9) |
| Sb(3)−C(111) | 2.177(3) | O(3)Sb(1)C(8) | 29.28(9) |
| Sb(3)−C(91) | 2.165(4) | C(31)Sb(1)O(2) | 103.97(12) |
| Sb(2)−C(41) | 2.120(4) | C(31)Sb(1)O(3) | 162.89(12) |
| Sb(2)−C(71) | 2.172(3) | C(31)Sb(1)C(8) | 133.61(13) |
| Sb(2)−O(1) | 2.263(2) | C(121)Sb(4)O(4) | 86.32(11) |
| Sb(2)−C(51) | 2.114(4) | C(121)Sb(4)C(151) | 97.00(14) |
| Sb(2)−C(61) | 2.125(3) | C(121)Sb(4)C(131) | 116.86(14) |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (ССDС № 1890704 (I), 1890706 (II), 1890713 (III), 1890714 (IV), 994519 (V), 994177 (VI); deposit@ccdc. cam.ac.uk; http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В литературе описан ряд соединений сурьмы, содержащих группировку Sb−O−Sb, в которых концевые лиганды – органосульфонатные [11–14], диметилфосфинатные [15], нитро- [16], карбоксилатные [17, 18] и другие органические группы [19–21].
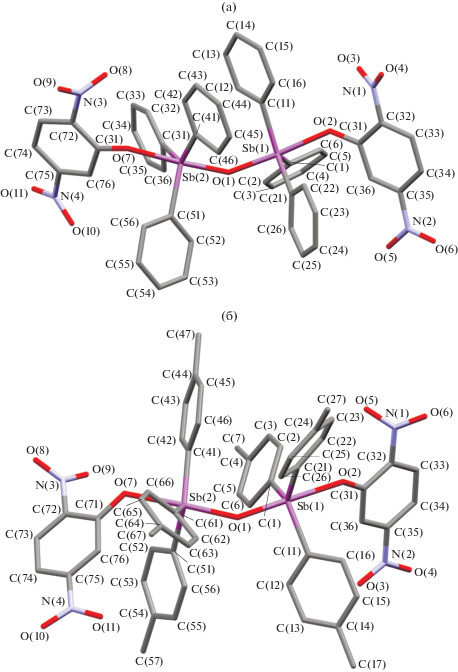
В настоящей работе продолжено изучение окислительного синтеза оксо-ароксидов триарилсурьмы. Установлено, что независимо от соотношения исходных реагентов, продуктами реакции трифенил- и три-(пара-толил)сурьмы с 2,5-динитрофенолом в присутствии трет-бутилгидропероксида в диэтиловом эфире являются биядерные соединения сурьмы [Ar3SbOC6H3(NO2)2-2,5]2O, Ar = Ph (I), 4‑MeC6H4 (II).
После перекристаллизации продуктов реакции из смеси бензол–октан получали устойчивые на воздухе красно-коричневые кристаллы.
Пентакоординированные атомы сурьмы в I и II связаны между собой через атомы кислорода (рис. 1). Углы OаксSbOакс (175.31(8)°, 176.80(8)° в I и 178.17(9)°, 177.51(10)° в II) мало различаются. Выходы атомов сурьмы из плоскостей [C3] к центральным атомам кислорода составляют 0.136, 0.155 Å в I и 0.171, 0.176 Å в II. Фрагменты Sb−O−Sb молекул I и II изогнуты (углы SbOSb 139.70(10)° и 142.32(12)°), что близко к величине аналогичного угла в μ2-оксо-бис[(2,4,6-тринитрофенолято)трифенилсурьме] (142.5(8)°) [7]. Расстояния Sb−С изменяются в интервалах 2.093(3)−2.109(3) и 2.104(3)−2.115(4) Å в I и II соответственно, при этом их средние значения в фенильных производных меньше, чем в толильных. Расстояния Sb−Oмост (1.973(3), 1.980(2) Å в I и 1.975(2), 1.977(2) Å в II) меньше, чем Sb−Oконц (2.211(3), 2.213(3) Å в I и 2.191(2), 2.191(2) Å в II). Отметим, что расстояния Sb−Oмост практически совпадают, в то время как расстояния Sb−Oконц в I длиннее, чем в II. Связи С−O в фенолятных лигандах (1.307(3), 1.312(4) Å в I и 1.303(4), 1.317(4) Å в II) сопоставимы по длине, но больше, чем в изолированных 2,5-динитрофенолятных анионах (1.268(6) Å [22]). В кристалле I межмолекулярные водородные связи O(3)∙∙∙H(64)2.42 Å сшивают структурные единицы в единое целое. В кристалле комплекса II структурирование осуществляется за счет водородных связей между атомом кислорода орто-нитрогруппы фенолятного лиганда одной молекулы с мета-Н фенолятной группы другой молекулы.
Мы показали, что продуктами реакций пентаарилсурьмы с I и II являются ароксиды тетраарилсурьмы Ar4SbOC6H3(NO2)2-2,5, Ar = Ph (III), 4-MeC6H4 (IV) и карбонаты тетраарилсурьмы, образующиеся при контакте реакционной смеси с углекислым газом воздуха [23].
Соединения III и IV также синтезировали из пентаарилсурьмы и 2,5-динитрофенола.
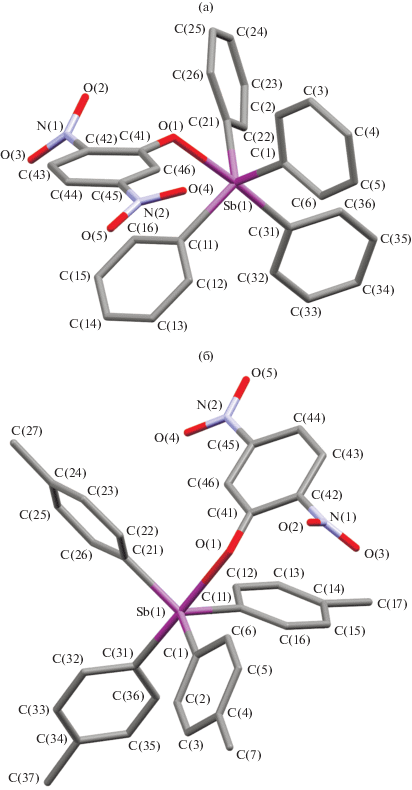
По данным РСА, в тригонально-бипирамидальных молекулах III и IV атомы кислорода занимают аксиальные положения (рис. 2). Аксиальные углы в III (175.80(7)°) и IV (176.86(10)°) близки к идеальному значению, как и суммы углов в экваториальной плоскости 354.54(9)° в III и 353.29(12)° в IV. Значения углов OSbCэкв меньше 90° (80.16(7)−85.16(7)°, 79.33(11)–83.67(12)°), поскольку отклонения атомов сурьмы от экваториальных плоскостей к аксиальным атомам углерода (0.286 и 0.317 Å) весьма существенны. Связи Sb−Cэкв (2.109(2)–2.118(2) Å в III и 2.106(3)–2.120(3) Å в IV) больше суммы ковалентных радиусов атомов Sb и C (sp2) (2.07 Å [24]). Аксиальные связи Sb−C (2.157(2), 2.159(3) Å) значительно длиннее и тоже равны в пределах погрешности эксперимента. Связь Sb−O в IV (2.342(2) Å) заметно длиннее, чем в III (2.290(2) Å), и значительно длиннее аналогичных расстояний в I, II. Удлинение связи Sb−O в молекуле IV коррелирует с большим искажением тригонально-бипирамидального полиэдра атома сурьмы в ней, что следует из сравнения валентных углов между аксиальными и экваториальными связями и отклонений атома сурьмы от экваториальных плоскостей в соединениях III и IV. Слабые водородные связи О⋅⋅⋅Н−С (О···Н 2.52−2.98 Å) объединяют структурные блоки в кристалле III в отличие от IV.
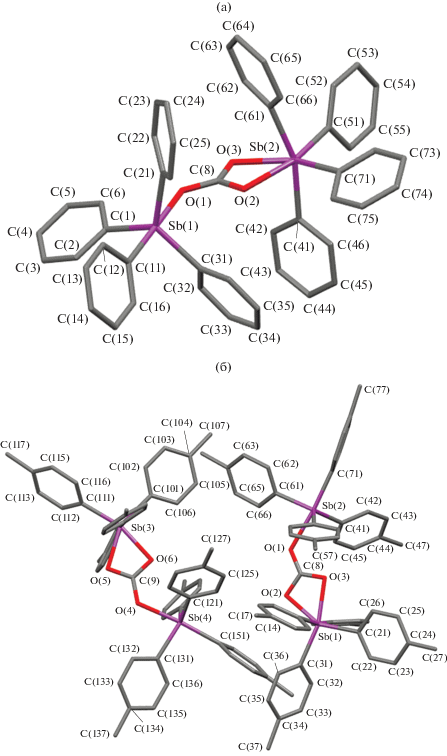
Структура выделенных карбонатов тетраарилсурьмы V и VI доказана методом РСА. Для соединения V известны триклинная [25] и моноклинная [26] модификации. Мы впервые расшифровали строение ромбической модификации. Соединение VI мы структурно охарактеризовали впервые (моноклинная модификация, два типа кристаллографически независимых молекул а, b). В молекулах V и VI атомы сурьмы имеют разные КЧ, равные 5, 6) (рис. 3). Тригонально-бипирамидальная координация атомов сурьмы практически не искажена, аксиальные углы OSbC составляют 178.7(3)° в V и 175.2(1)°, 175.1(1)° в VIa, VIb. Суммы углов в экваториальной плоскости равны 356.7(3)° и 356.9(1)°, 356.9(1)°. Связи Sb–Cэкв (2.114(9) и 2.120(4), 2.121(4) Å) в среднем короче, чем Sb–Cакс (2.181(9) и 2.170(3), 2.172(3) Å). Связи Sb–О (2.245(6) и 2.263(3), 2.263(3) Å) в V и VI короче, чем в III и IV.
Суммы валентных углов между связями в экваториальной плоскости [О2С2] при октаэдрических атомах сурьмы равны 359.9(4)° в V и 360° в VIa, VIb. Однако индивидуальные значения углов сильно различаются: OSbO не превышают 60°, CSbC ∼105°. Транс-углы в экваториальной плоскости CSbО равны 163.1(3)°, 152.8(3)° и 162.9(1)°, 151.8(1)°; 163.0(1)°, 151.8(1)°. Углы между аксиальными связями СSbC тоже меньше теоретического значения (161.6(3)° и 165.6(2)°, 165.8(2)°). Расстояния Sb−C изменяются в интервалах 2.152(9)−2.179(9) и 2.159(4)−2.178(3), 2.157(4)−2.177(3) Å. Карбонатный лиганд координируется с атомом сурьмы несимметрично: расстояния Sb–O равны 2.249(6), 2.273(5) и 2.216(2), 2.251(2); 2.217(2), 2.251(2) Å; при этом толильные лиганды связаны с центральным атомом прочнее, чем фенильные. Длины связей C–O в карбонатной группе различаются: 1.260(10), 1.302(10), 1.278(10) Å в V, 1.284(4), 1.293(4), 1.277(4) Å в VIа, 1.285(4), 1.293(4), 1.274(4) Å в VIb. При этом наблюдается закономерность: более короткой связи Sb−О соответствует более длинная С−О. Отметим, что значения валентных углов в триклинной, моноклинной и ромбической модификациях соединения V имеют близкие значения. Некоторые отличия наблюдаются в значениях длин связей Sb−О; например, в молекулах триклинной модификации эти расстояния равны 2.258, 2.185, 2.325 Å [25], а в молекулах моноклинной модификации 2.273, 2.239, 2.262 Å [26].
Таким образом, синтезированы и структурно охарактеризованы новые фенильные и пара-толильные производные сурьмы(V). Установлено, что прочность связывания атома сурьмы с лигандами зависит как от природы арильных заместителей, так и от типа сурьмаорганического соединения.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Hadjikakou S.K., Ozturk I.I., BantiC. N. et al. // J. Inorg. Biochem. 2015. V. 153. P. 293. https://doi.org/10.1016/j.jinorgbio.2015.06.006
Ali M.I., Rauf M.K., Badshah A. et al. // Dalton Trans. 2013. V. 42. P. 16733. https://doi.org/10.1039/C3DT51382C
Zhang X.-Y., Cui L., Zhang X. et al. // J. Mol. Struct. 2017. V. 1134. P. 742. https://doi.org/10.1016/j.molstruc.2017.01.039
Гущин А.В., Грунова Е.В., Моисеев Д.В. и др. // Изв. АН. Сер. хим. 2003. № 6. С. 1302.
Шарутин В.В., Шарутина О.К., Ефремов А.Н. и др. // Журн. неорган. химии. 2018. Т. 63. № 2. С. 164 (Sharutin V.V., Sharutina O.K., Efremov A.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 2. P. 174). https://doi.org/10.1134/S0036023618020195
Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. неорган. химии. 2018. Т. 63. № 3. С. 327 (Sharutin V.V., Sharutina O.K., Efremov A.N. // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 343). https://doi.org/10.1134/S0036023618030208
Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Вестник ЮУрГУ. Сер. хим. 2014. Т. 6. № 4. С. 14.
SMART and SAINT-Plus. Version 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Version 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison: (WI, USA), 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Li N., Qiu R., Zhang X. et al. // Tetrahedron. 2015. V. 71. P. 4275. https://doi.org/10.1016/j.tet.2015.05.013
Gibbons M.N., Sowerby D.B. // J. Organomet. Chem. 1998. V. 555. P. 271. https://doi.org/10.1016/S0022-328X(97)00759-6
Ruther R., Huber F., Preut H. // Angew. Chem. Int. Ed. 1987. V. 26. P. 906. https://doi.org/10.1002/anie.198709061
Preut H., Ruther R., Huber F. // Acta Crystallogr. C. 1986. V. 42. P. 1154. https://doi.org/10.1107/S010827018609306X
Gibbons M.N., Sowerby D.B. // Dalton Trans. 1997. P. 2785.
Effendy, Grigsby W.J., Hart R.D. et al. // Aust. J. Chem. 1997. V. 50. P. 675. https://doi.org/10.1071/C96042
Quan L., Yin H., Wang D. // Acta Crystallogr. E. 2009. V. 65. P. m99. https://doi.org/10.1107/S1600536808042335
Quan L., Yin H., Wang D. // Acta Crystallogr. E. 2008. V. 64. P. m349. https://doi.org/10.1107/S1600536808000676
Ebina F., Ouchi A., Yoshino Y. et al. // Acta Crystallogr. B. Chem. 1978. V. 34. P. 2134. https://doi.org/10.1107/S0567740878007578
Mahon M.F., Molloy K.C., Omotowa B.A. et al. // J. Organomet.Chem. 1998. V. 560. P. 95. https://doi.org/10.1016/S0022-328X(98)00488-4
Abakumov G.A., Vavilina N.N., Kursky Yu.A. et al. // Russ. Chem. Bull. 2007. V. 9. P. 1813.
Perpetuo G.J., Janczak J. // Acta Crystallogr. C. 2005. V. 61. P. o165. https://doi.org/10.1107/S0108270105001253
Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Коорд. химия. 2001. Т. 27. № 9. С. 710 (Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Coord. Chem. 2001. V. 27. № 9. P. 669). https://doi.org/10.1023/A:1017909824029
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015 (Batsanov S.S. // Russ. J. Inorg. Chem. 1991. V. 36. № 12. P. 3015).
Ferguson G., Hawley D.M. // Acta Crystallogr. B. 1974. V. 30. № 1. P. 103. https://doi.org/10.1107/S0567740874002299
Шарутин В.В., Шарутина О.К., Платонова Т.П. и др. // Журн. oбщ. химии. 2001. Т. 71. № 10. С. 1637 (Sharutin V.V., Sharutina O.K., Platonova T.P. et al. // Russ. J. Gen. Chem. 2001. V. 71. № 10. P. 1550). https://doi.org/10.1023/A:1013938600798
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия