Координационная химия, 2020, T. 46, № 1, стр. 56-61
Кристаллическая структура 1,2,4,1',2',4'-гексаметилферроцена
Н. З. Ибрагимова 1, *, **, Г. М. Джафаров 1, Д. Б. Тагиев 1, И. У. Лятифов 1
1 Институт катализа и неорганической химии НАН Азербайджана
Баку, Азербайджан
* E-mail: iltifatl@mail.ru
** E-mail: nigar-ibrahimova93@mail.ru
Поступила в редакцию 12.02.2019
После доработки 15.03.2019
Принята к публикации 10.04.2019
Аннотация
Методом РСА определена кристаллическая структура 1,2,4,1',2',4'-гексаметилферроцена (Ме6Fcсим). В молекуле Ме6Fcсим С5-кольца находятся в заторможенной конформации. Длина связи Fе–Ц(центр С5-кольца) в ряду Ме2Fcсим, Ме6Fcсим, Ме8Fcсим и Ме10Fcсим имеет тенденцию к удлинению. Взаимная конформация вицинальных Ме-групп в молекулах Ме6Fcсим, Ме8Fcсим и Ме10Fcсим, а также особенность изменения ЯМР 1Н и 13С сигналов Ме-групп в ряду полиметилферроценов МеnFcсим (n = 2, 4, 6, 8, 10) по сравнению с аналогами в ряду метилбензолов указывают на то, что Ме-группы в симметричных полиметилферроценах не находятся в зацепленном состоянии, а относительно свободно вращаются вокруг связи С(С5-кольцо)–С(Ме) (CIF file CCDC № 1436882).
Химическая устойчивость и разнообразие производных ферроцена, наряду с их различными возможными прикладными аспектами [1], делает эти соединения одними из наиболее интенсивно изучаемых химических систем за последние 60 лет. Наш интерес к производным ферроцена связан с возможностью разработки на основе полиметилферроценов и соответствующих катионов полиметилферрициния обратимых электрохимических электродов сравнения в неводных средах [2].
Из-за неустойчивости катиона феррициния в ряде растворителей и зависимости редокс потенциала системы ферроцен–феррициний от природы органического растворителя [3], в настоящее время полиметилферроцены и соответствующие им катионы полиметилферрициния рассматриваются как более перспективные системы для создания электродов сравнения [2]. Учитывая это, в качестве объектов исследования мы выбрали 1,2,4,1',2',4'-гексаметилферроцен (Ме6Fcсим) и гексафторфосфат-1,2,4,1',2',4'-гексаметилферрициния (Me6Fc+${\mathbf{PF}}_{{{\mathbf{6}}\,{\mathbf{сим}}}}^{--}$). ЯМР 1Н исследование гомогенной системы Ме6Fcсим–Me6Fc+${\text{PF}}_{{{\text{6}}\,{\text{сим}}}}^{--}$ в дейтероацетоне показало [4, 5], что электронный обмен в ней протекает в ~3–4 раза быстрее, чем в системе ферроцен–феррициний. Поэтому данная система удовлетворяет условию обратимости одному из требований, предъявляемых к электродам сравнения [6] со стороны ИЮПАК.
Для выяснения соответствия редокс системы Ме6Fcсим–Me6Fc+${\text{PF}}_{{{\text{6}}\,{\text{сим}}}}^{--}$ другим требованиям ИЮПАК к электродам сравнения, а также применения недавно усовершенствованного уравнения Маркуса [7] к электронному обмену в этой системе мы изучили кристаллические структуры этих двух комплексов.
В настоящей работе рассмотрены особенности кристаллической структуры молекулы Ме6Fcсим.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединение Ме6Fcсим синтезировали в соответствии с методикой [8]. Монокристаллы Ме6Fcсим размером 0.16 × 0.13 × 0.11 мм выращивали в гексане при –10°С.
РСА Ме6Fссим проведен на автоматическом трехкружном дифрактометре с двухкоординатным детектором Bruker SMART APEX-II CCD (T = 150 K, MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор, φ- и ω-сканирование). Учет поглощения рентгеновского излучения проведен по программе SADABS [9]. Структура расшифрована прямыми методами и уточнена полноматричным МНК по F 2 в анизотропном приближении для неводородных атомов. Положения атомов водорода рассчитаны геометрически и включены в уточнение по модели “наездника” с фиксированными изотропными параметрами (Uизо(H) = 1.5Uэкв(C) для CH3-групп и Uизо(H) = = 1.2Uэкв(C) для всех остальных групп). Все расчеты проведены по комплексу программ SHELXTL [10]. Основные характеристики эксперимента и параметры элементарной ячейки приведены в табл. 1, некоторые длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры Ме6Fcсим
| Параметр | Значение |
|---|---|
| М | 270.18 |
| Сингония | Mоноклинная |
| Пр. гр. | P21/c |
| Параметры ячейки: | |
| a, Å | 8.685(6) |
| b, Å | 10.871(7) |
| c, Å | 7.513(5) |
| β, град | 109.894(14) |
| V, Å3 | 667.1(7) |
| Z | 2 |
| ρ(выч.), г/см3 | 1.345 |
| μ, мм–1 | 1.106 |
| F(000) | 288 |
| Размер кристалла, мм | 0.16 × 0.13 × 0.11 |
| Диапазон θ, град | 3.120–24.964 |
| Пределы индексов h, k, l | –10 ≤ h ≤ 8, –12 ≤ k ≤ 12, –8 ≤ l ≤ 8 |
| Общее число отражений | 4197 |
| Число независимых отражений (Rint) | 1166 (0.1150) |
| GOOF дляF 2 | 1.022 |
| R-фактор (I > 2σ(I)) | R1 = 0.0579, wR2 = 0.0893 |
| R-фактор (все отражения) | R1 = 0.1374, wR2 = 0.1155 |
| Δρmax/Δρmin, e Å–3 | 0.370/–0.487 |
Таблица 2.
Некоторые длины связей и валентные углы в молекуле Ме6Fcсим
| Связь | d, Å | Связь | d, Å | Угол | ω, град |
|---|---|---|---|---|---|
| Fe(1)–C(4) | 2.037(5) | C(1)–C(5) | 1.420(7) | C(5)C(1)C(2) | 107.8(4) |
| Fe(1)–C(2) | 2.043(5) | C(1)–C(2) | 1.425(7) | C(1)C(2)C(3) | 108.7(5) |
| Fe(1)–C(1) | 2.045(5) | C(2)–C(3) | 1.430(7) | C(4)C(3)C(2) | 106.5(5) |
| Fe(1)–C(5) | 2.049(5) | C(3)–C(4) | 1.416(7) | C(3)C(4)C(5) | 109.6(5) |
| Fe(1)–C(3) | 2.051(5) | C(4)–C(5) | 1.420(6) | C(1)C(5)C(4) | 107.5(5) |
| среднее | 2.045(5) | среднее | 1.422(7) | ||
| C(1)–C(6) | 1.504(7) | C(5)C(1)C(6) | 126.8(5) | ||
| C(3)–C(7) | 1.499(7) | C(2)C(1)C(6) | 125.4(5) | ||
| C(5)–C(8) | 1.503(6) | C(1)C(5)C(8) | 126.2(5) | ||
| среднее | 1.502(7) | C(4)C(5)C(8) | 126.3(5) | ||
Таблицы координат атомов, длин связей, валентных и торсионных углов и анизотропных параметров смещения для Ме6Fссим депонированы в Кембриджском банке структурных данных (CCDC № 1861054; deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
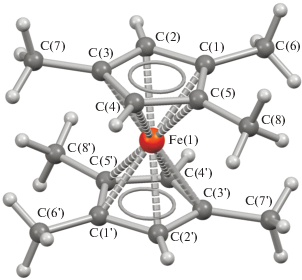
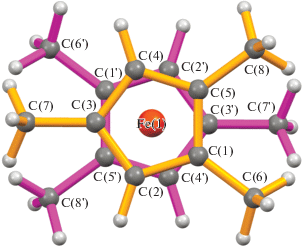
Геометрия молекулы Ме6Fcсим показана на рис. 1, 2. Как видно из рис. 2, в молекуле Ме6Fссим С5-кольца расположены в заторможенной конформации (φ = 35.67°), как и в молекулах Ме8Fссим [11] и Ме10Fссим [12]. Поскольку в твердом состоянии в молекуле Ме2Fссим [13, 14] С5-кольца имеют заслоненную конформацию, изменение конформации в молекулах перечисленных трех полиметилферроценов логичнее приписать к стерическим взаимодействиям Ме-групп разных колец или же силам кристаллической упаковки.
С5-кольцо в молекуле Ме6Fссим плоское, наибольшее отклонение от плоскости составляет 0.003(5) Å. С5-кольца параллельны. Величина угла, проходящего через центры С5-колец и атом железа, равна 180(16)°. Расстояние между центрами колец 3.298 Å.
В молекуле Ме6Fcсим все расстояния С(C5-кольцо)–С(C5-кольцо) в пределах ошибки эксперимента одинаковы. Их среднее значение 1.422(7) Å близко к соответствующим расстояниям в молекулах Ме8Fссим (1.428(4) Å) [11] и Ме10Fссим (1.419(2) Å) [12]. Среднее расстояние С(С5-кольцо)–С(Ме), равное 1.502(7) Å, соответствует длине обычной связи C(sp2)–C(sp3) [15]. Средняя длина связи Fе–С(C5-кольцо) 2.045(5) Å также соответствует длинам связи Fе–С(C5-кольцо) в молекулах Ме8Fссим (2.054(3) [11], 2.048(6) [16]) и Ме10Fссим (2.053(2) [17], 2.050(2) Å [12]).
В структуре Ме6Fcсим наблюдается ряд слабых межмолекулярных нековалентных связей. Многие из них образуются между С5-кольцом (донором электронов) одной молекулы и атомом водорода (акцептором электронов) С5-кольца другой молекулы. Эти контакты фактически связывают металлоорганические цепочки в 3D-супрамолекулярный каркас, расширяя структуру в направлении x, y и z [18–20].
В табл. 2 приведены некоторые длины связей и валентные углы в молекуле Ме6Fссим, в которой Ме-группы отклоняются от плоскости С5-кольца (от атома Fе). Одиночная Ме-группа отклоняется на 2.49° (C(7)), вицинальные Ме-группы – на 0.87° (С(8)) и 1.64° (С(6)). Впервые об отклонении Ме-групп от плоскости С5-кольца (от атома Fе) в молекулах метилзамещенных ферроценов было указано в [11] на примере кристаллических структур Ме8Fcсим и Ме10Fcсим, изучение которых было предпринято с целью установить причины аддитивного сильнопольного смещения резонансных сигналов атомов углерода Ме-групп, наблюдаемого в спектрах ЯМР 13С МеnFcсим (n = 2, 4, 6, 8, 10) [21]. Несмотря на то что ближайшие невалентные контакты С· · · С Ме-групп разных колец (3.79–3.85 Å) были меньше удвоенного ванн-дер-ваальсового радиуса Ме-группы (4 Å), отклонение Ме-групп от плоскости С5-кольца авторы [11] не стали связывать со стерическими взаимодействиями Ме-групп разных С5-колец, поскольку аналогичное отклонение Ме-групп наблюдается и в молекуле Ме5С5Fе(СО)2SO2CH2–CH=CH–C6H5 [22], где отсутствует второе метилзамещенное кольцо [11].
Впоследствии исследование спектров ЯМР 13С несимметричных полиметилферроценов позволило выявить и оценить вышеуказанное стерическое взаимодействие между Ме-группами, расположенными в разных кольцах симметричных полиметилферроценов (~0.4–0.5 м.д.), что примерно в 3 раза меньше стерического взаимодействия между вицинальными Ме-группами (~1.5 м.д.) [8, 23].
Причины отклонения Ме-групп от атома Fе в молекуле Ме10Fссим авторы [11, 12] связали только со стерическим взаимодействием вицинальных Ме-групп, расположенных в одном С5-кольце.
Действительно, в молекулах полиметилферроценов невалентные контакты Н· · · Н вицинальных Ме-групп наиболее короткие среди всех контактов Н· · · Н. Например, в Ме6Fссим указанные контакты Н· · · Н составляют 2.38, в Ме8Fcсим – 2.23 и 2.26 Å [11], а в Ме10Fcсим – средн. 2.4 Å [11, 12]. Если причиной отклонения Ме-групп от атома Fе является только взаимодействие вицинальных Ме-групп в пределах одного кольца, следовало бы ожидать, что некоторые из метильных групп в полиметилферроценах должны были бы отклониться от плоскости кольца и к атому железа. Так, в молекуле полностью замещенного производного бензола Ме6С6 стерическая перегруженность вицинальных метильных групп разрешается путем поочередного отклонения последних вверх и вниз от плоскости бензольного кольца [24, 25] и согласованным (зацепленным) вращением метильных групп вокруг связи С(С6)–С(Ме) [26, 27].
В отличие от метилбензолов, в гомологическом ряду полиметилферроценов из-за присутствия фрагмента МеmС5Н5 – mМ, связанного с рассматриваемым метилзамещенным С5-кольцом, метильные группы последнего не в состоянии отклониться в обе стороны от плоскости С5-кольца, т.е. и к атому Fе. Во вторых, из-за большего угла (72°) между вицинальными Ме-группами Ме5С5-кольца (относительно аналогичного угла в 60° в Ме6С6) стерическое взаимодействие между ними слабее, чем в Ме6С6. Под влиянием перечисленных двух факторов, последовательно возрастающее стерическое напряжение в гомологическом ряду метилферроценов в комплексе Ме10Fссим не разрешается, как в молекуле Ме6С6, и напряжение сохраняется. Все Ме-группы отклонены в одну сторону от плоскости С5-кольца (от атома железа), авицинальные Ме-группы находятся не в зацепленном состоянии (в конформации 2 : 1 или 1 : 2), а в конформации 2 : 2. Так, в конформации 2 : 2 (или близком к 2 : 2) находятся вицинальные Ме-группы в молекуле Ме6Fс, все Ме-группы в Ме8Fссим [11] и шесть из десяти Ме-групп в Ме10Fссим [12].
Разные структурные следствия стерической перегруженности в метильных гомологах ферроцена и бензола позволяют объяснить и отличительную особенность их спектров ЯМР 1Н и 13С [21, 27]. Так, в ряду Ме2Fссим, 1,3,1',3'-Ме4Fссим, Ме6Fссим, Ме8Fссим и Ме10Fссим монотонно возрастающее стерическое взаимодействие вицинальных Ме-групп проявляется в последовательном и аддитивном сильнопольном смещении резонансных сигналов ЯМР 1Н и 13С Ме-групп (табл. 3).
Таблица 3.
Химические сдвиги ЯМР 1Н(СН3) и 13С(СН3) метильных групп (в CS2 и СН2Cl2 соответственно) в р-яду симметричных полиметилферроценов МеnFссим (n = 2, 4, 6, 8, 10)* относительно соответствующего сигнала ТМС
| МеnFссим | n | ||||
|---|---|---|---|---|---|
| 2 | 4 | 6 | 8 | 10 | |
| 1Н(СН3) | 1.92 | 1.88 | 1.79(1) 1.76(2) |
1.72 1.66 |
1.61 |
| 13С(СН3) | 14.32 | 14.19 | 13.67(1) 11.85 |
11.59 9.64 |
9.48 |
В ряду метил-, 1,2-диметил-, 1,3,5-триметил-, 1,2,4,5-тетраметил-, пентаметил-, гексаметилбензолов (и др.) резонансные сигналы ЯМР 1Н и 13С Ме-групп последовательно и также аддитивно смещаются в сильное магнитное поле включительно до Ме5С6Н [27]. При переходе от пентаметилбензола к гексаметилбензолу эта тенденция в изменении химических сдвигов ЯМР 1Н и 13С нарушается, наблюдается слабопольное смещение резонансных сигналов ЯМР 1Н и 13С Ме-групп, что указывает на ослабление стерического взаимодействия между вицинальнымиМе-группами в молекуле Ме6С6. По данным [24, 25], ослабление стерического взаимодействия в молекуле Ме6С6 можно объяснить альтернирующим отклонением вниз и вверх от плоскости бензольного кольца и согласованным вращением последних [26, 27]. В симметричных полиметилферроценах не имеет место ни одно из перечисленных двух структурных изменений. Поэтому вопрос о причинах отклонения Ме-групп от плоскости С5-кольца от атома Fе в полиметилферроценах пока остается открытым.
Сравнение длины связи Fе–Ц(С5-кольца) в молекуле Ме6Fссим (1.649(5) Å) с таковой в комплексах Ме2Fссим (1.647 [28], 1.6447(10) и 1.6487(10) [13], 1.649(6) [14]), Ме8Fссим (1.653 [16], (1.655(8) [11]) и Ме10Fссим (1.6568(8) [11], 1.651 Å [28]) позволяет предположить, что в гомологическом ряду связь Fе–Ц(С5-кольца) имеет общую тенденцию к удлинению. Хотя это увеличение в ряду метилзамещенных гомологов ферроцена находится в пределах 2–3σ, однако оно соответствует наблюдаемому в спектрах ЯМР 13С комплексов МеnFссим стерическому взаимодействию Ме-групп, расположенных в разных кольцах, и оцениваемому в ~0.4–0.5 м.д. в сильное магнитное поле [8, 23].
Таким образом, рассмотренные особенности кристаллической структуры молекулы Ме6Fссим в основном могут быть интерпретированы стерическими взаимодействиями вицинальных метильных групп, как между собой (в пределах рассматриваемого лиганда МеmС5Н5 –m), так и c Ме-группами, расположенными в другом лиганде МеmС5Н5 –m молекулы.
Сравнительный анализ результатов рентгеноструктурного исследования кристаллических структур Ме6Fссим и его катиона 1,2,4,1',2',4'-гексаметилферрициния (в виде симметричного гексафторфосфата гексаметилферрициния) будет рассмотрен в следующей публикации.
Список литературы
Astruc D. // Eur. J. Inorg. Chem. 2017. V. 1. P. 6.
Bartlett P.N., Branch J. // J. Electroanalyt. Chem. 2016. V. 780. P. 282.
Nielson R.M., McManis G.E., Safford L.K., Weaver M.J. // J. Phys. Chem. 1989. V. 93. P. 2152.
Ибрагимова Н.З., Мамедов И.Г., Джафаров Г.М. и др. // Chem. Problems. 2017. № 1. P. 51.
Ibrahimova N.Z., Jafarov G.M., Tagiyev D.B., Lyatifov I.U. // Chem. Problems. 2019. № 2. P. 310.
Gritzner G., Kuta J. // Pure Appl. Chem. 1984. V. 56. № 4. P. 461.
Li Xiang-Yuan // Intern. J. Quantum Chem. 2015. V. 115. P. 700.
Лятифов И.Р. Дис. … докт. хим. наук. Ленинград: ЛТИ, 1990. 395 с.
Sheldrick G.M. SADABS. Version 2.03. Bruker/Siemens Area Detector Absorption Correction Program. Madison (WI, USA): Bruker AXS Inc., 2003.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Struchkov Yu.T., Andrianov V.G., Sal’nikova T.N. et al. // J. Organomet. Chem. 1978. V. 145. P. 213.
Freyberg D.P., Robbins J.L., Raymond K.N., Smart J.C. // J. Am. Chem. Soc. 1979. V. 101. P. 892.
Lousada C.M., Pinto S.S., Canongia Lopes J.N. et al. // J. Phys. Chem. A. 2008. V. 112. P. 2977.
Foucher D.A., Honeyman Ch.H., Lough A.J. et al. // Acta Crystallogr. C. 1995. V. 51. P. 1795.
Tables of Interatomic Distances and Configuration in Molecules and Ions. Supplement 1956–1959 / Ed. Sutton L.E., London: Chemical Society, 1965.
Schmitz D., Fleischhauer J., Meier U. et al. // J. Organomet. Chem. 1981. V. 205. P. 381.
Arrais A., Diana E., Gobetto R. et al. // Eur. J. Inorg. Chem. 2003. P. 1186.
Gurbanov A.V., Mahmoudi G., Guedes da Silva M.F.C. et al. // Inorg. Chim. Acta. 2018. V. 471. P. 130.
Hazra S., Martins N.M.R., Mahmudov K.T. et al. // J. Organomet. Chem. 2018. V. 867. P. 193.
Kvyatkovskaya E.A., Zaytsev V.P., Zubkov F.I. et al. // Acta Crystallogr. E. 2017. V. 73. № 4. P. 515.
Materikova R.B., Babin V.N., Lyatifov I.R. et al. // J. Organomet. Chem. 1977. V. 142. P. 81.
Churchill M.R., Wormald J. // Inorg. Chem. 1971. V. 10. № 3. P. 572.
Мамедов И.Г., Оруджева А.Б., Cалимов Р.М. и др. // Вестник БГУ. 2013. № 3. С. 5.
Stride J. // Acta Crystallogr. B. 2005. V. 61. P. 200.
Le Maguères P., Lindeman S.V., Kochi J.K. // Organometallics. 2001. V. 20. P. 115.
Wolfoenden W.R., Grant D.M. // J. Am. Chem. Soc. 1966. V. 88. P. 1496.
Cheney B.V., Grant D.M. // J. Am. Chem. Soc. 1967. V. 89. P. 5319.
Makal A.M., Plazuk D., Zakrzewski J. et al. // Inorg. Chem. 2010. V. 49. P. 4046.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия