Координационная химия, 2020, T. 46, № 11, стр. 698-705
Триметилацетат меди(II) с кофеином: синтез, строение и биологическая активность
Д. С. Ямбулатов 1, *, С. А. Николаевский 1, И. А. Луценко 1, М. А. Кискин 1, М. А. Шмелев 1, О. Б. Беккер 2, Н. Н. Ефимов 1, Е. А. Уголкова 1, В. В. Минин 1, А. А. Сидоров 1, И. Л. Еременко 1, 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт общей генетики им. Н.И. Вавилова PAH
Москва, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова PAH
Москва, Россия
* E-mail: yambulatov@yandex.ru
Поступила в редакцию 09.06.2020
После доработки 15.06.2020
Принята к публикации 17.06.2020
Аннотация
Взаимодействие триметилацетата меди(II), [Cu(Piv)2]n (Piv = C(Me)3COO–), и кофеина (L) (Cu : L = = 1 : 1) в безводном ацетонитриле привело к образованию биядерного комплекса [Cu2(Piv)4(L)2] ⋅ ⋅ 2CH3CN (I). Строение комплекса в кристалле установлено методом РСА (CIF file CCDC № 2006753), электронное строение исследовано методом ЭПР. Установлено влияние координации кофеина к биогенному комплексообразователю – биологическая активность полученного комплекса in vitro в отношении непатогенного штамма Mycolicibacterium smegmatis в 8 раз выше, чем у свободного кофеина.
Медь является одним из основных микроэлементов в организме человека, участвует в процессе переноса и хранения кислорода, регуляции процессов окисления в белках [1], ионы меди образуют комплексы с различными лигандами и взаимодействуют с биомолекулами, главным образом белками и нуклеиновыми кислотами [2]. Координационные соединения меди проявляют активность в отношении различных раковых клеток [3–5], а также подавляют размножение некоторых видов бактерий: сальмонелл [6] и кишечной палочки [7, 8].
Трендом современной бионеорганической химии является использование в качестве лигандов простых биологически активных веществ, например различных пуриновых оснований (теобромина, теофиллина и кофеина) [9]. Как известно, кофеин является лекарственным препаратом [10] и играет важную роль в жизни человека [11]. Одним из первых биологически активных координационных соединений с кофеином, 1,3,7-триметил-1H-пурин-2,6(3H,7H)-дионом (L), можно считать соединение платины [P(C6H5)3(CH3)][PtCl3(L)], проявляющее противоопухолевую активность in vivo [12]. Недавно было показано, что свободный кофеин обладает очень слабой цитотоксичностью, в то время как комплексы золота(I) с L проявляют высокую и избирательную цитотоксичность в отношении клеток рака различного типа [13]. Более того, была доказана in vitro цито- и генотоксичность простейших координационных соединений цинка [ZnL(H2O)(Hal)2] (Hal = Cl, Br, I) и кадмия {[Cd(H2O)2I2] ⋅ L ⋅ 2H2O}n [14, 15].
Карбоксилатные анионы – удобные лиганды, которые в совокупности с донорными молекулами позволяют управлять формированием определенной молекулярной или даже полимерной структуры металлоостова комплексов [16–20]. Кроме того, в зависимости от природы заместителей в карбоксилатных анионах, а также от их электронных и геометрических характеристик можно рассчитывать на проявление биофизических свойств таких молекул [1]. Например, одним из таких карбоксилатных лигандов является α-фуранкарбоновая кислота (пирослизевая, HFur), нитропроизводные которой входят в состав антимикробных фармацевтических препаратов (фуразолидона, фурадонина, хинифурила). Известно, что некоторые комплексы переходных металлов с анионами пирослизевой кислоты оказываются также биоактивными. Так, недавние исследования показали, что гетерометаллический карбоксилатный комплекс [Fe2CoO(Fur)6(THF)(H2O)2], содержащий анионы этой кислоты, проявляет активность по отношению к вирулентному штамму Mycobacterium tuberculosis H37Rv и слабую цитотоксичность [21]. Добавим, что моно- и биядерные комплексы цинка, меди(II) и кобальта(II) с анионами α-фуранкарбоновой кислоты и различными N-донорными лигандами показали биологическую активность in vitro против непатогенного штамма M. smegmatis, которая до 50 раз выше по сравнению со свободной кислотой [22, 23].
Цель настоящей работы – синтез триметилацетатного комплекса меди(II), в котором нет биогенных карбоксилатных анионов α-фуранкарбоновой кислоты, но есть биоактивный N-донорный лиганд кофеин, определение структуры полученного соединения, его электронного строения, а также исследование биологических свойств в отношении M. smegmatis и сопоставление полученных данных со свободным кофеином. Отметим, что в известных работах, посвященных комплексам с кофеином, авторы обращали внимание на строение [24–29], магнитные свойства [30–32] и их корреляцию [33, 34], при этом биологическая активность таких соединений изучена лишь в нескольких работах [9, 35, 36].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и выделение целевого продукта проводили в безводной среде с использованием стандартной техники Шленка. Ацетонитрил (“х. ч.”, “Химмед”) сушили над оксидом фосфора(V), хранили на активированных молекулярных ситах (4 Å), отбирали конденсацией непосредственно перед синтезом. Безводный триметилацетат меди(II), [Cu(Piv)2]n, получали аналогично [Co(Piv)2]n [37] из моногидрата ацетата меди(II) (“х. ч.”, “Русхим”) в расплаве HPiv с выдерживанием продукта при 120°С в динамическом вакууме в течение 10 ч. Кофеин (99%, “Alfa Aesar”) использовали без дополнительной очистки.
ИК-спектр соединения регистрировали в диапазоне 400–4000 см–1 на спектрофотометре Perkin Elmer Spectrum 65, оснащенном приставкой Quest ATR Accessory (Specac), методом нарушенного полного внутреннего отражения (НПВО). Элементный анализ выполняли на автоматическом C,H,N,S-анализаторе EuroEA-3000 (EuroVektor).
Спектры ЭПР записывали на приборе Bruker ELEXSYS E-680X в X-диапазоне при T = 300 K. Параметры всех спектров ЭПР находили методом наилучшего приближения между экспериментальными и теоретическими спектрами путем минимизации функционала ошибки:
где $Y_{i}^{E}$ – массив экспериментальных значений интенсивности сигнала ЭПР с постоянным шагом по магнитному полю Н, $Y_{i}^{T}$ – теоретические значения при тех же значениях поля Н, N – число точек. Построение спектра ЭПР порошка, проводили с использованием метода Белфорда (eigenfield method) [38]. Теоретический спектр раствора строили способом, описанным в [39]. В соответствии с теорией релаксации [40] ширину линий задавали выражением
где ${{{\text{m}}}_{I}}$ – проекция ядерного спина на направление магнитного поля, α, β и γ – параметры ширины линии. В качестве функции формы линии использовали сумму функций Лоренца и Гаусса [41]. В ходе минимизации варьировали g-факторы, константы СТС, ширины и формы линий.
Биологическую активность определяли в тест-системе M. smegmatis mc2 155 методом бумажных дисков. Фиксировали величину зоны подавления роста штамма, засеянного газоном на агаризованной среде, вокруг бумажных дисков, содержащих вещество в различных концентрациях. Бактерии, смытые с чашек Петри со средой триптон-соевый агар М-290 (Himedia), выращивали в течение ночи в жидкой среде Lemco-TW (Lab Lemco’ Powder 5 г/л (Oxoid), Peptone special 5 г/л (Oxoid), NaCl 5 г/л, Tween-80) при 37°С до среднелогарифмической фазы роста при оптической плотности OD600 = 1.5, смешивали с расплавленной агаризованной средой М-290 в соотношении 1 : 9 : 10 (культура : : Lemco-TW : М-290). Культуру инкубировали в течение 24 ч при 37°C. MИК (минимальной ингибирующей концентрацией) считали концентрацию вещества, при которой зона подавления роста минимальна.
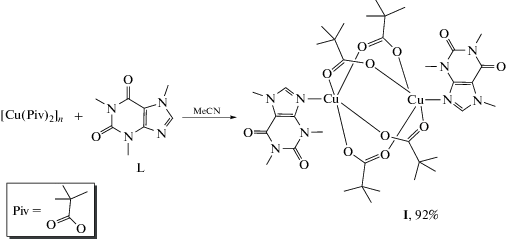
Синтез [Cu2(Piv)4L2] ⋅ 2MeCN (I). В стеклянную ампулу поместили навески [Cu(Piv)2]n (0.265 г, 1.0 ммоль) и кофеина (0.194 г, 1.0 ммоль), дегазировали в динамическом вакууме в течение 20 мин, конденсировали ацетонитрил (15 мл), ампулу запаивали и нагревали на масляной бане при 130°C до полного растворения реагентов (1 ч), цвет реакционной смеси был зеленым. Реакционную смесь охлаждали (10°С/ч) до 60°С и наблюдали образование кристаллов. Термостатирование (3 ч) и дальнейшее охлаждение реакционной смеси до комнатной температуры приводило к образованию зеленых кристаллов в виде шестигранных гексагональных призм. Выход 0.460 г (92%).
ИК-спектр (НПВО; ν, см–1): 3132 сл, 2984 сл, 2959 ср, 2932 сл, 2903 сл, 2868 сл, 2245 сл, 1708 ср, 1665 оч. с., 1607 оч. с., 1568 с, 1505 ср, 1482 с, 1455 ср, 1440 ср, 1417 оч. с., 1378 ср, 1363 ср, 1326 сл, 1284 сл, 1226 с, 1184 ср, 1084 сл, 1032 ср, 980 сл, 930 сл, 897 сл, 856 сл, 799 сл, 789 ср, 762 ср, 747 с, 612 с, 487 ср.
РСА монокристалла соединения I выполнен на дифрактометре Bruker Apex II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [42], по программе SADABS [43] введена полуэмпирическая поправка на поглощение. Структуры расшифрованы прямыми методами и уточнены полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX [44] с использованием OLEX2 [45]. Кристаллографические параметры и детали уточнения структуры I при T = 100(2) K: C40H62N10O12Cu2, M = 1002.07 г/моль, пр. гр. P21/n, ромбические зеленые кристаллы размером 0.1 × 0.2 × 0.2 мм, a = 12.2676(5), b = = 15.6847(6), c = 12.6737(5) Å, β = 101.051(2)°, V = = 2393.37(16) Å3, Z = 2, ρ(выч.) = 1.390 г см–3, μ = = 0.956 мм–1, 2.570° ≤ θ ≤ 30.503°, сегмент сферы –15 ≤ h ≤ 15, –19 ≤ k ≤ 19, –15 ≤ l ≤ 15, 21 979 измеренных рефлексов, 4675 независимых рефлексов, 3958 отражений с I > 2σ(I), Rint = 0.0496, GООF = 1.047, R1 (I > 2σ(I)) = 0.0467, wR2 (I > 2σ(I)) = 0.0906, R1 (все данные) = 0.0581, wR2 (все данные) = 0.947, Δρmin/Δρmax, е Å–3 = –0.483/0.581. Геометрия полиэдров атомов металлов определена с использованием программы SHAPE 2.1 [46, 47].
Структурные данные депонированы в Кембриджском банке структурных данных (CCDC № 2006753; deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействием эквимольных количеств безводного пивалата меди(II) и кофеина получены кристаллы димерного комплекса [Cu2(Piv)4L2] ⋅ ⋅ 2MeCN (I) с практическим выходом 92% (схема 1 ). В этой реакции [Cu(Piv)2]n растворяется в MeCN с образованием [Cu2(Piv)4(MeCN)2] [48], в котором лабильные молекулы растворителя замещаются монодентатными молекулами кофеина.
Схема 1 .
Комплекс I кристаллизуется в моноклинной пространственной группе P21/n с двумя сольватными молекулами ацетонитрила (рис. 1). Молекула комплекса симметричная, центр инверсии лежит между атомами Cu(1) и Cu(1A). Атомы металлов связаны четырьмя мостиковыми карбоксилатными группами (Cu–O 1.955(2)–1.970(2) Å; Cu…Cu 2.6219(5) Å). Апикальный лиганд (молекула кофеина) координирован монодентатно через атом N имидазольного цикла (Cu–N 2.234(2) Å). Лиганд сохраняет плоскую структуру, двугранный угол между пиримидиновым и имидазольным циклом составляет 1.3°, максимальное отклонение атомов из среднеквадратичной плоскости наблюдается для N(1) (0.025(1) Å) и O(5) (0.057(1) Å). Координационное окружение атома меди (CuNO4) соответствует квадратной пирамиде (τ(Cu) = 0 [49]), ее основание практически сохраняет форму квадрата, о чем свидетельствуют близкие значения углов ОCuО (O(1)Cu(1)O(3) 90.6(1)°; O(2)Cu(1)O(3) 88.60(9)°; O(2)Cu(1)O(3) 88.94(9)°; O(1)Cu(1)O(4) 89.53(10)°).
Рис. 1.
Молекулярная структура комплекса I, тепловые эллипсоиды с 35%-ной вероятностью. Атомы водорода не показаны.
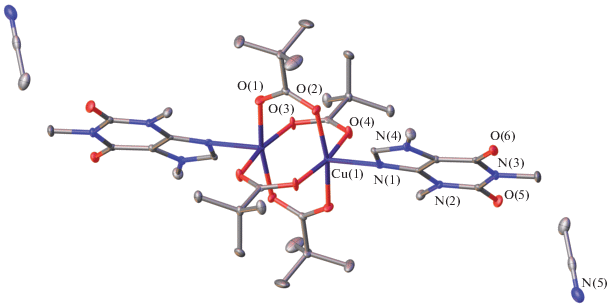
В структуре молекулы комплекса I наблюдается отклонение от линейной геометрии во фрагменте N(1)–Сu(1)…Cu(1)–N(1) (угол N(1)Cu(1)Cu(1) составляет 171.67(6)°). Атом Cu(1) выходит из плоскости четырех атомов кислорода (O(1), O(2), O(3), O(4)) на 0.198 Å по направлению к атому N(1) молекулы кофеина. Карбоксилатные мостиковые фрагменты имеют несимметричное строение, так как пара атомов O расположена вблизи пиримидинового фрагмента. В результате два угла OCuN больше, чем 90° (O(1)Cu(1)N(1) 102.20(8)°, O(4)Cu(1)N(1) 99.31(8)°). Углы OCuN при атомах O, не испытывающих влияния объемного заместителя L, близки к прямому: (O(2)Cu(1)N(1) 89.35(8)°, O(3)Cu(1)N(1) 92.07(8)°).
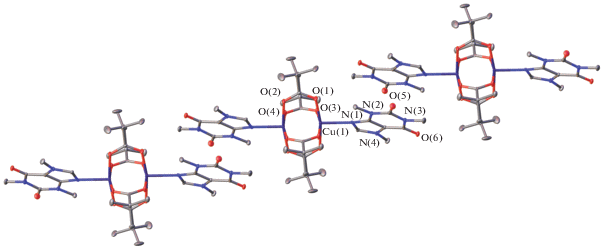
Взаимная ориентация ароматических систем кофеина соседних молекулярных фрагментов в кристаллической упаковке свидетельствует о межмолекулярном π–π-взаимодействии, это приводит к формированию супрамолекулярных цепей в комплексе I (расстояние между центроидами пиримидиновых фрагментов и угол между плоскостями составляют 3.3808(15) Å и 0.00(12)° соответственно) (рис. 2).
Рис. 2.
Фрагмент упаковки комплекса I, тепловые эллипсоиды с 35%-ной вероятностью. Атомы водорода и сольватные молекулы не показаны.
Формирование биядерных тетрамостиковых структур типично для комплексов меди(II) с анионами монокарбоновых кислот и кофеином, где последний выступает в качестве монодентатного N-донорного [24–26, 28, 29, 31, 32, 34] или O-донорного [50] лиганда. На данный момент описан только один пример комплекса, где кофеин выступает в качестве N,О-донорного мостикового лиганда, связывая фрагменты {Cu2(µ-O2CR)4L} в 1D-полимерную цепь [33].
Длины связей Cu–O и Cu–N и искажения геометрии комплекса I сопоставимы cо значениями для известных комплексов состава [Cu2(µ-Piv)4${\text{L}}_{2}^{'}$], где L' – пиридин [51], 2-аминопиридин [52], 2,3-циклододеценопиридин [53], хинолин [54], а также для биядерных соединений меди с анионами монокарбоновых кислот и молекулами кофеина [Cu2(µ-O2CR)4L2], где O2CR – анионы монохлоруксусной [24], бензойной [34], 2-бромпропионовой [29], 2-иодобензойной [26], 6-метокси-α-метил-2-нафталинуксусной [25], 2-формилбензойной [31] кислот. Более значительное искажение геометрии металлоостова по сравнению с комплексом I наблюдается в соединении [Cu2(O2CCCl3)4L2] [33], в котором значение угла CuCuN уменьшается до 156.89°, расстояние Cu–Cu значительно увеличивается и составляет 3.062 Å, а связь Сu–N уменьшается до 2.046 Å.
Спектр ЭПР мелкодисперсного порошка комплекса I (рис. 3а) характерен для аксиально-симметричного комплекса с полным спином S = 1 и описывается спиновым гамильтонианом (СГ) с тонкой структурой:
(3)
$\begin{gathered} H = {\beta }\left( {{{g}_{x}}{{S}_{x}}{{H}_{x}} + {{g}_{y}}{{S}_{y}}{{H}_{y}} + {{g}_{z}}{{S}_{z}}{{H}_{z}}} \right) + \\ + \,\,D\left( {S_{z}^{2} - \frac{{S\left( {S + 1} \right)}}{3}} \right)~, \\ \end{gathered} $Рис. 3.
Экспериментальные и теоретические спектры ЭПР мелкодисперсного порошка (а) и раствора (б) в смеси хлористый метилен–пиридин (20 : 1) комплекса I при 300 К. Параметры теоретических спектров приведены в тексте.
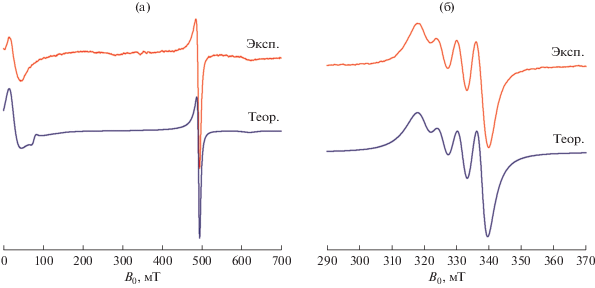
где S = 1; Sx, Sy, Sz – проекции полного спина на оси x, y, z соответственно; D – компонента тензора тонкого взаимодействия; gx, gy, gz – компоненты g-тензора; H – напряженность магнитного поля. Параметры СГ (3) наилучшего приближения между экспериментальным и теоретическим спектром порошка соединения I оказались равными: |D| = 0.3479 см–1, gz = g|| = 2.340, gx = gy = g┴ = 2.055 (рис. 3а).
При растворении комплекса I в хлористом метилене спектр ЭПР не наблюдается. Добавление пиридина приводит к появлению изотропного спектра ЭПР со сверхтонкой структурой (СТС), состоящей из четырех линий (рис. 3б). Такой спектр характерен для моноядерного комплекса меди(II). Спектр ЭПР моноядерного комплекса, полученного в результате растворения I в смеси хлористый метилен–пиридин (20 : 1) при комнатной температуре, описывается изотропным СГ с полным спином S = 1/2 с зеемановским и сверхтонким взаимодействием:
где g – компонента g-тензора, β – магнетон Бора, а – компонента тензора СТС, S = 1/2, I = 3/2. В результате наилучшего приближения теоретического спектра к экспериментальному для моноядерных фрагментов были получены следующие значения параметров СГ (4): g = 2.141, а = 5.81 × × 10–3 см–1 (рис. 3б).
Антибактериальная активность соединения I была определена в отношении M. smegmatis. Этот штамм используется для скрининга противотуберкулезных препаратов, так как является непатогенным (используется в лаборатории без дополнительных уровней защиты), растет быстрее, чем другие виды микобактерий и чувствителен к клинически используемым противотуберкулезным лекарственным средствам [55, 56]. Известно, что устойчивость микобактерий к химиотерапевтическим агентам связана с низкой проницаемостью микобактериальной клеточной стенки, с ее необычной структурой. Тест-система M. smegmatis проявляет более высокую степень устойчивости к антибиотикам и противотуберкулезным агентам, чем M. tuberculosis, поэтому критерием отбора является концентрация вещества <100 нмоль/диск в отличие от M. tuberculosis [57]. Метод испытания включает количественную оценку диаметра зоны подавления роста культуры M. smegmatis, выращенной газоном на агаризованной среде, вокруг бумажных дисков, пропитанных испытуемыми соединениями. Исследуемый комплекс наносили на диски в разных концентрациях. Наблюдали увеличение диаметра halo (зона ингибирования роста) с увеличением количества вещества, нанесенного на диск. MИК-концентрация вещества, при которой наблюдается минимальная видимая зона подавления роста: чем меньше значение МИК, тем активнее вещество. Результаты антибактериальной активности в тестовой системе M. smegmatis mc2 155 и ее изменение с течением времени приведены в табл. 1. Как следует из данных табл. 1, значение МИК для свободного кофеина составляет 2000 нмоль/диск и показывает почти полное отсутствие активности в отношении M. smegmatis (практически сразу происходит зарастание зоны подавления роста культуры). Координация кофеина к Cu2+ повышает биоактивность в 8 раз и обусловливает более стойкий бактериостатический эффект. Для сравнения в табл. 1 приведены данные биологической активности для некоторых фуроатных комплексов меди(II) с различными N-донорными лигандами [22, 23]. Можно ожидать, что соединение меди с двумя разными биологически активными лигандами (анион α-фуранкарбоновой кислоты, кофеин) сможет превысить достигнутые нами показатели.
Таблица 1.
Результаты антибактериальной активности в отношении Mycolicibacterium smegmatis mc2 155
| Соединение* | MИК, (нмоль/диск) | MИК, (мкг/диск) | Зона ингибирования, мм | |
|---|---|---|---|---|
| 24 ч | 120 ч | |||
| I | 250 | 250 | 6.5** | 0 |
| [Сu(α-Fur)2(Рhen)] [22] | 5 | 2 | 7.0*** | 7.0*** |
| [Сu(α-Fur)2(Bipy)(H2O)] [23] | 100 | 46 | 7.0*** | 7.0*** |
| [Сu2(α-Fur)4(Рy)2] [22] | 200 | 146 | 7.0** | 7.0** |
| [Сu(α-Fur)2(Рy)2)(H2O] [22] | 400 | 153 | 7.0** | 7.0** |
| Изониазид | 700 | 100 | 9.0 | 6.5*** |
| Рифампицин | 12 | 10 | 7.0 | 7.0*** |
| Кофеин | 2000 | 388 | 0**** | 0**** |
* Рhen = 1,10-фенантролин; Bipy = 2,2'-бипиридин; Рy – пиридин. ** Зона ингибирования роста культуры бактерий, изначально возникшая после нескольких часов роста, начинает зарастать по всей поверхности зоны. *** Величина диаметра зоны ингибирования роста культуры не изменяется в течение указанного времени. **** Зона ингибирования роста отсутствует.
Таким образом, синтезирован новый биядерный триметилацетатный комплекс меди(II) с кофеином, установлено его молекулярное и кристаллическое строение. Методом ЭПР установлено, что комплекс I имеет полный спин S = 1, что, в свою очередь, подтверждает биядерное строение металлокомплекса и наличие магнитных взаимодействий между ионами меди в молекуле. Показано, что соединение I, в отличие от свободного кофеина, проявляет биологическую активность in vitro в отношении бактерий M. smegmatis.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Jones C.J., Thornback J.R. Medicinal Applications of Coordination Chemistry. The Royal Society of Chemistry, 2007.
Iakovidis I., Delimaris I., Piperakis S.M. // Mol. Biol. Int. 2011. V. 2011. ID 594529.
Trávníček Z., Maloň M., Šindelář Z. et al. // J. Inorg. Biochem. 2001. V. 84. P. 23.
Daniel K.G., Gupta P., Harbach R.H. et al. // Biochem. Pharmacol. 2004. V. 67. P. 1139.
Marengo A., Forciniti S., Dando I. et al. // Biochim. Biophys. Acta Gen. Subjects. 2019. V. 1863. P. 61.
Mekahlia S., Bouzid B. // Phys. Procedia. 2009. V. 2. P. 1045.
Sousa I., Claro V., Pereira J.L. et al. // J. Inorg. Biochem. 2012. V. 110. P. 64.
Efthimiadou E.K., Thomadaki H., Sanakis Y. et al. // J. Inorg. Biochem. 2007. V. 101. P. 64.
Melník M., Sprusansky O., Musil P. // Adv. Biol. Chem. 2014. V. 4. P. 274.
European Pharmacopoeia, 6.2. Strasbourg: Council of Europe, 2007.
Preedy V.R. Caffeine Chemistry, Analysis, Function and Effects. The Royal Society of Chemistry, 2012.
Cramer R.E., Ho D.M., Van Doorne W. et al. // Inorg. Chem. 1981. V. 20. P. 2457.
Trommenschlager A., Chotard F., Bertrand B. et al. // ChemMedChem. 2018. V. 13. P. 2408.
Rukk N.S., Kuzmina L.G., Shamsiev R.S. et al. // Inorg. Chim. Acta. 2019. V. 487. P. 184.
Rukk N.S., Kuz’mina L.G., Davydova G.A. et al. // Mendeleev Commun. 2019. V. 29. P. 640.
Nikolaevskii S.A., Evstifeev I.S., Kiskin M.A. et al. // Polyhedron. 2018. V. 152. P. 61.
Kiskin M.A., Eremenko I.L. // Russ. Chem. Rev. 2006. V. 75. P. 559.
Sidorov A.A., Kiskin M.A., Aleksandrov G.G. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 621. https://doi.org/10.1134/S1070328416100031
Nikolaevskii S.A., Yambulatov D.S., Starikova A.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 260. https://doi.org/10.1134/S1070328420040053
Zorina-Tikhonova E.N., Yambulatov D.S., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 75. https://doi.org/10.1134/S1070328420020104
Melnic S., Prodius D., Stoeckli-Evans H. et al. // Eur. J. Med. Chem. 2010. V. 45. P. 1465.
Луценко И.А., Баравиков Д.Е., Кискин М.А. и др. // Коорд. химия 2020. Т. 46. № 6. С. 366 (Lutsenko I.A., Baravikov D.E., Kiskin M.A. // Russ. J. Coord. Chem. 2020. V. 46. No. 6. P. 411). https://doi.org/10.1134/S1070328420060056
Луценко И.А., Ямбулатов Д.С., Кискин М.А. и др. // Коорд. химия. 2020. Т. 46. № 12. https://doi.org/10.31857/S0132344X2012004X
Koreň B., Valach F., Sivý P., Melník M. // Acta Crystallogr. C. 1985. V. 41. P. 1160.
Koman M., Melník M., Moncol’ J., Glowiak T. // Inorg. Chem. Commun. 2000. V. 3. P. 489.
Valach F., Tokarčík M., Maris T. et al. // J. Organomet. Chem. 2001. V. 622. P. 166.
Valach F., Melník M., Bernardinelli G., Fromm K.M. // J. Chem. Crystallogr. 2006. V. 36. P. 571.
Ma Z., Moulton B. // Mol. Pharm. 2007.V. 4. P. 373.
Valach F., Tokarčík M., Melník M. // J. Coord. Chem. 2009. V. 62. P. 225.
Horie H., Husebye S., Kato M., et al. // Acta Chem. Scand. A. 1986. V. 40. P. 579.
Harada A., Tsuchimoto M., Ohba S. et al. // Acta Crystallogr. B. 1997. V. 53. P. 654.
Melník M., Koman M., Glowiak T. // Polyhedron. 1998. V. 17. P. 1767.
Uekusa H., Ohba S., Tokii T. et al. // Acta Crystallogr. B. 1992. V. 48. P. 650.
Kawata T., Uekusa H., Ohba S. et al. // Acta Crystallogr. B. 1992. V. 48. P. 253.
Dudová B., Hudecová D., Pokorný R. et al. // Folia Microbiol. (Praha). 2001. V. 46. P. 379.
Dudová B., Hudecová D., Pokorný R. et al. // Folia Microbiol. (Praha). 2002. V. 47. P. 225.
Fomina I.G., Aleksandrov G.G., Dobrokhotova Z.V. et al. // Russ. Chem. Bull. 2006. V. 55. P. 1909.
Belford G.G., Belford R.L., Burkhalter J.F. // J. Magn. Reson. 1973. V. 11. P. 251.
Ракитин Ю.В., Ларин Г.М., Минин В.В. Интерпретация спектров ЭПР координационных соединений. М.: Наука, 1993.
Wilson R., Kivelson D. // J. Chem. Phys. 1966. V. 44. P. 154.
Лебедев Я.С., Муромцев В.И. // ЭПР и релаксация стабилизированных радикалов. М.: Химия, 1972.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Crystallogr. 2015. V. 48. P. 3.
Sheldrick G.M. SADABS. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Dolomanov O.V, Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Crystallogr. 2009. V. 42. P. 339.
Alvarez S., Llunell M. // Dalton Trans. 2000. P. 3288.
Casanova D., Llunell M., Alemany P., Alvarez S. // Chem. Eur. J. 2005. V. 11. P. 1479.
Uvarova M.A., Sinelshchikova A.A., Golubnichaya M.A. et al. // Cryst. Growth Des. 2014. V. 14. P. 5976.
Addison A.W., Rao T.N., Reedijk J. et al. // Dalton Trans. 1984. P. 1349.
Stachova P., Moncol J., Valigura D., Lis T. // Acta Crystallogr. C. 2006. V. 62. P. m375.
Blewett G., Esterhuysen C., Bredenkamp M.W., Koch K.R. // Acta Crystallogr. E. 2006. V. 62. P. m420.
Fomina I.G., Dobrokhotova Z. V, Aleksandrov G.G. et al. // Russ. Chem. Bull. 2010. V. 59. P. 1175.
Gogoleva N. V, Aleksandrov G.G., Pavlov A.A. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 91. https://doi.org/10.1134/S1070328418020057
Fomina I.G., Dobrokhotova Z.V, Aleksandrov G.G. et al. // Russ. Chem. Bull. 2007. V. 56. P. 1722.
Yagi A., Uchida R., Hamamoto H. et al. // J. Antibiot. (Tokyo). 2017. V. 70. P. 685.
Ramón-García S., Ng C., Anderson H. et al. // Antimicrob. Agents Chemother. 2011. V. 55. P. 3861.
Bekker O.B., Sokolov D.N., Luzina O.A. et al. // Med. Chem. Res. 2015. V. 24. P. 2926.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия