Координационная химия, 2020, T. 46, № 2, стр. 91-97
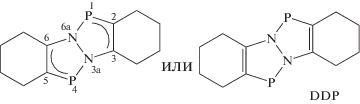
Комплексы 3a,6a-Диаза-1,4-дифосфапенталена с кислотами Льюиса (InI3, SbCl3)
А. Н. Корнев 1, *, Ю. С. Панова 1, В. В. Сущев 1, В. Е. Гальперин 1, А. В. Шеянова 1, Г. К. Фукин 1, Е. В. Баранов 1, Г. А. Абакумов 1
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
* E-mail: akornev@iomc.ras.ru
Поступила в редакцию 04.07.2019
После доработки 19.08.2019
Принята к публикации 26.08.2019
Аннотация
3a,6a-Диаза-1,4-дифосфапентален (DDP) образует с трийодидом индия комплекс состава [In(DDP)I3] (I) с соотношением In : DDP = 1 : 1. Лиганд DDP реагирует с хлоридом сурьмы(III) с образованием координационного полимера, при обработке которого пиридином в присутствии гидрохлорида пиридина получен комплекс состава [PyH]+[Sb(DDP)Cl4)]– (II) (CIF files CCDC № 1937822 (I), 1937823 (II)). Координация метала по атому фосфора осуществляется под углом к плоскости гетеропенталенового цикла (101.9(1)° и 106.0(1)°) для In и Sb соответственно. Это свидетельствует о том, что координация осуществляется за счет электронов гетероароматической π-системы.
Несмотря на то, что 3a,6a-диаза-1,4-дифосфапентален (DDP) [1] относится к аннелированным азафосфолам [2], это соединение проявляет химические свойства, отличные от свойств классических азафосфолов.
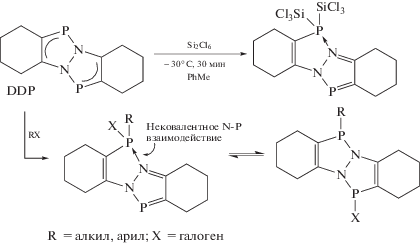
Показано, что DDP очень легко вступает в реакции присоединения по атому фосфора. В частности, гексахлордисилан присоединяется к двухкоординированному атому фосфора при –30°С с разрывом связи Si–Si с образованием бис(трихлорсилил)-производного [3] (схема 1 ). При взаимодействии лиганда DDP с органилгалогенидами получены продукты 1,1-присоединения без изменения степени окисления фосфора [4, 5] (схема 1 ), тогда как реакции присоединения к атому фосфора для обычных ароматических азафосфолов неизвестны.
Схема 1 .
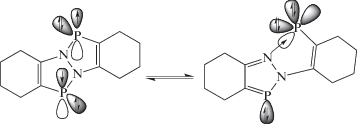
Как показали квантовохимические расчеты [1], неподеленная электронная пара атомов фосфора DDP лежит в плоскости гетероцикла, следовательно, при ее координации с льюисовским центром последний должен также располагаться в плоскости гетероцикла. Однако эксперименты с хлоридами олова(II) и ртути(II) показали [1], что атомы металлов координируются с атомом фосфора DDP не в плоскости гетеропенталенового цикла, а под углом 104.6° (Hg), 108.7°(Sn). Это свидетельствует о том, что неподеленная электронная пара на атоме фосфора не принимает участия в координации.
Известно, что представители класса азафосфолов, используемые в качестве лигандов, весьма неохотно координируются с металлами [2]. Исключение составляют 1,3-бензазафосфолы, имеющие избыточную π-электронную плотность на атоме фосфора за счет частичного перераспределения заряда при комплексообразовании [6, 7]:
Тип координации 1,3-бензазафосфолов зависит от природы металла. При возможности эффективного обратного π-донирования с металла (Cr, Mo, W) на 1,3-бензазафосфольный лиганд координация атома фосфора с металлом происходит в плоскости гетероцикла. В остальных случаях имеет место координация под углом к гетероциклу [6, 7]. Отметим, что прочность координационной связи металлов с 1,3-бензазафосфолами, как правило, ниже, чем с родственными шестичленными циклами-фосфининами [7].
Высокая координационная активность DDP также обусловлена внутримолекулярным донированием электронной плотности на один из атомов фосфора, однако в данном случае следует говорить не о таутомерных канонических формах, а о равновесии между центросимметричной формой (10-электонная ароматическая гетеропенталеновая π-система) и формой стабилизированного фосфинидена, в которой нарушена центросимметричность молекулы и одна из связей N–P удлинена.
В настоящем сообщении мы приводим сведения о синтезе и структурных особенностях комплексов DDP с кислотами Льюиса – InI3 и SbCl3. Индий и сурьма принадлежат к пятому ряду периодической системы элементов, имеют три и пять валентных p-электронов соответственно. Они обладают склонностью к образованию гипервалентных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений проводили в условиях вакуума и атмосфере высокочистого аргона. Тетрагидрофуран (ТГФ) очищали кипячением и перегонкой над натрием в присутствии бензофенона (кетил-Na). Пиридин кипятили и перегоняли над KOH. Лиганд DDP получали по методике, описанной в [1].
Синтез [In(DDP)I3] (I). Раствор DDP (0.13 г, 0.5 ммоль) в 15 мл ТГФ добавляли к раствору InI3 (0.25 г, 0.5 ммоль) в 20 мл того же растворителя и выдерживали 8 ч при комнатной температуре. За это время сформировался желто-коричневый мелкокристаллический осадок. Кристаллы промывали тетрагидрофураном, сушили в вакууме. Выход I 0.30 г (79%).
| Найдено, %: | C 23.46; | H 3.01; | I 46.50. |
| Для C16H24N2OP2I3In (М = 817.85) | |||
| вычислено, %: | C 23.50; | H 2.96; | I 46.55. |
ИК-спектр (вазелиновое масло; ν, см–1): 1601 ср, 1345 ср, 1335 сл, 1281 ср, 1224 сл, 1161 сл, 1130 ср, 1071 ср, 1037 сл, 1020 ср, 957 ср, 907 ср, 949 ср, 813 ср, 796 ср, 773 сл, 726 ср, 684 сл, 593 сл, 542 сл. Tразл = = 100°С.
Синтез [PyH]+[Sb(DDP)Cl4)]– (II). Раствор DDP (0.25 г, 1.0 ммоль) в 15 мл ТГФ добавляли к раствору SbCl3 (0.23 г, 1.0 ммоль) в 20 мл того же растворителя. Осадок отфильтровывали, сушили в вакууме и кипятили в пиридине (20 мл) в присутствии гидрохлорида пиридина (0.12 г, 1.0 ммоль) 3 ч. Раствор фильтровали горячим. При медленном остывании фильтрата до комнатной температуры происходило образование мелкокристаллического осадка комплекса I. Выход I 0.26 г (45%).
| Найдено, %: | C 34.42; | H 3.69; | Cl 23.91. |
| Для C17H22N3P2Cl4Sb (М = 593.90) | |||
| вычислено, %: | C 34.38; | H 3.73; | Cl 23.88. |
ИК-спектр (вазелиновое масло; ν, см–1): 1601 ср, 1524 ср, 1341 сл, 1281 сл, 1265 сл, 1243 ср, 1225 сл, 1195 сл, 1147 сл, 1136 сл, 1076 сл, 1040 сл, 1020 сл, 999 сл, 961 сл, 904 ср, 849 ср, 794 ср, 770 с, 686 с, 632 сл, 606 сл, 563 сл, 545 сл, 470 сл.
ИК-спектры записывали на приборе Perkin-Elmer 577 в диапазоне 4000–400 см–1 в вазелиновом масле или на Perkin-Elmer FT-IR 2000.
РСА I, II. Кристаллографические данные собраны на автоматическом дифрактометре Agilent Xcalibur E (ω-сканирование, МоКα-излучение, λ = 0.71073 Å). Экспериментальные наборы интенсивностей интегрированы с помощью программы CrysAlisPro [8]. Cтруктуры расшифрованы “dual-space” методом в программе SHELXT [9] и уточнены полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении для всех неводородных атомов с помощью пакета программ SHELXTL [10, 11]. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в модели наездника. Программа SCALE3 ABSPACK [12] использована для введения поправок на поглощение. В кристалле II найдена сольватная молекула ТГФ в общем положении. Анионная часть комплекса I разупорядочена по двум положениям. Диаграммы структур получены при помощи программы Olex2 [13]. Основные кристаллографические характеристики и параметры уточнения для I, II представлены в табл. 1, основные длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные и параметры уточнения для I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Температура, K | 100(2) | 100(2) |
| Сингония | Триклинная | Моноклинная |
| Пр. гр. | P1 | P21 |
| a, Å | 8.1547(2) | 8.8596(4) |
| b, Å | 12.2389(3) | 13.6610(5) |
| c, Å | 12.9680(3) | 8.9729(4) |
| α, град | 64.662(2) | 90 |
| β, град | 86.231(2) | 91.090(4) |
| γ, град | 86.571(2) | 90 |
| V, Å–3 | 1166.51(5) | 1085.80(8) |
| Z | 2 | 2 |
| ρ(выч.), мг м–3 | 2.328 | 1.816 |
| μ, мм–1 | 5.128 | 1.919 |
| F(000) | 760 | 588 |
| Размер кристалла, мм | 0.70 × 0.30 × 0.20 | 0.25 × 0.17 × 0.10 |
| Область сбора данных по θ, град | 3.04–26.00 | 3.20–28.68 |
| Интервалы индексов отражений | –10 ≤ h ≤ 10, –15 ≤ k ≤ 15, –15 ≤ l ≤ 15 |
–11 ≤ h ≤ 11, –18 ≤ k ≤ 18, –12 ≤ l ≤ 12 |
| Измерено отражений | 16 076 | 24 972 |
| Независимых отражений | 4562 | 5578 |
| Отражений с I > 2σ(I) | 4454 | 5385 |
| Rint | 0.0383 | 0.0107 |
| Число параметров уточнения | 226 | 312 |
| GOOF (F 2) | 1.164 | 1.046 |
| R1, wR2 (I > 2σ(I)) | 0.0292, 0.0706 | 0.0400, 0.0898 |
| R1, wR2 (по F 2 для всех отражений) | 0.0301, 0.0712 | 0.0428, 0.0914 |
| Остаточная электронная плотность (Δρmax/Δρmin), e Å–3 | 1.239/–1.065 | 0.904/–1.228 |
Таблица 2.
Избранные длины связей (Å) и валентные углы (град) в комплексах I, II
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| I | |||
| In(1)–P(1) | 2.592(2) | P(1)In(1)I(1) | 112.73(3) |
| In(1)–I(1) | 2.7213(4) | P(1)In(1)I(2) | 103.57(3) |
| In(1)–I(2) | 2.7224(4) | P(1)In(1)I(3) | 112.27(3) |
| In(1)–I(3) | 2.7008(4) | I(1)In(1)I(2) | 108.29(2) |
| P(1)–N(1) | 1.778(4) | I(1)In(1)I(3) | 112.32(2) |
| P(1)–C(1) | 1.805(5) | I(2)In(1)I(3) | 107.04(2) |
| P(2)–N(2) | 1.694(4) | N(1)P(1)C(1) | 86.8(2) |
| P(2)–C(7) | 1.738(5) | N(1)P(1)In(1) | 95.8(2) |
| N(1)–C(8) | 1.341(6) | C(1)P(1)In(1) | 97.7(2) |
| N(1)–N(2) | 1.357(5) | C(7)P(2)N(2) | 88.8(2) |
| N(2)–C(2) | 1.408(6) | C(8)N(1)N(2) | 112.0(4) |
| C(1)–C(2) | 1.344(7) | C(8)N(1)P(1) | 133.6(3) |
| C(7)–C(8) | 1.376(7) | N(2)N(1)P(1) | 114.3(3) |
| II | |||
| Sb(1)–Cl(1) | 2.569(2) | Cl(1)Sb(1)Cl(2) | 88.90(7) |
| Sb(1)–Cl(2) | 2.674(2) | Cl(1)Sb(1)Cl(3) | 166.02(9) |
| Sb(1)–Cl(3) | 2.634(3) | Cl(1)Sb(1)Cl(4) | 91.37(7) |
| Sb(1)–Cl(4) | 2.566(2) | Cl(2)Sb(1)Cl(3) | 88.20(7) |
| Sb(1)–P(1) | 2.624(2) | Cl(2)Sb(1)Cl(4) | 174.53(8) |
| P(1)–N(1) | 1.770(7) | Cl(3)Sb(1)Cl(4) | 90.23(7) |
| P(1)–C(1) | 1.818(7) | Cl(1)Sb(1)P(1) | 91.86(9) |
| P(2)–N(2) | 1.715(7) | Cl(4)Sb(1)P(1) | 82.33(7) |
| P(2)–C(7) | 1.746(8) | P(1)Sb(1)Cl(2) | 92.21(7) |
| N(1)–C(8) | 1.35(1) | P(1)Sb(1)Cl(3) | 74.59(8) |
| N(1)–N(2) | 1.361(9) | N(1)P(1)Sb(1) | 102.6(2) |
| N(2)–C(2) | 1.404(10) | N(1)P(1)C(1) | 86.7(4) |
| C(1)–C(2) | 1.334(11) | C(1)P(1)Sb(1) | 103.3(3) |
| C(7)–C(8) | 1.388(11) | ||
Кристаллографическая информация для структур депонирована в Кембриджском банке структурных данных (№ 1937822 (I), 1937823 (II); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплекс трийодида индия с аннелированным DDP может быть легко получен при взаимодействии эквимолярных растворов реагентов. При проведении реакции в толуоле, однако, образуется мелкокристаллический осадок, нерастворимый в органических растворителях. Использование в качестве растворителя ТГФ позволило замедлить рост кристаллов и выделить продукт I в монокристаллическом виде. Молекулярная структура I изображена на рис. 1а.
Рис. 1.
Молекулярная структура комплексов I (а) и II (б) с тепловыми эллипсоидами 30%-ной вероятности.
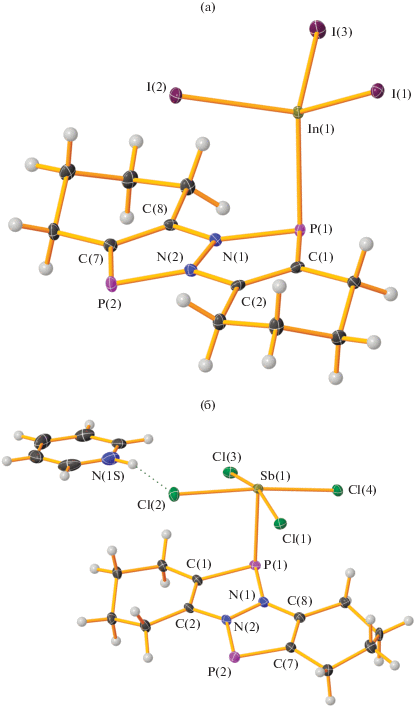
Кристаллическая ячейка комплекса I содержит два энантиомера и две сольватные молекулы ТГФ. Длина координационной связи P(1)–In(1) составляет 2.592(2) Å. Это значение превышает сумму ковалентных радиусов элементов (2.47 Å [14]), но значительно меньше суммы их ван-дер-ваальсовых радиусов (3.73 Å). Геометрия пятичленных гетероциклов в молекуле I близка к планарной, максимальное отклонение атомов от плоскости составляет 0.044(2) Å. Угол, образуемый линией связи In(1)–P(1) с плоскостью пятичленного гетероцикла, составляет 101.9(1)°. Трехкоординированный атом фосфора имеет пирамидальную геометрию с суммой валентных углов 280.4°.
В гетеропенталеновом фрагменте пятичленные гетероциклы неэквивалентны, что заметно по различию в длинах связей. Связь C(7)–C(8) (1.376(7) Å) носит более выраженный ароматический характер, чем C(1)–C(2) (1.344(7) Å), которая частично выходит из сопряжения. Аналогично происходит укорочение связи P(2)–N(2) (1.694(4) Å), в то время как связь P(1)–N(1) удлиняется (1.778(4) Å) при образовании координационного соединения.
Атом индия в соединении I имеет тетраэдрическое окружение. Небольшое искажение тетраэдрической геометрии обусловлено, очевидно, нековалентными взаимодействиями в кристалле. Короткие контакты обнаружены, в частности, для взаимодействий I(2)∙∙∙I(2), P(1)∙∙∙I(1), I(1)∙∙∙C(2) (рис. 2).
Рис. 2.
Межмолекулярные короткие контакты в кристалле I. Тепловые эллипсоиды приведены с 30%-ной вероятностью. Расстояния даны в Å.
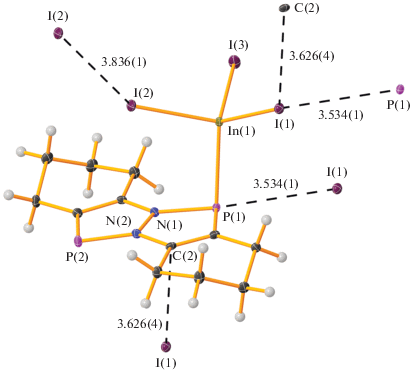
Комплекс I представляет собой координационный полимер. Растворимость I в органических растворителях оказалась крайне низкой, что не позволило изучить его состояние в растворе методом ЯМР.
Отметим, что трийодид индия способен образовывать также тригонально-бипирамидальные комплексы с двумя молекулами третичного фосфина [15]. Эксперименты с DDP показали, что в условиях двукратного избытка лиганда образуется тот же комплекс состава [In(DDP)I3] (I).
В отличие от классических кислот Льюиса трихлорид сурьмы вступает в комплексообразование с донорами электронной пары по-другому механизму, образуя гипервалентные производные [16]. Известны несколько типов комплексов с третичными фосфинами: нейтральные (R3P)nSbCl3 (n = 1, 2), катионные [Cl2(R3P)nSb]+ (n = 1, 2), анионные [Cl4(R3P)Sb]– (R3P = Me3P, Ph3P, (C6H11)3P) [16]. Во всех случаях сурьма имеет пирамидальную геометрию.
Взаимодействие растворов DDP и SbCl3 сопровождается выпадением обильного аморфного осадка, являющегося, очевидно, координационным полимером нерегулярного строения. Кипячение осадка в пиридине в течение 3 ч привело к его частичному растворению. После фильтрования из маточного раствора выделили желто-зеленые кристаллы соединения, по данным РСА представляющего собой комплекс анионного типа [PyH]+[Sb(DDP)Cl4)]– (II). Молекулярная структура II представлена на рис. 1б.
Кристаллическая ячейка II содержит два энантиомера, в которых анионная часть разупорядочена по общим позициям. Анионная часть комплекса II содержит квадратный фрагмент SbCl4, являющийся основанием тетрагональной пирамиды, в вершине которой находится атом фосфора диазадифосфапенталена. Длина связи Sb(1)–P(1) (2.624(2) Å) находится в рамках, типичных для комплексов с третичными фосфинами (Cl3SbPMe3 2.5951(9), Cl3SbPPh3 2.7576(5), Cl3SbPCy3 2.6516(14) Å [16].
Геометрия диазадифосфапенталенового каркаса в молекуле II планарная, максимальное отклонение атомов от плоскости составляет 0.069(6) Å. Угол, образуемый линией связи Sb(1)–P(1) с плоскостью гетероцикла, составляет 106.0(1)°.
При координации атома сурьмы с фосфором симметричность гетеропенталенового каркаса нарушается, как и в случае комплекса I, что заметно по различию в длинах связей. Связь C(7)–C(8) (1.388(11) Å) носит более выраженный ароматический характер, чем C(1)–C(2) (1.334(11) Å), частично выходящая из сопряжения. Аналогично происходит укорочение связи P(2)–N(2) (1.715(7) Å), в то время как связь P(1)–N(1) удлиняется (1.770(7) Å) при образовании координационного соединения.
Катионный фрагмент соединения II представляет собой катион пиридиния, связанный водородной связью (N(1S)–H···Cl(2) 2.352(3) Å) с ближайшим атомом хлора фрагмента SbCl4 и имеющий короткие контакты CH···Cl (2.71–2.83 Å) с соседними молекулами. В кристалле имеются также короткие контакты P(2)···Cl(2) (3.430(3) Å) и множественные контакты атомов хлора с атомами водорода циклогексильных фрагментов (2.79–2.86 Å).
Соединение II ионное, оно теряет растворимость в органических растворителях после первой кристаллизации из маточного раствора, что препятствует изучению растворов методов ЯМР.
Мы показали, что выход соединения II можно повысить с 10 до 45%, добавив гидрохлорид пиридина к реакционной смеси (DDP–SbCl3) при кипячении в пиридине.
Мы исследовали комплексообразование аннелированного DDP с трифторидом сурьмы. В данном случае, при проведении реакции в ТГФ, происходит частичное восстановление SbF3 до металлической сурьмы и образование смеси фосфорорганических соединений со связями P–F, о чем свидетельствует характерный спектр ЯМР 31P с константами спин-спинового взаимодействия JP, F ~ 840 Гц.
Таким образом, получены и охарактеризованы комплексы аннелированного 3a,6a-диаза-1,4-дифосфапенталена с галогенидами индия и сурьмы [In(DDP)I3] (I) и [PyH]+[Sb(DDP)Cl4)]– (II), демонстрирующие координацию металла с атомом фосфора под углом к плоскости гетеропенталенового цикла 101.9(1)° и 106.0(1)° соответственно. Это свидетельствует о том, что координация осуществляется в основном за счет электронов гетероароматической π-системы.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Kornev A.N., Sushev V.V., Panova Y.S. et al. // Inorg. Chem. 2014. V. 53. P. 3243.
Bansal R.K. // Phosphorous Heterocycles I: Top. Heterocycl. Chem. Berlin–Heidelberg: Springer-Verlag, 2009. V. 20. P. 1.
Корнев А.Н., Сущев В.В., Киреева В.В. и др. // Докл. РАН. 2015. Т. 462. № 5. С. 550 (Kornev A.N., Sushev V.V., Kireeva V.V. et al. // Dokl. Chem. 2015. V. 462. P. 145).
Kornev A.N., Galperin V.E., Sushev V.V. et al. // Eur. J. Inorg. Chem. 2016. V. 22. P. 3629.
Корнев А.Н., Гальперин В.Е., Сущев В.В. и др. // Изв. АН. Сер. хим. 2016. Т. 11. С. 2658 (Kornev A.N., Galperin V.E., Sushev V.V. et al. // Russ. Chem. Bull. 2016. V. 65. № 11. P. 2658).
Heinicke J.W., Ghalib M., Schulzke C. et al. // Phosphorus Sulfur Silicon Relat. Elem. 2015. V. 190. № 5–6. P. 806.
Ghalib M., Niaz B., Jones P.G., Heinicke J.W. // Heteroatom. Chem. 2013. V. 24. № 6. P. 452.
Data Collection. Reduction and Correction Program. CrysAlisPro – Software Package Agilent Technologies, 2014.
Sheldrick G.M. // Acta Crystallpgr. A. 2015. V. 71. P. 3.
Sheldrick G.M. SHELXTL. Version 6.14. Structure Determination Software Suite. Madison (WI, USA): Bruker AXS, 2003.
Sheldrick G.M. // Acta Crystallpgr. C. 2015. V. 71. P. 3.
SCALE3 ABSPACK. Empirical Absorption Correction. CrysAlisPro – Software Package Agilent Technologies, 2014.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. №. 12. С. 3015 (Batsanov S.S. // Russ. J. Inorg. Chem. 1991. V. 36. № 12. P. 1694).
Brown M.A., Tuck D.G., Wells E.J. // Can. J. Chem. 1996. V. 74. P. 1535.
Chitnis S.S., Burford N., McDonald R. et al. // Inorg. Chem. 2014. V. 53. P. 5359.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия