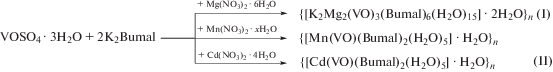Координационная химия, 2020, T. 46, № 2, стр. 81-90
Координационные полимеры на основе бутилмалонатных фрагментов оксованадия(IV) и катионов калия, магния и кадмия
Е. С. Бажина 1, *, Г. Г. Александров 1, М. А. Кискин 1, А. А. Сидоров 1, И. Л. Еременко 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: evgenia-VO@mail.ru
Поступила в редакцию 04.09.2019
После доработки 18.09.2019
Принята к публикации 23.09.2019
Аннотация
Представлены результаты по синтезу и исследованию кристаллической структуры соединений {[K2Mg2(VO)3(Bumal)6(H2O)15] · 2H2O}n (I) и {[Cd(VO)(Bumal)2(H2O)5] · H2O}n (II), образованных анионными фрагментами [VO(Bumal)2(H2O)]2– c оксованадием(IV) и двумя хелатно координированными анионами бутилмалоновой кислоты (H2Bumal = C5H10(COOH)2). В кристаллах I (CCDC № 1911220) анионные фрагменты [VO(Bumal)2(H2O)]2– связаны между собой катионами K+ и Mg2+ в 2D полимерную структуру, в соединении II (CCDC № 1033008) – катионами Cd2+, формируя 1D координационный полимер.
Анионы карбоновых кислот благодаря многообразию проявляемых ими способов координации
– удобный инструмент для конструирования полиядерных комплексов переходных металлов,
обладающих магнитными [1–7] и/или люминесцентными свойствами [8–14], а также проявляющих каталитическую [15, 16] и биологическую активность [17]. Мостиковые анионы дикарбоновых кислот находят широкое применение в конструировании
пористых металлоорганических каркасных полимеров, способных к селективной сорбции
малых молекул и ионов [18–26]. Среди представителей этого обширного класса лигандов особое место занимают замещенные
малоновые кислоты (H2R2mal), анионы которых за счет образования шестичленного хелатного цикла с катионами 3d-металлов способны формировать устойчивые моноядерные бисхелатные анионные комплексы
[M(R2mal)2]2– (M = VO2+, Co2+, Ni2+, Cu2+, Zn2+), содержащие свободные для координации атомы кислорода карбоксильных групп. Такие
комплексы перспективны в качестве металлсодержащих блоков для сборки сложных полиядерных
структур и координационных полимеров, содержащих атомы металлов разного типа [27, 28]. Природа заместителей (R) в малонат-анионе оказывает влияние не только на растворимость продукта взаимодействия
в конкретной реакционной среде, но и на его кристаллическую структуру. Кроме того,
структурообразующую роль в малонатных системах играют также и катионы щелочных (M') и щелочноземельных металлов (M"), вводимые в реакцию в виде соли замещенной малоновой кислоты. Радиус этих катионов
в сочетании с размером заместителя малонатного лиганда в большинстве случаев определяет
размерность формирующихся полимерных структур [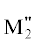 M(R2mal)2]n и [M"M(R2mal)2]n (M = катион 3d-металла) [29]. Несомненным преимуществом таких соединений является возможность замещения катионов
щелочных и щелочноземельных металлов двухзарядными катионами магния и различных d-металлов, что приводит к формированию новых гетерометаллических соединений иных состава
и строения. Например, ранее было продемонстрировано, как взаимодействие водных растворов
соединений {[Ba(VO)(Me2mal)2-(H2O)] · H2O}n и {[Ba3(VO)3(Bumal)6(H2O)13] · 4H2O}n с сульфатом марганца(II) привело к полному замещению катионов бария(II) катионами
марганца(II) и формированию 1D-полимеров {[Mn(VO)- (R2mal)2(H2O)5] · H2O}n (R2 = Me2 или Bu соответственно) [30]. В случае гетерометаллических комплексов K-M возможно как полное, так и частичное
замещение катионов калия. На примере реакций [K4(VO)2(Сbdc)4(H2O)4]n с нитратом магния, комплекса [K8Cu4(Me2mal)8(H2O)8]n с нитратами магния, никеля(II) или кобальта(II) продемонстрировано частичное замещение
катионов калия катионами соответствующих металлов [31, 32], а взаимодействие [K8Cu4(Me2mal)8(H2O)8]n с нитратом кадмия привело к продукту полного замещения катионов калия кадмием [33].
M(R2mal)2]n и [M"M(R2mal)2]n (M = катион 3d-металла) [29]. Несомненным преимуществом таких соединений является возможность замещения катионов
щелочных и щелочноземельных металлов двухзарядными катионами магния и различных d-металлов, что приводит к формированию новых гетерометаллических соединений иных состава
и строения. Например, ранее было продемонстрировано, как взаимодействие водных растворов
соединений {[Ba(VO)(Me2mal)2-(H2O)] · H2O}n и {[Ba3(VO)3(Bumal)6(H2O)13] · 4H2O}n с сульфатом марганца(II) привело к полному замещению катионов бария(II) катионами
марганца(II) и формированию 1D-полимеров {[Mn(VO)- (R2mal)2(H2O)5] · H2O}n (R2 = Me2 или Bu соответственно) [30]. В случае гетерометаллических комплексов K-M возможно как полное, так и частичное
замещение катионов калия. На примере реакций [K4(VO)2(Сbdc)4(H2O)4]n с нитратом магния, комплекса [K8Cu4(Me2mal)8(H2O)8]n с нитратами магния, никеля(II) или кобальта(II) продемонстрировано частичное замещение
катионов калия катионами соответствующих металлов [31, 32], а взаимодействие [K8Cu4(Me2mal)8(H2O)8]n с нитратом кадмия привело к продукту полного замещения катионов калия кадмием [33].
В настоящей работе исследованы возможности замещения катионов K+ катионами Mg2+ и d‑металлов (Mn2+, Cd2+) в реакции взаимодействия сульфата ванадила и калиевой соли бутилмалоновой кислоты в соотношении 1 : 2. Выделены в виде монокристаллов и исследованы методом РСА два новых соединения оксованадия(IV): продукт частичного замещения катионов калия магнием, 2D-полимер {[K2Mg2(VO)3(Bumal)6-(H2O)15] · 2H2O}n (I), имеющий иные состав и строение, чем ранее описанный комплекс {[KMg0.5(VO)(Cbdc)2(H2O)5.5] · 2.5H2O}n с анионами циклобутан-1,1-дикарбоновой кислоты [31], и продукт полного замещения катионов калия кадмием, 1D-полимер {[Cd(VO)(Bumal)2(H2O)5] · H2O}n (II), схожий по строению с ранее описанным комплексом {[Mn(VO)(Bumal)2(H2O)5] · H2O}n [30].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез новых комплексов выполняли на воздухе с использованием дистиллированной воды, этанола (95%), VOSO4 · 3H2O (99+%), KОН (99+%), Mg(NO3)2 · 6H2O (98+%), Mn(NO3)2 · xH2O (98%, Sigma Aldrich), Cd(NO3)2 · 4H2O (99+%, Acros Organics), H2Bumal (99%, Sigma-Aldrich). ИК-спектры соединений регистрировали в интервале частот 4000–400 см–1 на ИК-спектрофотометре с Фурье-преобразованием Spectrum 65 (PerkinElmer), оборудованном приставкой Quest ATR Accessory (Specac). Элементный анализ выполняли на CHNS-анализаторе EuroЕА 3000 (EuroVe-ctor).
Синтез {[K2Mg2(VO)3(Bumal)6(H2O)15] · 2H2O}n (I). К раствору VOSO4 · 3H2O (0.15 г, 0.69 ммоль) в 10 мл дистиллированной воды добавляли раствор K2Bumal, полученный нейтрализацией H2Bumal (0.221 г, 1.38 ммоль) и KOH (0.154 г, 2.76 ммоль) в 15 мл воды. Реакционную смесь перемешивали 10 мин при 40°С. К полученному раствору синего цвета добавляли Mg(NO3)2 · 6H2O (0.354 г, 1.38 ммоль) и перемешивали еще 10 мин. Полученный раствор выдерживали при 22°С. Образовавшиеся через 2 мес. кристаллы синего цвета, пригодные для РСА, отделяли от маточного раствора фильтрованием, промывали холодной водой (Т ≈ 5°C), этанолом (Т ≈ 22°C) и сушили на воздухе. Выход соединения I 0.211 г (57.9% в расчете на VOSO4 · 3H2O).
ИК-спектр (НПВО; ν, см–1): 3184 о. сл ν(O–H), 2958 сл ν(C–H), 2935 сл ν(C–H), 2873 сл ν(C–H), 1638 с νas(COO–), 1583 с νas(COO–), 1400 с νs(COO–), 1348 с, 1326 с, 1304 ср, 1272 ср, 1245 сл, 1199 ср, 1116 сл, 1103 с, 1006 с ν(V=O), 952 с, 892 с, 808 с δ(OCO), 774 с, 745 с, 700 о.с, 613 с, 526 с, 496 с, 454 с [34, 35].
Синтез {[Cd(VO)(Bumal)2(H2O)5] · H2O}n (II). К раствору VOSO4 · 3H2O (0.1 г, 0.46 ммоль) в 10 мл дистиллированной воды добавляли раствор K2Bumal, полученный нейтрализацией H2Bumal (0.148 г, 0.92 ммоль) и KOH (0.103 г, 1.84 ммоль) в 15 мл воды. Реакционную смесь перемешивали 10 мин при 40°С. К полученному раствору синего цвета добавляли Cd(NO3)2 · 4H2O (0.284 г, 0.92 ммоль) и перемешивали еще 10 мин. Образовавшийся кристаллический осадок голубого цвета отделяли фильтрованием, промывали водой (Т ≈ 22°C) и сушили на воздухе. Кристаллы, пригодные для РСА, получали медленным испарением маточного раствора при 22°C в течение 7 сут. Кристаллы отделяли от маточного раствора фильтрованием, промывали водой (Т ≈ 22°C) и сушили на воздухе. Выход соединения II 0.124 г (44.5% в расчете на VOSO4 · 3H2O).
ИК-спектр (НПВО; ν, см–1): 3652 о. сл, 3497 сл. ш ν(O–H), 3371 сл. ш ν(O–H), 3222 сл. ш ν(O–H), 2960 сл ν(C–H), 2930 сл ν(C–H), 2870 о. сл ν(C–H), 1549 с νas(COO–), 1418 с νs(COO–), 1354 ср, 1341 ср, 1313 ср, 1290 ср, 1232 сл, 1202 сл, 1190 сл, 1139 о. сл, 1103 сл, 1071 о. сл, 987 с ν(V=O), 963 ср, 912 сл, 865 о.сл, 807 ср δ(OCO), 772 ср, 715 с, 669 ср, 511 с, 486 с, 456 с, 440 с, 428 с, 420 с [34, 35].
РСА монокристаллов I и II выполнен на дифрактометре Bruker SMART APEX II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [36]. Введена полуэмпирическая поправка на поглощение [37]. Структуры расшифрованы прямыми методами и уточнены полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX-97 и SHELX-2014 [38]. Кристаллографические параметры и детали уточнения структур I, II приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры расчетов структуры кристаллов I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| М | 1582.81 | 602.73 |
| Т, К | 153(2) | 170(2) |
| Сингония | Триклинная | Триклинная |
| Пр. гр. | P1 | P1 |
| a, Å | 11.7871(7) | 9.9366(14) |
| b, Å | 18.3252(11) | 10.6972(16) |
| c, Å | 18.5491(11) | 11.8978(17) |
| α, град | 65.6160(10) | 83.797(2) |
| β, град | 74.3830(10) | 65.603(2) |
| γ, грал | 82.7430(10) | 83.475(2) |
| V, Å3 | 3514.0(4) | 1141.7(3) |
| Z | 2 | 2 |
| ρ(выч.), г см–3 | 1.496 | 1.753 |
| μ, мм–3 | 0.626 | 1.410 |
| θmin–θmax, град | 2.19–29.47 | 2.62–26.05 |
| F(000) | 1658 | 612 |
| Tmin/Tmax | 0.6342/0.7459 | 0.5852/0.7456 |
| Интервалы индексов отражений | –16 ≤ h ≤ 16, –25 ≤ k ≤ 2, –25 ≤ l ≤ 25 | –12 ≤ h ≤ 12, –13 ≤ k ≤ 13, –15 ≤ l ≤ 15 |
| Измерено отражений | 39 607 | 11 117 |
| Независимых отражений | 19 418 | 5164 |
| Rint | 0.033 | 0.031 |
| Отражений с I > 2σ(I) | 15 841 | 4189 |
| GООF | 1.016 | 0.982 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0908, wR2 = 0.2507 | R1 = 0.0434, wR2 = 0.1264 |
| R-факторы по всем отражениям | R1 = 0.1061, wR2 = 0.2666 | R1 = 0.0556, wR2 = 0.1377 |
| Остаточная электронная плотность (min/max), e/Å3 | –3.039/3.317 | –0.826/1.568 |
Структурные данные соединений I и II депонированы в Кембриджском банке структурных данных (CCDC № 1911220, 1033008 соответственно); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействием VOSO4 · 3H2O, K2Bumal и Mg(NO3)2 · 6H2O в мольном соотношении 1 : 2 : 2 получен 2D-координационный полимер {[K2Mg2(VO)3(Bumal)6(H2O)15] · 2H2O}n (I). Аналогичная реакция с использованием Cd(NO3)2 · 4H2O и Mn(NO3)2 · xH2O вместо Mg(NO3)2 · 6H2O, взятых в том же количестве, приводит к образованию 1D-полимеров {[Cd(VO)(Bumal)2(H2O)5] · H2O}n (II) и {[Mn(VO)(Bumal)2(H2O)5] · H2O}n (получен ранее по другой методике, см. [30]), которые имеют одинаковое строение и не содержат катионов калия (схема 1).
Схема 1.
Базовый структурный фрагмент I (рис. 1) образован тремя бисхелатными дианионами [VO(Bumal)2(H2O)]2–, содержащими кристаллографически неэквивалентные атомы ванадия (V(1), V(2), V(3)), двумя атомами магния (Mg(1), Mg(2)), двумя атомами калия (K(1), K(2)) и пятнадцатью молекулами воды, координированными к атомам металлов. Схожее строение элементарного звена (наличие трех бисхелатных дианионов с неэквивалентными атомами ванадия) мы наблюдали ранее в структурах соединений Ba–V [30], Sr–V [39] и Na–V [40] с анионами Bumal2– . Атомы ванадия в составе дианионов [VO(Bumal)2(H2O)]2– находятся в искаженно октаэдрическом координационном окружении шести атомов O. Экваториальную плоскость полиэдра занимают атомы O карбоксильных групп двух хелатно координированных бутилмалонат-анионов, в аксиальных позициях находятся атом O ванадильной группы и атом O молекулы воды. Длины связей и углы, характеризующие координационные полиэдры ванадия, находятся в интервалах, наблюдаемых для других известных замещенных малонатов оксованадия(IV) (табл. 2) [30, 31, 39–45]. В пределах одного элементарного звена металлофрагменты [V(3)O(Bumal)2(H2O)]2– и [V(2)O(Bumal)2(H2O)]2– за счет координации карбоксильных групп анионов бутилмалоновой кислоты связывают атомы магния Mg(1) и Mg(2) соответственно, а атом K(1) соединяет атом Mg(1) с бисхелатными дианионами [V(1)O(Bumal)2-(H2O)]2– и [V(2)O(Bumal)2(H2O)]2– за счет координации двух мостиковых молекул воды и четырех атомов O карбоксильных групп ванадийсодержащих фрагментов. Атомы Mg(2), K(1) и K(2) также координируют по одному атому карбоксильных групп металлофрагментов [V(1)O(Bumal)2- (H2O)]2–, [V(2)O(Bumal)2(H2O)]2– и [V(3)O(Bumal)2-(H2O)]2– соответственно, принадлежащих соседним звеньям, связывая элементарные структурные фрагменты в слоистую полимерную структуру (рис. 2), которая дополнительно стабилизируется за счет водородных связей (табл. 3). Расстояния между атомами ванадия V(1)···V(2), V(2)···V(3), V(3)···V(1) в элементарном структурном фрагменте равны 7.882, 7.652, 11.583 Å соответственно. Атом Mg(1) помимо одного карбоксилатного атома O дианиона [V(3)O(Bumal)2(H2O)]2– координирует пять молекул воды, находясь в октаэдрическом координационном окружении. Две молекулы воды (O(9w) и O(10w)) мостиковые и связывают атом Mg(1) с атомом K(1), а три – координированы монодентатно (O(1w), O(3w), O(11w)). Октаэдрическое окружение атома Mg(2) образовано двумя карбоксилатными атомами O металлофрагментов [V(1)O(Bumal)2(H2O)]2–, [V(2)O(Bumal)2-(H2O)]2–, принадлежащих соседним структурным звеньям, и четырьмя молекулами воды, одна из которых мостиковая (O(15w)) и связывает атом Mg(2) с атомом K(2), а три – координированы монодентатно (O(13w), O(14w), O(16w)). Значения основных углов в полиэдрах Mg приведены в табл. 2. Атом K(2) дополнительно монодентатно координирует три молекулы воды (O(4w), O(6w) и O(7w)).
Рис. 1.
Базовый фрагмент 2D-полимерной структуры I. Бутильные заместители анионов кислоты и атомы водорода не показаны.
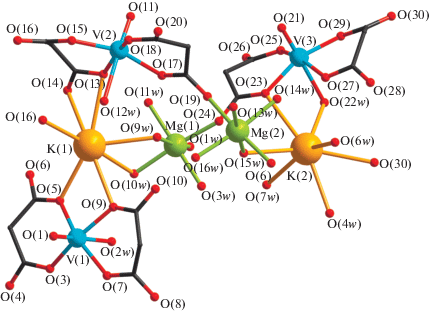
Таблица 2.
Основные длины связей (d, Å) и валентные углы (ω, град), характеризующие координационные полиэдры ванадия (КПV), магния и кадмия (КПMg, Cd) в соединениях I и II
| Связь | d, Å | |
|---|---|---|
| I (M = Mg) | II (M = Cd) | |
| V=O | 1.586(3), 1.593(3), 1.595(3) | 1.580(3) |
| V–O (Bumal) | 1.987(3)–2.023(3) | 1.986(2)–2.003(3) |
| V–O (H2O) | 2.321(3), 2.326(3), 2.363(3) | 2.316(3) |
| M–O (Bumal) | 2.060(3), 2.079(3), 2.085(3) | 2.323(2), 2.327(3) |
| M–O (H2O) | 2.034(3)–2.095(3) | 2.238(3)–2.303(3) |
| К–O (Bumal) | 2.698(3)–3.024(3) | |
| К–O (H2O) | 2.761(3) –3.100(3) | |
| КПV | ||
| Угол | ω, град | |
| I (M = V) | II ( M = V) | |
| OоксоVOэкв | 98.42(15)–102.14(16) | 99.20(13)–102.47(13) |
| OоксоVOакс | 176.48(15), 177.89(15), 179.17(15) | 175.68(14) |
| OэквVOэкв (смежные) | 86.64(12)–91.24(12) | 84.74(10)–89.32(10) |
| OэквVOакс | 77.51(11)–81.86(12) | 75.87(11)–82.19(11) |
| КПMg, Сd | ||
| Угол | ω, град | |
| I (M = Mg) | II (M = Cd) | |
| OаксMOэкв | 83.69(12), 86.79(13)–96.12(14) | 80.64(10), 85.68(11)–94.32(11), 99.36(10) |
| OэквMOэкв (смежные) | 82.32(12), 86.88(15)–96.96(13) | 80.49(10), 87.18(12), 92.82(12), 99.51(10) |
| OаксMOакс | 170.48(14), 177.27(15) | 180 |
Рис. 2.
Строение полимерного слоя соединения I. Синие линии соединяют атомы V(1), V(2) и V(3) элементарных звеньев. Бутильные заместители и атомы водорода не показаны.
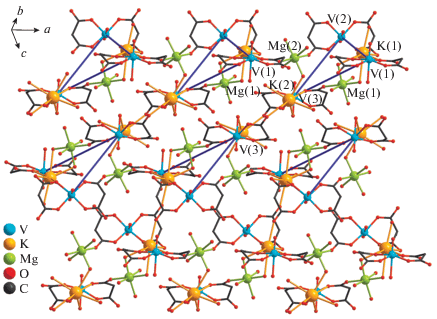
Таблица 3.
Геометрические параметры водородных связей в структуре I*
| D–H···A | Расстояние, Å | Угол D–H···A, град | ||
|---|---|---|---|---|
| D–H | H···A | D···A | ||
| O(3w)–H(3wa)···O(8)(i) | 0.83 | 1.88 | 2.706 | 176 |
| O(5w)–H(5wb)···(O1)(ii) | 0.83 | 2.26 | 3.069 | 168 |
| O(5w)–H(5wa)···O(4w)(iii) | 0.83 | 2.05 | 2.815 | 153 |
| O(16w)–H(16c)···O(10)(iv) | 0.83 | 1.94 | 2.749 | 164 |
| O(11w)–H(11c)···O(28)(iv) | 0.83 | 2.01 | 2.826 | 171 |
| O(2w)–H(2wa)···O(8)(v) | 0.83 | 1.94 | 2.702 | 152 |
| O(1w)–H(1wa)···O(29)(vi) | 0.83 | 2.18 | 2.859 | 140 |
| O(12w)–H(12c)···O(20)(ii) | 0.83 | 1.98 | 2.771 | 159 |
| O(11w)–H(11d)···O(13) | 0.83 | 2.06 | 2.886 | 179 |
| O(16w)–H(16d)···O(20)(ii) | 0.83 | 1.96 | 2.782 | 176 |
| O(2w)–H(2wb)···O(4)(i) | 0.83 | 1.98 | 2.795 | 168 |
| O(4w)–H(4wa)···O(4)(i) | 0.83 | 1.99 | 2.820 | 174 |
| O(3w)–H(5wb)···O(7w) | 0.83 | 1.89 | 2.712 | 169 |
| O(22w)–H(22d)···O(28)(vii) | 0.83 | 2.29 | 3.093 | 163 |
| O(15w)–H(15d)···O(8w) | 0.83 | 1.82 | 2.639 | 169 |
| O(1w)–H(1wb)···O(25)(vi) | 0.83 | 1.94 | 2.730 | 158 |
| O(10w)–H(10d)···O(2w)(iv) | 0.83 | 2.10 | 2.902 | 162 |
| O(9w)–H(9wb)···O(17) | 0.83 | 1.93 | 2.760 | 177 |
| O(8w)–H(8wa)···O(7)(i) | 0.83 | 2.06 | 2.819 | 152 |
| O(8w)–H(8wb)···O(3)(i) | 0.83 | 2.19 | 2.853 | 137 |
| O(14w)–H(14e)···O(14)(viii) | 0.83 | 1.84 | 2.654 | 167 |
| O(13w)–H(13c)···O(15)(ii) | 0.83 | 2.40 | 2.850 | 115 |
| O(13w)–H(13d)···O(18)(ii) | 0.83 | 1.97 | 2.778 | 164 |
| O(14w)–H(14d)···O(27) | 0.83 | 2.39 | 3.059 | 138 |
Несмотря на подобие методик синтеза ранее полученного 1D-полимера {[KMg0.5(VO)(Cbdc)2-(H2O)5.5] · 2.5H2O}n и нового 2D-полимера {[K2Mg2(VO)3(Bumal)6(H2O)15] · 2H2O}n (I), их состав и строение абсолютно разные, что может определяться как природой карбоксилатного аниона (стерическим эффектом заместителя в малонатном лиганде), так и соотношением металлов, входящих в структуру. Так, соотношение K : Mg : V в элементарном фрагменте соединения с анионами Cbdc2– равно 1 : 0.5 : 1, в соединении I – 2 : 2 : 3. Таким образом, содержание Mg в элементарном звене I в четыре, а V – в три раза больше по сравнению с циклобутан-1,1-дикарбоксилатом, что, несмотря на наличие в малонат-анионе объемного бутильного заместителя, по-видимому, поспособствовало формированию структуры более высокой размерности.
Полимерные цепочки соединения II образованы фрагментами {VO(Bumal)2(H2O)}, близкими по строению бисхелатным блокам соединения I (рис. 3, табл. 2), причем все атомы ванадия в структуре кристаллографически эквивалентны. Металлофрагменты {VO(Bumal)2(H2O)} связаны в полимерные цепочки атомами кадмия, каждый из которых координирует по два карбоксилатных атома O лиганда соседних бисхелатных ванадийсодержащих фрагментов. В отличие от ранее полученного соединения {[Cd(VO)(Сbdc)2(H2O)5] · H2O}n [44], в котором анионы дикарбоновой кислоты фрагмента {VO(Сbdc)2(H2O)} проявляют разный тип координации (µ3,κ2-хелатно-мостиковый и κ2-хелатный), в II оба аниона кислоты фрагмента {VO(Bumal)2(H2O)} демонстрируют µ,κ2-тип координации. Межатомные расстояния V(1)···Cd(1) и V(1)···Cd(2) в полимерной цепи неодинаковы и равны 5.155 и 5.089 Å соответственно, а расстояния между соседними атомами кадмия одинаковы и равны 9.235 Å, что на ~1.34 Å больше, чем в соединении {[Cd(VO)(Cbdc)2(H2O)5] · H2O}n. Кроме того, в отличие от циклобутан-1,1-дикарбоксилата V-Cd, в II на ~2.4 Å увеличиваются расстояния V···V, которые неодинаковы (10.178 и 10.311 Å). Кристаллическая структура II дополнительно стабилизируется за счет водородных связей, в образовании которых принимают участие сольватные и координированные молекулы воды и атомы O карбоксильных групп (табл. 4). В структуре II существуют два типа кристаллографически неэквивалентных атомов кадмия, Cd(1) и Cd(2), имеющие отличающиеся характеристики октаэдрических координационных полиэдров. Экваториальную плоскость полиэдра Cd(1) образуют четыре атома O монодентано координированных молекул воды (два O(3w) и два O(4w)), аксиальные позиции занимают атомы O(7) карбоксильных групп бутилмалонат-анионов бисхелатных фрагментов {VO(Bumal)2- (H2O)}. В полиэдре Cd(2) карбоксилатные атомы O(5) бисхелатных фрагментов {VO(Bumal)2(H2O)} лежат в экваториальной плоскости вместе с двумя атомами O монодентано связанных молекул воды (два O(2w)), еще два атома O молекул воды (O(5w)) находятся в аксиальных позициях. Значения основных углов в полиэдрах Cd приведены в табл. 2.
Рис. 3.
Строение полимерной цепочки комплекса II. Бутильные заместители анионов кислоты и атомы водорода не показаны.
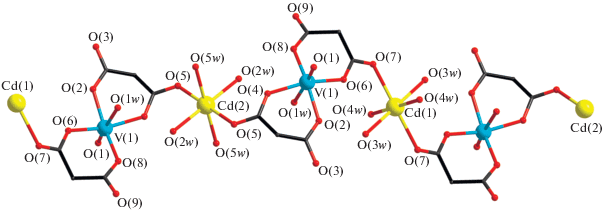
Таблица 4.
Геометрические параметры водородных связей в структуре II*
| D–H···A | Расстояние, Å | Угол D–H···A, град | ||
|---|---|---|---|---|
| D–H | H···A | D···A | ||
| O(1w)–H(1w1)···O(3)i | 0.83 | 1.84 | 2.659 | 169 |
| O(1w)–H(2w1)···O(9)ii | 0.83 | 1.92 | 2.688 | 155 |
| O(2w)–H(1w2)···O(1w) | 0.83 | 2.10 | 2.893 | 160 |
| O(2w)–H(2w2)···O(7)iii | 0.83 | 2.05 | 2.838 | 159 |
| O(3w)–H(1w3)···O(2)iv | 0.83 | 2.16 | 2.975 | 164 |
| O(3w)–H(2w3)···O(5)v | 0.83 | 2.02 | 2.835 | 165 |
| O(4w)–H(1w4)···O(9)ii | 0.83 | 1.87 | 2.701 | 176 |
| O(4w)–H(2w4)···O(6w) | 0.83 | 2.19 | 2.836 | 134 |
| O(5w)–H(1w5)···O(6w)ii | 0.83 | 1.98 | 2.768 | 160 |
| O(5w)–H(2w5)···O(3)vi | 0.83 | 1.89 | 2.711 | 170 |
| O(6w)–H(1w6)···O(8)ii | 0.83 | 2.22 | 2.924 | 142 |
| O(6w)–H(1w6)···O(2w)ii | 0.83 | 2.63 | 3.138 | 121 |
При рассмотрении упаковки полимерных цепей в кристалле расстояния между атомами Cd соседних цепей оказываются меньше, чем расстояния Cd···Cd одной цепи, на 3.29 Å (5.949 Å), а соответствующие межатомные расстояния V···V – меньше на 2.9 Å (7.403 и 7.436 Å).
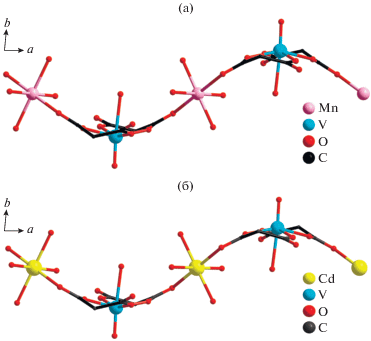
Строение и упаковка полимерных цепей в кристалле II аналогичны строению и упаковке цепей в структуре его марганецсодержащего аналога {[Mn(VO)(Bumal)2(H2O)5] · H2O}n, полученного замещением катионов бария(II) (см. [30]) (рис. 4). Это свидетельствует об отсутствии влияния радиуса катиона d-металла на строение гетерометаллического соединения, образованного бисхелатными ванадильными фрагментами, как это наблюдалось для соединений с анионами циклобутан-1,1-дикарбоновой кислоты (см. [44]).
Рис. 4.
Сравнение строения полимерных цепочек соединения {[Mn(VO)(Bumal)2(H2O)5] · H2O}n (а) и II (б). Бутильные заместители анионов кислоты и атомы водорода не показаны.
Таким образом, показано, что в системах с оксованадием(IV), подобно малонатам меди(II) [28], происходит лишь частичное замещение катионов калия магнием, независимо от природы заместителя в малонат-анионе. При этом комплекс {[K2Mg2(VO)3(Bumal)6(H2O)15] · 2H2O}n (I) с анионами бутилмалоновой кислоты, содержащими объемный заместитель, имеет большую размерность (2D), чем соответствующее соединение с анионами циклобутан-1,1-дикарбоновой кислоты {[KMg0.5(VO)(Cbdc)2(H2O)5.5] · 2.5H2O}n, имеющее 1D полимерную структуру. По-видимому, такой эффект можно объяснить наличием в элементарном фрагменте соединения I большего количества металлоцентров, способных связывать бисхелатные ванадийсодержащие фрагменты между собой. В то же время полное замещение катионов калия происходит при взаимодействии с марганцем и кадмием несмотря на существенную разницу их ионных радиусов. Формирующиеся 1D полимерные комплексы с общей формулой {[M(VO)(Bumal)2(H2O)5] · H2O}n (M = Mn, Cd) имеют одинаковое строение.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Papatriantafyllopoulou C., Wernsdorfer W., Abboud K.A., Christou G. // Inorg. Chem. 2011. V. 50. P. 421.
Langley S.K., Wielechowski D.P., Vieru V. et al. // Angew. Chem. Int. Ed. 2013. V. 52. P. 12014.
Zhao F.-H., Li H., Che Y.-X. et al. // Inorg. Chem. 2014. V. 53. P. 9785.
Pineda E.M., Chilton N.F., Tuna F. et al. // Inorg. Chem. 2015. V. 54. P. 5930.
Kiskin M., Zorina-Tikhonova E., Kolotilov S. et al. // Eur. J. Inorg. Chem. 2018. P. 1356.
Fan S., Xu S., Zheng X. et al. // CrystEngComm. 2018. V. 20. P. 2120.
Botezat O., van Leusen J., Kögerler P., Baca S.G. // Eur. J. Inorg. Chem. 2019. P. 2236.
Yin M., Lei X., Li M. et al. // J. Phys. Chem. Solids. 2006. V. 67. P. 1372.
Bo Q.-B., Wang H.-Y., Wang D.-Q. et al. // Inorg. Chem. 2011. V. 50. P. 10163.
Goldberg A., Kiskin M., Shalygina O. et al. // Chem. Asian J. 2016. V. 11. P. 604.
Кискин М.А., Доброхотова Ж.В., Богомяков А.С. и др. // Изв. АН. Сер. хим. 2016. № 6. С. 1488.
Zheng S.-R., Tan J.-B., Cai S.-L. et al. // CrystEngComm. 2016. V. 18. P. 8672.
Kiraev S.R., Nikolaevskii S.A., Kiskin M.A. et al. // Inorg. Chim. Acta. 2018. V. 477. P. 15.
Hou S., Tang X.-Y., Li Y. et al. // J. Mol. Struct. 2018. V. 1167. P. 239.
Nesterov D.S., Nesterova O.V., Pombeiro A.J.L. // Coord. Chem. Rev. 2018. V. 355. P. 199.
Wei L.-Q., Ye B.-H. // Inorg. Chem. 2019. V. 58. P. 4385.
Kuhn P.-S., Cremer L., Gavriluta A. et al. // Chem. Eur. J. 2015. V. 21. P. 13703.
Shi F.-N., Pinto M.L., Ananias D., Rocha J. // Micropor. Mesopor. Mat. 2014. V. 188. P. 172.
Ding Y.-J., Li T., Hong X.-J. et al. // CrystEngComm. 2015. V. 17. P. 3945.
Sapianik A.A., Zorina-Tikhonova E.N., Kiskin M.A. et al. // Inorg. Chem. 2017. V. 56. P. 1599.
Zou J., Li L., You S. et al. // Dalton Trans. 2017. V. 46. P. 16432.
Feng X., Feng Y., Guo N. et al. // Inorg. Chem. 2017. V. 56. P. 1713.
Sapchenko S.A., Demakov P.A., Samsonenko D.G. et al. // Chem. Eur. J. 2017. V. 23. P. 2286.
Zhao S., Hao X.-M., Liu J.-L. et al. // J. Solid State Chem. 2017. V. 255. P. 76.
Litvinova Yu.M., Gayfulin Y.M., Kovalenko K.A. et al. // Inorg. Chem. 2018. V. 57. P. 2072.
Bolotov V.A., Kovalenko K.A., Samsonenko D.G. et al. // Inorg. Chem. 2018. V. 57. P. 5074.
Dobrokhotova Zh.V., Gogoleva N.V., Zorina-Tikhonova E.N. et al. // Eur. J. Inorg. Chem. 2015. P. 3116.
Gogoleva N.V., Zorina-Tikhonova E.N., Bogomyakov A.S. et al. // Eur. J. Inorg. Chem. 2017. P. 547.
Бажина Е.С., Гоголева Н.В., Зорина-Тихонова Е.Н. и др. // Журн. структур. химии. 2019. Т. 6. № 6. С. 893.
Bazhina E.S., Aleksandrov G.G., Bogomyakov A.S. et al. // Polyhedron. 2014. V. 77. P. 47.
Бажина Е.С., Александров Г.Г., Кискин М.А. и др. // Коорд. химия. 2017. Т. 43. № 11. С. 641. https://doi.org/10.7868/S0132344X17110019
Gogoleva N.V., Zorina-Tikhonova E.N., Bogomyakov A.S. et al. // Eur. J. Inorg. Chem. 2017. P. 547.
Заузолкова Н.В., Зорина Е.Н., Сидоров А.А. и др. // Изв. АН. Сер. хим. 2012. № 7. С. 1404.
Накамото К. Инфракрасные спектры неорганических и координационных соединений. М.: Мир, 1966. 411 с.
Беллами Л. Инфракрасные спектры сложных молекул. М.: Изд-во ИЛ, 1963. 590 с.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS, Inc., 1997.
Sheldrik G.M. SADABS. Program for Scanning and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 2004.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Бажина Е.С., Александров Г.Г., Сидоров А.А., Еременко И.Л. // Коорд. химия. 2015. Т. 41. № 11. С. 657. https://doi.org/10.7868/S0132344X15110018
Бажина Е.С., Александров Г.Г., Кискин М.А. и др. // Изв. АН. Сер. хим. 2014. № 7. С. 1475.
Бажина Е.С., Никифорова М.Е., Александров Г.Г. и др. // Изв. АН. Сер. хим. 2011. № 5. С. 779.
Бажина Е.С., Александров Г.Г., Ефимов Н.Н. и др. // Изв. АН. Сер. хим. 2013. № 4. С. 962.
Бажина Е.С., Александров Г.Г., Кискин М.А. и др. // Изв. АН. Сер. хим. 2016. № 1. С. 249.
Bazhina E.S., Gogoleva N.V., Aleksandrov G.G. et al. // Chem. Select. 2018. P. 13765.
Bazhina E.S., Aleksandrov G.G., Kiskin M.A. et al. // Eur. J. Inorg. Chem. 2018. P. 5075.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия