Координационная химия, 2020, T. 46, № 5, стр. 264-269
Супрамолекулярный полибромид-бромоанимонат(V) (2,6-BrPyH)3[SbBr6]{(Br2)Br} · 2H2O: особенности контактов галоген···галоген в кристаллической структуре
М. А. Бондаренко 1, С. А. Адонин 1, 2, 3, 4, *, А. С. Новиков 5, М. Н. Соколов 1, 4, В. П. Федин 1, 4
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
2 Тюменский индустриальный университет, Тобольский индустриальный институт
Тобольск, Россия
3 Южно-Уральский государственный университет
Челябинск, Россия
4 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
5 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: adonin@niic.nsc.ru
Поступила в редакцию 01.11.2019
После доработки 15.11.2019
Принята к публикации 26.11.2019
Аннотация
Реакцией раствора Sb2O3 в HBr в присутствии Br2 c раствором 2,6-дибромпиридина (2,6-BrPy) в HBr получен супрамолекулярный полибромид-бромоантимонат (2,6-BrPy)3[SbBr6]{(Br2)Br} · 2H2O (I). Cтруктура I определена методом РСА (СIF file CCDC № 1962867). Энергии нековалентных взаимодействий Br···Br в твердом теле оценены с помощью квантовохимических расчетов.
Растущий интерес к химии галогенидных комплексов p-элементов (Pb, Sb, Bi и др.) [1–3] в значительной степени связан с возможностью их использования в качестве компонентов солнечных батарей так называемого перовскитного типа [4–10]. Недавно мы показали, что бромоантимонаты(V) также могут выступать в этой роли; КПД первых модельных устройств на основе (1-EtPy)[SbBr6] достигает 4% [11]. Бромидные комплексы Sb(V) можно получить по общей схеме: [SbIIIBr6]3– + Br2 + CatBrx + + HBr (Cat = органический катион). Следует отметить, однако, что разнообразие продуктов таких реакций не ограничивается лишь моноядерными Cat[SbVBr6]. Фактором, предопределяющим строение и состав образующихся соединений, является природа катиона, соль которого используется в синтезе [12, 13]. При этом могут реализовываться различные варианты: Sb(III) может претерпевать полное либо частичное окисление до Sb(V). Одновременно с этим в структуру комплекса могут входить либо не входить полибромидные фрагменты, как правило, образующие галогенные связи (ГС) [14–16] с бромоантимонат(V)-анионами в твердом теле, что ведет к одно-, двух- либо трехмерным супрамолекулярным ассоциатам [17–20]. Ранее мы показали [12], что при использовании в качестве реагентов бромидных солей замещенных производных пиридиния (Py) по вышеуказанной схеме можно получить комплексы, содержащие до 11 атомов Br на олин атом Sb. Для галогензамещенных Py мы отметили также [12, 21], что в ряде случаев в кристаллической упаковке реализуются нековалентные контакты галоген···галоген с участием катионов. В продолжение данной серии экспериментов с использованием 2,6-дибромпиридина в качестве прекурсора мы получили полибромид-бромоантимонат (2,6-BrPyH)3[SbBr6]{(Br2)Br} · 2H2O (I), строение которого определено методом РСА. Энергии нековалентных взаимодействий Br···Br в структуре I оценены с помощью квантовохимических расчетов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез проводили на воздухе. Исходные реагенты получали из коммерческих источников. Работа с растворами Br2 требует обязательного соблюдения мер предосторожности. В синтезе использовали концентрированную HBr (“х. ч.”).
Синтез (2,6-BrPyH)3[SbBr6]{(Br2)Br} · 2H2O (I). 37 мг (0,13 ммоль) Sb2O3 растворяли в 3 мл HBr и добавляли последовательно: 1.5 мл 1 М раствора Br2 в HBr, раствор 60 мг (0.25 ммоль) 2,6-дибромпиридина в 1 мл HBr. Смесь выдерживали в течение 1 сут при охлаждении (6°С); образуются вишнево-черные кристаллы I. Выход 76%.
РСА I выполнен при 130 K на автоматическом дифрактометре Agilent Xcalibur, оснащенном двухкоординатным детектором Atlas S2 (графитовый монохроматор, λ(MoKα) = 0.71073 Å, ω-сканирование). Интегрирование, учет поглощения, определение параметров элементарной ячейки проведен с использованием пакета программ CrysAlisPro. Кристаллические структуры расшифрованы по программе SHELXT и уточнены полноматричным МНК в анизотропном (за исключением атомов водорода) приближении с использованием программы SHELXL [22]. Позиции атомов водорода органических лигандов рассчитаны геометрически и уточнены по модели “наездника”. Кристаллографические данные и детали дифракционных экспериментов приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структуры I
| Параметр | Значение |
|---|---|
| Брутто-формула | C15H16N3O2Br21Sb2 |
| M | 2191.92 |
| Сингония | Моноклинная |
| Пр. гр. | C2/c |
| a, Å | 32.8242(9) |
| b, Å | 9.6155(2) |
| c, Å | 14.7877(4) |
| β, град | 101.732(3) |
| V, Å3 | 4569.8(2) |
| Z | 4 |
| ρ(выч.), г/см3 | 3.186 |
| μ, мм−1 | 19.57 |
| F(000) | 3920 |
| Размер кристалла, мм | 0.41 × 0.34 × 0.32 |
| Область сканирования по θ, град | 29.0–3.3 |
| Диапазон индексов hkl | –32 ≤ h ≤ 44, –13 ≤ k ≤ 12, –19 ≤ l ≤ 20 |
| Число измеренных /независимых отражений | 16 416/5262 |
| Rint | 0.039 |
| Число отражений с I > 2σ(I) | 4480 |
| R (F 2 > 2σ(F 2)), wR (F 2), S | 0.034, 0.080, 1.06 |
| Δρmax/ρmin, e Å−3 | 1.46/–1.73 |
Полные таблицы межатомных расстояний и валентных углов, координаты атомов и параметры атомных смещений депонированы в Кембриджском банке структурных данных (CCDC № 1962867; https:// www.ccdc.cam.ac.uk/structures/).
Квантовохимические расчеты выполнены в рамках теории функционала плотности (M06/DZP-DKH) [23–25] с помощью программного пакета Gaussian-09.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как отмечалось выше, состав и строение комплексов, полученных по общей схеме [SbIIIBr6]3– + + Br2 + CatBrx + HBr, предопределяется природой CatBrx. Первые работы, посвященные структурной характеризации продуктов таких реакций, были опубликованы в конце 1960-х – начале 1970-х гг. [18–20, 26, 27], впоследствии мы описали еще более 20 соединений [12, 21, 28].
Координационное окружение Sb в анионах [SbVBr6]– в I представляет собой слегка искаженный октаэдр; длины связей Sb–Br типичны для бромоантимонатов(V) (2.527–2.563 Å). В структуре присутствуют дибром-фрагменты (Br–Br 2.377 Å), связываемые между собой бромид-анионами (Br(35)···Br(34) 2.956 Å, обозначения атомов Br здесь и далее см. табл. 2) в бесконечные полимерные цепочки $\{ ({\text{B}}{{{\text{r}}}_{{\text{2}}}}){\text{Br}}\} _{n}^{{n--}};$ подобные структурные мотивы были описаны ранее для полибромидных солей ряда органических катионов [29]. Необычная особенность I – присутствие сольватных молекул H2O (две на формульную единицу).
Таблица 2.
Значения электронной плотности ρ(r), лапласиана электронной плотности ∇2ρ(r), суммарной плотности энергии (Hb), плотности потенциальной энергии (V(r)) и лагранжиана кинетической энергии (G(r)) (атомные единицы) в критических точках связей (3, –1), соответствующих нековалентным взаимодействиям Br···Br в кристалле BM107_a, длины данных контактов (l, Å) и их энергии (E, ккал/моль), оцененные с помощью различных предложенных в литературе корреляций
| Супрамолекулярный контакта | ρ(r) | ∇2ρ(r) | Hb | V(r) | G(r) | E б | E в | E г | E д | l е |
|---|---|---|---|---|---|---|---|---|---|---|
| Br(5)···Br(32) (тип 1) | 0.011 | 0.027 | 0.000 | –0.006 | 0.006 | 1.9 | 1.6 | 2.2 | 2.1 | 3.453 |
| Br(4)···Br(14) (тип 1) | 0.010 | 0.023 | 0.000 | –0.005 | 0.006 | 1.6 | 1.6 | 1.8 | 2.1 | 3.582 |
| Br(35)···Br(34) (тип 2) | 0.028 | 0.061 | 0.000 | –0.015 | 0.015 | 4.7 | 4.0 | 5.5 | 5.4 | 2.956 |
| Br(15)···Br(34) (тип 2) | 0.007 | 0.019 | 0.000 | –0.004 | 0.004 | 1.3 | 1.1 | 1.5 | 1.4 | 3.369 |
| Br(18)···Br(5) (тип 2) | 0.009 | 0.026 | 0.001 | –0.005 | 0.006 | 1.6 | 1.6 | 1.8 | 2.1 | 3.504 |
а Классификация супрамолекулярных контактов с участием атомов галогенов по типам подробно обсуждается в [14]. б E = –V(r)/2 (корреляция разработана для оценки энергии водородных связей) [41]. в E = 0.429G(r) (корреляция разработана для оценки энергии водородных связей) [42]. г E = 0.58(−V(r)) (корреляция разработана специально для оценки энергии нековалентных взаимодействий с участием атомов брома) [43]. д E = 0.57G(r) (корреляция разработана специально для оценки энергии нековалентных взаимодействий с участием атомов брома) [43]. е Наименьший ван-дер-ваальсов радиус для атома брома равен 1.83 Å [44].
Система нековалентных взаимодействий Br···Br в структуре I весьма сложна. Это обусловлено тем, что в ее образовании участвуют атомы брома, принадлежащие и [SbVBr6]–, и $\{ ({\text{B}}{{{\text{r}}}_{{\text{2}}}}){\text{Br}}\} _{n}^{{n--}},$ и 2,6-дибромпиридиниевым катионам. Каждый из бромоантимонат(V)-анионов взаимодействует с тремя соседними (Br···Br 3.453–3.582, Br(5)···Br(32) и Br(4)···Br(14) Å – контакты типа 1), а также с одним 2,6-BrPyH+ (Br···Br 3.504 Å (Br(18)···Br(5), тип 2)). В свою очередь, 2,6-BrPyH+ образует контакты с бромид-анионом в составе цепочек $\{ ({\text{B}}{{{\text{r}}}_{{\text{2}}}}){\text{Br}}\} _{n}^{{n--}}$ (Br···Br 3.369 Å (Br(15)···Br(34), тип 2)); в совокупности все взаимодействия Br···Br ведут к формированию трехмерной структуры (рис. 1–3).
Рис. 1.
Упаковка катионов и анионов в структуре I. Катионы отображены в модели “wire-and-stick”, анионы [SbBr6]– – в виде полиэдров.
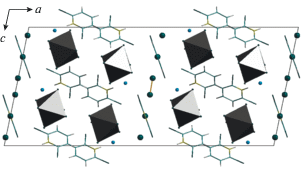
Рис. 2.
Контакты Br···Br (показаны пунктиром) между бромидными лигандами анионов [SbBr6]– (отображены в виде полиэдров) в структуре I.
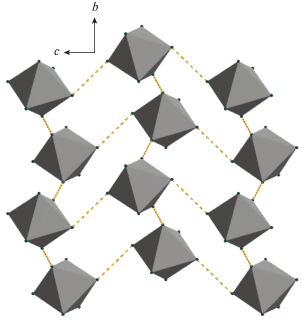
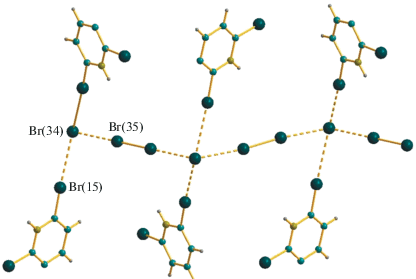
Рис. 3.
Контакты Br···Br (показаны пунктиром) между полибромидными фрагментами $\{ ({\text{B}}{{{\text{r}}}_{{\text{2}}}}){\text{Br}}\} _{n}^{{n--}}$ и катионами 2,6-BrPyH+ в структуре I.
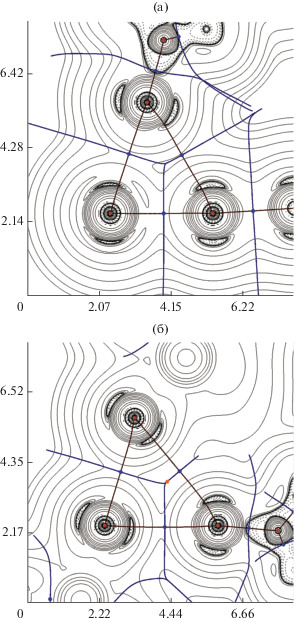
Для оценки энергий вышеупомянутых контактов были проведены квантовохимические расчеты (детали см. выше) и топологический анализ распределения электронной плотности по методу QTAIM [30] (данный подход широко применяется для изучения свойств нековалентных взаимодействий различных типов [31–38]). Результаты представлены в табл. 2, диаграммы контурных линий распределения лапласиана электронной плотности ∇2ρ(r), связевые пути и поверхности нулевого потока, соответствующие различным нековалентным взаимодействиям Br···Br в кристалле I, представлены на рис. 4. Значения электронной плотности, лапласиана электронной плотности, суммарной плотности энергии, плотности потенциальной энергии и лагранжиана кинетической энергии в критических точках связей (3, –1), соответствующих нековалентным взаимодействиям Br···Br в кристалле I, вполне типичны для такого рода супрамолекулярных контактов с участием атомов галогенов [39, 40]. Оценочные значения энергии нековалентных взаимодействий Br···Br в кристалле I варьируют в диапазоне 1.1–5.5 ккал/моль в зависимости от типа контакта и могут различаться (до 0.5 ккал/моль, см. табл. 2) в зависимости от способа оценки. Однако заметим, что энергии контактов Br···Br между различными фрагментами сопоставимы, и это согласуется с наблюдениями, сделанными нами ранее [28].
Рис. 4.
Диаграммы контурных линий распределения лапласиана электронной плотности ∇2ρ(r), связевые пути и поверхности нулевого потока, соответствующие нековалентным взаимодействиям Br(35)···Br(34) и Br(15)···Br(34) (а); Br(5)...Br(32) и Br(18)···Br(5) (б) в кристалле I. Критические точки связей (3, –1) показаны синим цветом, критические точки ядер (3, –3) – светло-коричневым цветом, критические точки цикла (3, +1) – оранжевым цветом. Единицы измерения длины – Å.
Соотношение плотности потенциальной энергии и лагранжиана кинетической энергии в критических точках связей (3, –1), соответствующих нековалентным взаимодействиям Br···Br в кристалле I, свидетельствует об отсутствии существенной доли ковалентной компоненты в данных супрамолекулярных контактах.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Buikin P.A., Rudenko A.Y., Baranchikov A.E. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 373. https://doi.org/10.1134/S1070328418060015
Kotov V.Y., Ilyukhin A.B., Simonenko N.P. et al. // Polyhedron. 2017. V. 137. P. 122.
Sharutin V.V., Sharutina O.K., Khisamov R.M. et al. // Russ. J. Inorg. Chem. 2017. V. 62. P. 766. https://doi.org/10.1134/S0036023617060201
Frolova L.A., Dremova N.N.,Troshin P.A. // Chem. Commun. 2015. V. 51. P. 14917.
Park B.-W., Philippe B., Zhang X. et al. // Adv. Mater. 2015. V. 27. P. 6806.
Ganose A.M., Savory C.N., Scanlon D.O. // Chem. Commun. 2017. V. 53. P. 20.
Frolova L.A., Anokhin D.V., Piryazev A.A. et al. // J. Phys. Chem. Lett. 2017. V. 8. P. 1651.
Frolova L.A., Anokhin D.V., Piryazev A.A. et al. // J. Phys. Chem. Lett. 2017. V. 8. P. 672.
Shestimerova T.A., Golubev N.A., Yelavik N.A. et al. // Cryst. Growth Des. 2018. V. 18. P. 2572.
Shestimerova T.A., Yelavik N.A., Mironov A.V. et al. // Inorg. Chem. 2018. V. 57. P. 4077.
Adonin S.A., Frolova L.A., Sokolov M.N. et al. // Adv. Energy Mater. 2018. V. 8. P. 1701140.
Adonin S.A., Bondarenko M.A., Novikov A.S. et al. // CrystEngComm. 2019. V. 21. P. 850.
Adonin S.A., Bondarenko M.A., Abramov P.A. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 128. https://doi.org/10.1134/S1070328419020027
Cavallo G., Metrangolo P., Milani R. et al. // Chem. Rev. 2016. V. 116. P. 2478.
Torubaev Y.V., Rai D., Skabitsky I.V. et al. // New J. Chem. 2019. V. 43. P. 7941.
Torubaev Y.V., Skabitskiy I.V., Rusina P. et al. // Cr-ystEngComm. 2018. V. 20. P. 2258.
Hubbard C.R., Jacobson R.A. // Inorg. Chem. 1972. V. 11. P. 2247.
Lawton S.L., McAfee E.R., Benson J.E. et al. // Inorg. Chem. 1973. V. 12. P. 2939.
Lawton S.L., Jacobson R.A. // Inorg. Chem. 1968. V. 7. P. 2124.
Lawton S.L., Jacobson R.A. // Inorg. Chem. 1971. V. 10. P. 709.
Adonin S.A., Bondarenko M.A., Samsonenko D.G. et al. // J. Mol. Struct. 2018. V. 1160. P. 102.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Zhao Y., Truhlar D.G. // Theor. Chem. Acc. 2008. V. 120. P. 215.
Barros C.L., de Oliveira P.J.P., Jorge F.E. et al. // Mol. Phys. 2010. V. 108. P. 1965.
Canal Neto A., Jorge F.E. // Chem. Phys. Lett. 2013. V. 582. P. 158.
Lawton S.L., Hoh D.M., Johnson R.C. et al. // Inorg. Chem. 1973. V. 12. P. 277.
Lawton S.L., Jacobson R.A., Frye R.S. // Inorg. Chem. 1971. V. 10. P. 701.
Adonin S.A., Bondarenko M.A., Abramov P.A. et al. // Chem. Eur. J. 2018. V. 24. P. 10165.
Haller H., Riedel S. // Z. Anorg. Allg. Chem. 2014. V. 640. P. 1281.
Bader R.F.W. // Chem. Rev. 1991. V. 1. P. 893.
Andrusenko E.V., Novikov A.S., Starova G.L. et al. // Inorg. Chim. Acta. 2016. V. 447. P. 142.
Novikov A.S., Ivanov D.M., Bikbaeva Z.M. et al. // Cryst. Growth Des. 2018. V. 18. P. 7641.
Kinzhalov M.A., Kashina M.V., Mikherdov A.S. et al. // Angew. Chem. Int. Ed. 2018. V. 7. P. 12785.
Bulatova M., Melekhova A.A., Novikov A.S. et al. // Z. Krist. Cryst. Mater. 2018. V. 33. P. 371.
Il’in M. V., Bolotin D.S., Novikov A.S. et al. // Inorg. Chim. Acta. 2019. V. 490. P. 267.
Burianova V.K., Bolotin D.S., Mikherdov A.S. et al. // New J. Chem. 2018. V. 42. P. 8693.
Ding X., Tuikka M.J., Hirva P. et al. // CrystEngComm. 2016. V. 18. P. 1987.
Mikherdov A.S., Kinzhalov M. A., Novikov A. S. et al. // J. Am. Chem. Soc. 2016. V. 138. P. 14129.
Adonin S.A., Gorokh I.D., Novikov A.S. et al. // Cry-stEngComm. 2018. V. 20. P. 7766.
Usoltsev A.N., Adonin S.A., Novikov A.S. et al. // Cr-ystEngComm. 2017. V. 19. P. 5934.
Espinosa E., Molins E., Lecomte C. // Chem. Phys. Lett. 1998. V. 285. P. 170.
Vener M. V., Egorova A. N., Churakov A. V. et al. // J. Comput. Chem. 2012. V. 33. P. 2303.
Bartashevich E.V., Tsirelson V.G. // Russ. Chem. Rev. 2014. V. 83. P. 1181.
Bondi A. // J. Phys. Chem. 1966. V. 70. P. 3006.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


