Координационная химия, 2020, T. 46, № 5, стр. 270-279
Синтез и структурное разнообразие трифенилацетатных комплексов лантана и неодима с триметилтриазациклогексаном и краун-эфиром
А. А. Виноградов 1, К. А. Лысенко 2, 3, *, И. В. Ананьев 2, 4, И. Э. Нифантьев 1, 3, Д. М. Ройтерштейн 1, 4, 5, **
1 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
5 Институт органической химии им. Н.Д. Зелинского РАН
Москва, Россия
* E-mail: kostya@xray.ineos.ac.ru
** E-mail: roiter@yandex.ru
Поступила в редакцию 01.12.2019
После доработки 24.12.2019
Принята к публикации 27.12.2019
Аннотация
Взаимодействие трифенилацетатов лантана и неодима с полидентатными 6- и 18-членными N- и O-гетероциклическими лигандами приводит к образованию различных типов трифенилацетатных моноядерных комплексов, содержащих вспомогательный полидентатный лиганд (нейтральныx либо катионныx и анионныx): [Nd(Ph3CCOO)3(Me3TACH)] ∙ CHCl3 (II), [La(Ph3CCOO)4(Me3TACH)]–-[NH4Me]+ (III), [La(Ph3CCOO)3(18-краун-6)] (IV), [Nd(Ph3CCOO)2(18-краун-6)]+[Nd(Ph3CCOO)4]– (V), а также биядерного [La2(Ph3CCOO)3(Me3TACH)] ∙ 2С6H5СH3 (I) (CIF files CCDC № 1968815 (I), 1968813 (II), 1968814 (III), 1968812 (IV), 1968816 (V)). Минимальное изменение ионного радиуса на примере перехода от La к Nd приводит к изменению характера координационного окружения. Макроциклические полидентатные лиганды позволяют проследить за такими изменениями.
Координационные соединения лантанидов весьма привлекательны для разработки новых люминесцентных и магнитных материалов, они находят применение как контрастные реагенты в магниторезонансной томографии, оптической визуализации клеток [1, 2].
Все лантаниды имеют сходные химические свойства вследствие близких значений ионных радиусов, изменение которых составляет лишь 15% при движении от начала к концу ряда 4f-элементов. Тем не менее в последние 10–12 лет в литературе встречаются упоминания о проявлениях различных химических свойств даже для лантанидов, находящихся вблизи друг от друга в 4f-ряду [3–5].
В связи с этим интересно обнаружить примеры химического поведения, приводящие к образованию координационных соединений различного типа для лантанидов с близким ионным радиусом. Такое явление должно быть обусловлено скорее различием электронной конфигурации ионов РЗЭ, нежели небольшими изменениями радиусов катионов Ln3+. Однако выбор лигандов, способных приводить к образованию таких соединений и тем самым демонстрировать искомые различия, не очевиден.
Мы предположили, что насыщенные азот- и кислородсодержащие гетероциклические соединения, содержащие от трех до шести гетероатомов в цикле, могут оказаться удачным примером полидентатных лигандов, позволяющих реализовать разные способы координации ионов РЗЭ и выявить отличия в строении комплексов лантанидов, обычно демонстрирующих сходный тип структурной организации.
В настоящей работе мы сообщаем о получении трифенилацетатных комплексов лантана и неодима с 1,3,5-триметил-1,3,5-триазациклогексаном (Me3TACH) и краун-эфиром (18-краун-6), в которых реализуется принципиально различное координационное окружение катионов лантана и неодима для одинакового набора лигандов в комплексе. Выбор 6- и 18-членных гетероциклических лигандов обусловлен их неодинаковой конформационной подвижностью: структурной жесткостью Me3TACH и конформационной лабильностью 18-crown-6, позволяющей наблюдать обсуждаемые структурные различия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все эксперименты проводили в атмосфере аргона с использованием сосудов Шленка и аргон-вакуумной линии. Аргон очищали путем пропускания через колонку с молекулярными ситами (4 Å), пропитанными Na/K-эвтектикой (10% по массе), и колонку со слюдой с нанесенным оксидом Mn(II). Трифенилацетаты лантана и неодима синтезировали по методике [6]. 1,3,5-Триметил-1,3,5-триазациклогексан (Aldrich) перегоняли над гидридом кальция, дегазировали и хранили над молекулярными ситами (4 Å). Органические растворители перегоняли в атмосфере аргона, 18-краун-6 (Aldrich) высушивали в динамическом вакууме перед использованием. Гексан перегоняли над Na/K-эвтектикой, толуол – над металлическим натрием, хлороформ – над гидридом кальция. Элементный анализ проводили на анализаторе PerkinElmer 2400 Series II. Анализ на лантанид выполняли прямым комплексонометрическим титрованием с индикатором ксиленоловым оранжевым.
Синтез [La2(Ph3CCOO)6(Me3TACH)] ∙ С6H5СH3 (I). К раствору 1.39 г (1.140 ммоль) [La(Ph3CCOO)3 -(THF)3] в 20 мл абсолютного толуола при перемешивании добавляли раствор Me3TACH в толуоле (1.74 мл, 0.325 М, 0.57 ммоль). Реакционную смесь перемешивали 2 ч, затем упаривали до 5 мл и добавляли 20 мл гексана. Осадок отделяли от раствора и высушивали в вакууме. Выход I 10.200 г (92%).
| Найдено, %: | C 71.51; | H 5.65; | N 1.81; | La 12.25. |
| Для C133H113N3O12La2 | ||||
| вычислено, %: | C 71.85; | H 5.12; | N 1.89; | La 12.50. |
Пригодные для РСА кристаллы получали в результате медленной диффузии гексана в раствор I в толуоле. Монокристалл образцa I содержит три сольватные молекулы толуола в расчете на одну формульную единицу. При высушивании в вакууме теряется две сольватныe молекулы толуола.
Синтез [Nd(Ph3CCOO)3(Me3TACH)] ∙ CHCl3 (II). К раствору 0.83 г (0.679 ммоль) [Nd(Ph3CCOO)3-(THF)3] в 3 мл хлороформа при перемешивании прибавляли раствор Me3TACH в хлороформе (4.35 мл, 0.164 M, 0.713 ммоль), перемешивали в течение часа, затем осторожно добавляли 25 мл гексана, избегая перемешивания. Через неделю в сосуде Шленка образовались голубые кристаллы. Выход II 0.520 г (61%).
| Найдено, %: | C 64.17; | H 5.07; | N 3.13; | Nd 11.49. |
| Для C67H61N3O6Cl3Nd | ||||
| вычислено, %: | C 64.13; | H 4.90; | N 3.35; | Nd 11.50. |
Монокристалл образцa II содержит одну сольватную молекулу гексана и одну сольватную молекулу хлороформа в расчете на одну формульную единицу. При высушивании в вакууме молекула гексана теряется.
Синтез [La(Ph3CCOO)3(18-краун-6)] (IV). К раствору 0.255 г (0.209 ммоль) [La(Ph3CCOO)3-(THF)3] в 5 мл абсолютного толуола аккуратно добавляли раствор 6.62 мг (0.234 ммоль) 18-краун-6 в 10 мл толуола так, чтобы образовалось два слоя. Через 3 cут. в сосуде Шленка образовались бесцветные кристаллы. Сосуд Шленка выдерживали в течение суток при –12°C. Кристаллы отделяли от раствора декантацией и высушивали в вакууме. Выход IV 0.230 г (87%).
Монокристалл образцa IV содержит сольватные молекулы толуола. При высушивании в вакууме они теряются.
Синтез [Nd(Ph3CCOO)2(18-краун-6)]+-[Nd(Ph3CCOO)4]– (V). К раствору 3.492 г (2.858 ммоль) [Nd(Ph3CCOO)3THF3] в 50 мл толуола добавляли раствор 0.400 г (1.515 ммоль) 18-краун-6 в 10 мл толуола. Наблюдали выпадение бледно-голубого осадка. Реакционную смесь перемешивали 6 ч. Осадок в виде голубых кристаллов отфильтровывали и высушивали в вакууме. Выход V 3.227 г (99%).
Пригодные для РСА кристаллы V получали в результате медленной диффузии раствора 18-краун-6 в раствор [Nd(Ph3CCOO)3(THF)3] в хлороформе.
РСА I–V проведен на дифрактометре SMART APEX 2 CCD (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структуры расшифрованы прямым методом и уточнены МНК в анизотропном полноматричном приближении по $F_{{hkl}}^{2}.$ Учет поглощения проведен полуэмпирически по эквивалентным отражениям. При уточнении разупорядоченных фрагментов использовaны ограничения для параметров атомных смещений и позиционных параметров (DFIX и EADP). В кристалле V в одной из пустот локализована сильно разупорядоченная сольватная молекула (возможно, наблюдаемое распределение электронной плотности отвечало суперпозиции CHCl3 и толуола), вклад которой удален из структурных амплитуд при помощи процедуры SQUEEZE [7]. Атомы водорода во всех структурах рассчитаны и уточнены по модели наездника. Все расчеты проведены по комплексу программ SHELXL-2014/2017 [8]. Основные кристаллографические данные и параметры уточнения для соединений I–V приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для соединений I–V
| Параметр | Значение | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| Брутто формула | C147H129N3O12La2 | C73H75N3O6Cl3Nd | C87H81N4O8La | C88.93H88.34O12La | C536H464O72Cl24Nd8 |
| М | 2407.34 | 1340.95 | 1449.46 | 1488.08 | 5030.88 |
| T, K | 100 | 100 | 100 | 100 | 100 |
| Сингония | Триклинная | Моноклинная | Моноклинная | Триклинная | Тетрагональная |
| Пр. гр. | P1 | P21/n | P21/n | P1 | I41/acd |
| Z | 2(1) | 4(1) | 4(1) | 2(1) | |
| a, Å | 14.5772(7) | 8.244(2) | 15.3326(11) | 14.1523(9) | 40.394(6) |
| b, Å | 18.0163(9) | 50.227(15) | 26.8157(19) | 15.3957(10) | 40.394(6) |
| c, Å | 24.1812(12) | 15.742(4) | 17.4929(12) | 18.6036(12) | 30.888(6) |
| α, град | 77.8907(9) | 90 | 90 | 69.8082(11) | 90 |
| β, град | 75.2585(9) | 95.856(10) | 94.489(2) | 87.5567(13) | 90 |
| γ, град | 77.4582(9) | 90 | 90 | 73.4724(12) | 90 |
| V, Å3 | 5914.2(5) | 6484(3) | 7170.2(9) | 3640.2(4) | 50 399(17) |
| ρ(выч.), г см–3 | 1.352 | 1.374 | 1.343 | 1.358 | 1.326 |
| μ, см–1 | 7.78 | 9.79 | 8.31 | 6.52 | 10.05 |
| F(000) | 2484 | 2772 | 3008 | 1550 | 20 576 |
| 2θmax, град | 58 | 58 | 58 | 58 | 52 |
| Число измеренных отражений | 72 493 (0.0413) | 44 111 (0.035) | 88 441 (0.0932) | 43 433 (0.0583) | 151 568 (0.1198) |
| Число независимых отражений | 31 369 | 14 155 | 19 051 | 19 272 | 12 382 |
| Число отражений с I > 2σ(I) | 25 064 | 12 604 | 13 522 | 14 126 | 6191 |
| GOОF | 1.019 | 0.971 | 1.005 | 0.943 | 1.008 |
| Количество уточняемых параметров | 1457 | 796 | 909 | 827 | 600 |
| R, wR2 (I > 2σ(I)) | 0.0301, 0.0690 | 0.0549, 0.1049 | 0.0400, 0.0804 | 0.0543, 0.1365 | 0.0850, 0.1841 |
| R, wR2 (по всем отражениям) | 0.0453, 0.0769 | 0.0652, 0.1091 | 0.0724, 0.0942 | 0.0877, 0.1625 | 0.1739, 0.2250 |
| Остаточная электронная плотность (min/max), e Å–3 | –0.745/1.290 | –1.529/0.784 | –0.885/0.776 | –1.665/1.097 | –0.984/0.875 |
Координаты атомов и другие параметры структур депонированы в Кембриджском банке структурных данных (№ 1968815 (I), 1968813 (II), 1968814 (III), 1968812 (IV), 1968816 (V); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
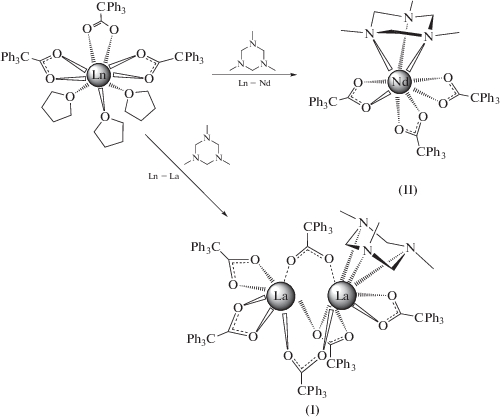
Взаимодействие трифенилацетатов лантана и неодима Me3TACH приводит к образованию биядерного комплекса I в случае лантана и к моноядерному II в случае неодима (схема 1 ). Использование избытка Me3TACH (2 экв.) в реакции с трифенилацетатом лантана не изменило результат реакции.
Схема 1 .
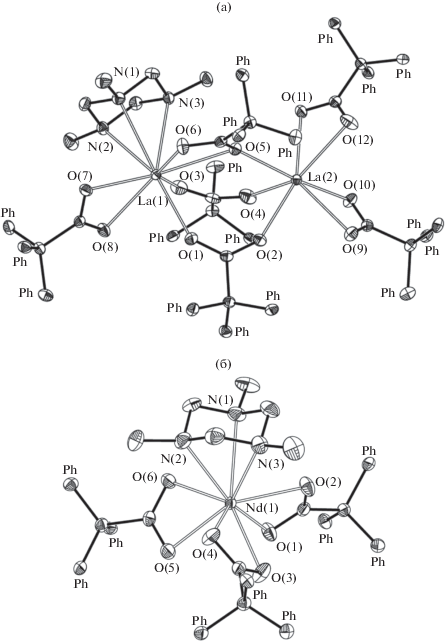
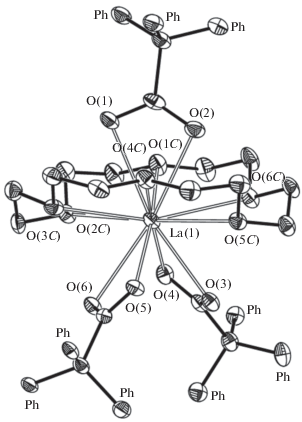
Строение I и II было установлено методом РСА (рис. 1, табл. 2). В биядерном комплексе I только один катион лантана координирован Me3TACH, два катиона металла связаны тремя мостиковыми лигандами Ph3CCOO–, два из которых координируются по типу μ2:κ1-κ1, оставшийся – μ2:κ2-k1. Атом La(1) (КЧ 9) дополнительно координирован одним лигандом κ2-Ph3CCOO– и молекулой Me3TACH по κ3-типу, La(2) (КЧ 7) координирован двумя концевыми лигандами трифенилацетата по κ2-типу. В моноядерном комплексе II центральный атом координирован тремя лигандами карбоксилата по κ2-типу и молекулой Me3TACH по κ3-типу (КЧ(Nd) 9). Расстояния Nd–O (карбоксилатный лиганд) в комплексе II сопоставимы с наблюдающимися в моноядерном трифенилацетатном комплексе [Nd(Ph3CCOO)3(THF)3] [6].
Таблица 2.
Основные параметры структур I–III
| Параметр | I(La(1)) | I(La(2)) | II(Nd) | III(La) |
|---|---|---|---|---|
| Ln−O (κ2-Ph3CCOO) |
2.5084(13)– 2.5289(13) | 2.4618(14)–2.5490(14) | 2.453(3)– 2.505(3) | 2.570(1)–2.692(1) |
| Ln−O (μ2-κ1:κ2-Ph3CCOO) |
2.5179(13), 2.7680(13) | 2.5294(13) | ||
| Ln−O (μ2-κ1:κ1-Ph3CCOO) |
2.4357(14)–2.4793(14) | 2.3781(14), 2.4562(13) | ||
| Ln–N | 2.7435(16)– 2.7580(17) | 2.670(4)–2.692(2) | 2.764(2)–2.880(2) | |
| Ln···Ln | 4.524 | |||
В комплексах I и II координированный Me3TACH находится в конформации кресла, расстояния Ln–N(Me3TACH) сопоставимы с наблюдавшимися в известных ранее комплексах [Pr(CH(AlMe3)3)(Me3TACH)] [3] и [(Sm(AlMe4)2-(изо-Pr3TACH)2] [9].
Можно предположить, что для обоих металлов (Nd и Lа) вначале формируется моноядерный комплекс, который в случае лантана, вследствие большего ионного радиуса, оказывается неустойчивым. Координационная сфера катиона лантана при образовании моноядерного аддукта не насыщена, и дальнейшее взаимодействие с исходным трифенилацетатом лантана приводит к формированию биядерного комплекса. По-видимому, другим способом разрушения гипотетического моноядерного комплекса лантана [La(Ph3CCOO)3(Me3TACH)] является его гидролиз под действием следов воды в растворителе. Процесс гидролиза затрагивает координированный триазациклогексановый лиганд и приводит к образованию соединения III. Очевидно, что образование катиона метиламмония происходит вследствие протонирования метиламина, образующегося при гидролизе Me3TACH. Из растворов I в толуоле выделено несколько кристаллов III, пригодных для РСА (рис. 2).
Рис. 2.
Общий вид комплекса III. Представлено только одно из положений катиона ${\text{C}}{{{\text{H}}}_{3}}{\text{NH}}_{3}^{ + }.$ Атомы водорода и атомы углерода фенильных заместителей не показаны.
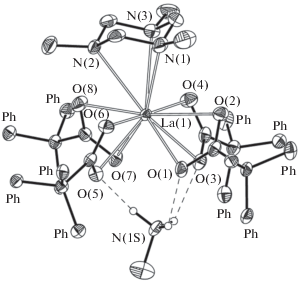
Комплекс III представляет собой моноядерный ate-комплекс, в котором катион лантана координирован четырьмя концевыми трифенилацетатными лигандами и одной молекулой Me3TACH. Расстояния Ln–O (κ2-Ph3CCOO) и Ln–N (Me3TACH) превышают таковые в I в среднем на 0.12 и 0.07 Å соответственно (табл. 2). Такое увеличение расстояний связано с изменением КЧ(La3+) в III до 11. Выступающий в качестве противоиона [NH3Me]+ образует водородные связи с атомами кислорода карбоксилатных лигандов. Принимая во внимание, что Ln-cодержащий анион (акцептор протона) имеет приближенную C4-симметрию, а катионный фрагмент CH3N${\text{H}}_{3}^{ + }$ (донор протона) – С3-симметрию, в кристалле наблюдается разупорядочение катиона аммония по двум положениям, которые образуют связи NH···O 2.67–2.85 Å. Образование подобного трифторметансульфонатного ate-комплекса [Pr2(CF3SO3)7(Et3TACH)2]–[EtNH3]+, выделенного в качестве минорного продукта при синтезе [Pr(CF3SO3)3(Et3TACH)], приведено в [10].
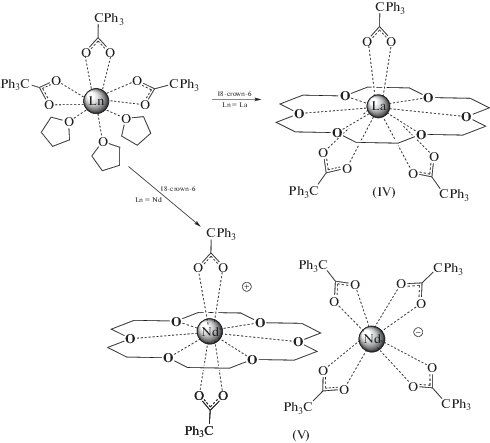
Реакция трифенилацетатов лантана и неодима с 18-краун-6, в молекуле которого размер цикла значительно больше, чем у триметилтриазациклогексана, также оказалась чувствительной к ионному радиусу применяемого лантанида. Взаимодействие 18-краун-6 с трифенилацетатами лантана или неодима приводит к образованию комплексов IV и V, нерастворимых в толуоле (схема 2 ). В случае лантана образуется соединениe IV (мольное соотношение металл : лиганд = 1 : 1), для неодима – комплекс V (2 : 1). Использование избытка 18-краун-6 в реакции с трифенилацетатом неодима (до 2.5 экв.) также приводит к образованию V.
Схема 2 .
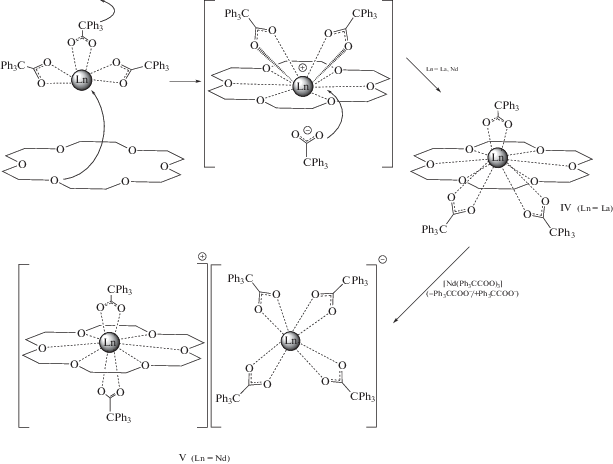
Очевидно, что координация 18-краун-6 с металлом может осуществиться только в результате диссоциации комплекса с отрывом одного карбоксилатного лиганда, поскольку объем трифенилацетатного лиганда не допускает его прохождение сквозь полость краун-эфира (cхема 3). Можно предположить, что первоначально образуется комплекс IV, достаточно устойчивый для La (КЧ 12), имеющего меньший ионный радиус по сравнению с неодимом. Комплекс такого типа оказывается координационно или стерически перегруженным и подвергается метатезису с образованием комплексных катиона [Nd(Ph3CCOO)2(18-краун-6)]+ и аниона [Nd(Ph3CCOO)4]– и в результате комплекса V в виде контактной-ионной пары.
Неожиданным было протекание такого процесса (диссоциации комплекса) в растворе толуола, обладающего низким значением относительной диэлектрической проницаемости (ε = 2.4) [11]. Обычно комплексы с краун-эфирами получают в средах с высокой диэлектрической проницаемостью. Например, известный ранее [Eu(NO3)2(дициклогексил-18-краун-6)2]2[Eu(NO3)5] был получен в этаноле [12], [LaCl3(18-краун-6)] и [Ln(NO3)3(18-краун-6)] (Ln = Ce, Pr, Nd) в смеси ацетонитрил–метанол [13–15].
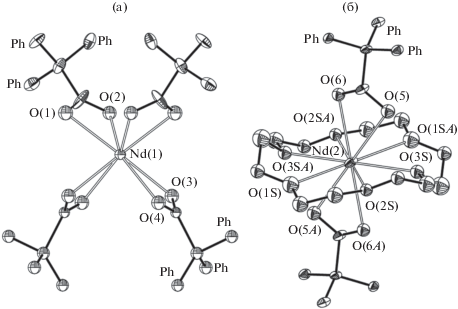
Строение IV и V установлено методом РСА. Комплекс лантана IV построен в виде моноядерного комплекса, трифенилацетатные лиганды находятся над и под циклом краун-эфира, центральный катион лантана координирован тремя лигандами Ph3CCOO– по κ2-типу и 18-краун-6 по κ6-типу (рис. 3, табл. 3). Расстояние от La до одного из трифенилацетатных лигандов заметно больше, чем до двух других, и расстояния La–O (18-краун-6) находятся в диапазоне 2.596(2)–2.781(2) Å (табл. 3). Строение комплекса IV подобно таковому [La(NO3)3(18-краун-6)] [16], однако в последнем расстояния ${\text{Ln}}{\kern 1pt} - {\kern 1pt} {\text{O(NO}}_{3}^{ - })$ одинаковы, а Ln–O(18-краун-6) находятся в диапазоне (2.662–2.780 Å). Очевидно, что эти различия связаны с отталкиванием фенильных групп трифенилацетатных и макроциклического лигандов.
Схема 3 .
Таблица 3.
Основные параметры структур IV и V
| Параметр | IV (La) | Va (Nd(1))* | Vb (Nd(2))* |
|---|---|---|---|
| Ln−O (κ2-Ph3CCOO) |
2.596(2)–2.781(2) | 2.43(1)–2.46(1) | 2.34(1)–2.47(1) |
| Ln–O (18-краун-6) | 2.6783(2)–2.873(2) | 2.598(6)–2.693(6) | 2.51(1)–2.80(1) |
| Ln···Ln | 7.789 | ||
| КЧ(Ln3+) | 12 | 10 | 8 |
Комплекс V построен как контактная ионная пара (рис. 4). Анионный фрагмент [Nd(Ph3CCOO)4]– характеризуется симметрией С2 и имеет форму сильно уплощенного тетраэдра (диэдральный угол 36), в вершинах которого расположены κ2-координированные лиганды Ph3CCOO–. В центросимметричном фрагменте V катион Nd координирован двумя лигандами κ2-Ph3CCOO–, а также 18-краун-6. Расстояния Nd–O(карбоксилатный лиганд) (табл. 3) сопоставимы с наблюдаемыми в [Nd(Ph3CCOO)3(THF)3] [6].
Интересно было сравнить конформацию макроцикла 18-краун-6 IV и V. Так, в комплексе V конформация 18-краун-6 близка к наблюдаемой в нитратном комплексе [Nd(NO3)2(18-краун-6)$]_{3}^{ + }$-[Nd(NO3)6]3– [14] и существенным образом отличается от наблюдаемой в IV. Атомы кислорода краун-эфира в комплексе V образуют почти плоский шестичленный цикл, максимальный выход атома кислорода крауна-эфира из плоскости составляет 0.05 Å. В IV расположение атомов кислорода краун-эфира напоминает конформацию чаши. По-видимому, искажение структуры 18-краун-6 связано с большим стерическим напряжением, возникающим в IV по сравнению с V, и обусловлено расположением двух трифенилацетатных лигандов по одну сторону макроцикла.
Ранее были получены аддукты нитратов лантанидов с 18-краун-6: [Ln(NO3)3(18-краун-6)] [15, 17] (М : L = 1 : 1) и [Ln(NO3)2(18-краун-6)$]_{3}^{ + }$[Ln(NO3)6]3– (Ln = La, Nd) [14, 17] (М : L = 4 : 3). В случае лантана образуется только первый комплекс, а в случае неодима – смесь двух комплексов, причем первый комплекс может превращаться во второй при нагревании.
Можно предположить, что аналогичный комплексу лантана IV аддукт (1 : 1) с 12-координационым катионом неодима неустойчив вследствие стерической перегруженности, поэтому реализуется менее нагруженная структура комплекса V с 10- и 8-координационными катионами неодима.
Таким образом, в результате данного исследования получены трифенилацетатные комплексы лантана и неодима с 6- и 18-членными насыщенными гетероциклическими лигандами. В полученных соединениях La(III) и Nd(III) (отличающихся ионными радиусами не более 4%) реализуются принципиально различные структуры для сходного набора лигандов.
Авторы сообщают, что у них нет конфликта интересов.
Список литературы
Bünzli J.-C.G. // Acc. Chem. Res. 2006. V. 39. P. 53.
Cui Y.J., Chen B.L., Qian G.D. // Coord. Chem. Rev. 2013. V. 273–274. P. 76.
Bojer D., Neumann B., Stammler H.G. et al. // Eur. J. Inorg. Chem. 2011. P. 3791.
Le Roux E., Nief F., Jaroschik F. et al. // Dalton Trans. 2007. P. 4866.
Roitershtein D M., Vinogradov A.A., Lyssenko K.A. et al. // Inorg. Chim. Acta. 2019. V. 487. P. 153.
Roitershtein D.M., Vinogradov A.A., Vinogradov A.A. et al. // Organometallics. 2013. V. 32. P. 1272.
Spek A.L. // Acta Crystallogr. C. 2015. V. 71. P. 9.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Bojer D., Neumann B., Stammler H.-G., Mitzel N.W. // Chem. Eur. J. 2011. V. 17. P. 6239.
Köhn R.D., Pan Z., Kociok-Köhn G., Mahon M.F. // Dalton Trans. 2002. P. 2344.
Вайсберг А., Проскауэр Э., Риддик Дж., Тупс Э. Органические растворители. М.: ИЛ, 1958. 519 с.
Nicolo F., Planeherel D., Claude J., Biinzli G. // Helv. Chim. Acta. 1987. V. 70. P. 1978.
Rogers R.D., Rollins A.N., Etzenhoussr R.D. et al. // Inorg. Chem. 1993. V. 32. P. 3451.
Bunzli J.-C.G., Klein B., Wessner D. // Inorg. Chim. Acta. 1981. V. 54. P. L43.
Bünzli J.-C.G., Klein B., Wessner D. // Inorg. Chim. Acta. 1980. V. 44. P. L147.
Backer-Dirks J.D., Cooke J.E., Galas A.M.R et al. // Dalton Trans. 1980. P. 2191.
Bünzli J.-C.G., Wessner D. // Helv. Chim. Acta. 1978. V. 61. P. 1454.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия