Координационная химия, 2020, T. 46, № 6, стр. 376-384
Координационный полимер и мономер с фрагментом Cd(NO3)2, содержащие 2-амино-5-бромпиридин: синтез, строение, ЯМР-исследование и люминесцентные свойства
В. В. Ковалев 1, *, Ю. В. Кокунов 1, Ю. К. Воронина 1, М. А. Кискин 1, С. Г. Сахаров 1, Л. Д. Попов 2, И. Л. Еременко 1, 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Южный федеральный университет
Ростов-на-Дону, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеяновa РАН
Москва, Россия
* E-mail: kovavlad@igic.ras.ru
Поступила в редакцию 24.12.2019
После доработки 29.01.2020
Принята к публикации 31.01.2020
Аннотация
При взаимодействии Cd(NO3)2 ⋅ 4H2O с 2-амино-5-бромопиридином (Аbp) выделены соединения [Cd(NO3)2(Аbp)(H2O)]n (I) и [Cd(NO3)2(Abp)2(H2O)2] (II). По данным РСА монокристаллов установлена структура обоих комплексов (CIF files CCDC № 1938624 (I) и 1959680 (II)). Соединение I представляет собой координационный 1D-полимер, в котором роль мостиков выполняют две хелатно-связанные группы ${\text{NO}}_{3}^{ - }$. При этом координационный полиэдр октакоординированного центрального атома кадмия в I состоит из семи атомов кислорода (один воды и шесть групп ${\text{NO}}_{3}^{ - }$) и атома азота Abp и представляет собой треугольный додекаэдр. Комплекс II представляет собой моноядерную молекулу, в которой октаэдрический координационный полиэдр Cd сформирован четырьмя атомами кислорода двух молекул воды и двух групп ${\text{NO}}_{3}^{ - }$ и двумя атомами азота двух молекул Abp-цикла. Аминогруппа Abp в обоих комплексах в координации с металлом не участвует. Проведено изучение I методом ЯМР 1H, 31C и 15N раствора полимерного комплекса в CD3CN, причем наиболее существенная разница хим. сдвигов связанного и свободного лиганда Abp наблюдается в спектрах 15N (37 м.д.). Отмечено, что, по данным люминесцентной спектроскопии, соединения I и II проявляют эмиссию в области 430–690 нм.
Синтез и изучение строения новых молекулярных и полимерных металлоорганических соединений остаются популярной областью исследований из-за их необычных координационных архитектур и ряда физико-химических свойств, таких как проводимость, фотолюминесценция, биологическая, фотохимическая и каталитическая активность, обеспечивающих возможность их потенциального применения в различных областях. Комбинирование способов управления строением комплексов позволяет получать новые молекулярные материалы, обладающие перспективой применения в катализе, оптике, электронике, люминесценции и биологии [1, 2].
Синтез координационных соединений, главным образом, основан на самосборке ионов металлов и органических лигандов, находящихся в растворе. Определяющими ход реакции факторами могут являться природа противоионов и растворителя, соотношение металл–лиганд, температура проведения реакции, рН среды и др. Кроме того, различные нековалентные взаимодействия, как сильные водородные связи, так и более слабые π–π, CH…O, lp…π, галогенные и др. взаимодействия, играют важную роль в процессах самосборки, формировании молекулярной и кристаллической структуры новых соединений, а также их устойчивости. Ионы металлов и органические лиганды, в зависимости от их электронного строения, определяют функциональные свойства кристаллов полученных соединений: магнитные, оптические или люминесцентные, механическую твердость, термическую устойчивость. Выбор лиганда и его количество в реакционной смеси также может являться причиной структурного разнообразия продуктов реакции, что позволяет более тонко управлять проявляемыми свойствами полученных соединений.
Как известно, N-гетероциклы широко используются при получении координационных дискретных и полимерных соединений металлов. Введение в положение 2 пиридинового кольца донорного заместителя (NH2) оказывает влияние на геометрические и электронные параметры лиганда, что проявляется в изменении строения соединений с его участием. Группа NH2 способна участвовать в образовании Н-связей и придавать стабильность новым структурным образованиям. Введение двух различных заместителей: одного – донора электронов, другого – акцептора – придает такому лиганду нелинейно-оптический характер [3, 4]. На основе таких органических соединений потенциально можно получать молекулярные материалы с низкой диэлектрической константой. В частности, для этих целей часто используют производные пиридина, в которых в положении 2 находится NH2-группа, а в положении 5 – галогенид-ионы или NO2-группа. Выполнен ряд исследований по получению координационных соединений Cu(I и II), Cd(II) с 2-амино-5-нитропиридином и Cu(II), Zn(II) и Ag(I) c 2-амино-5-бромпиридином (Аbp) [5–10], изучены их строение и физико-химические свойства.
В настоящей работе изучена реакционная система, содержащая катионы кадмия(II) и 2-амино-5-бромпиридин. Варьирование соотношения Cd : L позволило выделить два продукта реакции, исследовать их состав, строение и сравнить люминесцентные свойства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали Cd(NO3)2 ⋅ 4H2O (“х. ч.”) и 2-амино-5-бромпиридин (97%; Aldrich), ацетонитрил и толуол без дополнительной очистки (Химмед).
Синтез [Cd(Аbp)(NO3)2(H2O)]n (I). Навески 2‑амино-5-бромпиридина (0.23 г, 1.33 ммоль) и Cd(NO3)2 ⋅ 4H2O (0.21 г, 0.66 ммоль) раздельно растворяли в 4 мл ацетонитрила. Растворы сливали и перемешивали течение 10 мин при температуре 40–45°С, отфильтровывали и выдерживали в условиях медленного испарения растворителя при комнатной температуре ~36 ч до испарения большей части растворителя. Образовавшиеся крупные пластинчатые кристаллы отделяли от раствора декантацией, промывали ацетонитрилом и растворяли в 6 мл смеси ацетонитрил–толуол (1 : 1) при нагревании до 40–45°С. Медленной кристаллизацией при комнатной температуре из раствора выделяли кристаллы, которые после высушивания на воздухе, по данным элементного анализа, отвечали составу I.
Синтез [Cd(Аbp)2(NO3)2(H2O)2] (II) выполняли таким же способом, как для I, но перекристаллизацию первоначально выделенных кристаллов проводили с использованием в качестве растворителя ацетонитрилa. Высушенные кристаллы отвечали составу II.
Спектры ЯМР 1H и 13C записывали на спектрометре Bruker AV 300 c рабочими частотами 300.13 и 75.47 МГц, соответственно, и внутренней стабилизацией по дейтерию при комнатной температуре (298 K). Хим. сдвиги ядер 1H и 13C приведены относительно ТМС. Спектры ЯМР 15N записывали на спектрометре Bruker AV 400 c рабочей частотой 40.54 МГц и внутренней стабилизацией по дейтерию при комнатной температуре (298 K). Хим. сдвиги ядер 15N приведены относительно жидкого NH3. Соотнесение сигналов в спектрах протонного и углеродного резонансов проводили с помощью двумерного гетерокоррелированного эксперимента 13C,1H–HMQC (heteronuclear multiple quantum correlation). Для накопления сигналов 15N, а также для соотнесения сигналов в спектрах протонного и азотного резонансов использовали методику двумерного инверсного гетерокоррелированного эксперимента 1H-1/15N HMBC (Heteronuclear multiple bond correlation) через дальние константы спин-спинового взаимодействия nJ(1H,15N) = 10 Гц.
Спектры возбуждения и эмиссии твердых образцов регистрировали при комнатной температуре в видимом диапазоне спектра с использованием спектрометра Perkin-Elmer LS-55.
РСА монокристаллов соединений I и II выполнен на дифрактометре Bruker Apex II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [11]. Для I введена полуэмпирическая поправка на поглощение по программе SADABS [12]. Структуры решены прямым методом и уточнены МНК сначала в изотропном, а затем в анизотропном приближении по $F_{{hkl}}^{2}$. Позиции атомов водорода рассчитаны геометрически и уточнены в изотропном приближении по модели наездника. Все расчеты проведены с помощью комплекса программ SHELXL [13]. Кристаллографические параметры и детали уточнения структур I и II приведены в табл. 1. Геометрия полиэдров атомов металлов определена с помощью программы Shape 2.1 [14–16].
Таблица 1.
Кристаллографические параметры и детали уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| М | 427.46 | 616.48 |
| Т, K | 150(2) | 298(2) |
| Сингония | Моноклинная | Моноклинная |
| Пр. гр. | P21/c | P21/c |
| a, Å | 7.8517(2) | 7.7061(4) |
| b, Å | 18.5145(5) | 16.5248(8) |
| c, Å | 8.8399(2) | 7.2898(5) |
| β, град | 111.5840(10) | 96.404(2) |
| V, Å3 | 1194.95(5) | 922.50(9) |
| Z | 4 | 2 |
| ρ(выч.), г см3 | 2.376 | 2.219 |
| μ, мм–1 | 1.746 | 5.567 |
| θ, град | 2.71–28.99 | 2.47–30.58 |
| Tmin/Tmax | 0.5706/0.7461 | |
| Число измеренных рефлексов | 13 030 | 12 140 |
| Число независимых рефлексов | 3144 | 2814 |
| Число рефлексов с I > 2σ(I) | 2939 | 1828 |
| Rint | 0.0228 | 0.1266 |
| Число уточняемых параметров | 163 | 134 |
| GOOF | 1.023 | 0.957 |
| R1, wR2 (I > 2σ(I)) | 0.0195, 0.0396 | 0.0562, 0.1136 |
| R1, wR2 (все данные) | 0.0218, 0.0404 | 0.0947, 0.1136 |
| Δρmin/Δρmax, e/Å 3 | –0.899/0.881 | –1.640/0.822 |
Структурные данные соединений I и II депонированы в Кембриджском банке структурных данных (КБСД № 1938624 и 1959680 соответственно).
РФА мелкокристаллических образцов I и II выполнен на дифрактометре Bruker D8 Advance (CuKα, Ni-фильтр, LYNXEYE детектор, геометрия на отражение).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование продуктов реакции Cd(NO3)2 ⋅ ⋅ 4H2O с Аbp выявило существенное влияние растворителя на их состав и строение. При использовании смеси толуол–ацетонитрил (1 : 1) был получен координационный полимер [Cd(Аbp)(NO3)2(H2O)]n (I). В среде ацетонитрила образуется моноядерное соединение [Cd(Аbp)2(NO3)2(H2O)2] (II).
Анализ параметров спектров ЯМР 1H, 13C{H} и 15N комплекса I в растворе CD3CN показывает, что, как и для комплексов Ag(I) с лутидинами [17], некоторые из них заметно изменяются при координации органического лиганда к атому Cd(II) (рис. 1, табл. 2). Например, сигнал протонов NH2-группы смещается в слабое поле на 0.58 м.д. Наименьшие изменения в сдвигах CH-протонов (от –0.09 до 0.17 м.д.) наблюдаются в спектрах ЯМР 1H. Так, при координации 2-амино-5-бромопиридина происходит смещение сигналов протонов кольца в положении 6 в сильное поле всего на 0.09 м.д. В то же время максимальное смещение в слабое поле наблюдается для CH-протонов кольца в положении 3. Интересно отметить, что КССВ между протонами в положениях 3 и 4 несколько увеличивается (на 0.2 Гц) при координации лиганда. Возможно, это связано с некоторым увеличением электроотрицательности атома азота пиридинового кольца при соединении с ионом Cd(II). Подтверждением этого является увеличение значений 3JH–H в положениях 3 и 4 пиридина на 0.4 Гц при протонировании [18]. Сдвиг сигналов в спектре 13С при комплексообразовании оказывается несколько больше, а именно от –1.6 до 2.7 м.д. в зависимости от расположения ядра углерода. Наибольший сдвиг в слабое поле при координации лиганда наблюдается для углеродных атомов кольца в положениях 3 (2.7 м.д.) и 4 (2.3 м.д.). Изменений же в спектре ЯМР 13C{H} при переходе к комплексу для углеродов в положениях 2 и 5 практически нет.
Рис. 1.
Спектр 2D-ЯМР 1H–13C (HMQC, long range) раствора, содержащего комплекс 2-амино-5-бромопиридина с Cd(NO3)2 в CD3CN.
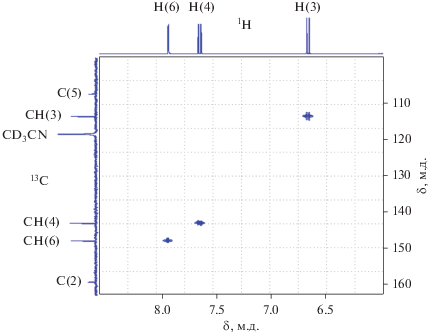
Таблица 2.
Параметры спектров ЯМР растворов 2-амино-5-бромопиридина в CD3CN и его комплекса с Cd(NO3)2
| Соединение | Атомы и группы | ПМР, м.д. (относительно ТМС) |
ЯМР 13C, м.д. (относительно ТМС) | ЯМР 15N, м.д. (относительно NH3(ж)) |
|||
|---|---|---|---|---|---|---|---|
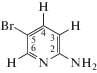 |
2-C | 159.3 | |||||
| 5-C | 107.6 | ||||||
| 3-CH | 6.48 | 110.9 | |||||
| 4-CH | 7.51 | 140.6 | |||||
| 6-CH | 8.03 | 149.3 | |||||
| NH2 | 5.05 | ||||||
| 1-N | 274 | ||||||
| 3J (3,4) | 8.8 Гц | ||||||
| 3J (3,6) | 0.7 Гц | ||||||
| 3J (4,6) | 2.6 Гц | ||||||
 |
Δδ* | Δδ | Δδ | ||||
| 2-C | 159.0 | –0.3 | |||||
| 5-C | 107.4 | –0.2 | |||||
| 3-CH | 6.65 | 0.17 | 113.6 | 2.7 | |||
| 4-CH | 7.65 | 0.14 | 142.9 | 2.3 | |||
| 6-CH | 7.94 | –0.09 | 147.7 | –1.6 | |||
| NH2 | 5.63 | 0.58 | |||||
| 1-N | 237 | –37 | |||||
| Δν** | |||||||
| 3J (3,4) | 9.0 Гц | 0.2 Гц | |||||
| 3J (3,6) | 0.7 Гц | 0.0 Гц | |||||
| 3J (4,6) | 2.5 Гц | –0.1 Гц | |||||
Гораздо более значительные изменения наблюдаются в спектрах 15N: сигнал координированного атома азота пиридинового кольца расположен на 37 м.д в более сильном поле по сравнению с соответствующим сигналом в спектре свободного лиганда. Как и в случае комплексов серебра с лутидинами, это объясняется изменением локального парамагнитного вклада при координации 2-амино-5-бромпиридина к атому кадмия за счет неподеленной пары атома азота пиридинового кольца.
Oсновные длины связей и валентные углы в структурах I, II приведены в табл. 3; их анализ показал, что они находятся в пределах значений, стандартных для каждого типа связи.
Таблица 3.
Основные длины связей (Å) и валентные углы (град) в I и II
| Cвязь | d, Å | Cвязь | d, Å |
|---|---|---|---|
| I | |||
| Cd(1)–N(1) | 2.2570(16) | O(32)Cd(1)O(43) | 76.37(6) |
| Cd(1)–O(1) | 2.2663(14) | N(1)Cd(1)O(31) | 89.75(6) |
| Cd(1)–O(31) | 2.5149(16) | O(1)Cd(1)O(31) | 149.13(5) |
| Cd(1)–O(32) | 2.4126(19) | O(41)Cd(1)O(31) | 75.66(5) |
| Cd(1)–O(41) | 2.3830(13) | O(32)Cd(1)O(31) | 51.55(5) |
| Cd(1)–O(42) | 2.5930(14) | O(43)Cd(1)O(31) | 113.61(5) |
| Cd(1)–O(41А) | 2.5436(13) | N(1)Cd(1)O(41) | 84.76(5) |
| Cd(1)–O(43) | 2.4538(16) | O(1)Cd(1)O(41) | 87.55(5) |
| N(2)–C(2) | 1.347(3) | O(41)Cd(1)O(41) | 128.909(15) |
| C(5)–C(6) | 1.365(3) | O(32)Cd(1)O(41) | 72.45(5) |
| II | |||
| Cd(1)–N(2) | 2.319(4) | N(2)–C(5) | 1.355(6) |
| Cd(1)–O(3) | 2.474(6) | N(3)–C(1) | 1.347(7) |
| Cd(1)–O(1w) | 2.365(4) | С(2)–С(3) | 1.365(8) |
| N(2)–C(1) | 1.348(6) | ||
| Угол | ω, град | Угол | ω, град |
| I | |||
| N(1)Cd(1)O(1) | 93.10(5) | O(43)Cd(1)O(41) | 51.39(4) |
| N(1)Cd(1)O(41) | 146.05(5) | O(31)Cd(1)O(41) | 123.32(5) |
| O(1)Cd(1)O(41) | 85.18(5) | N(1)Cd(1)O(42) | 95.06(5) |
| N(1)Cd(1)O(32) | 93.14(7) | O(1)Cd(1)O(42) | 77.46(5) |
| O(1)Cd(1)O(32) | 158.39(5) | O(41)Cd(1)O(42) | 51.41(4) |
| O(41)Cd(1)O(32) | 100.83(6) | O(32)Cd(1)O(42) | 122.50(5) |
| N(1)Cd(1)O(43) | 136.13(5) | O(43)Cd(1)O(42) | 126.73(5) |
| O(1)Cd(1)O(43) | 84.83(5) | O(31)Cd(1)O(42) | 71.66(5) |
| O(41)Cd(1)O(43) | 77.59(4) | O(41)Cd(1)O(42) | 164.98(5) |
| II | |||
| N(2)Cd(1)O(1w) | 89.50(14) | O(1w)Cd(1)O(3) | 70.35(15) |
| N(2)Cd(1)O(3) | 87.49(14) | ||
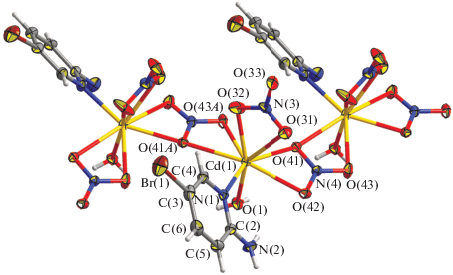
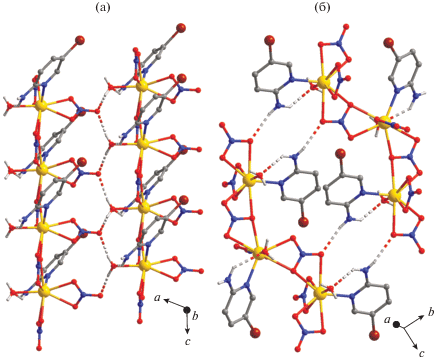
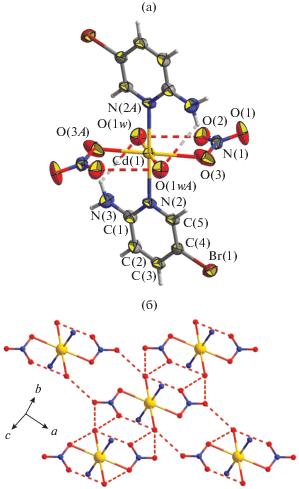
Координационный полиэдр октакоординированного центрального атома кадмия Cd(1) (CdO7N) в структуре I представляет собой треугольный додекаэдр (D2d, SQ(P) = 4.703), состоящий из трех бидентатных нитрогрупп и монодентатных лигандов Аbp и воды (рис. 2). Максимально отдаленными от атома кадмия являются атомы кислорода аксиально расположенных нитрогрупп (O(41а) и O(42)), являющихся мостиковыми в полимерной структуре изученного соединения. Такое расположение мостиковых групп приводит к ленточному строению всей полимерной цепи, при котором атомы кадмия находятся в одной плоскости, а атомы нитрогрупп лишь незначительно выходят из нее. Пиримидиновый цикл развернут на 45.35° относительно этой плоскости, при том что атом азота N(1) лежит непосредственно на ней. Плоскость, образованная атомом кислорода молекулы воды и свободной нитрогруппой, практически перпендикулярна основной плоскости полимерной структуры (угол между плоскостями 81.05°). Такая геометрическая структура и наличие нескольких центров водородного связывания приводит к тому, что полимерные ленты связаны друг с другом с одной стороны водородными связями O–H…O, с другой – N–H…O (рис. 3а, 3б; табл. 4). Кроме того, кристаллическая структура изученного соединения дополнительно стабилизируется взаимодействиями CH…O, а также π…π-взаимодействиями между пиридиновыми циклами (расстояние между центрами взаимодействующих циклов 4.3912(14) Å, угол между плоскостями 0.00(11)°, расстояние от центра одного цикла до плоскости другого – 3.3553(9) Å ) и взаимодействиями Br…O с участием атома кислорода воды (расстояние Br…O составляет 3.4070(50) Å, угол С–Br…O 148.71(7)°).
Таблица 4.
Параметры водородных связей в кристалле I и II
| D–H…A | Расстояние, Å | Угол D–H…A, град | Элемент симметрии атома A(#) | ||
|---|---|---|---|---|---|
| D–H | H…A | D…A | |||
| I | |||||
| O(1)–H(11)…O(33#) | 0.75 | 2.04 | 2.774(2) | 168 | x – 1, y, z |
| O(1)–H(12)…O(33#) | 0.82 | 1.99 | 2.800(2) | 171 | x – 1, –y + 3/2, z – 1/2 |
| N(2)–H(21)…O(1) | 0.91 | 2.32 | 3.079(2) | 141 | |
| N(2)–H(21)…O(42) | 0.91 | 2.51 | 3.136(2) | 127 | |
| N(2)–H(22)…O(42#) | 0.80 | 2.23 | 3.007(2) | 166 | –x, –y + 1, –z |
| C(4)–H(4A)…O(32) | 0.95 | 2.57 | 3.236(3) | 128 | |
| C(6)–H(6A)…O(31) | 0.95 | 2.49 | 3.371(3) | 155 | –x + 1, –y + 1, –z + 1 |
| II | |||||
| O(2)…O(1w) | 2.881(6) | ||||
| N(3)–H(3A)…O(1w) | 0.90 | 2.15 | 2.953(7) | 119 | |
| O(1w)…O(1#) | 3.223(6) | x, y, z – 1 | |||
| O(1w)…O(2#) | 2.909(8) | x, y, z – 1 | |||
| O(1w)…O(1#) | 2.896(6) | –x, 1 – y, 1 – z | |||
| C(3)–H(3C)…O(2#) | 0.93 | 2.53 | 3.341(6) | 145 | |
| C(5)–H(5C)…O(3#) | 0.93 | 2.49 | 3.130(7) | 126 | –x + 1, –y + 1, –z + 1 |
| N(3)–H(3B)…Br(1#) | 0.90 | 2.98 | 3.527(5) | 121 | x – 1, –y + 1/2, z – 1/2 |
Комплекс II представляет собой моноядерную молекулу, в которой атом Cd(1) располагается в центре инверсии. Координационный полиэдр CdO4N2 соответствует октаэдру (Oh, SQ(P) = 2.150) и сформирован четырьмя атомами кислорода двух молекул воды и двух NO3-групп и двумя атомами азота двух молекул Аbp (рис. 4, основные длины связей и углы приведены в табл. 3). Одинаковые лиганды располагаются в транс-положении относительно друг друга. Между атомом азота NH2-группы и атомом кислорода молекулы воды, а также атомами H молекулы воды и атомами кислорода NO3-группы образованы водородные связи (рис. 4а, табл. 4). В кристалле молекулы комплекса формируют супрамолекулярный слой параллельно плоскости ac за счет водородных связей между молекулами воды и атомами кислорода NO3-групп (рис. 4б, табл. 4). Дополнительно кристаллическая структура изученного соединения стабилизируется взаимодействиями NH…Br и CH…O, которые способствуют связыванию слоев в трехмерную сетку (табл. 4).
Рис. 4.
(а) – Молекулярная структура II (пунктиром показаны внутимолекулярные H-связи, эллипсоиды даны с вероятностью 50%); (б) – фрагмент супрамолекулярного слоя в кристалле II, образованного водородными связями O(H2O)…O(NO3) (атомы водорода и молекулы 2-NH2-5-Br-пиридина не показаны).
Поскольку строение лиганда играет одну из ключевых структурообразующих ролей в свойствах комплексного соединения, в частности с ионами Cd(II), было проанализировано строение Аbp как в органических соединениях, так и в комплексах некоторых d-металлов. При анализе данных КБСД обнаружено 22 структуры 2-амино-5-бромпиридина, в которых аминопиридин не связан с атомом металла и восьми структур, в которых аминопиридин выступает в виде лиганда. Сравнение длин связей внутри пиридинового цикла показало, что при образовании комплексов происходит некоторое увеличение длин связей С–N(H2) и С(N)–C(Br) (соответствуют С(2)–N(2) и С(5)–С(6) в структуре соединения I и С(1)–N(3) и C(2)–C(3)): в неметаллических соединениях длины связей находятся в пределах 1.313–1.346 и 1.335–1.366 Å, в комплексах – 1.334–1.373 и 1.353–1.377 Å соответственно). Длина связи М…N определяется природой металла.
Согласно [19] существует три типа координации NO3-групп – монодентатная, симметричная бидентатная и асимметричная бидентатная. Различия в расстояниях металл–атомы кислорода ${\text{NO}}_{3}^{ - }$ определяют тип координации. Более 0.6 Å – монодентатная координация, менее 0.3 Å – симметричная бидентатная и промежуточное значение – асимметричная бидентатная. В представленной структуре I NO3-группы симметричные бидентатные, в структуре II монодентатные. Кроме того, в I одна из NO3-групп имеет мостиковые тридентатные свойства, координируясь к разным ионам кадмия за счет трех атомов кислорода ${\text{NO}}_{3}^{ - }$, формируя полимерную структуру. Интересно, что эта NO3-группа присоединяется к ионам металла бидентатно-хелатным образом.
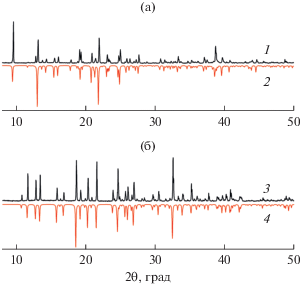
Структурная целостность и фазовая чистота мелкокристаллических образцов I и II, полученных в качестве основных продуктов реакции, подтверждены методом РФА (рис. 5).
Рис. 5.
Порошковые дифрактограммы образцов I (а, 1) и II (б, 3) и теоретически рассчитанные по данным РСА) (а, кривая 2; б, кривая 4, соответственно).
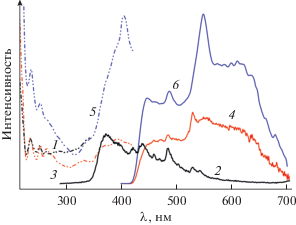
Для полученных соединений I, II и нейтрального лиганда Аbp изучены спектры возбуждения и эмиссии (рис. 6). Пиридин и его производные, так же как и простые соединения кадмия, например галогениды, не обладают люминесцентными свойствами однако все координационные соединения кадмия, содержащие пиридиновые лиганды, при возбуждении показывают интенсивную флуоресценцию при частоте, соответствующей полосе поглощения лиганда [20, 21]. Соединения I (λвозб = 390 нм) и II (λвозб = 405 нм) проявляют эмиссию в области 430–690 нм, а лиганд Аbp (λex = = 236 нм) – в области 350–540 нм., т.е. при координации к иону металла люминесценция Аbp смещается в длинноволновую область спектра. Люминесцентные свойства соединений кадмия и цинка, согласно литературным данным, обусловлены внутрилигандными π–π*-переходами ароматических фрагментов органических молекул. Считается, что фотолюминесцентное поведение ассоциируется с локальным окружением иона металла и соотношением лиганд–металл [22, 23]. Небольшое различие в спектрах I и II, несмотря на одинаковую природу атомов (N и O) в координационных сферах кадмия, по-видимому, может быть связано с различным координационным числом иона металла (КЧ 8 в I; КЧ 6 в II).
Рис. 6.
Спектры возбуждения (λэм = 372 (1), 480 (3), 550 нм (5)) и эмиссии (λвозб = 236 (2), 390 (4), 405 нм (6)) для твердых образцов 2-NH2-5-Br-пиридина, I и II, соответственно, при комнатной температуре.
Таким образом в работе представлены новые координационный полимер [Cd(Abp)(NO3)2(H2O)]n (I) и мономер [Cd(NO3)2(Abp)2(H2O)2] (II). Структуры обоих соединений установлены методом РСА монокристаллов, охарактеризованы химическим анализом, РФА, фотолюминесцентными свойствами и методом ЯМР соединения I в растворе CD3CN. В соединении I у иона кадмия(II) КЧ 8 в форме трeугольного додекаэдра, в соединении II Cd имеет октаэдрическое окружение. В II полимерную структуру определяют мостиковые нитратогруппы. Исследование I в растворе CD3CN методом ЯМР показало, что наибольшие изменения наблюдаются в спектрах 15N координированного 2-амино-5-бромпиридина. В спектрах люминесценции полосы эмиссии соединений I и II лежат в области 430–690 нм.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Ho C.-L., Wong W.-Y. // Coord. Chem. Rev. 2011. V. 255. P. 2469.
Leong W.L., Vittal J.J. // Chem. Rev. 2011. V. 111. P. 688.
Koshima H., Hamada M., Yagi I., Uosaki K. // Cryst. Growth. Des. 2001. V. 1. P. 467.
Tomaru S., Matsumoto S., Kurihara T. et al. // Appl. Phys. Lett. 1991. V. 58. P. 2583.
Luque A., Sertucha J., Lesama L. et al. // Dalton Trans. 1997. P. 847.
Mojdekaulous S., Khalaji A.D., Xu D. // Jpn. Soc. Analyt. Chem. 2007. V. 23. P. x189.
Zhou W.-W., Zhao W., Wei B. et al. // Inorg. Chim. Acta. 2012. V. 386. P. 17.
Futriani, Hausongnern K., Leesakul N. et al. // Acta Crystallogr. E. 2013. V. 69. P. m302.
Zhou W.-W., Zhao W., Zhao X. et al. // Synth. React. Inorg. Met.-Org. Nano-Met. Chem. 2013. V. 43. P. 1171.
Seth S.K. // CrystEngComm. 2013. V. 15. P. 1772.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS, Inc., 1997.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Cirera J., Alemany P., Alvarez S. // Chem. Eur. J. 2004. V. 10. P. 190.
Casanova D., Llunell M., Alemany P., Alvarez S. // Chem. Eur. J. 2005. V. 11. P. 1479.
Alvarez.D., Avnir D., Llunell M., Pinsky M. // New J. Chem. 2002. V. 26. P. 996.
Sakharov S.G., Kovalev V.V., Gorbunova Yu.E., Kokunov Yu.V. // Russ. J. Coord. Chem. 2013. V. 39. P. 187. https://doi.org/10.1134/S1070328413020061
Tables of Spectral Data for Structuew Determination of Organic Compounds. Springer-Verlag, Berlin, Heidelberg, New York, Tokyo, 1983, P. H275.
Kleywegt J.G.J., Weismeijer W.G.R., Van Driel G.J. et al. // Dalton Trans. 1985. P. 2171.
Chattopadhyay T., Banerjee A., Banu K.S. et al. // Polyhedron. 2008. V. 27. P. 2452.
Neumann T., Germann L.S., Mandrakovski I. et al. // Z. Anorg. Allg. Chem. 2017. V. 643. P. 1904.
Fu Z.-Y., Wu X.-T., Dai J.-C. et al. // Eur. J. Inorg. Chem. 2002. P. 2730.
Nather C., Jess I., Germann L.S. et al. // Eur. J. Inorg. Chem. 2017. P.1245.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия