Координационная химия, 2020, T. 46, № 6, стр. 366-375
Биоизостерные модификации Cu2+ и Zn2+ с анионами пирослизевой кислоты и N-донорами: синтез, строение, термические свойства и биологическая активность
И. А. Луценко 1, *, Д. Е. Баравиков 2, М. А. Кискин 1, Ю. В. Нелюбина 1, 3, П. В. Примаков 3, 4, О. Б. Беккер 5, А. В. Хоршилов 1, А. А. Сидоров 1, И. Л. Еременко 1, 3
1 Институт общей и неорганической химии им. Н.С. Курнакова PAH
Москва, Россия
2 Школа на Юго-Востоке Москвы им. В.И. Чуйкова
Москва, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова PAH
Москва, Россия
4 Московский государственный университет
Москва, Россия
5 Институт общей генетики им. Н.И. Вавилова PAH
Москва, Россия
* E-mail: irinalu05@rambler.ru
Поступила в редакцию 15.01.2020
После доработки 20.01.2020
Принята к публикации 31.01.2020
Аннотация
Взаимодействием ацетатов меди(II) и цинка(II) с анионами пирослизевой кислоты (2-фуранкарбоновая кислота (HFur)) и N-донорными лигандами (пиридин (Рy), 4-фенилпиридин (Рhpy), 1,10-фенантролин (Рhen)) в ацетонитриле получены моно- и биядерные комплексы [Cu(Fur)2(Phen)] (I), [Cu2(Fur)4(Py)2] (II), [Cu(Fur)2(Py)2(H2O)] (III), [Zn2(Fur)4L2] (L = Py (IV), Phpy (V)). Комплексы меди с пиридином формируются из одной реакционной смеси последовательно, сначала биядерный II, после моноядерный III. Все соединения выделены в виде монокристаллов и определена их структура методом РСА (CIF files CCDC № 1974386 (I), 1974388 (II), 1974389 (III), 1974387 (IV), 1974385 (V)). Термическое поведение II и III исследовано методом синхронного термического анализа. Биологическая активность in vitro всех комплексов определена в отношении непатогенного микобактериального штамма Mycolicibacterium smegmatis. Установлено, что I и V проявляют высокую биологическую активность и перспективны для дальнейших исследований на противотуберкулезную активность.
Противостояние вирусным и инфекционным заболеваниям – одна из основных задач современной медицины. Проблема туберкулеза остается второй после ВИЧ среди инфекционных заболеваний [1]. Все пути создания эффективных средств борьбы с Mycobacterium tuberculosis (палочка Коха) блокируются благодаря его фенотипической гетерогенности, повышенной адаптивной способности, а также наличием системы генов природной лекарственной устойчивости, что обеспечивает патогену аномально высокую выживаемость в неблагоприятных условиях. Возможно, одним из путей решения данной проблемы является выявление факторов, определяющих характер взаимодействия металлокомплексов с клеткой патогена и ответственных за их биоактивное действие. Действительно, в последнее время активно ведутся работы по исследованию биоактивности координационных соединений металлов в отношении различных патогенов – грибковых и бактериальных инфекций, малярии, туберкулеза, а также раковых клеток [2–10]. Ионы металлов выполняют множество важных функций в бактериальных патогенах: действуют как необходимые кофакторы для клеточных белков, делая их незаменимыми как для структуры, так и для функции белка, а также играют важную роль в передаче сигналов и регуляции вирулентности. Следовательно, поддержание клеточного гомеостаза ионов металлов имеет решающее значение для жизнеспособности и патогенности бактерий.
В качестве объектов исследований данной работы были выбраны 2-фуранкарбоновая кислота и ионы цинка(II) и меди(II). 2-Фуранкарбоновая кислота и ее производные являются действующими в качестве бактерицидных и фунгицидных средств, и часто используются в биомедицинских исследованиях, в том числе в поиске препаратов против туберкулеза [11–13]. Эссенциальные ионы металлов-комплексообразователей, цинк(II) и медь(II), входят в состав ферментативных систем живых организмов и выполняют важную роль переноса электронов в дыхательной цепи [14]. Эти ионы металлов в реакциях с анионами кислот способны образовывать устойчивые соединения различного строения и состава.
Цель настоящего исследования – синтез комплексов Cu(II) и Zn(II) с 2-фуранкарбоновой кислотой в присутствии N-донорных лигандов (1,10-фенантролин (Рhen), пиридин (Рy), 4-фенилпиридин (Рhpy)), определение их структуры, термических свойств и установление биологической активности in vitro в отношении Mycolicibacterium smegmatis.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез комплексов проводили с использованием коммерческих реагентов и растворителей без дополнительной очистки: 2-фуранкарбоновая кислота (HFur) (Acros), цинк(II) ацетат дегидрат (98%, Acros), медь(II) ацетат моногидрат (95%, Acros), пиридин (“ч.”, Химмед), 4-фенилпиридин (97%, Aldrich), 1,10-фенантролин (Alfa Aesar), ацетонитрил (“ос. ч.”, Химмед).
ИК-спектры соединений регистрировали на ИК-спектрофотометре с Фурье преобразованием Perkin-Elmer Spectrum 65 методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
Элементный анализ выполняли на автоматическом С,H,N-анализаторе Carlo Erba EA 1108.
Биологическую активность определяли в тест-системе M. smegmatis mc2 155 методом бумажных дисков. Фиксировали величину зоны подавления роста штамма, засеянного газоном на агаризованной среде, вокруг бумажных дисков, содержащих вещество в различных концентрациях. Бактерии, смытые с чашек Петри со средой Триптон-соевый агар М-290 (Himedia), выращивали в течение ночи в жидкой среде Lemco-TW (Lab Lemco’ Powder 5 g L–1 (Oxoid), Peptone special 5 g L–1 (Oxoid), NaCl 5 g L–1, Tween-80) при 37°С до среднелогарифмической фазы роста при оптической плотности OD600 = 1.5 и смешивали с расплавленной агаризованной средой М-290 в соотношении 1 : 9 : 10 (культура : Lemco-TW : М-290). Культуру инкубировали в течение 24 ч при 37°С. Минимальной ингибирующей концентрацией (MИК) считали концентрацию вещества, при которой зона подавления роста минимальна.
Синтез [Cu(Fur)2(1,10-Phen)] (I). Навески Сu(OAc)2 ⋅ H2O (0.182 г, 1 ммоль) и HFur (0.448 г, 4 ммоль) растворяли в 40 мл MeCN. К полученной суспензии добавляли Phen (0.200 мг, 1 ммоль) и выдерживали реакционную смесь при 70°С в течение 3 ч. Полученный синий раствор отфильтровывали и концентрировали до объема 20 мл. Через сутки образовывались кристаллы темно-синего цвета, которые отделяли от маточного раствора декантацией и сушили в токе аргона. Выход I 0.26 г (55%).
ИК (ν, см–1): 3137 о.сл, 3098 сл, 3067 о.сл, 1622 сл, 1565 о.с, 1516 ср, 1483 ср, 1473 о.с, 1427 ср, 1409 сл, 1386 ос, 1355 о.с, 1254 сл, 1225 ср, 1187 о.с, 1137 ср, 1106 сл, 1078 ср, 1050 о.сл, 1012 ср, 930 ср, 889 ср, 857 с, 812 о.с, 781 о.с, 750 с, 738 ср, 723 о.с, 649 ср, 602 ср, 564 ср, 544 ср, 506 сл, 469 о.с.
Синтез [Cu2(Fur)4(Py)2] (II) и [Cu(Fur)2(Py)2-(H2O)] (III). Навески Сu(OAc)2 ⋅ H2O (0.182 г, 1 ммоль) и HFur (0.448 г, 4 ммоль) растворяли в 40 мл MeCN. К полученной суспензии добавляли Py (0.3 мл, 4 ммоль) и выдерживали реакционную смесь при 70°С в течение 3 ч. Полученный раствор отфильтровывали и концентрировали до объема 25 мл. Через сутки образовывались кристаллы зеленого цвета, которые отделяли от маточного раствора декантацией и сушили в токе аргона. Выход II 0.32 г (44% в пересчете на исходную соль). Маточный раствор выдерживали при комнатной температуре при медленном испарении растворителя. Через сутки образовывались кристаллы синего цвета, которые отделяли от раствора декантацией и высушивали в токе аргона. Выход III 0.17 г (37% в пересчете на исходную соль).
ИК (ν, см–1): 3125 о.сл, 1621 о.с, 1600 сл, 1583 ср, 1575 сл, 1477 о.с, 1447 ср, 1414 о.с, 1368 ср, 1227 ср, 1217 о.с, 1198 с, 1140 с, 1069 ср, 1038 ср, 1009 с, 934 ср, 883 ср, 839 о.сл, 806 ос, 779 о.с, 763 сл, 750 о.сл, 696 о.с, 628 ср, 616 сл, 597 ср, 520 о.с, 418 с.
ИК (ν, см–1): 3223 ср, 1599 о.с, 1560 ср, 1488 сл, 1472 с, 1448 с, 1392 с, 1358 с, 1218 ср, 1192 с, 1155 сл, 1136 сл, 1070 с, 1046 ср, 1009 с, 952 осл, 930 ср, 882 ср, 788 о.с, 751 с, 695 с, 640 ср, 598 сл, 577 о.сл, 474 с, 436 ср.
Синтез [Zn2(Fur)4(Рy)2] (IV). Навески Zn(OAc)2 ⋅ · 2H2O (0.1 г, 0.46 ммоль) и HFur (0.206 г, 1.84 ммоль) растворяли в 40 мл MeCN. К полученной суспензии добавляли Py (0.15 мл, 4 ммоль) и выдерживали реакционную смесь при 70°С в течение 3 ч. Полученный бесцветный раствор отфильтровывали и концентрировали до объема 20 мл. Через сутки образовывались бесцветные кристаллы, которые отделяли от маточного раствора декантацией и сушили в токе аргона. Выход IV 0.42 г (57%).
ИК (ν, см–1): 3117 о.сл, 3068 о.сл, 2973 о.сл, 2098 о.сл, 1724 с, 1628 ш.ср, 1601 ш.ср, 1583 ш.сл, 1571 ш.сл, 1547 о.сл, 1478 ос, 1452 о.сл, 1412 о.с, 1397 о.сл, 1366 ср, 1263 сл, 1226 ср, 1187 с, 1137 сл, 1119 ср, 1072 ср, 1047 сл, 1008 с, 932 с, 884 ср, 834 с, 825 с, 801 с, 776 о.с, 748 ср, 721 сл, 698 сл, 681 ср, 644 сл, 608 с, 591 о.с, 529 о.с, 518 о.с, 492 о.сл.
Синтез [Zn2(Fur)4(Phpy)2] (V). Навески Zn(OAc)2 ⋅ 2H2O (0.100 г, 0.46 ммоль) и HFur (0.206 г, 1.84 ммоль) растворяли в 40 мл MeCN. К полученной суспензии добавляли Phpy (0.285 мл, 4 ммоль) и выдерживали реакционную смесь при 70°С в течение 3 ч. Полученный бесцветный раствор отфильтровывали и концентрировали до объема 20 мл. Через сутки образовывались бесцветные кристаллы, которые отделяли от маточного раствора декантацией и сушили в токе аргона. Выход V 0.48 г (45%).
ИК (ν, см–1): 3144 о.сл, 3054 о.сл, 2986 о.сл, 2931 о.сл, 2253 о.сл, 2050 о.сл, 1639 о.с, 1614 ср, 1586 ср, 1575 ср, 1477 о.с, 1413 о.с, 1396 сл, 1368 с, 1229 с, 1192 с, 1139 ср, 1080 с, 1047 ср, 1025 ср, 1012 ср, 933 с, 884 с, 843 с, 800 о.с, 783 о.с, 766 с, 745 сл, 730 сл, 693 с, 626 о.с, 613 ср, 593 о.с, 562 с, 501 ш.о.с, 486 ш.ср, 429 о.с, 420 с.
РСА комплексов I, III–V проводили при 120 K, II – при 296 K на дифрактометре Bruker Apex II DUO (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор). Структуры расшифрованы с использованием программы ShelXT [15] и уточнены в полноматричном МНК с помощью программы Olex2 [16] в анизотропном приближении для неводородных атомов. Атомы водорода OH локализованы из разностных Фурье-синтезов, а положения остальных атомов водорода рассчитаны геометрически. Все они уточнены в изотропном приближении в модели “наездника”. Диффузный вклад разупорядоченных молекул растворителя описан с помощью опции BYPASS (a.k.a. SQUEEZE) пакета программ [16]. Основные кристаллографические данные и параметры уточнения приведены в табл. 1.
Таблица 1.
Кристаллографические параметры и детали уточнения структур I–V
| Параметр | Значение | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| M | 465.91 | 729.60 | 461.91 | 733.26 | 967.56 |
| Т, K | 120 | 296 | 120 | 120 | 120 |
| Сингония | Моноклинная | Моноклинная | Моноклинная | Моноклинная | Моноклинная |
| Пр. гр. | P21/n | P21/c | P21 | P21/c | P21/c |
| Размер кристалла, мм; цвет | 0.2 × 0.1 × 0.1; голубые | 0.3 × 0.15 × 0.158; зеленые | 0.2 × 0.06 × 0.06; синие | 0.3 × 0.1 × 0.1; бесцветные | 0.2 × 0.2 × 0.1; бесцветные |
| a, Å | 9.7524(5) | 8.6154(7) | 5.6787(5) | 8.7218(13) | 8.0447(2) |
| b, Å | 17.5838(8) | 19.3254(14) | 21.853(2) | 19.369(3) | 29.3563(8) |
| c, Å | 10.9894(5) | 9.1674(7) | 8.3890(7) | 9.1026(14) | 9.5325(2) |
| β, град | 99.7370(10) | 111.323(2) | 108.124(3) | 111.838(3) | 111.6060(10) |
| V, Å3 | 1857.36(15) | 1421.85(19) | 989.38(15) | 1427.4(4) | 2093.04(9) |
| Z | 4 | 4 | 2 | 2 | 2 |
| ρ(выч.), г/см3 | 1.666 | 1.7040 | 1.550 | 1.706 | 1.687 |
| μ, мм–1 | 1.222 | 1.568 | 1.150 | 1.753 | 2.846 |
| F(000) | 948 | 742 | 474 | 744 | 1080 |
| Область сбора данных по θ, град | 2.208–25.242 | 2.11–27.99 | 2.555–27.473 | 2.103–25.242 | 3.01–67.87 |
| Интервалы индексов отражений | –12 ≤ h ≤ 12, –22 ≤ k ≤ 19, –14 ≤ l ≤ 14 |
–12 ≤ h ≤ 11, 0 ≤ k ≤ 25, 0 ≤ l ≤ 12 |
–7 ≤ h ≤ 7, –28 ≤ k ≤ 28, –10 ≤ l ≤ 10 |
–11 ≤ h ≤ 11, –25 ≤ k ≤ 25, –12 ≤ l ≤ 12 |
–9 ≤ h ≤ 9, –31 ≤ k ≤ 34, –10 ≤ l ≤ 11 |
| Число измерено отражений | 16 683 | 4305 | 10 866 | 16 208 | 28 170 |
| Число независимых отражений (Rint) | 4062 (0.0562) | 3438 (0.0000) | 4516 (0.0605) | 3441 (0.0678) | 3750 (0.0435) |
| Число отражений с I > 2σ(I) | 3158 | 2685 | 3682 | 3014 | 3556 |
| Переменных уточнения | 280 | 208 | 279 | 208 | 290 |
| GООF | 1.027 | 1.0140 | 1.025 | 1.080 | 1.079 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0392, wR2 = 0.0892 |
R1 = 0.0367, wR2 = 0.0764 |
R1 = 0.0523, wR2 = 0.0878 |
R1 = 0.0373, wR2 = 0.0860 |
R1 = 0.0330, wR2 = 0.0833 |
| R-факторы по всем отражениям | R1 = 0.0562, wR2 = 0.0982 |
R1 = 0.0545, wR2 = 0.0858 |
R1 = 0.0688, wR2 = 0.0937 |
R1 = 0.0446, wR2 = 0.0891 |
R1 = 0.0346, wR2 = 0.0845 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.396/ 0.897 | –0.5065/0.5596 | –0.622/0.466 | –0.891/0.678 | –0.416/0.479 |
Полный набор рентгеноструктурных параметров депонирован в Кембриджском банке структурных данных (CCDC № 1974386 (I), 1974388 (II), 1974389 (III), 1974387 (IV), 1974385 (V); deposit@ccdc.cam.uk).
Термическое поведение II и III изучали методом синхронного термического анализа (СТА) в атмосфере аргона с одновременной регистрацией кривых термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК). Исследование проводили на приборе CTA 449 F1 Ju-piter (фирмы NETZSCH) в алюминиевых тиглях под крышкой с отверстием, обеспечивающим давление паров при термическом разложении образцов в 1 атм. Скорость нагрева составляла 10°С/мин до 450°С. Масса навесок – 10.99 мг (II) и 4.12 мг (III). Точность измерения температуры ±0.7°С, изменения массы ±1 × 10−2 мг. При съемке кривых ТГ и ДСК использовали файл коррекции, а также калибровки по температуре и чувствительности для заданной температурной программы и скорости нагрева. После проведения термического анализа качественное определение химического состава и микроморфологию остаточного вещества анализировали с помощью растрового электронного микроскопа CarlZeissNVision 40, оснащенного рентгеноспектральным детектором Oxford X-Max, при ускоряющем напряжении 1 и 20 кВ соответственно. Увеличение составляло от ×3000 до ×300 000.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтетическая задача данного исследования заключалась в получении комплексов меди(II) и цинка(II) с анионами Fur– и различным набором N-донорных лигандов. Такая стратегия преследовала задачи определения влияния природы N‑донора на состав, строение и биологическую активность образующихся соединений. Комплексы меди и цинка были получены в реакциях их ацетатов и HFur (в соотношении 1 : 4) с последующим добавлением N-донора. Такой взаимный обмен кислотных остатков относится к биоизостерным модификациям11. На стадии смешения соли металла и карбоновой кислоты в ацетонитриле образовывалась суспензия, которая при добавлении лиганда и выдерживании реакционной смеси при 70°С, давала раствор. Кристаллы комплексов выделяли из реакционных растворов. В реакции Сu(OAc)2 ⋅ H2O, HFur и Py было выделено два продукта: на первой стадии кристаллизации формировался комплекс [Cu2(Fur)4(Py)2] (II), последующее выдерживание маточного раствора позволило выделить второй продукт – комплекс [Cu(Fur)2(Py)2(H2O)] (III). Можно предположить, что образование III происходит за счет роста концентрации пиридина относительно ионов меди(II) по мере выпадения комплекса II в осадок.
Все полученные соединения были выделены в виде монокристаллов, что позволило определить их кристаллическое строение. Основные длины связей в комплексах I–V приведены в табл. 2.
Таблица 2.
Основные длины связей для I–V
| Связь | d, Å | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| M−O(Fur) |
1.955(2)–1.9719(18) | 1.9728(15)–1.9742(19) | 1.947(4)–1.960(4) |
2.0424(19)–2.0563(15) | 2.0198(14)–2.0672(17) |
| M−O(H2O) | 2.218(4) | ||||
| M−N | 2.000(2)–2.024(2) | 2.168(3) | 2.025(5)–2.031(5) | 2.041(2) | 2.0252(19) |
Рис. 1.
Общий вид комплекса I (а) и III (б) в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Атомы водорода С–H удалены для ясности.
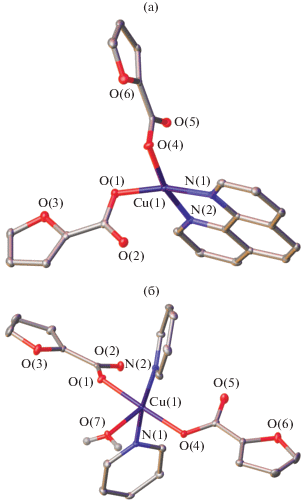
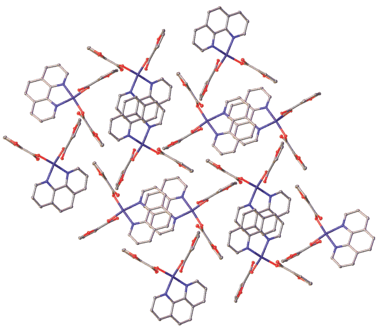
Комплекс I моноядерный: атом меди(II) окружен двумя атомами O двух фуроатных анионов и двумя атомами N-хелатной молекулы Phen (рис. 1а). Два атома O обеих карбоксилатных групп образуют слабые контакты с атомом меди (Cu…O 2.497, 2.532 Å). Геометрия полиэдра CuO2N2 соответствует искаженному квадрату. Между фенантролиновыми циклами соседних молекул комплекса наблюдаются π–π-стэкинг-взаимодействия, организующие отдельные молекулы в цепи, с расстоянием между центрами циклов 3.608(3) Å и углом 0.00(19)° (рис. 2).
Рис. 2.
Общий вид упаковки комплекса I в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Атомы водорода С–H удалены для ясности.
Комплекс III, так же как и I, моноядерный: атом меди координирует по два атома O двух анионов Fur–, два атома N двух молекул пиридина и атом O молекулы воды (pис. 1б). Геометрия полиэдра CuO3N2 соответствует квадратной пирамиде, основание которой составляют атомы N и атомы O карбоксилатных групп. Как следует из данных РСА (табл. 2), в моноядерных комплексах I и III наблюдаются наиболее прочные связи между Cu и атомами O фрагментов кислоты, что является результатом анион-катионных взаимодействий. Координированная к атому меди молекула воды в III образует водородные связи с атомами кислорода карбоксилат-анионов соседней молекулы (2.728(9) Å, 2.744(9) Å; 175(7)°, 169(5)°), формируя 1D-полимерный мотив (рис. 3).
Рис. 3.
Формирование 1D-мотива III. Общий вид водородных связей между молекулами комплекса III в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Атомы водорода С–H удалены для ясности.
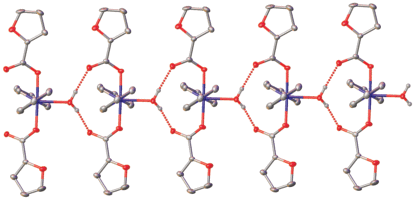
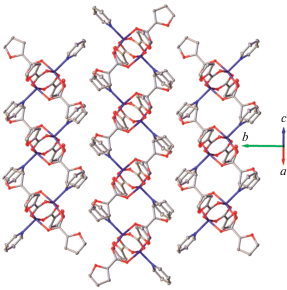
Комплексы II, IV и V представляют собой биядерные тетракарбоксилатно связанные комплексы (рис. 4, табл. 2). В этих соединениях каждый атом металла окружен четырьмя атомами O четырех µ-мостиковых карбоксилатных групп и одним атомом N пиридинового фрагмента. Окружение атомов металлов MO4N соответствует квадратной пирамиде с атомами O в основании. Гетероциклы внутри молекулы располагаются попарно во взаимно перпендикулярных плоскостях (рис. 5). Анализ упаковки молекул комплексов в кристаллах выявил перекрывание пиридинового и фуранового циклов соседних молекул. Длины связей M–O (Fur–) в комплексах IV и V достаточно близки между собой и несколько длиннее, чем в II (табл. 2).
Рис. 4.
Общий вид комплекса II в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Атомы водорода С–H удалены для ясности, пронумерованы только неуглеродные атомы в симметрически независимой части молекулы.
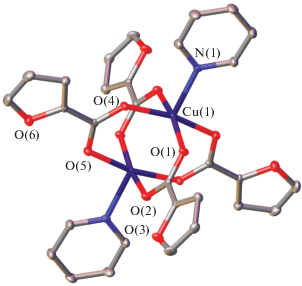
Рис. 5.
Общий вид упаковки комплекса II в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Атомы водорода С–H удалены для ясности.
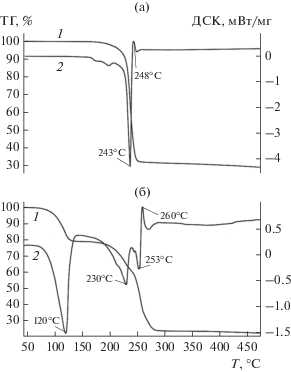
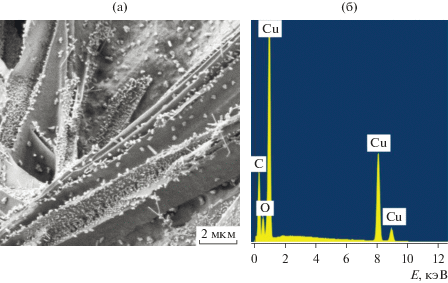
Термическое поведение II и III было исследовано методом СТА в атмосфере аргона (с одновременной регистрацией кривых ТГ и ДСК) до 450°С. Различия в составе и структуре комплексов обусловили разный характер протекания процессов термолиза. Комплекс II термостабилен до 175°С. Соединение разлагается в одну стадию с единственным эндотермическим эффектом (экстремум 243°С) (рис. 6a, 1, 2). Аналогичный характер термолиза был отмечен ранее для пивалатного комплекса цинка(II) [17]. На кривой ТГ комплекса III можно выделить три основные стадии (табл. 3, рис. 6 б, 1): первая в интервале 75–140°С сопровождается эндотермическим эффектом (экстремум 120°С) и соответствует десорбции координированной молекулы воды (Ткип = 100°С) и одной молекулы пиридина (Ткип = 115.6°С). Суммарная потеря массы на этой стадии составляет 20.9%, что полностью совпадает с теоретически рассчитанной. Вторая и третья стадии протекают друг за другом практически без стабилизации массы на кривой ТГ (рис. 6б, 1). Стадия 2 (табл. 3), соответствующая десорбции второй молекулы пиридина (mтеор/эксп = 17.1/17.4%), переходит в следующую – декарбоксилирование 2-фуранкарбоновой кислоты (200–205°С [18]) и частичное разложение аниона COО–. На кривой ДСК комплекса III (рис. 6б, 2) присутствует комплексный эндо-пик (экстремум 253°С) переходящий в экзо-пик (экстремум 260°С). Из 48% от общей массы комплекса, приходящейся на кислотные остатки, к 320°С уходит только ∼40%, оставшаяся часть элиминирует до конца процесса. Остатки после термолиза II и III представляют собой черные с металлическим блеском вещества. Для определения состава финального вещества III был проведен EDX и проанализирована микроморфология (рис. 7). Результаты эксперимента показывают наличие в продукте термолиза Сu (13.58%), O (11.75%) и С (74.67%), что соответствует образованию CuO с содержанием углерода (невысокая температура эксперимента и инертная атмосфера не позволяют полностью десорбироваться С). Поэтому финальная масса остатка несколько завышена.
Таблица 3.
Данные СТА для комплексов II и III (атмосфера аргона)
| Комплекс | Этап/ΔT, °С | Δm (TГ), % | Tэндо/экзо, °С | mфин, % |
|---|---|---|---|---|
| II | 1/125–206 | 69 | 243 ± 0.7, 248 ± 0.7 | 28.7 |
| III | 1/75–140 2/140–236 3/236–286 |
20.9 17.5 28.8 |
120 ± 0.7 230 ± 0.7 253 ± 0.7, 260 ± 0.7 |
2.52 |
Рис. 7.
Фотография микроморфологии (а; × 10 000) и энергодисперсионный спектр (б) остаточного вещества после термолиза III.
Все полученные результаты биоактивности in vitro исследованных соединений соотносились с активностью для изониазида (INH) и рифампицина (RMP) в данных условиях эксперимента. N‑Донорные лиганды, используемые в синтезе, биологическую активность не проявляют. Противомикробная активность индивидуальной HFur в отношении M. smegmatis незначительна (табл. 4). Однако в составе металлокомплекса наблюдался рост биоактивности [19]. Мы провели эксперименты, которые позволили определить бактериологическую эффективность комплексов в зависимости от лиганда и/или металла-комплексообразователя.
Таблица 4.
Результаты антибактериальной активности в отношении Mycolicibacterium smegmatis
| Соединение | MИК, мкг/диск | Зона ингибирования, мм | |
|---|---|---|---|
| 24 ч | 24 ч | 120 ч | |
| I | 2 | 7 (прозрачная)* | 7 (прозрачная) |
| II | 146 | 7 (мутная)** | 7 (мутная) |
| III | 153 | 7 (мутная) | 7 (мутная) |
| IV | 366 | 6.5 (прозрачная) | 6.5 (прозрачная) |
| V | 41 | 6.5 (прозрачная) | 6.5 (прозрачная) |
| HFur | 112 | ||
| INH | 25 | 7 (мутная) | 6.5 (мутная) |
| RMP | 41 | 6.5 (прозрачная) | 6.5 (прозрачная) |
Антибактериальная активность соединений I–V была определена в отношении непатогенного штамма M. smegmatis. Известно, что устойчивость микобактерий к химиотерапевтическим агентам связана с низкой проницаемостью микобактериальной клеточной стенки, с ее необычной структурой. M. smegmatis быстрорастущие непатогенные бактерии и поэтому используются в качестве модельного организма для медленно растущих бактерий M. tuberculosis, а также для первичного скрининга противотуберкулезных препаратов [20]. Тест-система M. smegmatis проявляет более высокую степень устойчивости к антибиотикам и противотуберкулезным агентам, чем M. tuberculosis, поэтому критерием отбора является концентрация вещества <100 нмоль/диск в отличие от M. tuberculosis [21]. Метод испытания включает количественную оценку диаметра зоны подавления роста культуры M. smegmatis, выращенной газоном на агаризованной среде, вокруг бумажных дисков, пропитанных испытуемыми соединениями. Вещества наносили на диски в разных концентрациях. Наблюдали увеличение диаметра halo (зона ингибирования роста) с увеличением количества вещества, нанесенного на диск. Концентрация вещества (мкг/диск), при которой наблюдается минимальная видимая зона подавления роста, считается MИК. Результаты антибактериальной активности в тестовой системе M. smegmatis mc2 155 и ее изменение с течением времени для соединений I–V приведены в табл. 4. Как видно из данных табл. 4 соединения II–IV с пиридином в качестве ко-лиганда не проявляют биологической активности. При замене пиридина на его производное Рhpy в V биологическая эффективность комплекса увеличивается и становится сопоставимой с активностью изониазида. Неожиданным оказался результат при использовании 1,10-фенантролина в качестве дополнительного лиганда в комплексе меди I – его биологическая активность оказалась в 5 раз выше, чем у RMP и примерно в 12.5 выше, чем у INH.
Таким образом, это исследование показало, что ионы меди(II) и цинка(II) с анионами 2-фуранкарбоновой кислоты формируют биядерные комплексы с монодентатными N-донорными лигандами, пиридином или 2-фенилпиридином. Образование моноядерного комплекса меди(II) с пиридином в качестве второго продукта реакции, скорее всего, происходит на фоне роста концентрации Рy в реакционной смеси. Использование хелатирующего 1,10-фенантролина в реакции с медью(II) приводит к формированию моноядерного комплекса. Среди исследованных образцов на биологическую активность in vitro в отношении M. smegmatis комплексы I и V являются наиболее перспективными, их биоэффективность сопоставима (V) или же значительно выше (I), чем у рифампицина и изониазида.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
WHO Global Tuberculosis Rreport 2018. Geneva: World Health Organization, 2018.
Honsa E.S., Johnson M.D.L., Rosch J.W. // Front. Cell. Infect. Microbiol. 2013. V. 3. P. 92.
Nagababu P., Naveena J., Latha L. et al. // Canad. J. Microbiol. 2006. V. 52. P. 1247.
Phopin K., Sinthupoom N., Treeratanapiboon L. et al. // EXCLI J. 2016. V. 15. P. 144.
Rojas S., Devic T., Horcajadac P. // J. Mater. Chem. B. 2017. V. 5. P. 2560.
Anacona J.R., Bravo A., Lopez M.E. // Lat. Am. J. Pharm. 2012. V. 31. P. 27.
Djoko K.Y., Goytia M.M., Donnelly P.S. et al. // Antimicrob. Ag. Chemoter. 2015. V. 59. P. 6444.
Tumer M., Koksal H., Serin S. // Transition Met. Chem. 1999. V. 24. P. 13.
Bello-Vieda N.J., Pastrana H.F., Garavito M.F. // Molecules. 2018. V. 23. P. 361.
Patel M.N., Parmar P.A., Gandhi D.S. // J. Enzyme Inhib. Med. Chem. 2010. V. 26. P. 188.
Sriram D., Yogeeswari P., Vyas D.R.K. et al. // Bioorgan. Med. Chem. Lett. 2010. V. 20. P. 4313.
Elsaman T., Suliman M., Mohamed M. // Bioorgan. Chem. 2019. V. 88. P. 102969.
Stüve P., Minarrieta L., Erdmann H. // Front. Immonol. 2018. V. 9. P. 495.
Овчинников Ю.А. Биоорганическая химия. Москва: Просвещение, 1987. 815 с.
Sheldrick G.M. // Acta Crystallpgr. A. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339.
Lutsenko I.A., Kiskin M.A., Efimov N.N. et al. // Polyhedron. 2017. V. 137. P. 165.
Wilson W.C. // Org. Synth. 1927. V. 7. P. 40.
Melnic S., Prodius D., Stoeckli-Evans H. et al. // Eur. J. Med. Chem. 2010. V. 45. P. 1465.
Ramon-García S., Ng C., Anderson H. et al. // Antimikrob. Agents Chem. 2011. V. 8. P. 3861.
Bekker O.B., Sokolov D.N., Luzina O.A. et al. // Med. Chem. Res. 2015. V. 24. P. 2926.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия