Координационная химия, 2020, T. 46, № 7, стр. 421-428
Синтез и структура новых комплексов золота(I) с 1,5-диаза-3,7-дифосфациклооктанами
Ю. С. Спиридонова 1, *, И. Д. Стрельник 1, Э. И. Мусина 1, Е. Хей-Хокинс 2, И. А. Литвинов 1, А. А. Карасик 1
1 Институт органической и физической химии им. А.Е. Арбузова Казанского научного центра РАН
Казань, Россия
2 Институт неорганической химии Университета Лейпцига
Лейпциг, Германия
* E-mail: aik791@gmail.com
Поступила в редакцию 10.01.2020
После доработки 07.02.2020
Принята к публикации 17.02.2020
Аннотация
Взаимодействием хлорида золота(I) или тетрагидротиофензолото(I) хлорида с 1,5-ди(p-толил)-3,7-дифенил-1,5,3,7-диазадифосфациклооктаном в разных соотношениях получены новые би- и трехъядерные комплексы золота(I). Структура полученных соединений подтверждена методами ЯМР-спектроскопии, элементного анализа и РСА (CIF files ССDC № 1974032 (I), 1974031 (II)). Показано, что в отличие от P-пиридилсодержащих 1,5-диаза-3,7-дифосфациклооктанов P-фенилзамещенные лиганды не претерпевают перегруппировки с расширением цикла в ходе формирования трехъядерных комплексов золота(I).
Металлокомплексы золота(I) с органическими лигандами, в которых возможно проявление аурофильности, слабых взаимодействий, характерных для катионов d-металлов, – уникальные объекты для исследований [1–5]. Полифосфиновые лиганды в комплексах золота(I) являются структурообразующими, и в то же время в комплексообразовании используются гибкие лиганды, способные подстраиваться под структуру формируемого ядра комплекса [6–11]. Лабильность лигандов в комплексах золота(I) используется для конструирования систем, обладающих люминесцентным откликом на наличие катионов металлов, органических растворителей и других субстратов [6, 12]. Намного реже используются полифосфиновые лиганды, имеющие жесткий каркас и обладающие ограниченной подвижностью, задающие геометрию ядра комплекса [13–15]. К такому классу лигандов можно отнести среднециклические аминометилфосфины, в которых два атома фосфора связаны в одной достаточно жесткой циклической системе. Тем не менее недавно было продемонстрировано, что жесткий каркас этих восьмичленных гетероциклических лигандов в условиях комплексообразования способен трансформироваться, давая гетероциклы большего размера. В частности, была показана возможность перегруппировки 1,5-ди(р-толил)-3,7-дипиридин-2-ил-1,5-диаза-3,7-дифосфациклооктана на трехъядерном темплате золота(I) в комплекс с 16-членным лигандом [16].
С другой стороны, полученные недавно в нашей лаборатории комплексы золота(I) на основе P-пиридилзамещенных 1,5-диаза-3,7-дифосфациклооктанов проявляют отклик люминесценции на наличие молекул растворителей как в твердой фазе, так и в растворе [13, 14, 17, 18]. Это явление для комплексов 1,5-диаза-3,7-дифосфациклоктанов обусловлено несколькими факторами, основным из которых является формирование супрамолекулярных систем по типу “гость–хозяин”. В указанных выше системах ключевую роль в формировании граничных молекулярных орбиталей, участвующих в процессах переноса заряда, вызывающих эмиссионные свойства, играют пиридильные фрагменты.
В настоящей работе мы представляем синтез новых комплексов золота(I) с 1,5-ди(р-толил)-3,7-дифенил-1,5-диаза-3,7-дифосфациклооктаном (L), в структуре которого отсутствует хромофорный пиридильный фрагмент, изучение их структурных параметров и спектральных свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции с производными золота(I) проводили в инертной атмосфере. Растворители очищали и дегазировали стандартными методами. Синтез лиганда L осуществляли по методике [19]. Au(Тht)Cl и AuCl коммерчески доступны.
Все ЯМР-эксперименты проводили при 303 К. Спектры ЯМР 1Н и 31Р регистрировали на ЯМР-спектрометре Bruker Avance-DRX 400 на частотах 161.9 МГц (31P) и 400.13 МГц (1Н). Химические сдвиги приводили по шкале δ (м.д.) относительно сигналов SiMe4 (δH 0.0 м.д.) и H3PO4 (δP 0.0 м.д.).
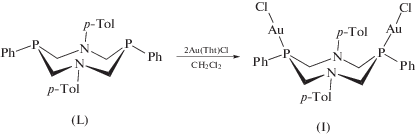
Синтез дихлоро[1,5-ди(p-толил)-3,7-дифенил-1,5-диаза-3,7-дифосфациклооктан]дизолото(I) (I). К раствору 0.100 г (0.21 ммоль) L в 2 мл CH2Cl2 приливали 0.134 г (0.42 ммоль) тетрагидротиофензолото(I) хлорида в 3 мл CH2Cl2 и перемешивали 3 ч. Образовавшийся осадок отфильтровывали и промывали CH2Cl2, сушили в вакууме. Выход I 0.17 г (92%).
Кристаллы I, пригодные для РСА, выращивали медленным упариванием растворителя из раствора комплекса I в CH3CN. Кристаллы I (C30H32N2P2Cl2Au2 + неопределeнный растворитель, M = 947.36) бесцветные призматические, моноклинные.
Спектр ЯМР 31P (CD3CN; δ, м.д.): 1.87. Спектр ЯМР 1Н (CD3CN; δ, м.д.): 2.26 (с., 6H, CH3), 4.66 (м., ш, 2H, P–CH2–N), 4.69 (м., ш, 2H, P–CH2–N), 4.86 (д.д., 2JHH = 4.58 Гц, 2JPH = 15.6 Гц, 4H, P–CH2–N), 6.98 (д., 2JHH = 8.2 Гц, 4H, C6H4), 7.06 (д., 2JHH = 8.24 Гц, 4H, C6H4), 7.67–7.71 (м., ш, 6H, C6H5), 7.96–8.00 (м., ш, 4H, C6H5).
| Найдено, %: | С 39.70; | H 4.20; | N 3.30; | P 6.30; | Cl 5.60; | Au 40.90. |
| Для C30H32N2P2Cl2Au2 | ||||||
| вычислено, %: | С 38.00; | H 3.40; | N 2.96; | P 6.56; | Cl 7.48; | Au 41.60. |
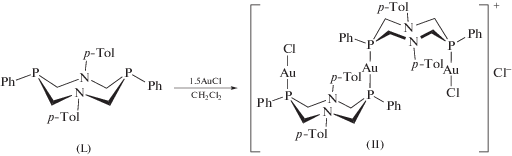
Синтез дихлоро[1,5-ди(p-толил)-3,7-дифенил-1,5-диаза-3,7-дифосфациклооктан]тризолотo(I) хлоридa (II). К раствору 0.100 г (0.21 ммоль) L в 2 мл CH2Cl2 приливали 0.072 г (0.31 ммоль) хлорида золота в 3 мл CH2Cl2 и перемешивали 3 ч. Образовавшийся осадок отфильтровывали и промывали CH2-Cl2. Выход II 0.065 г (17%).
Кристаллы II, пригодные для РСА, выращивали из бифазной системы ДМФА–CH3CN в соотношении 1 : 4. Кристаллы II ([C60H63N4P4Cl2Au3]+Cl– + + неопределeнный растворитель, M = 1661.29) бесцветные, призматические, моноклинные.
Спектр ЯМР 31P (ДМСО-d6; δ, м.д.): –1.2. Спектр ЯМР 1Н (ДМСО-d6; δ, м.д.): 1.90 (с., ш, 6H, CH3); 2.07 (с., ш, 3H, CH3 (скрыт за ацетоном)), 2.18 (с., ш, 3H, CH3), 4.65–4.68 (м., ш, 4H, P–CH2–N), 5.16–5.20 (м., ш, 4H, P–CH2–N), 6.82–7.08 (м., ш, 8H, C6H4), 7.65–7.77 (м., ш, 10H, C6H5).
| Найдено, %: | С 42.80; | H 3.40; | N 4.02; | P 6.78; | Cl6.24; | Au 36.76. |
| Для C60H64N4P4Cl3Au3 | ||||||
| вычислено, %: | C 43.35; | H 3.88; | N 3.37; | P 7.45; | Cl 6.40; | Au 35.55. |
РСА I и II выполнен на дифрактометре Bruker Smart APEX II CCD в отделении РСА федерального центра коллективного пользования (ЦКП САЦ) на базе лаборатории дифракционных методов исследования ИОФХ им. А.Е. Арбузова Ка-зНЦ РАН. Параметры ячеек и экспериментальные данные получены при T = 296(2) K (MoKα-излучение, λ = 0.71073 Å, ω-сканирование). Учет поглощения проведен по программе SADABS [20]. Структуры расшифрованы прямым методом по программе SHELXT 2014/4 [21] и уточнены полноматричным МНК по F 2 по программе SHELXL-2018/3 [22]. Все расчеты выполнены с использованием программного пакета WinGX-2014.1 [23] и APEX2 [24]. Неводородные атомы уточнены в анизотропном приближении. В обеих структурах выявлено множество интенсивных пиков электронной плотности, попытки задания их в качестве сольватных молекул не привели к успеху. Предприняты попытки задания сольватных молекул ацетонитрила, хлористого метилена, ацетона, диметилформамида. Во всех случаях приходилось фиксировать геометрию сольватных молекул, уточнять дробную заселенность позиций молекул. Тем не менее эти попытки приводили к нереальным параметрам тепловых колебаний. Понижение симметрии структур (переход в нецентросимметричные пространственные группы) не привело к исчезновению разупорядоченности. Было принято решение уточнять обе структуры по процедуре SQUEEZE из программы PLATON [25] для учета неопределенного растворителя. Атомы водорода при атомах углерода молекулярных комплексов помещены в вычисленные положения и уточнены по “схеме наездника”. Кристаллографические данные и результаты уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| М | 947.36 | 1662.30 |
| T, K | 296 | 296 |
| Пр. гр. | С2/с | P21/n |
| Z | 4 (молекула в частном положении на оси 2) | 4 |
| a, Å | 23.04(3) | 11.404(2) |
| b, Å | 11.316(16) | 26.382(5) |
| c, Å | 16.01(2) | 21.801(4) |
| β, град | 126.222(16) | 97.160(2) |
| V, Å3 | 3367(8) | 6508(2) |
| ρ(выч.), г см–3 | 1.869 | 1.697 |
| μ, мм–1 | 8.979 | 7.006 |
| F(000) | 1792 | 3200 |
| 2θmax, град | 57.2 | 58.0 |
| Диапазон индексов hkl | –30 ≤ h ≤ 30, –15 ≤ k ≤ 15, –20 ≤ l ≤ 21 |
–14 ≤ h ≤ 15, –34 ≤ k ≤ 34, –29 ≤ l ≤ 29 |
| Число отражений измеренных/независимых | 13 572/4089 | 56 618/16 042 |
| Rint | 0.1255 | 0.1349 |
| Oтражений с I > 2σ(I) | 1697 | 6474 |
| Число уточняемых параметров | 172 | 667 |
| R1/wR2 (I > 2σ(I)) | 0.0612/0.1340 | 0.0718/0.1677 |
| R1/wR2 (по всем отражениям) | 0.1572/0.1757 | 0.2093/0.2125 |
| GOOF | 0.852 | 0.995 |
| Остаточная электронная плотность (max/min), e/Å3 | –3.02/1.22 | –2.01/2.19 |
Координаты атомов, длины связей, валентные углы и температурные параметры депонированы в Кембриджской базе структурных данных (ССDC № 1974032 (I), 1974031 (II); deposit@ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В результате взаимодействия тетрагидротиофензолото(I) хлорида с 1,5-диаза-3,7-дифосфациклооктаном в соотношении 1 : 2 с количественным выходом образуется биядерный комплекс I в виде белого порошка (схема 1 ).
Схема 1 .
Комплекс стабилен на воздухе как в твердом состоянии, так и в растворе. Полученное соединение растворимо в ДМСО, ДМФА и, ограниченно, в ацетонитриле.
В спектре ЯМР 31Р соединения I регистрируется узкий сигнал при 1.87 м.д. Спектр ЯМР 1H соединения содержит хорошо разрешенный набор сигналов как для ароматической, так и для гетероциклической частей молекулы, аналогичный тому, который наблюдается для биядерного комплекса золота(I) с 1,5-ди(р-толил)-3,7-ди(пиридил-2-ил)-1,5,3,7-диазадифосфациклооктаном [13]. Ароматическая часть р-толильного фрагмента представлена АВ-системой при 6.98 и 7.08 м.д с константой спин-спинового взаимодействия (КССВ) 8.2 Гц. Протоны фенильных групп регистрируются двумя мультиплетами при 7.7 и 7.97 м.д. с соответствующими интегральными интенсивностями. Протоны гетероциклического фрагмента P–CH2–N регистрируются при 4.68 и 4.88 м.д. в виде одного дублета дублетов с КССВ 2JHH = 15.6 Гц и 2JPH = = 4.58 Гц и одного уширенного дублета. Зарегистрированная спектральная картина позволяет утверждать, что гетероциклическая часть лиганда находится в C2-симметричной конформации, близкой к конформации свободных лигандов. Протоны метильной группы р-толильного фрагмента регистрируются в виде узкого синглета при 2.26 м.д.
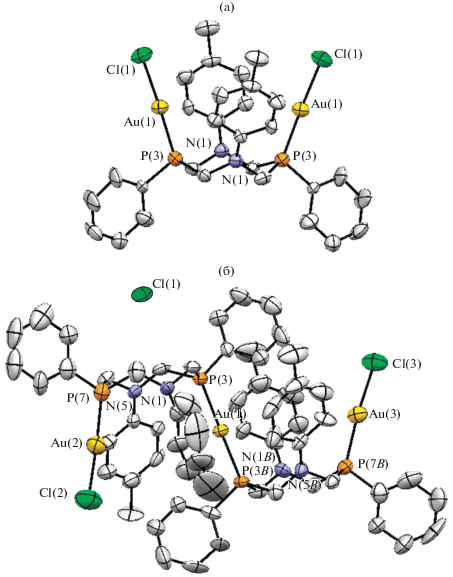
Структура комплекса была подтверждена методом РСА и представлена на рис. 1а. Пригодные для исследования кристаллы комплекса I были выращены медленным упариванием раствора комплекса в ацетонитриле. Молекула лиганда в комплексе I имеет конформацию “кресло-кресло” с экваториальной ориентацией заместителей при атомах фосфора и аксиальной ориентацией р-толильных заместителей при атомах азота, так что оба золотосодержащих фрагмента находятся с одной стороны цикла. Внутримолекулярное расстояние Au⋯Au составляет 5.834 Å, при таком строении молекулы в ней создается небольшая полость, образованная фрагментами P–Au–Cl и заместителями при атомах азота, находящимися с одной стороны цикла. Четыре аксиальных протона фрагмента P–CH2–N молекулы лиганда с другой стороны гетероцикла предорганизованы для слабых электрофильных взаимодействий с молекулой растворителя. К сожалению, не удалось однозначно определить сольватную молекулу, разупорядоченную осью симметрии. Локализация множества интенсивных пиков в разностных рядах электронной плотности в полости комплекса свидетельствует о нахождении в ней сольватных молекул (в качестве которых пытались задать ацетонитрил, хлористый метилен, ацетон, диметилформамид). В заключительных циклах структура уточнена по процедуре SQUEEZE [25] (учет неопределенного растворителя).
Рис. 1.
Геометрия молекул I (а) и II (б) в кристалле. Атомы водорода не показаны. Эллипсоиды приведены с вероятностью 50%.
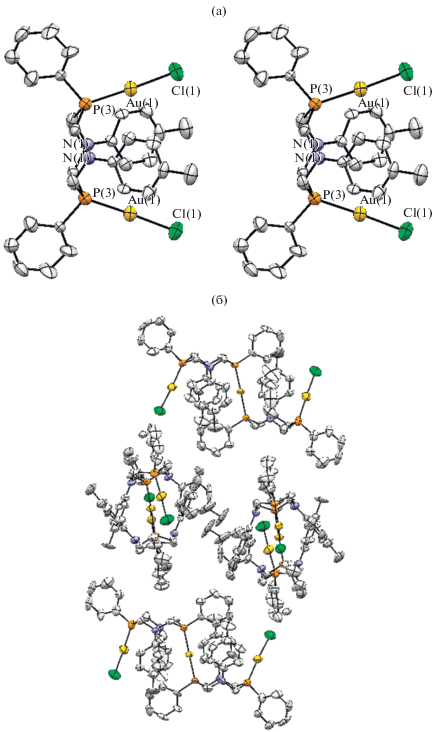
Анализ упаковки кристалла соединения I позволяет предположить, что молекулы неопределенного растворителя связывают молекулы комплекса в стопки по оси симметрии кристалла (вдоль оси b) по типу “голова к хвосту” слабыми взаимодействиями. Существуют также взаимодействия между атомами водорода при атомах углерода восьмичленного гетероцикла и сольватными молекулами с одной стороны, и атомами хлора, золота и п-толильными заместителями – с другой (рис. 2a). При этом можно предположить, что отсутствие в кристалле I сильных направленных межмолекулярных взаимодействий (типа классических водородных связей) приводит к разупорядоченности сольватных молекул в нем.
Рис. 2.
Фрагмент упаковки кристалла соединений I (а) (показаны доступные для молекул растворителя полости между соседними молекулами) и II (б).
При взаимодействии лиганда L c хлоридом золота(I) в соотношении 2 : 3 с количественным выходом образуется трехъядерный комплекс II катионного типа в виде белого порошка (cхема 2).
Схема 2 .
В отличие от комплекса I соединение II растворимо только в ДМСО и ДМФА. Для раствора соединения II в ДМСО-d6 в спектрах ЯМР наблюдается уширение сигналов, связанное с возможной диссоциацией и разрушением комплекса. Так, в спектре ЯМР 31P регистрируется слабоинтенсивный сигнал при 1.8 м.д. В спектре ЯМР 1H соединения II протоны фенильного фрагмента регистрируются в виде двух групп неразрешенных мультиплетов при 7.07 и 7.67 м.д., протоны р‑толильного фрагмента – в виде мультиплетов при 6.82–6.98 и 7.77–8.02 м.д., частично перекрывающихся с сигналами протонов фенильного фрагмента при атомах фосфора, протоны цикла регистрируются в виде двух дублетов при 4.68–5.16 м.д. и одного сильно уширенного мультиплета в области 4.38 м.д. Таким образом, в комплексе II в растворе наблюдается неэквивалентность двух частей аминометилфосфинового цикла, вызванного различным связыванием двух эндоциклических атомов фосфора с катионами золота(I). Интегральные интенсивности и расположение всех групп сигналов согласуются с предполагаемой структурой, показанной на схеме 2 .
Структура комплекса II была окончательно установлена методом РСА. Пригодные для исследования кристаллы комплекса II выращены из бифазной смеси диметилформамида с ацетонитрилом. Так же, как и в структуре I, не удалось однозначно определить тип растворителя: в разностных рядах электронной плотности можно “собрать” из интенсивных пиков и молекулы ацетонитрила, и диметилформамида, и хлористого метилена, и ацетона. При уточнении даже с наложением ограничений на длины связей и параметры тепловых колебаний атомов эти молекулы с дробной заселeнностью не дают разумной геометрии разупорядоченных фрагментов. Поэтому было принято решение уточнять структуру по процедуре SQUEEZE [25] (учeт неопределeнного растворителя).
В кристалле II комплекс является катионом, противоионом – хлорид-анион (pис. 1б). В трехъядерном катионе один из атомов золота мостиковый между двумя гетероциклическими лигандами и имеет линейную координацию (валентный угол P(3)Au(1)P(3В) 178.8(1)°). Атомы золота концевых групп также имеют практически линейную координацию (углы Cl(2)Au(2)P(7) 176.95(17)° и Cl(3)Au(3)P(7B) 174.18(15)°). Длины связей Au(1)–P(3) и Au(1)–P(3В) 2.303(3) и 2.293(3) Å в пределах экспериментальных погрешностей одинаковы (Au(2)–P(7) 2.223(4) и Au(3)–P(7B) 2.222(3) Å) и немного меньше, чем длины связей мостикового атома золота. Связи Au(2)–Cl(2) 2.284(5) и Au(3)–Cl(3) 2.282(4) Å также одинаковые. Внутримолекулярные расстояния Au(1)…Au(2) и Au(1)…Au(2) составляют 5.601 и 5.849 Å, что исключает какое-либо аурофильное взаимодействие. Казалось бы, что комплексный катион имеет симметричную конформацию и мог бы в кристалле находиться в частном положении. Но общее положение катиона в кристалле объясняется различной конформацией гетероциклических лигандов. Несмотря на то что конформация восьмичленных гетероциклов одинаковая, “кресло-кресло”, как и в свободной молекуле лиганда, и фенильные заместители при атомах фосфора имеют экваториальную ориентацию, а р-толильные заместители при атомах азота – аксиальную ориентацию, лиганды различаются разворотом р‑толильных заместителей. В лиганде В оба атома азота имеют практически плоскую координацию связей (сумма валентных углов при атомах N(1B) и N(5B) 356.8(9)° и 357.1(9)° соответственно) и плоскости ароматических колец при них компланарны плоскостям связей атомов азота (торсионные углы вокруг связей N(1B)–C(9B)–N(5В)–C(22B) 14(2)° и 3(2)°). В первом лиганде атом N(5) имеет практически плоскую координацию (сумма валентных углов при нем 357.7(9)°), а атом N(1) имеет тригонально-пирамидальную координацию (сумма валентных углов при нем 348.6(9)°). р-Толильный заместитель при атоме N(5) находится в плоскости его связей (торсионный угол вокруг связи N(5)–C(22) 2(2)°), но заместитель при атоме N(1) находится в бисекторной плоскости эндоциклических связей атома азота (торсионный угол вокруг связи N(1)–C(9) 75(2)°), что исключает сопряжение неподеленной электронной пары (НЭП) атома азота с ароматическим кольцом. Отсутствие сопряжения в первом лиганде проявляется в некотором удлинении связи N(1)–C(9) 1.420(16) Å по сравнению со связью N(1B)–C(9B) 1.394(15) Å.
Анализ упаковки кристалла соединения II показывает, что хлорид-анион имеет короткие контакты с атомами водорода при атомах углерода восьмичленных гетероциклов соседних молекул, а неопределенные сольватные молекулы располагаются в полостях между атомами Au(2) и Cl(2) соседних молекул (рис. 2б), связанных центром симметрии.
Важно отметить, что в аналогичной реакции хлорида золота(I) с Р-пиридилзамещенным аминометилфосфином происходит перегруппировка, сопровождающаяся расширением диазадифосфациклоооктанового цикла до 16-членного макроцикла [16], и образуется изомерный комплекс. Вероятно, наличие пиридильной группы обуслoвливает большую лабильность фрагмента P–CH2–N лиганда по сравнению с Р-фенилзамещенными аналогами.
Таким образом, получены новые комплексы хлорида золота (I) на основе 1,5-диаза-3,7-дифосфациклооктанов и установлена их структура в растворах и твердой фазе. Показано, что в кристаллической структуре биядерного комплекса золота(I) реализуется так называемая “открытая” конформация комплекса, связанная с образованием комплекса по типу “гость-хозяин”, реализующегося за счет формирования слабых взаимодействий с фрагментами P–Au–Cl с одной стороны и с фрагментами P–CH2–N – с другой. Образование комплекса по типу “гость-хозяин” подтверждает тенденцию к реализации такого рода взаимодействий во всех аналогичных комплексах независимо от заместителей при атомах фосфора. Показано, что в отличие от пиридилсодержащих 1,5-диаза-3,7-дифосфациклооктанов P-фенилзамещенные лиганды не претерпевают перегруппировки с расширением цикла в ходе формирования трехъядерных комплексов золота(I). Обнаружено необычное бисекторное расположение р-толильного заместителя в комплексе, вызывающее выход из сопряжения НЭП атома азота аминометилфосфинового цикла. Полученные комплексы не проявляют существенной эмиссии в твердой фазе и в растворах, что подтверждает необходимость введения к атомам фосфора хромофорных групп, формирующих граничные молекулярные орбитали, участвующие в переносе заряда и вызывающие эмиссионные свойства, для конструирования люминесцентных комплексов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Pyykkoe P. // Chem. Soc. Rev. 2008. V. 37. № 9. P. 1967.
Pyykkoe P. // Chem. Rev. 1997. V. 97. № 3. P. 597.
He X., Yam V.W.W. // Coord. Chem. Rev. 2011. V. 255. № 17–18. P. 2111.
Wong V.C.H., Po C., Leung S.Y.-L. et al. // J. Am. Chem. Soc. 2018. V. 140. № 2. P. 657.
Schmidbaur H., Schier A. // Chem. Soc. Rev. 2012. V. 41. P. 370.
Lima J.C., Rodriguez L. // Chem. Soc. Rev. 2011. V. 40. P. 5442.
Yam V.W.W., Chan C.L., Li C.K., Wong K.M.C. // Co-ord. Chem. Rev. 2001. V. 216–217. P. 173.
Moreno-Alcantar G., Romo-Islas G., Flores-Alamo M. et al. // New J. Chem. 2018. V. 42. P. 7845.
Musina E.I., Wittmann T.I., Lonnecke P. et al. // Russ. Chem. Bull. 2018. V. 67. № 2. P. 328.
Shakirova J.R., Grachova E.V., Melnikov A.S. et al. // Organometallics. 2013. V. 32. № 15. P. 4061.
Koshevoy I.O., Karttunen A.J., Kritchenkou I.S. et al. // Inorg. Chem. 2013. V. 52. № 7. P. 3663.
Wenger O.S. // Chem. Rev. 2013. V. 113. P. 3686.
Strelnik I. Gurzhiy V.V., Sizov V.V. et al. // CrystEngComm. 2016. V. 18. P. 7629.
Shamsutdinova N.A., Strelnik I.D., Musina E.I. et al. // New J. Chem. 2016. V. 40. № 11. P. 9853.
Arif T., Cazorla C., Bogliotti N. et al. // Catal. Sci. Technol. 2018. V. 8. № 3. P. 710.
Strelnik I.D., Dayanova I.R., Poryvaev T.M. et al. // Mendeleev Commun. 2020. V. 30. № 1. P. 40.
Karasik A.A., Musina E.I., Strelnik I.D. et al. // Pure Appl. Chem. 2019. V. 91. № 5. P. 839.
Nikolaeva Y.A., Balueva A.S., Khafizov A.A. et al. // Dalton Trans. 2018. V. 47. № 23. P. 7715.
Maerkl G., Jin G.Y., Schoerner Ch. // Tetrahedron Lett. 1980. V. 21. № 15. P. 1409.
Sheldrick G.M. SADABS. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. SHELXT (version 4). 2014.
Sheldrick G.M. SHELXL (version 3). 2018.
Farrugia L.J. // J. Appl. Cryst. 2012. V. 45. P. 849.
APEX2 (version 2.1). SAINTPlus. Data Reduction and Correction Program (version 7.31A). Bruker Advanced X-ray Solution. Bruker AXS Inc., 2006.
Spek A.L. // Acta Crystalligr. D. 2009. V. 65. P. 148.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия