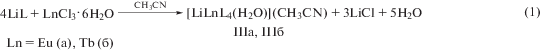Координационная химия, 2020, T. 46, № 8, стр. 485-492
Редкий пример дискретных лантанид-литий тетракис-β-дикетонатов. Синтез, строение и люминесцентные свойства
Ю. С. Кудякова 1, П. А. Слепухин 1, 2, М. С. Валова 1, Я. В. Бургарт 1, 2, В. И. Салоутин 1, 2, Д. Н. Бажин 1, 2, *
1 Институт органического синтеза им. И.Я. Постовского УрО РАН
Екатеринбург, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: dnbazhin@gmail.com
Поступила в редакцию 26.12.2019
После доработки 13.02.2020
Принята к публикации 17.02.2020
Аннотация
Взаимодействие функционализированного CF3-β-дикетоната лития (LiL) с хлоридами европия(III) и тербия(III) в среде ацетонитрила приводит к гетеробиметаллическим комплексам с общей формулой [LiLnL4(H2O)](CH3CN) (Ln = Eu (IIIa), Tb (IIIб). Установлено, что формирование (Ln-Li)-тетракис-β-дикетонатов возможно также при кристаллизации из ацетонитрила ранее синтезированных комплексов состава [(LnL3)(LiL)(MeOH)] (I) и [(LnL3)(LiL)(H2O)] (II). Впервые в ряду (Ln-Li)-тетракис-β-дикетонатов монокристаллы соединений были охарактеризованы методом РСА (CIF files CCDC № 1973632 (IIIa), 1973633 (IIIб)). Изучены фотолюминесцентные свойства полученных гетерометаллических комплексов в твердом виде.
Интерес к комплексным соединениям на основе трехвалентных ионов лантанидов (Ln) обусловлен их уникальными люминесцентными свойствами, включая характерный спектральный диапазон, узкие полосы испускания и длинные времена жизни [1–7]. Оптимизация люминесцентных свойств комплексов Ln(III) требует тонкой настройки молекулярной структуры используемых органических лигандов. Интенсивное использование 1,3-дикетонов в качестве хелатирующих агентов связано с их эффективным связыванием с ионами металлов и возможностью варьирования природы заместителей в дикарбонильном фрагменте [8–12]. Наиболее перспективные лантанидные комплексы на основе 1,3-дикетонов – трис-дикетонаты Ln(β-дикетонат)3(солиганд) и тетракис-дикетонаты (катион)Ln(β-дикетонат)4 вследствие проявляемых ими ярких (механо)люминесцентных свойств [3, 13, 14].
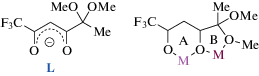
Ранее мы синтезировали гетеробиметаллические биядерные комплексы [(LnL3)(LiL)(MeOH)] (I) и [(LnL3)(LiL)(H2O)] (II) (Ln = Eu, Tb, Dy) на основе полученного CF3-β-дикетоната лития (LiL) [15]. Структура используемого β-дикетонат-аниона L и реализуемые им координационные возможности представлены на схеме 1 .
В состав (Ln-Li)-комплексов (I, II) входит четыре молекулы лиганда, что, с одной стороны, делает их схожими c известными тетракис-β-дикетонатами лантанидов(III). С другой стороны, оригинальная структура комплекса формируется за счет лантанидного трис-β-дикетонатного фрагмента и исходного дикетоната лития, выступающего в качестве солиганда. Важно отметить, что именно наличие дополнительной функциональной группы в структуре дикетоната способствует формированию уникальных структур гетеробиметаллических комплексов [16, 17].
Схема 1 .
В настоящей работе рассмотрен подход к получению литий-лантанидных тетракис-β-дикетонатов с использованием функционализированного трифторметилсодержащего β-дикетоната лития (LiL), а также изучены их фотолюминесцентные свойства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом новых комплексов, выполняли на воздухе с использованием коммерческих реактивов (EuCl3 ∙ 6H2O (99.99%), TbCl3 ∙ 6H2O (99.99%) и ацетонитрила (Alfa Aesar)). Трифторметилсодержащий β-дикетонат лития LiL синтезирован согласно работе [18].
ИК-спектры соединений регистрировали на ИК-Фурье спектрометре Perkin Elmer Spectrum One в интервале 400–4000 см–1 с использованием приставки диффузного отражения для твердых веществ. Элементный анализ выполняли на автоматическом анализаторе Perkin Elmer PE 2400 Series II.
Измерения фотолюминесцентных свойств проводили на флуоресцентном спектрофотометре Varian Cary Eclipse. Фосфоресценцию измеряли в твердой фазе, кристаллы наносиди на кварцевое стекло, повернутое на 50° в сторону, противоположную окну детектора, чтобы избежать отражений. Механолюминесценцию синтезированных комплексов исследовали на данном спектрофотометре в режиме Bio/Chemiluminescence при растирании кристаллов между кварцевыми стеклами.
Синтез комплексов [LiLn(L)4(H2O)](CH3CN) (Ln = Eu (IIIa), Tb (IIIб)). К β-дикетонату лития LiL (4 ммоль) в 15 мл ацетонитрила добавляли LnCl3 ∙ 6H2O (1 ммоль). Полученную суспензию нагревали до кипения и выдерживали до образования прозрачного раствора, после чего охлаждали до комнатной температуры. Медленное упаривание растворителя приводило к образованию кристаллов комплексов. Кристаллы промывали водой, сушили в вакууме. Выход IIIa 0.90 г (80%), IIIб 0.96 г (85%).
| Найдено, %: | С 35.47; | H 3.93; | N 0.72. |
| Для C32H42O17F12LiEu ∙ 0.5 (CH3CN) (IIIa) (в расчете на 1/2 сольватной молекулы ацетонитрила) | |||
| вычислено, %: | С 35.83; | H 3.96; | N 0.63. |
ИК-спектр (ν, см–1): 3538, 3489 ν(O–H), 3001, 2948, 2840 ν(C–H), 1654, 1632 ν(C=O), 1613 ν(С=С), 1464, 1436 νas(CH3), 1318–1142 ν(C–F).
| Найдено, %: | С 36.11; | H 4.02; | N 1.30. |
| Для C32H42O17F12TbLi ∙ (CH3CN) (IIIб) | |||
| вычислено, %: | С 36.02; | H 4.00; | N 1.24. |
ИК-спектр (ν, см–1): 3536, 3494 ν(O–H), 2999, 2949, 2842 ν(C–H), 1652, 1634 ν(C=O), 1614, 1604 ν(С=С), 1468, 1437 νas(CH3), 1316–1140 ν(C–F).
РСА. Кристаллографические данные для монокристаллов комплексов IIIa, IIIб получены на автоматическом 4-х кружном дифрактометре с CCD-детектором Xcalibur 3 по стандартной про-цедуре (МоKα-излучение, графитовый монохроматор, ω-сканирование с шагом 1° при Т = 295(2) К). Введена эмпирическая поправка на поглощение. Структура определена прямым статистическим методом и уточнена полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в модели “наездника”. Все расчеты проведены в программной оболочке Olex [19] c использованием программного пакета SHELX [20]. Кристаллографические данные и параметры уточнения для структур IIIa, IIIб приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения для cтруктур IIIa, IIIб
| Параметр | Значение | |
|---|---|---|
| IIIa | IIIб | |
| M | 1126.61 | 1133.57 |
| Температура, K | 295(2) | |
| Сингония | Триклинная | |
| Пр. гр. | $P1 - $ | |
| a, Å | 11.9147(5) | 11.8882(2) |
| b, Å | 11.9855(5) | 11.9996(5) |
| c, Å | 18.9069(8) | 18.8718(7) |
| α, град | 104.960(4) | 105.212(3) |
| β, град | 96.274(4) | 96.109(3) |
| γ, град | 110.240(4) | 110.162(4) |
| V, Å3 | 2387.93(17) | 2380.33(17) |
| Z | 2 | 2 |
| ρ(выч.), г см–3 | 1.567 | 1.582 |
| μ, мм–1 | 1.425 | 1.597 |
| Размер кристалла, мм | 0.46 × 0.39 × 0.27 | 0.48 × 0.36 × 0.24 |
| θmin–θmax, град | 3.53–31.04 | 3.54–31.16 |
| F(000) | 1132 | 1136 |
| Интервалы индексов отражений | –14 ≤ h ≤ 15, –15 ≤ k ≤ 16, –25 ≤ l ≤ 27 |
–11 ≤ h ≤ 16, –16 ≤ k ≤ 17, –26 ≤ l ≤ 26 |
| Измерено отражений | 22 441 | 20 712 |
| Независимых отражений (Rint) | 12 912 (1132) | 13 115 (1136) |
| Число отражений с I > 2σ(I) | 9051 | 9544 |
| GOOF | 1.055 | 1.028 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0604, wR2 = 0.1493 |
R1 = 0.0595, wR2 = 0.1462 |
| R-факторы по всем отражениям | R1 = 0.0905, wR2 = 0.1928 |
R1 = 0.0853, wR2 = 0.1941 |
| Остаточная электронная плотность (max/min), e/Å3 | 1.469/–1.984 | 1.459/–1.925 |
Координаты атомов и другие параметры структур IIIа, IIIб депонированы в Кембриджском банке структурных данных (№ 1973632, 1973633 соответственно; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие CF3-β-дикетоната лития LiL с хлоридами Eu(III) и Tb(III) в среде ацетонитрила приводит к образованию комплексов IIIa, IIIб соответственно, согласно уравнению реакции (1). Соединения IIIa, IIIб могут быть также получены перекристаллизацией из ацетонитрила соответствующих комплексов [(LnL3)(LiL)(MeOH)] (Ia, Iб) и [(LnL3)(LiL)(H2O)] (IIa, IIб), синтезированных ранее [15].
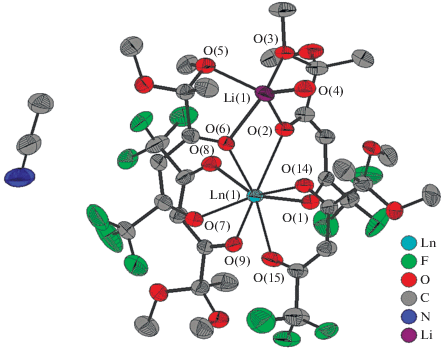
По данным РСА, биядерные гетерометаллические комплексы IIIa и IIIб – нейтральные тетракис-β-дикетонаты, кристаллизующиеся в центросимметричной пр. гр. $P--$ триклинной системы (рис. 1, табл. 1). Атом Ln(III) восьмикоординирован за счет атомов кислорода четырех дикетонат-анионов. При этом два лиганда мостиковые и через атомы кислорода 1,3-дикарбонильного фрагмента μ2‑O(2) и μ2-O(6) дополнительно координируют ион лития. Атом лития достраивает свое координационное окружение до [LiO5] за счет атомов кислорода O(3) и O(5) двух метокси-групп и O(4) молекулы H2O. Три молекулы лиганда из Ln(III) тетракис-дикетонатного фрагмента находятся в цис-положении по отношению друг к другу.
Рис. 1.
Молекулярное строение комплексов IIIa (Ln = Eu) и IIIб (Ln = Tb) (атомы водорода не показаны, тепловые эллипсоиды с вероятностью 30%).
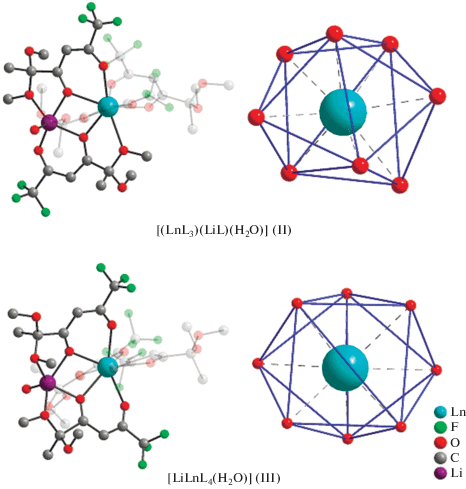
Можно предположить, что при переходе от спиртов (метанола и этанола) к более полярному ацетонитрилу формирование комплекса определяется предпочтительной ориентацией четырех отрицательно заряженных β-дикетонат-анионов вокруг иона лантанида(III), тогда как комплексы I, II содержат Ln(III) трис-β-дикетонатный фрагмент и LiL в качестве солиганда. Таким образом, главным отличием комплексов IIIa, IIIб от IIa, IIб является разная организация гетеробиметаллического остова (рис. 2).
Рис. 2.
Различия в организации гетеробиметаллического остова и геометрии координационных многогранников LnO8 у трис(β-дикетонатов) [(LnL3)(LiL)(H2O)] II [15] и тетракис(β-дикетонатов) [LiLnL4(H2O)] III.
Отметим, что соединения IIIa, IIIб – редкие примеры литий-лантанидных тетракис-β-дикетонатов, структура которых установлена с использованием данных РСА. Полученные ранее гетеробиметаллические (Ln-Li)-комплексы на основе нефункционализированных β-дикетонов были отнесены к тетракис-β-дикетонатам [LiLn(β-дикетонат)4] только на основании данных ИК-спектроскопии и элементного анализа [21, 22].
В отличие от других расстояний Ln–O в комплексах IIIа, IIIб длины связей с мостиковыми атомами кислорода Ln–μ2-O заметно длиннее (табл. 2). При этом наблюдается систематическое уменьшение длин связей Ln–O при переходе от европия к тербию, обусловленное эффектом f‑сжатия.
Таблица 2.
Основные геометрические характеристики и времена жизни фосфоресценции серии гетерометаллических биядерных комплексов
| Комплекс | Расстояние, Å | Геометрия [LnO8]** | Время жизни фосфоресценции, мкс | Литература | |||
|---|---|---|---|---|---|---|---|
| Ln–O | Ln–μ2-O | Ln···Ln | Ln···M* | ||||
| [(EuL3)(LiL)(MeOH)] (Ia) | 2.334–2.533 | 2.362–2.426 | 10.527 | 3.498 | TDD-8 | 732 | 15 |
| [(TbL3)(LiL)(MeOH)] (Ib) | 2.306–2.505 | 2.350–2.404 | 10.552 | 3.471 | TDD-8 | 648 | 15 |
| [(EuL3)(LiL)(H2O)] (IIa) | 2.346–2.523 | 2.361–2.412 | 9.613 | 3.508 | TDD-8 | 642 | 15 |
| [(TbL3)(LiL)(H2O)] (IIb) | 2.320–2.503 | 2.330–2.389 | 9.923 | 3.494 | TDD-8 | 520 | 15 |
| [LiEuL4(H2O)](CH3CN) (IIIа) | 2.352–2.389 | 2.420–2.461 | 9.560 | 3.568 | BTPR-8 | 576 | |
| [LiTbL4(H2O)](CH3CN) (IIIб) | 2.344–2.368 | 2.398–2.448 | 9.545 | 3.535 | BTPR-8 | 480 | |
| Na[TbL4](MeOH)(H2O) (IV) | 2.323–2.400 | 2.375–2.384 | 11.658 | 3.784 | TDD-8 | 640 | 16 |
| K[TbL4](H2O) (V) | 2.331–2.401 | 2.377-2.393 | 10.455 | 4.047 | TDD-8 | 292 | 16 |
| Cs[TbL4] (VI) | 2.308–2.363 | 2.410–2.421 | 10.995 | 4.456, 4.505 | SAPR-8 | 48 | 16 |
Согласно расчетным данным, полученным по программе SHAPE [23, 24], в комплексах IIIa, IIIб координационный восьмигранник [LnO8] имеет геометрию искаженной дважды наращенной тригональной призмы (табл. 2), а пятигранник [LiO5] – искаженной квадратной пирамиды.
Особенностью кристаллической упаковки молекул определяется взаимная межмолекулярная ориентация трифторметильных групп по отношению друг к другу (рис. 3). Наименьшие расстояния F···F составляют 3.4–3.5 Å, однако угол между связями С–F трифторметильных групп отличается от 90° [25], что не позволяет рассматривать их как истинное галоген-галогенное взаимодействие. При этом расстояния Ln–Ln между соседними молекулами близки к таковым, найденным для комплексов IIa, IIб (табл. 2). В комплексах IIIa, IIIб молекула воды, находящаяся в координации с ионом лития, образует два типа водородных связей: внутримолекулярную H-связь с атомом кислорода O(16) метоксигруппы и межмолекулярную H-связь с сольватной молекулой ацетонитрила (рис. 3, табл. 3).
Рис. 3.
Молекулярная упаковка комплексов IIIa, IIIб вдоль оси c. Атомы H (за исключением атомов H(4A) и H(4B) молекулы воды) не показаны. Межмолекулярные водородные связи изображены пунктирной линией.
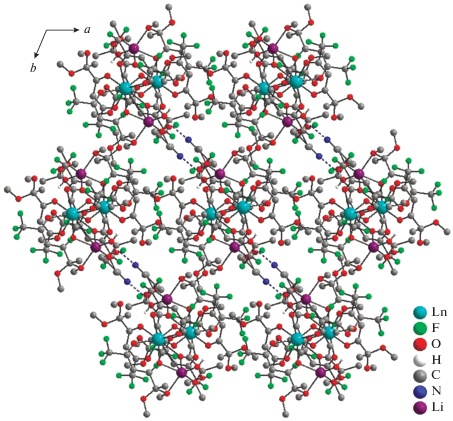
Таблица 3.
Геометрические параметры водородных связей в комплексах IIIa, IIIб
| Комплекс | D–H···A | Расстояние, Å | ∠DHA, град | Симметрия | ||
|---|---|---|---|---|---|---|
| D···H | H···A | D···A | ||||
| IIIa | O(4)–H(4A)···N(1) | 0.862 | 2.054 | 2.889 | 163.01 | x – 1, y, z |
| O(4)–H(4B)···O(16) | 0.860 | 2.258 | 2.964 | 139.28 | ||
| IIIб | O(4)–H(4A)···N(1) | 0.858 | 2.061 | 2.902 | 166.65 | x – 1, y, z |
| O(4)–H(4B)···O(16) | 0.858 | 2.139 | 2.967 | 161.97 | ||
Фотолюминесцентные свойства соединений IIIa, IIIб изучали в твердом виде. В спектрах абсорбции комплексов IIIa, IIIб максимумы поглощения наблюдали при длинах волн 338 и 343 нм соответственно (рис. 4). Используя эти длины волн света были зарегистрированы спектры фотолюминесценции соединений IIIa, IIIб, содержащие характеристичные для ионов европия(III) и тербия(III) полосы металл-центрированной эмиссии, обусловленные f–f-переходами (табл. 4). В табл. 2 представлен ряд гетеробиметаллических (Ln-M)-комплексов (M = Li, Na, K, Cs) I–VI, полученных на основе функционализированного CF3-β-дикетоната L [15, 16]. Варьирование иона щелочного металла и условий кристаллизации приводит к изменению симметрии координационного полиэдра вокруг иона Ln(III) и природы поля лиганда, что, в свою очередь, отражается в спектрах фотолюминесценции комплексов [26]. По сравнению с соединениями Ia, Iб, IIa, IIб, IV времена жизни фосфоресценции комплексов II-Ia, IIIб уменьшаются, что, по-видимому, является результатом изменения геометрии полиэдра [TbO8] с тригонального додекаэдра на дважды наращенную тригональную призму (табл. 2). С другой стороны, переход от полимерных тербий(III) тетракис-дикетонатов калия и цезия V, VI к комплексам I, III, IV приводит к более длительному послесвечению, что обусловлено снижением числа возможных безызлучательных переходов в случае дискретных структур. Таким образом, фотолюминесцентные свойства (Ln-M)-дикетонатов зависят от совокупности факторов: координационного окружения вокруг иона лантанида, природы щелочного металла и межмолекулярной организации гетерометаллических комплексов.
Рис. 4.
Спектр фотолюминесценции комплекса IIIa (λвозб = 338 нм) (а) и IIIб (λвозб = 343 нм) (б) в твердом виде при комнатной температуре.
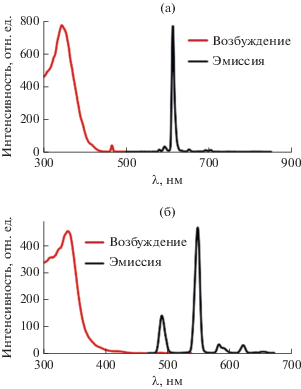
Таблица 4.
Данные спектров фотолюминесценции комплексов IIIa, IIIб
| Ln(III) | Электронные переходы | Длина волны, нм | Интенсивность полосы испускания, % |
|---|---|---|---|
| Eu | 5D0 → 7F6 | 580 | 1.3 |
| 5D0 → 7F5 | 592 | 4.6 | |
| 5D0 → 7F4 | 613 | 91.6 | |
| 5D0 → 7F3 | 652 | 2.0 | |
| 5D0 → 7F1 | 750 | 0.5 | |
| Tb | 5D0 → 7F6 | 490 | 18.1 |
| 5D0 → 7F5 | 546 | 66.4 | |
| 5D0 → 7F4 | 582 | 6.1 | |
| 5D0 → 7F3 | 621 | 4.0 | |
| 5D0 → 7F2 | 650 | 0.8 |
Ранее мы установили взаимосвязь между структурой кристаллической упаковки комплексов Ia, Iб, IIa, IIб и реализацией механолюминесцентных свойств дикетонатов [15, 16]. Аналогично комплексам [(LnL3)(LiL)(H2O)] (IIa, IIб) наличие межмолекулярных H-взаимодействий является причиной отсутствия свечения при механическом разрушении кристаллов IIIa, IIIб (табл. 3). Данное наблюдение подтверждает определяющую роль межмолекулярной организации комплексов в кристаллическом состоянии на их механолюминесцентные свойства [27]. Наличие межслоевого пространства, так называемых плоскостей разрыва, определяет возможность смещения/разрушения кристаллической структуры вдоль этих плоскостей под механическим воздействием, которое вызывает свечение, аналогичное спектру люминесценции вещества [28, 29]. В полученных комплексах I–III расстояние Ln–Ln (меньше 10 Å) является показателем более плотной кристаллической упаковки, в которой вследствие близкого расстояния между слоями реализуются межмолекулярные водородные взаимодействия.
В данной работе показано, что при взаимодействии функционализированного CF3-β-дикетоната лития с солями трехвалентных европия и тербия в среде ацетонитрила образуются литий-лантанидные тетракис(β-дикетонаты). На основании рентгеноструктурных данных установлено, что наличие ацетальной группы в структуре лиганда определяет координацию иона лития с лигандом и формированием дискретной структуры комплекса. В ряду гетерометаллических (Ln-M)-β-дикетонатов (M = щелочной металл) выявлена зависимость фотолюминесцентных свойств от координационного окружения иона лантанида, природы щелочного металла и особенностей кристаллической упаковки.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Kovacs D., Borbas K.E. // Coord. Chem. Rev. 2018. V. 364. P. 1.
Xu H., Sun Q., An Z. et al. // Coord. Chem. Rev. 2015. V. 293–294. P. 228.
Bünzli J.-C.G. // Coord. Chem. Rev. 2015. V. 293–294. P. 19.
Bünzli J.-C.G. // J. Lumin. 2016. V. 170. P. 866.
Балашова Т.В., Румянцев Р.В., Фукин Г.К. и др. // Коорд. химия. 2017. Т. 43. С. 754 (Balashova T.V., Rumyantsev R.V., Fukin G.K. et al. // Russ. J. Coord. Chem. 2017. V. 43. P. 852).https://doi.org/10.1134/S1070328417120016
Yuan C.M., Hu X., Li Y. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 824. https://doi.org/10.1134/S1070328419110113
Kharcheva A.V., Borisova N.E., Ivanov A.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 219. https://doi.org/10.1134/S0036023618020092
Brock A.J., Clegg J.K., Li F., Lindoy L.F. // Coord. Chem. Rev. 2018. V. 375. P. 106.
Mishra S., Daniele S. // Chem. Rev. 2015. V. 115. P. 8379.
Vigato P.A., Peruzzo V., Tamburini S. // Coord. Chem. Rev. 2009. V. 253. P. 1099.
Condorelli G.G., Malandrino G., Fragala I.L. // Coord. Chem. Rev. 2007. V. 251. P. 1931.
Kudyakova Y.S., Bazhin D.N., Burgart Y.V., Saloutin V.I. // Mendeleev Commun. 2016. V. 26. P. 54.
Eliseeva S.V., Bünzli J.-C.G. // Chem. Soc. Rev. 2010. V. 39. P. 189.
Binnemans K. // Chem. Rev. 2009. V. 109. P. 4283.
Bazhin D.N., Kudyakova Y.S., Bogomyakov A.S. et al. // Inorg. Chem. Front. 2019. V. 6. P. 40.
Kudyakova Yu.S., Slepukhin P.A., Valova M.S et al. // Eur. J. Inorg. Chem. 2020. № 6. P. 523.
Krisyuk V.V., UrkasymKyzy S., Rybalova T.V. et al. // J. Coord. Chem. 2018. V. 71. P. 2194.
Bazhin D.N., Chizhov D.L., Röschenthaler G.-V. et al. // Tetrahedron Lett. 2014. V. 55. P. 5714.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Priya J., Gondia N.K., Kunti A.K., Sharma S.K. // ECS J. Solid State Sci. Tech. 2016. V. 5. P. R166.
Teixeira K.C., Moreira G.F., Quirino W.G. et al. // J. Therm. Anal. Calorim. 2011. V. 106. P. 587.
Casanova D., Llunell M., Alemany P., Alvarez S. // Chem. Eur. J. 2005. V. 11. P. 1479.
Llunell M., Casanova D., Cirera J. et al. SHAPE. Version 2.1. Barcelona (Spain): Electronic Structure Group Univ. de Barcelona, 2013.
Reichenbächer K., Süss H.I., Huliger J. // Chem. Soc. Rev. 2005. V. 34. P. 22.
Binnemans K. Handbook on the Physics and Chemistry of Rare Earths. Elsevier, 2005. V. 35. P. 107.
Bünzli J.-C.G., Wong K.-L. // J. Rare Earths. 2018. V. 36. P. 1.
Bukvetskii B.V., Mirochnik A.G., Zhikhareva P.A. // Luminescence. 2017. V. 27. P. 773.
Bukvetskii B.V., Shishov A.S., Mirochnik A.G. // Luminescence. 2016. V. 31. P. 1329.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия