Координационная химия, 2020, T. 46, № 9, стр. 545-553
Синтез и кристаллическое строение новых тройных висмутидов NaZnBi и NaCdBi
А. И. Шилов 1, 2, *, К. С. Перваков 2, В. А. Тафеенко 1, И. В. Морозов 1, **
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Центр высокотемпературной сверхпроводимости и квантовых материалов им. В.Л. Гинзбурга
Физического института им. П.Н. Лебедева РАН
Москва, Россия
* E-mail: tanknbp@live.com
** E-mail: morozov@inorg.chem.msu.ru
Поступила в редакцию 10.12.2019
После доработки 20.02.2020
Принята к публикации 25.03.2020
Аннотация
Монокристаллы новых тройных висмутидов NaZnBi (I) и NaCdBi (II) получены кристаллизацией из раствора компонентов в жидком висмуте. Изучение их кристаллического строения методом монокристального рентгеноструктурного анализа (CIF file CCDC № 1956988 (I), 1956989 (II)) показало, что полученные вещества образуют изоструктурные ряды со своими более легкими пниктидными аналогами. Так, I аналогично NaZnPn (Pn = P, As, Sb) кристаллизуется в структурном типе PbFCl, пр. гр. P4/nmm, a = 4.5114(5), c = 7.5970(10) Å, в то время как II, так же как и NaCdPn (Pn = As, Sb), относится к структурному типу MgSrSi, пр. гр. Pnma, a = 8.0812(5), b = 4.8026(3), c = 8.7320(7) Å. Кристаллическая структура I состоит из антифлюоритоподобных слоев [ZnBi], разделенных прослойкой из атомов натрия, в то время как в структуре II можно выделить гексагональные гофрированные слои [CdBi], стянутые между собой связями Cd–Bi с образованием каналов, в которых размещаются атомы натрия. Для полученных висмутидов проведено сравнение их кристаллического строения как между собой, так и с более легкими представителями изоструктурных рядов.
Соединения состава ATPn (A = щелочной металл, T = d-элемент, Pn = пниктид) проявляют большое разнообразие строения и свойств, обусловленное образованием составляющими атомами различных координационных полиэдров и их взаимным расположением. Среди них имеются изоляторы, полупроводники, соединения с металлической проводимостью, сверхпроводники, также они могут проявлять термоэлектрические и разнообразные магнитные свойства. К наиболее известным можно отнести кристаллизующиеся в структурном типе PbClF (пр. гр. P4/nmm) слоистые железосодержащие сверхпроводники AFePn (Pn = P, As; A = Li, Na) [1] и обширное семейство производных марганца AMnPn (A – щелочной металл, Cu; Pn = P, As, Sb, Bi), проявляющих свойства полупроводниковых антиферромагнетиков [2–4], полугейслеровские соединения (half-Heusler compounds), характеризующиеся антифлюоритоподобной структурой (пр. гр. Fm$\bar {3}$m и F$\bar {4}$3m), проявляющие разнообразные физические свойства, в том числе и обусловленные топологией Ферми поверхности [5]. Особый интерес представляет семейство слоистых пниктидов ATPn, содержащих гексагональные слои [TPn], построенные из чередующихся атомов T и Pn, и атомов A, располагающихся между этими слоями (семейство ZrBeSi, пр. гр. P63/mmc), причем слои могут быть стянуты межслоевыми связями T–Pn с образованием каркасных центро- или нецентросимметричных структур (семейства MgSrSi, пр. гр. Pnma и LiGaGe, пр. гр. P63mc соответственно), проявляющих антисегнето- и сегнетоэлектрические свойства [2, 6].
Недавно был опубликован ряд работ, в которых на основании уже известных структурных данных, а также теоретических расчетов предсказывается термодинамическая устойчивость ряда соединений ATPn, подчиняющихся формализму Цинтля [7], где сумма валентных электронов, приходящихся на формульную единицу, составляет 8 или 18, и делается прогноз о проявлении этими соединениями нетривиальных функциональных свойств [5]. Среди таких соединений наше внимание привлекли висмутиды NaTBi, где T = Zn и Cd. Несмотря на то что более легкие пниктиды аналогичного состава NaTPn (Pn = As, Sb) были получены ранее [8–10], производные висмута оставались неизвестными. Между тем переход к тяжелым пниктидам ведет к закономерному изменению свойств и может привести к появлению новых особенностей, в частности нетривиальных свойств, обусловленных топологией Ферми поверхности. Кроме того, такие соединения могут оказаться эффективными мягкими восстановителями для получения кластеров висмута с использованием неводных растворителей.
В настоящей работе впервые получены монокристаллы NaZnBi (I) и NaCdBi (II) и установлено их кристаллическое строение. Несмотря на одинаковую стехиометрию и сходство координационных полиэдров составляющих атомов Na, Zn/Cd и Bi, эти соединения относятся к разным структурным типам. Сопоставление кристаллического строения полученных соединений в сравнении с более легкими представителями изоструктурных рядов позволяет выявить определенные факторы, влияющие на реализацию того или иного структурного типа в тройных пниктидах ATPn (A = щелочной металл, T = Zn, Cd).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Все операции по приготовлению исходных реакционных смесей, отделению полученных соединений от побочных продуктов и подготовке синтезированных образцов для проведения дальнейших исследований выполняли в сухом аргоновом боксе с содержанием воды не более 0.1 ppm и кислорода не более 0.5 ppm. Металлические реагенты Na (99.95%), Zn (99.9%) или Cd (99.9%), Bi (99.95%) в мольном соотношении Na : (Zn/Cd) : Bi = 1 : 1 : 6 помещали в отожженный алундовый тигель, верхнюю часть которого закрывали кварцевой ватой для дальнейшего отделения флюса центрифугированием, после чего тигель помещали в кварцевую ампулу, вакуумировали, заполняли сухим аргоном до остаточного давления 0.1 атм. и запаивали. После этого ампулу с тиглем внутри помещали в муфельную печь и нагревали до температуры 873 К за 24 ч, выдерживали при этой температуре течение 48 ч для гомогенизации расплава и затем охлаждали до 573 К со скоростью 2 K/ч. Избыток висмута удаляли при помощи высокотемпературного центрифугирования.
После окончания реакции и центрифугирования расплава в случае системы Na–Zn–Bi из тигля извлекали блоки пластинчатых кристаллов NaZnBi (I) с металлическим блеском правильной прямоугольной формы размером до 1 см, легко отделяющихся друг от друга при помощи скальпеля (рис. 1а). На воздухе полученные кристаллы крайне неустойчивы и разрушаются в течение нескольких минут, поэтому все работы проводили в сухом боксе в атмосфере аргона.
Рентгенофазовый анализ (РФА) поликристаллического образца, полученного измельчением в ступке отобранных монокристаллов, проводили на дифрактометре Rigaku MiniFlex 600 (графитовый монохроматор, CuKα-излучение). Для защиты от контакта с открытым воздухом образец помещали в герметичный держатель внутри сухого бокса. Полученная рентгенограмма свидетельствует об однофазности образца и хорошо индицируется в пр. гр. P4/nmm с параметрами кристаллической ячейки, близкими к NaMnBi [3].
В случае системы Na–Cd–Bi в результате центрифугирования удалось отделить серые кристаллы NaCdBi (II) неправильной формы с размерами до 2 × 2 × 5 мм (рис. 1б). В отличие от I соединение II более устойчиво и демонстрирует заметные признаки деградации лишь по прошествии нескольких часов экспозиции на воздухе, что, как стало ясно в дальнейшем, объясняется разным строением комплексов. РФА растертых монокристаллов подтвердил, что получено новое, ранее неизвестное, вещество с предполагаемым составом II. Окончательно состав и строение полученных монокристаллов установлены на основании данных РСА.
РСА. Монокристаллы I, II с линейными размерами ~0.1 мм при помощи микроскопа помещали в стеклянные капилляры, смоченные сухим вазелиновым маслом, которые затем запаивали. Массив рентгенодифракционных данных собран при помощи монокристального дифрактометра STOE, оборудованного детектором Pilatus 100K, графитовым монохроматором и коллиматором с диаметром капилляра 0.5 мм с использованием MoKα-излучения. Структуры решены при помощи пакетов программ SHELXL2014 и SHELXT и уточнены с использованием метода наименьших квадратов при помощи пакета программ SHELXL2014 [11, 12]. После нескольких циклов уточнения в изотропном приближении для параметров тепловых колебаний атомов применена анизотропная модель. В результате проведенного уточнения факторы недостоверности составили 0.0516 для I и 0.043 для II. Кристаллографические данные и параметры уточнения комплексов I, II приведены в табл. 1, характерные межатомные расстояния – в табл. 2.
Таблица 1.
Кристаллографические данные и параметры уточнения комплексов I, II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Сингония | Тетрагональная | Ромбическая |
| Пр. гр. | P4/nmm | Pnma |
| T, K | 294 | 294 |
| a, Å b, Å c, Å |
4.5114(5) 4.5114(5) 7.597(1) |
8.0812(5) 4.8026(3) 8.7320(7) |
| V, Å3 | 154.62(4) | 338.90(4) |
| Z | 2 | 4 |
| µ, mm−1 | 64.39 | 57.95 |
| Размер кристалла (мм) | 0.08 × 0.04 × 0.03 | 0.1 × 0.06 × 0.04 |
| Информация о сборе данных | ||
| Учeт поглощения | Difabs | Multi scan |
| Tmin, Tmax | 0.737, 0.823 | |
| Количество измеренных, независимых и наблюдаемых (I > 2σ(I)) отражений | 177, 177, 164 | 505, 505, 432 |
| Rint | 0.0516 | 0.043 |
| (sin θ/λ)max, Å−1 | 0.728 | 0.683 |
| R (F 2 > 2σ(F 2)), wR (F 2), S | 0.052, 0.138, 1.15 | 0.038, 0.102, 1.07 |
| Количество уточняемых параметров | 10 | 19 |
| Δρmax, Δρmin, e Å−3 | 2.70, −2.73 | 1.75, −2.04 |
Таблица 2.
Характерные межатомные расстояния в I и II
| I | II | ||
|---|---|---|---|
| Связь | d, Å | Связь | d, Å |
| Zn(1)−Bi(1) | 4 × 2.8383(7) | Cd(1)−Bi(1) | 2 × 2.9571(16) |
| 2.9699(17) | |||
| 3.0391(17) | |||
| Na(1)−Bi(1) | 3.280(17) | Na(1)−Bi(1) | 3.256(9) |
| 4 × 3.307(4) | 2 × 3.400(6) | ||
| 2 × 3.468(6) | |||
Координаты атомов и другие параметры структур I и II депонированы в Кембриджском банке структурных данных (ССDС № 1956988 (I) и 1956989 (II); deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
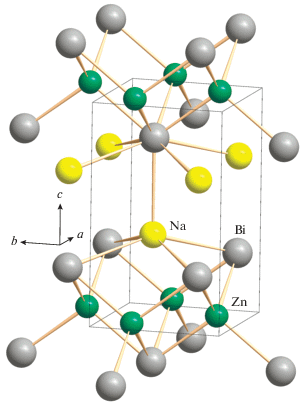
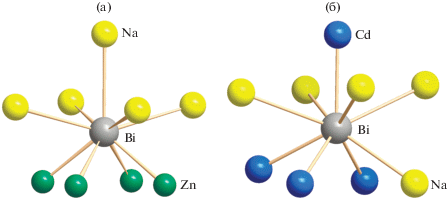
Соединение I кристаллизуется в структурном типе PbFCl [7] (пр. гр. P4/nmm) и состоит из антифлюоритоподобных слоев состава [ZnBi] с прослойками из атомов Na. В слоях атомы Zn образуют плоскую квадратную сетку, а атомы Bi в шахматном порядке размещаются над и под центрами квадратов [Zn4], в результате чего каждый атом Zn имеет тетраэдрическое окружение из четырех атомов Bi (рис. 2). Тетраэдрический полиэдр [ZnBi4] несколько вытянут вдоль инверсионной оси С4i, которая проходит параллельно оси с через два противоположных ребра тетраэдра. Об этом свидетельствуют величины двух углов BiZnBi (105.26(4)°), опирающихся на эти ребра. В ряду пниктидов NaZnPn с ростом размера Pn растяжение тетраэдра несколько увеличивается (табл. 3). Атомы Na располагаются между слоями [ZnBi] с образованием координационного полиэдра [NaBi5] в виде квадратной пирамиды, основанием которой служат четыре атома Bi из одного слоя, а в аксиальной вершине располагается пятый атом висмута из соседнего слоя (рис. 2). Через вершину пирамиды и середину основания параллельно оси c проходит ось С4. В табл. 2 и 3 представлены геометрические параметры пирамиды, из которых следует, что расстояния от атома Na до базальных атомов Bi (lb), лежащих в основании пирамиды, лишь незначительно превышают расстояние до атома Bi в аксиальной вершине (отношение la/lb = 0.99). Атом висмута находится внутри одношапочной квадратной антипризмы [BiZn4Na5] (рис. 3а). Нижнее основание антипризмы образовано четырьмя атомами Zn, а верхнее основание и шапочная вершина – атомами Na. Полиэдр [BiZn4-Na5] ориентирован вдоль оси c таким образом, что через середину квадрата [Zn4] и шапочную вершину проходит поворотная ось С4. Следует отметить, что NaZnBi изоструктурен производному марганца NaMnBi [3], при этом размер элементарной ячейки и межатомные расстояния последнего несколько увеличиваются из-за бол-ьшего размера атома Mn по сравнению с Zn [14, 15].
Таблица 3.
Сопоставление параметров элементарной ячейки, характерных длин связей (Å) и валентных углов (град) в ряду изоструктурных пниктидов NaZnPn, где Pn − P, As, Sb, Bi (структурный тип PbClF, пр. гр. P4/nmm)
| Pn | a c |
c/a | R(Pn3–)* | Zn–Pn** | 2 × PnZnPn | Zn–Zn | 1 × Na–Pn (la) |
4 × Na–Pn (lb) | la/lb | Литература |
|---|---|---|---|---|---|---|---|---|---|---|
| P | 4.012 6.801 |
1.695 | 1.71(4) | 2.473 (2.45) |
108.41 | 2.837 | 2.913 | 3.006 | 0.97 | [13] |
| As | 4.122 6.995 |
1.697 | 1.81(2) | 2.537 (2.55) |
108.65 | 2.914 | 3.003 | 3.092 | 0.97 | [10] |
| Sb | 4.365 7.363 |
1.687 | 1.974(8) | 2.722 (2.714) |
106.59 | 3.087 | 3.181 | 3.223 | 0.99 | [9] |
| Bi | 4.511 7.597 |
1.684 | 2.08(2) | 2.8383 (2.82) |
105.261 | 3.190 | 3.280 | 3.307 | 0.99 | Настоящая работа |
* Оценка эффективных радиусов анионов пниктидов Pn3– в структурах NaTPn (T = Zn, Mn, Cd) проведена с привлечением структурных данных из кристаллографической базы данных неорганических структур ICSD и эффективных ионных радиусов катионов T2+ (КЧ 4), которые, согласно [14, 15], составляют 0.74, 0.80, 0.92 Å для B = Zn, Mn, Cd соответственно. ** В скобках приведены длины связей Zn–Pn, рассчитанные как сумма R(Pn3–) и R(Zn2+).
Замена атома цинка на кадмий приводит к существенному изменению кристаллического строения: II, так же как и его более легкие аналоги NaCdPn (Pn = As, Sb), кристаллизуется в структурном типе MgSrSi (ромбическая сингония Pnma). В структуре II можно выделить гофрированные гексагональные слои, в которых каждый атом Bi связан с тремя атомами Cd и наоборот (рис. 4). Слои располагаются параллельно плоскости (bc) и ориентированы таким образом, что вдоль направления b на одинаковой высоте x образуются ряды из связанных трансляцией атомов Cd (или Bi). Атомы кадмия помимо трех связей Cd–Bi в слое образуют четвертую связь с атомом висмута из вышележащего или нижележащего слоя, довершая свою координацию до искаженной тетраэдрической. В тетраэдре [CdBi4] одно из ребер Bi···Bi и атом Cd лежат в плоскости симметрии. Средняя длина связи Cd–Bi (2.98 Å) на 0.14 Å превышает длину связи Zn–Bi в I (2.84 Å), что коррелирует с увеличением эффективного ионного радиуса на 0.18 Å [14, 15] при переходе от Zn2+ к Cd2+.
Рис. 4.
Кристаллическое строение II: проекция вдоль оси a (а); проекция вдоль оси b (б); расположение атомов Na между гексагональными слоями [CdBi] (в). Для части атомов Cd и Na приведены координационные полиэдры синим и желтым цветом соответственно.
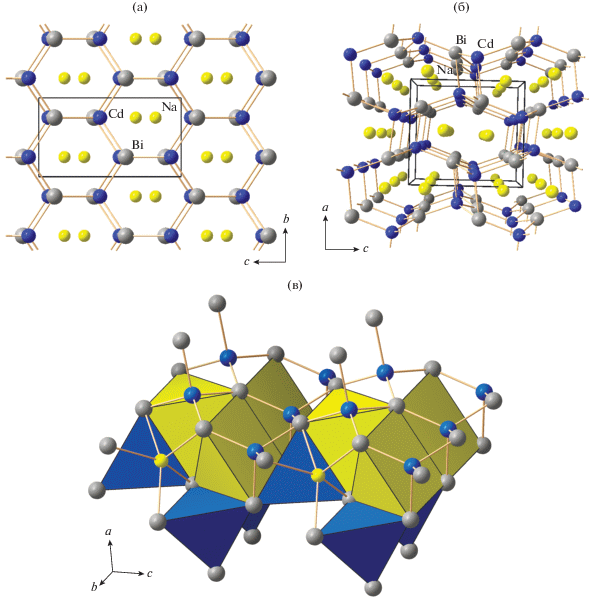
За счет межслоевых стяжек Cd–Bi между соседними гексагональными слоями [CdBi] образуются каналы, направленные вдоль оси b. В этих каналах располагаются атомы натрия, координируя пять атомов висмута с образованием искаженного тетрагонально-пирамидального координационного полиэдра [NaBi5]. В основании пирамиды лежит прямоугольник, одна сторона которого принадлежит одному слою [CdBi], а вторая сторона и аксиальная вершина – соседнему (рис. 4в). Сопоставление данных табл. 3 и 4 показывает, что по сравнению с квадратной пирамидой [NaBi5] структуры I в аналогичной пирамиде структуры II длины связей Na–Bi до базальных атомов Bi заметно возросли (на 4%), в то время как расстояние Na–Bi до аксиальной вершины несколько уменьшилось (на 0.8%). Эти изменения отразились на параметре la/lb, который для структур NaCdPn составляет 0.94–0.95 в отличие от 0.97–0.99 для структур NaZnPn (табл. 3, 4).
Таблица 4.
Сопоставление параметров элементарной ячейки и характерных длин связей (Å) в ряду изоструктурных пниктидов NaCdPn (Pn = As, Sb, Bi), структурный тип MgSrSi, пр. гр. Pnma
| Pn | a b c |
c/a | b/a | 2 × Сd–Pn Cd–Pn Cd–Pn |
1 × Na–Pn* | 2×Na–Pn 2×Na–Pn |
la/lb средн. |
Литература |
|---|---|---|---|---|---|---|---|---|
| As | 7.576 4.471 8.044 |
1.062 | 0.590 | 2.7327 2.7253 2.8253 |
3.022 (2.95) |
3.204 3.236 |
0.94 | [10] |
| Sb | 7.940 4.704 8.420 |
1.059 | 0.592 | 2.8639 2.8695 2.9765 |
3.167 (3.11) |
3.336 3.438 |
0.94 | [10] |
| Bi | 8.081 4.803 8.732 |
1.081 | 0.594 | 2.9571 2.9699 3.0391 |
3.256 (3.22) |
3.400 3.468 |
0.95 | Настоящая работа |
Заметным образом в двух рассматриваемых структурах различаются и полиэдры висмута [BiNa5Cd4]. Полиэдр структуры II менее симметричен. Его тоже можно рассматривать как одношапочную квадратную антипризму, однако, в отличие от структуры I, нижнее основание включает три атома Cd и один атом Na, верхнее основание включает четыре атома Na, а в шапочной вершине располагается кадмий (рис. 2б).
Следует отметить, что длины связей Bi–T (T = = Zn, Cd) и Bi–Na в I и II типичны для подобных соединений. Так, в Na3Bi длины связей Bi–Na находятся в диапазоне от 3.15 до 3.53 Å [16], в Ba2Cd3Bi4 Bi–Cd 2.93–3.38 Å [17]. Интересно сопоставить изменение параметров элементарной ячейки, характерных длин связей и валентных углов в рядах пниктидов NaTPn (T = Zn, Mn, Cd, Pn = = P, As, Sb, Bi). Для удобства сравнения мы оценили эффективные радиусы анионов Pn3–. Так, Rэфф(Pn3–, КЧ 9) в этих соединениях определяли как длины связей T–Pn за вычетом эффективных ионных радиусов Rэфф(T2+, КЧ 4) [13, 14] и усредняли полученные значения (табл. 3).
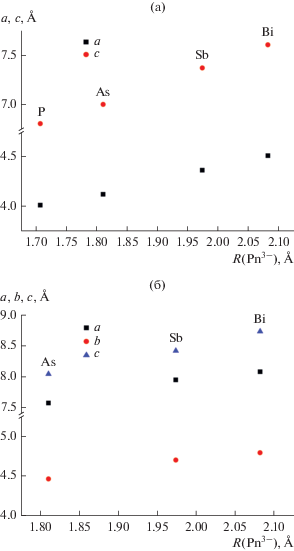
На рис. 5 представлено изменение параметров элементарных ячеек в рядах NaTPn (T = Zn, Cd) в зависимости от Rэфф(Pn3–). Можно видеть, что с увеличением размера пниктогена размеры элементарной ячейки тройных пниктидов NaTPn линейно возрастают (рис. 5а, 5б), при этом для T = Zn отношение c/a остается практически постоянным (табл. 3). Расстояние Zn···Zn (|Zn–Zn| = = ${a \mathord{\left/ {\vphantom {a {\sqrt 2 }}} \right. \kern-0em} {\sqrt 2 }}$) при увеличении размера пниктогена закономерно возрастает от 2.85 до 3.3 Å, что может отразиться на проявляемых физических свойствах. Так, в ряду изоструктурных производных марганца NaMnPn увеличение расстояния Mn···Mn приводит к закономерному уменьшению магнитного взаимодействия, что выражается в увеличении эффективного магнитного момента [18–20].
Рис. 5.
Зависимость параметров элементарных ячеек от размера пниктида в рядах NaZnPn (а) и NaCdPn (б).
Сопоставление структур I и II показывает, что в обеих модификациях (P4/nmm и Pnma) атомы Na, Zn/Cd и Bi образуют сходные координационные полиэдры, что может свидетельствовать о близкой термодинамической устойчивости обеих модификаций. Тем не менее возникает вопрос, чем обусловлена смена одной структурной модификации на другую? Ответ, по-видимому, связан со снижением устойчивости полиэдра [NаBi5]. Действительно, сопоставление тетрагонально пирамидальных координационных полиэдров [NaBi5] в двух изученных структурах показывает, что в структуре II в пирамиде [NaBi5] заметно ослаблены связи натрия с базальными атомами Bi. Их длина существенно превышает длину связи Na–Bi, рассчитанную как сумму эффективных ионных радиусов, в то время как расстояние Na–Bi до аксиальной вершины и длины связей Na–Bi в структуре I вполне соответствуют расчету (табл. 4). Удлинение связей Na–Bi связано с тем, что при переходе от Zn к Cd увеличиваются размеры прямоугольного основания [Bi4], так как его стороны одновременно являются ребрами четырех тетраэдров [CdBi4]. Увеличение размера катиона T2+ при переходе от Zn к Cd и приводит к возрастанию длины ребра Bi···Bi. В свою очередь, для устойчивости квадратной пирамиды необходимо, чтобы длина связи Na–Bib превосходила половину диагонали основания пирамиды. В результате атом натрия с трудом удерживается внутри тетрагональной пирамиды за счет значительного увеличения длин связей NaBib. Таким образом, вероятная причина смены структурного типа состоит в том, что в слоистой структуре типа PbClF катионы натрия обеспечивают связывание слоев вдоль оси c за счет достаточно прочных связей Na–Pn. При замене Zn на Cd устойчивость тетрагональной пирамиды [NaPn5] уменьшается, и, хотя натрий образует сходный полиэдр, реализуется каркасная структура, в которой в образовании 3D-связности большая роль отводится связям Cd–Bi.
Интересно отметить, что для всех производных марганца AMnPn независимо от выбора щелочного металла A (A = Na, K, Rb, Cs) и пниктида реализуется структурный тип PbClF (P4/nmm). По-видимому, повышенная устойчивость именно этого структурного типа в случае Mn связана с дополнительной стабилизацией за счет магнитного взаимодействия: в слоистой структуре этого типа атомы d-элемента образуют плоские квадратные сетки, в которых наблюдается взаимодействие между атомами металла с установлением дальнего магнитного порядка [21]. Для других 3d-элементов образование производных ATPn в структурном типе PbClF характерно только для легких щелочных металлов и пниктидов начала ряда: P и As. Причина того, что структура типа PbClF нехарактерна для больших катионов щелочных металлов, состоит в том, что такие катионы склонны образовывать полиэдры с более высокими КЧ. Так, в случае T = Fe, соединения состава AFePn (Pn = P, As) известны только для A = Li и Na. При увеличении размера щелочного металла реализуются соединения состава AFe2Pn2 (A = K, Rb, Cs), в которых также присутствуют антифлюоритоподобные слои [FePn], однако катионы щелочного металла образуют координационный полиэдр в виде прямоугольного параллелепипеда (КЧ 8). В случае производных цинка и кадмия дополнительная стабилизация структур за счет магнитного взаимодействия отсутствует, и, таким образом, размерный фактор играет еще более важную роль. Причем, имеющиеся литературные данные, дополненные нашим исследованием, показывают, что решающим является отношение размеров катиона щелочного металла и d-элемента, в то время как размеры пниктогена играют второстепенную роль. В этой связи показательной является изоструктурность рядов KCdPn и NaZnPn для которых Rэфф(A+)/Rэфф(T2+) составляет 1.65 и 1.54 соответственно (табл. 5). Данные, представленные в табл. 5, показывают, что по мере уменьшения отношения эффективных ионных радиусов Rэфф(A+)/Rэфф(T2+) для соединений ATPn последовательно реализуются структурные типы, в которых координационные числа катионов щелочного металла A уменьшаются и, соответственно, изменяется выполняемая ими кристаллохимическая роль. Так, структуры с высоким отношением Rэфф(A+)/Rэфф(T2+) являются слоистыми, в них присутствуют гексагональные (KZnPn) или антифлюоритоподобные (NaZnPn и KCdPn) слои [TPn], разделенные прослойками из атомов щелочных металлов. По мере уменьшения отношения Rэфф(A+)/Rэфф(T2+) структуры становятся каркасными (NaCdPn, LiTPn). Cтруктуры LiTPn можно рассматривать как трехмерные каркасы, состоящие из тетраэдров [TPn4/4] с общими вершинами, упакованных по мотиву вюрцита (пр. гр. P63mc) или сфалерита (пр. гр. F$\bar {4}$3m) [22, 23], при этом атомы Li располагаются соответственно в октаэдрических или тетраэдрических пустотах анионной подрешетки Pn.
Таблица 5.
Сравнение кристаллического строения пниктидов ATPn (A = Li, Na, K; T = Zn, Cd; Pn = P, As, Sb, Bi)
| ATPn | KZnPn | KCdPn | NaZnPn | NaCdPn | LiZnPn | LiCdPn | ||
|---|---|---|---|---|---|---|---|---|
| Pn = Sb, Bi | Pn = P, As | |||||||
| Rэфф(A+)/Rэфф(T2+) [13, 14] | 2.05 | 1.65 | 1.54 | 1.24 | 1.09 | 0.88 | ||
| Структурный тип [7] | ZrBeSi | PbFCl | MgSrSi | LiGaGe | MgAgAs | |||
| Пр. гр. | P63/mmc | P4/nmm | Pnma | P63mc | F$\bar {4}$3m | |||
| Координационный полиэдр (КЧ)* | A | ТрАП (6) | ТП (5) | ТП (5) | Тр (3) | Т (4) | ||
| T | Тр (3) | Т (4) | Т (4) | Т (4) | T (4) | |||
| Pn | ТТрП (9) | ОТА (9) | ОТА (9) | ОТрA (7) | К (8) | |||
Проведенное рассмотрение ставит под сомнение предположение авторов работы [6] о возможности полиморфного перехода из структурного типа LiGaGe (пр. гр. P63mc) в структурный тип MgSrSi (пр. гр. Pnma), так как для этих структурных типов заметно различаются характерные значения отношения Rэфф(A+)/Rэфф(T2+).
Таким образом, кристаллизацией из раствора в жидком висмуте выращены монокристаллы двух ранее неизвестных висмутидов: NaZnBi и NaCdBi. Их кристаллическое строение установлено методом монокристального РСА, показано, что несмотря на одинаковую стехиометрию и сходные координационные полиэдры атомов Na, Zn/Cd и Bi, эти соединения относятся к различным структурным типам и образуют изоструктурные ряды со своими более легкими пниктидными аналогами: NaZnBi, так же как и остальные NaZnPn (Pn = P, As, Sb) кристаллизуется в структурном типе PbFCl, в то время как NaCdBi аналогично NaCdPn (Pn = As, Sb) относится к структурному типу MgSrSi. Детальное рассмотрение особенностей геометрии координационных полиэдров составляющих атомов показывает, что важным фактором, влияющим на реализацию того или иного структурного типа в соединениях ATPn (А = щелочной металл, T = элемент 12 группы (Zn, Cd), Pn = пниктоген), является отношение эффективных ионных радиусов Rэфф(A+)/Rэфф(T2+).
Следует также отметить, что полученные соединения содержат атомы висмута в формально отрицательной степени окисления и проявляют достаточно высокую химическую активность (особенно слоистый неустойчивый на воздухе NaZnBi), что делает рассматриваемые соединения перспективными прекурсорами для получения кластерных соединений висмута с использованием неводных растворителей. Так, в [24] синтез кластерных катионов висмута осуществляли сопропорционированием металлического висмута и Bi3+ в среде жидкого GaBr3, идея мягкого восстановления Bi3+ в неводных средах была успешно реализована и в [25].
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Ren Z.-A., Zhao Z.-X. // Adv. Mater. 2009. V. 21. № 45. P. 4584.
Bennett J.W., Garrity K.F., Rabe K.M. et al. // Phys. Rev. Lett. 2012. V. 109. № 16. P. 167602.
Yang J., Wegner A., Brown C.M. et al. // Appl. Phys. Lett. 2018. V. 113. № 12. P. 122105.
Schuster H.-U., Achenbach G. // Z. Naturforsch. B. 1978. V. 33. P. 113.
Zhang X., Liu Q., Xu Q. et al. // J. Am. Chem. Soc. 2018. V. 140. № 42. P. 13687.
Bennett J.W., Garrity K.F., Rabe K.M., Vanderbilt D. // Phys. Rev. Lett. 2013. V. 110. № 1. P. 017603.
Ovchinnikov A., Bobev S. // J. Solid State Chem. 2019. V. 270. P. 346.
Krenkel B., Tiburtius C., Schuster H.-U. // Z. Naturforsch. B. 1979. V. 34. P. 1686.
Savelsberg G., Schäfer H. // Z. Naturforsch. B. 1978. V. 33. № 4. P. 370.
Kahlert H., Schuster H.-U. // Z. Naturforsch. B. 1976. V. 31. P. 1538.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. № 1. P. 3.
Sheldrick G.M. // Acta Crystallogr A Found Adv. 2015. Vol. 71. № 01. P. 3–8.
Eisenmann B., Somer M. // Z. Naturforsch. B. 1985. V. 40. № 11. P. 1419.
Shannon R.D., Prewitt C.T. // Acta Crystallogr. B. 1969. V. 25. № 5. P. 925.
Shannon R.D., Prewitt C.T. // Acta Crystallogr. B. 1970. V. 26. № 7. P. 1046.
Kushwaha S.K., Krizan J.W., Feldman B.E. et al. // APL Materials. 2015. V. 3. № 4. P. 041504.
Xia S., Bobev S. // J. Solid State Chem. 2006. V. 179. № 11. P. 3371.
Reshak A.H., Auluck S. // Comput. Mater. Sci. 2015. V. 96. P. 90.
Jaiganesh G., Merita Anto Britto T., Eithiraj R.D. et al. // J. Phys. 2008. V. 20. № 8. P. 085220.
Charifi Z., Baaziz H., Noui S. et al. // Comput. Materi. Sci. 2014. V. 87. P. 187.
Schucht F., Dascoulidou A., Muller R. et al. // Z. Anorg. Allg. Chem. 1999. V. 625. P. 31.
Schuster H.-U., Schroeder G. // Z. Naturforsch. B. 1972. V. 27. P. 81.
Winter F., Pöttgen R., Greiwe M. et al. // Rev. Inorg. Chem. 2015. V. 35. № 1. P. 1.
Kuznetsov A.N., Popovkin B.A., Henderson W. et al. // Dalton Trans. 2000. № 11. P. 1777.
Kuznetsov A.N., Popovkin B.A., Ståhl K. et al. // Eur. J. Inorg. Chem. 2005. V. 2005. № 24. P. 4907.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия