Координационная химия, 2021, T. 47, № 10, стр. 598-603
Координационные полимеры Ni(II) с тиофеновыми лигандами: синтез, строение и магнитные свойства
В. А. Дубских 1, А. А. Лысова 1, Д. Г. Самсоненко 1, А. Н. Лавров 1, Д. Н. Дыбцев 1, *, В. П. Федин 1
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
* E-mail: dan@niic.nsc.ru
Поступила в редакцию 15.03.2021
После доработки 09.04.2021
Принята к публикации 12.04.2021
Аннотация
Два новых металл-органических координационных полимера [Ni(Btdc)(Bipy)(H2O)2] (I) и [Ni(a-zobipy)(H2O)4](Btdc) (II) (H2Btdc = 2,2'-битиофен-5,5'-дикарбоновая кислота, Bipy = 4,4'-бипиридил, azobipy = 4,4'-азобипиридил) были получены в сольватотермальных условиях. Структура и состав соединений установлены с помощью монокристального рентгеноструктурного анализа (ССDС № 2068945 (I), 2068946 (II)) и подтверждены методами рентгенофазового, элементного и термогравиметрического анализов и ИК-спектроскопией. Структура I представляет собой редкий пример взаимного переплетения сетчатых мотивов в двух независимых направлениях. Соединение II имеет ионную природу и состоит из чередующихся катионных [Ni(azobipy)(H2O)4]2+ и анионных Btdc2– фрагментов. Для соединения I были проведены измерения магнитной восприимчивости и эффективного магнитного момента в диапазоне температур 1.77–300 К в магнитных полях до 10 кЭ. Значение μэфф составляет 3.08 µB при 300 К, что близко к чисто спиновому значению для изолированного высокоспинового иона Ni2+ с S = 1 (2.83 µB) с учетом вклада орбитального момента. При температурах T < 10 K наблюдается слабые антиферромагнитные взаимодействия между ионами Ni2+.
Интерес к химии металл-органических координационных полимеров (МОКП) в последние несколько десятилетий обусловлен наличием у этого класса соединений уникальных функциональных свойств, которые можно тонко настраивать за счет комбинирования различных органических лигандов и ионов (или кластеров) металлов [1–4]. Один из способов функционализации МОКП – это использование мостиковых лигандов, содержащих гетероатом, в частности атом серы. Было показано, что относительно высокая электронная плотность и поляризуемость атома серы улучшает сорбционные и люминесцентные характеристики таких координационных полимеров [5–10]. Кроме того, представляет интерес исследование магнитных свойств МОКП на основе таких лигандов [11] и парамагнитных катионов металлов, в частности Ni(II). На данный момент опубликовано всего несколько работ, в которых обсуждаются магнитные свойства МОКП на основе ионов Ni2+ и тиофен-2,5-дикарбоновой кислоты (H2Tdc). В ряде работ [12–14] сообщается об антиферромагнитных обменных взаимодействиях между ионами Ni2+ в тиофенсодержащих координационных полимерах внутри строительных блоков {Ni2} или {Ni3}, и дальнего магнитного упорядочения в этих соединениях не наблюдается. В [15] сообщается об одномерном координационном полимере [Ni(Tdc)- (Pen)2] (Pen = 1,3-диаминопропан) со значением эффективного магнитного момента (μэфф) при 300 К равным 2.62 µB. В [16] синтезирован трехмерный каркас с изолированными атомами никеля. Падение μэфф при T < 25 K говорит о наличии антиферромагнитных взаимодействий, которые, по словам авторов, происходят через карбоксилатные лиганды. О соединениях с более длинными гетероциклическими лигандами тиофенового ряда с исследованными магнитными свойствами не сообщалось.
В настоящей работе впервые синтезированы никель(II)-органические координационные полимеры с использованием 2,2'-битиофен-5,5'-дикарбоновой кислоты (H2Вtdc), установлено их кристаллическое строение и изучены магнитные свойства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез H2Вtdc проводили по методике, описанной в [17]. Остальные исходные вещества и растворители использовали в виде коммерчески доступных реактивов без дополнительной очистки.
Синтез [Ni(Вtdc)(Bipy)(H2O)2] (I). 29.1 мг (0.1 ммоль) Ni(NO3)2 · 6H2O, 25.4 мг (0.1 ммоль) H2Btdc и 15.6 мг (0.1 ммоль) 4,4'-бипиридила (Bipy), 2.5 мл N,N-диметилформамида (ДМФА), 2.5 мл воды и 5.5 мкл ледяной уксусной кислоты герметизировали в реакторе из тефлона и нагревали в стальном автоклаве при 110°C в течение 48 ч. Полученные кристаллы зеленого цвета промывали ДМФА (3 × 5 мл) и сушили на воздухе. Выход 23 мг (46%). Состав и структура продукта определяли с помощью РСА.
ИК-спектр (ν, см–1): 3639 сл, 3391 ш.сл, (νs(O–H); 1609 ср, 1547 ср (νas(C=O)), 1512 ср γ(С–С); 1435 ср , 1414 ср, 1372 с νs(C=O); 1217 ср, 1121 сл, 1100 сл, 1070 сл, 1038 сл, 1009 сл, 887 сл, 814 с, 777 с (δoop(C–H); 752 сл, 733 сл, 671 сл, 648 ср, 633 ср, 600 ср, 567 ср, 519 с, 471 сл, 438 ср.
Синтез [Ni(azobipy)(H2O)4](Btdc) (II). 58.2 мг (0.2 ммоль) Ni(NO3)2 ⋅ 6H2O, 50.8 мг (0.2 ммоль) H2Btdc и 36.8 мг (0.2 ммоль) 4,4'-азобипиридила (azobipy), 2.5 мл ДМФА, 2.5 мл воды и 22 мкл ледяной уксусной кислоты герметизировали в реакторе из тефлона и нагревали в стальном автоклаве при 110°C в течение 48 ч. Полученные кристаллы красного цвета промывали ДМФА (3 × 5 мл) и сушили на воздухе. Выход 108 мг (81%). Состав и структура продукта определяли с помощью РСА.
ИК-спектр (ν, см–1): 3291 ш.ср (νs(O–H); 1603 ср, 1564 с νas(C=O); 1514 ср (γ(С–С); 1439 с (νs(C=O); 1420 ср, 1366 с νs(C=O); 1225 сл, 1190 сл, 1117 сл, 1038 ср, 1038 ср, 1022 сл, 885 ср, 845 ср, 827 ср, 781 с δoop(C–H); 696 ср, 648 ср, 575 с, 554 ср, 532 сл, 521 сл, 498 сл, 461 сл.
ИК-спектры в диапазоне 4000–400 см–1 регистрировали в таблетках с KBr на Фурье-спектрометре Scimitar FTS 2000. Термогравиметрический анализ (ТГА) проводили на термоанализаторе NETZSCH TG 209 F1 при линейном нагревании образцов в атмосфере He со скоростью 10 град мин–1. Элементный анализ (ЭА) выполняли на CHN-анализаторе VarioMICROcube. Данные РФА получали на порошковом дифрактометре Shimadzu XRD 7000S (CuKα-излучение, λ = 1.54178 Å (I) и CoKα, λ = 1.78897 Å (II)).
Измерения намагниченности поликристаллических образцов проводили с помощью магнитометра Quantum Design MPMS-XL SQUID в диапазоне 1.77–300 К при магнитных полях до 10 кЭ. Температурные зависимости намагниченности (M(T)) измеряли при нагреве образца после его охлаждения либо в нулевом магнитном поле, либо в заданном магнитном поле, а также при охлаждении образца. Для определения парамагнитной составляющей молярной магнитной восприимчивости (χp(T)) температурно-независимый диамагнитный вклад (χd) и возможную намагниченность ферромагнитных микропримесей (χFM(T)) оценивали и вычитали из измеренных значений суммарной молярной восприимчивости (χ = M/H). В то время как χd вычисляли с использованием аддитивной схемы Паскаля, (χFM(T)), если таковая имеется, определяли по измеренным изотермическим зависимостям M(H) и данным M(T), взятым при различных магнитных полях. Для определения µэфф ионов Ni2+ парамагнитную восприимчивость χp(T) анализировали с использованием зависимости Кюри–Вейса χp(T) = ${{{{N}_{{\text{A}}}}\mu _{{{\text{эфф}}}}^{2}} \mathord{\left/ {\vphantom {{{{N}_{{\text{A}}}}\mu _{{{\text{эфф}}}}^{2}} {3{{k}_{{\text{B}}}}(T - \theta )}}} \right. \kern-0em} {3{{k}_{{\text{B}}}}(T - \theta )}},$ где NA и kB– числа Авогадро и Больцмана соответственно. Влияние на магнитную восприимчивость расщепления в нулевом поле уровней ионов Ni2+ оценивали с использованием подходов, описанных в [18].
РСА. Дифракционные данные для монокристалла I получены при 100 К на синхротронной станции “БЕЛОК” Национального исследовательского центра “Курчатовский институт”, используя двухкоординатный детектор Rayonix SX165 CCD (λ = 0.79313 Å, ω-сканирование с шагом 1.0°). Интегрирование, учет поглощения, определение параметров элементарной ячейки проводили с использованием пакета программ XDS [19]. Дифракционные данные для монокристалла II получены при 140 К на автоматическом дифрактометре A-gilent Xcalibur, оснащeнном двухкоординатным детектором AtlasS2 (графитовый монохроматор, λ(MoKα) = 0.71073 Å, ω-сканирование с шагом 0.25°). Интегрирование, учет поглощения, определение параметров элементарной ячейки проводили с использованием пакета программ CrysAlisPro [20]. Структуры расшифрованы с использованием программы SHELXT [21] и уточнены полноматричным МНК в анизотропном (за исключением атомов водорода) приближении с использованием программы SHELXL [22]. Позиции атомов водорода органических лигандов рассчитаны геометрически и уточнены по модели “наездника”. Кристаллографические данные и детали дифракционных экспериментов приведены в табл. 1. Полные таблицы межатомных расстояний и валентных углов, координаты атомов и параметры атомных смещений депонированы в Кембриджский банк структурных данных (CCDC № 2068945 (I), 2068946 (II); https:// www.ccdc.cam.ac.uk/structures/).
Таблица 1.
Кристаллографические данные и параметры уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| M | 503.18 | 567.23 |
| Сингония | Моноклинная | Моноклинная |
| Пр. гр. | С2 | С2/с |
| a, Å | 19.623(3) | 6.6198(2) |
| b, Å | 11.197(2) | 12.8425(5) |
| c, Å | 14.907(2) | 26.0359(8) |
| α, град | 90 | 90 |
| β, град | 103.80(3) | 93.747(3) |
| γ, град | 90 | 90 |
| V, Å3 | 3180.8(9) | 2208.70(13) |
| Z | 6 | 4 |
| ρ(выч.), г/см3 | 1.576 | 1.706 |
| μ, мм−1 | 1.548 | 1.126 |
| F(000) | 1548 | 1168 |
| Размер кристалла, мм | 0.07 × 0.05 × 0.03 | 0.17 × 0.11 × 0.10 |
| Область сканирования по θ, град | 1.57–31.00 | 3.14–28.98 |
| Диапазон индексов hkl | −25 ≤ h ≤ 25, −14 ≤ k ≤ 14, −17 ≤ l ≤ 19 |
−8 ≤ h ≤ 9, −9 ≤ k ≤ 15, −33 ≤ l ≤ 32 |
| Число измеренных/независимых отражений | 23 003/7131 | 5115/2442 |
| Rint | 0.0299 | 0.0124 |
| Число отражений с I > 2σ(I) | 7014 | 2271 |
| GOOF | 1.086 | 1.050 |
| R-факторы (I > 2σ(I)) | R1 = 0.0380, wR2 = 0.1076 | R1 = 0.0284, wR2 = 0.0724 |
| R-факторы (по всем отражениям) | R1 = 0.0387, wR2 = 0.1088 | R1 = 0.0310, wR2 = 0.0736 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.566/−0.675 | 1.562/−0.243 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
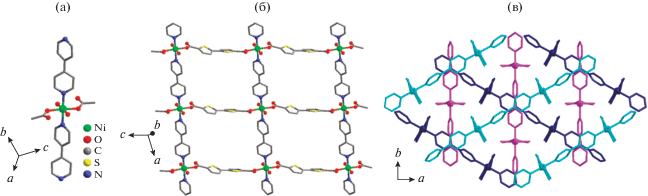
Монокристаллы соединения [Ni(Btdc)(Bipy)-(H2O)2] (I) были получены нагреванием Ni(NO3)2 · · 6H2O, H2Btdc и Bipy в смеси растворителей ДМФА–вода (1 : 1 по объему) с небольшим добавлением ледяной уксусной кислоты при 110°С. Согласно данным РСА, соединение I кристаллизуется в моноклинной сингонии с пространственной группой симметрии С2 с Z = 6. Независимая часть структуры содержит один катион Ni2+, один анион Btdc2–, одну молекулу Bipy и две молекулы воды. Атом Ni(1) находится в октаэдрическом окружении, создаваемым двумя атомами азота двух лигандов Bipy в аксиальных положениях, двумя атомами кислорода двух карбоксильных групп двух лигандов Btdc2– и двумя атомами кислорода координированных молекул воды в экваториальных положениях (рис. 1а). Для катиона Ni(1) КЧ равно 6. Длины связей Ni–N составляют 2.069(6) и 2.090(6) Å, а Ni–О находятся в интервале от 2.043(3) до 2.086(3) Å. Каждый катион никеля(II) соединен с четырьмя другими катионами через две мостиковые молекулы Bipy и два мостиковых аниона Btdc2–, что приводит к образованию двухмерных сетчатых структур (рис. 1б) с квадратной топологией и размерами ячеек 7 × 9 Å. Расстояния между плоскостями соседних параллельных сеток соответствуют ∼9.7 Å. Интересно, что данные сетки расположены в трех разных ориентациях, параллельных оси c, что приводит к взаимному переплетению всех сеток координационного полимера с образованием супрамолекулярного каркаса (рис. 1в). Таким образом, кристаллическая структура I, построенная на основе слоистых мотивов, не может быть разрушена без разрыва химических связей и является трехмерным поликатенаном. Следует отметить, что взаимопрорастание по типу поликатенанов в слоистых МОКП встречается достаточно редко и представляет интерес с точки зрения направленного дизайна координационных и супрамолекулярных соединений [23–25].
Рис. 1.
Структура координационного полимера I: строение вторичного строительного блока (а); фрагмент слоя (б); схема взаимного переплетения координационных сеток в структуре супрамолекулярного каркаса (в). Атомы водорода не показаны для ясности.
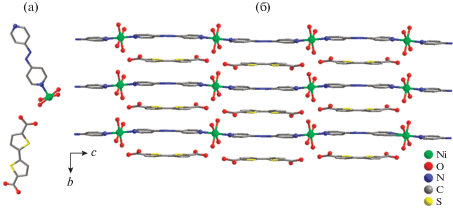
Соединение [Ni(azobipy)(H2O)4](Btdc) (II) было синтезировано нагреванием эквимолярной смеси Ni(NO3)2 ⋅ 6H2O, H2Btdc и azobipy в смеси растворителей ДМФА–вода (1 : 1 по объему) с небольшим добавлением ледяной уксусной кислоты при 110°С. По данным РСА, соединение II кристаллизуется в моноклинной сингонии с пространственной группой симметрии С2/с с Z = 4. Независимая часть структуры содержит один катион Ni2+, одну молекулу azobipy, четыре молекулы воды и один анион Btdc2– (рис. 2а). Атом Ni(1) находится в окружении, создаваемым двумя атомами азота двух лигандов azobipy в аксиальных положениях и четырьмя атомами кислорода четырех координированных молекул воды в экваториальных положениях. Для катиона Ni(1) КЧ равно 6, а координационный полиэдр имеет форму октаэдра. Длины связей Ni–N составляют 2.0971(15) и 2.0972(15) Å, а Ni–О находятся в интервале от 2.0443(13) до 2.1144(13) Å. С помощью молекул azobipy атомы Ni(1) соединяются в положительно заряженные полимерные цепочки, тянущиеся вдоль кристаллографической оси с. Анионы Btdc2– служат в качестве противо-ионов. В результате цепочки [Ni(azobipy)(H2O)4]+ образуют положительно заряженные слои, параллельные плоскости ac, которые чередуются с отрицательно заряженными слоями, состоящими из анионов Btdc2–, что обеспечивает общий нейтральный заряд кристаллического соединения (рис. 2б).
Рис. 2.
Структура координационного полимера II: строение независимой части (а); вид кристаллической упаковки (б). Атомы водорода не показаны для ясности.
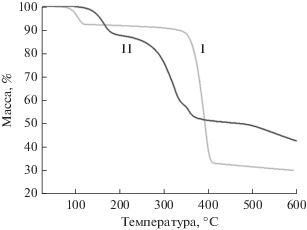
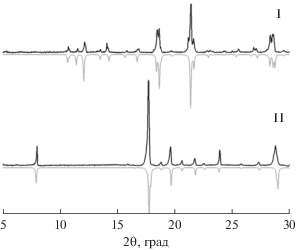
Данные РФА для порошковых образцов I и II полностью соответствуют теоретически рассчитанным дифрактограммам и подтверждают фазовую чистоту полученных соединений (рис. 3). По данным ТГА, соединение I стабильно до Т ≈ 100°С, далее происходит небольшая потеря массы (~8%), связанная с удалением двух координированных молекул воды. Масса координационного полимера остается постоянной вплоть до Т ≈ 340°С, после чего происходит его термолиз. Соединение II имеет ступень потери массы (~12%) в диапазоне 140–180°С, также связанную с удалением четырех координированных молекул воды. При температуре выше 230°С происходит постепенное разложение координационного полимера (рис. 4).
Рис. 3.
Сравнение экспериментальной (черный) и теоретической (серый) порошковых дифрактограмм для соединений I и II.
ИК-спектр соединения I содержит полосы, характерные для деформационных внеплоскостных колебаний связи C–H при 777 см–1, а также полосы валентных симметричных и асимметричных колебаний связи С=О в карбоксилатных группах при 1372 и 1547 см–1 соответственно. Широкая полоса при 3391 см–1 относится к валентным колебаниям связи О–Н в молекуле воды. В ИК-спектре соединения II имеется полоса при 781 см–1, относящаяся к деформационным внеплоскостным колебаниям связи C–H, а также полосы, характерные для валентных симметричных и асимметричных колебаний связи С=О в карбоксилатных группах при 1439 и 1564 см–1 соответственно. Широкая полоса средней интенсивности при 3291 см–1 соответствует валентным колебаниям связи О–Н в молекуле воды.
Температурные зависимости молярной магнитной восприимчивости (χp(T)) соединения I были измерены в диапазоне 1.77–300 К при магнитных полях до 10 кЭ. Магнитная восприимчивость координационного полимера постепенно увеличивалась с понижением температуры до минимальной доступной температуры 1.77 К, что вполне ожидаемо для парамагнитного соединения, содержащего ионы Ni2+. После вычитания диамагнитного вклада, χd, рассчитанного с использованием аддитивной схемы Паскаля, из общей магнитной восприимчивости оставшийся парамагнитный компонент χp(T) был нанесен на график как 1/χp в зависимости от температуры (рис. 5). Практически во всем температурном диапазоне кривая 1/χp(Т) близка к линейной, следуя парамагнитной зависимости Кюри–Вейса χp(T) = ${{{{N}_{{\text{A}}}}\mu _{{{\text{эфф}}}}^{2}} \mathord{\left/ {\vphantom {{{{N}_{{\text{A}}}}\mu _{{{\text{эфф}}}}^{2}} {3{{k}_{{\text{B}}}}(T - \theta )}}} \right. \kern-0em} {3{{k}_{{\text{B}}}}(T - \theta )}}$ с θ ≈ 1–1.5 К. Рассчитанный μэфф для соединения I составляет 3.08 µB при 300 К, что близко к чисто спиновому значению (2.83 µB) для изолированного высокоспинового иона Ni2+ с S = 1. Избыток величины обусловлен вкладом орбитального момента в магнитный момент иона никеля. Резкое снижение значения μэфф при температурах T < 10 K может быть связано как с расщеплением уровней ионов в нулевом поле, ожидаемым для ионов Ni2+ со спином S = 1, так и с наличием слабого антиферромагнитного обменного взаимодействия между ионами. Следующий по важности после обменного диполь-дипольный механизм межионного взаимодействия не оказывает в данном случае определяющего влияния. Диполь-дипольное взаимодействие имеет характерный масштаб энергий (gµB)2/r3 (r = расстояние между магнитными ионами), который для ионов Ni2+ с S = 1 при имеющихся в структуре МОКП расстояниях в десятки раз меньше наблюдающихся значений θ. Попытки численного описания температурной зависимости μэфф с использованием подходов, описанных в [18], показали, что хорошее согласие с экспериментом можно получить только при учете обоих факторов: расщепления в нулевом поле и антиферромагнитного обменного взаимодействия. На рис. 5 тонкой сплошной линией показаны результаты аппроксимации со значениями коэффициента расщепления D/kB ≈ 4.8 K и обменного межмолекулярного взаимодействия zJ ≈ –0.16 K, где z – магнитное координационное число ионов Ni2+. Полученное значение D характерно для комплексов Ni(II) [18].
Рис. 5.
Температурная зависимость 1/χp и μэфф на один ион никеля для соединения I. Магнитное поле H = 1 и 10 кЭ. Прерывистой линией показано формальное описание кривой 1/χp(T) зависимостью Кюри−Вейса, тонкой сплошной линией изображены результаты аппроксимации зависимости μэфф(T) с учетом расщепления уровней ионов Ni2+ в нулевом поле и межионного обменного взаимодействия.
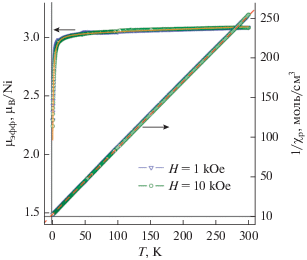
Механизмы обменного взаимодействия в соединении I не очевидны. Внутри слоя парамагнитные центры разделены длинными органическими лигандами Btdc2– и Bipy на расстояния 14.9 и 11.3 Å соответственно, что делает невозможным обменное взаимодействие между ионами Ni2+ в рамках одного слоя. Но поскольку координационный полимер I является взаимопроросшим, то расстояние между ионами Ni2+, относящимися к разным слоям, сокращается до 6.9 Å, что, по-видимому, приводит к формированию путей для слабого антиферромагнитного взаимодействия.
Таким образом, синтезированы и полностью охарактеризованы два новых металл-органических координационных полимера на основе ионов Ni2+. Для соединения I проведены измерения магнитной восприимчивости и эффективного магнитного момента.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Zhou H.-C., Kitagawa S. // Chem. Soc. Rev. 2014. V. 43. P. 5415.
Yuan S., Feng L., Wang K. et al. // Adv. Mater. 2018. P. 1704303.
Schneemann A., Bon V., Schwedler I. et al. // Chem. Soc. Rev. 2014. V. 43. P. 6062.
Stock N., Biswas S. // Chem. Rev. 2012. V. 112. P. 933.
Demakov P.A., Volynkin S.S., Samsonenko D.G. et al. // Molecules. V. 25. 4396.
Bolotov V.A., Kovalenko K.A., Samsonenko D.G. et al. // Inorg. Chem. 2018. V. 57. P. 5074.
Lysova A.A., Samsonenko D.G., Dorovatovskii P.V. et al. // J. Am. Chem. Soc. 2019. V. 141. P. 17260.
Hua C., D’Alessandro D.M. // Cryst. Growth Des. 2017. V. 17. P. 6262.
Zhao J., Shi X., Li G.et al. // Inorg. Chim. Acta. 2012. V. 383. P. 185.
Ding B., Hua C., Kepert C. et al. // Chem. Sci. 2019. V. 10. P. 1392.
Dubskikh V.A., Lysova A.A., Samsonenko, D.G. et al. // Molecules. 2021. V. 26. 1269.
Demessence A., Mesbah A., François M. et al. // Eur. J. Inorg. Chem. 2009. V. 25. P. 3713.
Lu K., Ma D.-Y., Sakiyama H. // Inorg. Chem. Commun. 2018. V. 91. P. 39.
Alexander D.S., Robert L.L. // Z. Anorg. Allg. Chem. 2016. V. 642. P. 966.
Yeşilel O.Z., İlker İ., Şahin E. // J. Inorg. Organomet. Polym. Mater. 2011. V. 21. P. 103.
Dong J.-L., Zhu P.-Y., Du J.-Q. et al. // RSC Adv. 2019. V. 9. P. 17560.
Dubskikh V.A., Lysova A.A., Samsonenko D.G. et al. // J. Struct. Chem. 2020. V. 61. P. 1800.
Boča R. // Coord. Chem. Rev. 2004. V. 248. P. 757.
Kabsch W. // Acta Crystallogr. D. 2010. V. 66. P. 125.
CrysAlisPro Software system. Version 1.171.40.84a. 2020.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Batten S.R., Robson R. // Angew. Chem. Int. Ed. 1998. V. 37. P. 1460.
Wang K., Lv B., Wang Z. // Dalton Trans. 2020. V. 49. P. 411.
Verma G., Butikofer S., Kumar S. et al. // ACS Appl. Mater. Interfaces. 2019. V. 12. P. 18715.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия