Координационная химия, 2021, T. 47, № 10, стр. 592-597
Циклометаллирование диметиламидного лиганда в реакции Ta(NMe2)5 c CS2
П. А. Петров 1, *, А. В. Рогачев 1, И. В. Ельцов 2, Т. С. Сухих 1, Ю. А. Ларичева 1, П. А. Абрамов 1, М. Н. Соколов 1
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: panah@niic.nsc.ru
Поступила в редакцию 02.04.2021
После доработки 05.05.2021
Принята к публикации 06.05.2021
Аннотация
При взаимодействии Ta(NMe2)5 с CS2 выделен азаметаллациклопропановый комплекс состава [Ta(MeDtc)3(η2-CH2NMe)] (I, MeDtc = диметилдитиокарбамат), охарактеризованный методом рентгеноструктурного анализа в бессольватной форме и в виде сольвата с толуолом (CCDC № 2005837 (I), 2049693 (I ∙ 0.5C7H8)), а также ЯМР-спектроскопией и расчетами методом DFT.
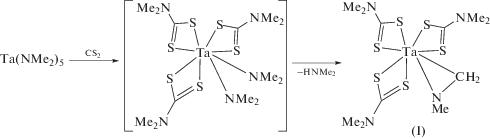
Амиды металлов играют важную роль в современной координационной химии и являются предшественниками множества других лигандов [1]. Кроме того, диалкиламиды (чаще всего диметиламиды) ранних переходных металлов и их разнолигандные производные – предшественники тонких пленок нитридов металлов, получаемых методом химического осаждения из газовой фазы (Chemical vapor deposition, CVD) [2]. Наличие примеси углерода в полученных пленках (как свободного, так и связанного с металлом) объяснялось образованием в процессе осаждения азаметаллациклопропанов за счет элиминирования протона метильной группы. Кроме того, как предполагается, азаметаллациклопропановые комплексы являются интермедиатами ряда каталитических реакций, например гидроаминирования алкенов [3, 4]. Было структурно охарактеризовано несколько комплексов ранних переходных металлов с дианионом CH2NMe2–, координированным как терминально, так и по мостиковому типу [4–8]. Настоящая работа посвящена синтезу и исследованию азаметаллациклопропанового комплекса тантала [Ta(MeDtc)3(η2-CH2NMe)].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез проводили в инертной атмосфере с использованием стандартной аппаратуры Шленка. Растворители подвергали обезвоживанию и дегазации кипячением и перегонкой в атмосфере аргона с использованием соответствующих осушителей [9]. CS2 (Acros) сушили над молекулярными ситами 3A, после чего дегазировали. Спектры ЯМР регистрировали на спектрометре Bruker Avance III 500 с рабочей частотой 500.03 МГц для ядер 1H и 125.73 МГц для ядер 13С; в качестве стандартов использовали сигналы растворителя (δH = = 3.58 м.д., δC = 67.21 м.д.) [10]. ИК-спектры в таблетках KBr записывали на приборе SCIMITAR FTS 2000. Элементный анализ выполняли в Аналитической лаборатории ИНХ СО РАН.
Синтез [Ta(MeDtc)3(η2-CH2NMe)] (I). 443 мг (1.10 ммоль) Ta(NMe2)5 (Далхим, Россия) помещали в сосуд Шленка и последовательно конденсировали в него при пониженном давлении и охлаждении 20 мл толуола и 200 мкл (253 мг, 3.32 ммоль) CS2. После самопроизвольного отогревания смеси от –196°C до комнатной температуры выпадал светлый осадок, цвет которого постепенно менялся на коричневый. Полученную суспензию нагревали при 65°C в течение суток, после чего охлаждали и упаривали досуха. Остаток экстрагировали 15 мл толуола, желтый экстракт фильтровали через стеклянный фильтр (G4) и запаивали в Г-образную ампулу. После медленного упаривания растворителя в свободном колене ампулы образовались желтые кристаллы I ∙ 0.5C7H8, пригодные для РСА. Выход 90 мг (15%).11
ЯМР 1H (500 МГц; ТГФ; δ, м.д.): 2.22 (с., 2H, CH2), 3.27 (м., 18H, CH3Dtc), 3.96 (с., 3H, CH3). ЯМР 13C (126 МГц; ТГФ; δ, м.д.): 39.0 (CH3Dtc), 48.2 (CH3NCH2), 56.0 (CH3NCH2), 204.7 (Me2NCS2), 206.7 (Me2NCS2).
ИК-спектр (KBr; ν, см–1): 2926 сл, 2855 сл, 1533 о.с, 1447 ср, 1395 о.с, 1247 с, 1147 с, 1049 ср, 996 ср, 982 ср, 899 сл, 574 сл.
РСА. Монокристаллы бессольватной формы I получены в качестве примеси в ранее описанном синтезе [Ta(MeDtc)4](MeDtc) ∙ C7H8 [11]. Измерения I и I ∙ 0.5C7H8 проведены по стандартной методике на автоматическом четырехкружном дифрактометре Bruker-Nonius X8 APEX (двухкоординатный CCD детектор, λ = 0.71073 Å, графитовый монохроматор). Интенсивности отражений измерены методом φ-сканирования узких (0.5°) фреймов. Поглощение учтено эмпирически (SADABS) [12]. Структуры расшифрованы по программе SHELXT [13] и уточнены по программе SHELXL [14] в анизотропном приближении для неводородных атомов с использованием программной оболочки Olex2 [15]. Атомы водорода локализованы геометрически и уточнены в приближении жесткого тела. Кристаллографические характеристики комплекса и детали дифракционного эксперимента приведены в табл. 1. Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDC № 2005837 (I) и 2049693 (I ∙ 0.5C7H8)) и могут быть получены по адресу: http://www.ccdc.cam.ac.uk/ conts/retrieving.html.
Таблица 1.
Кристаллографические данные и параметры уточнения структур I и I · 0.5C7H8
| Параметр | Значение | |
|---|---|---|
| I | I · 0.5C7H8 | |
| Брутто-формула | C11H23N4S6Ta | C29H54N8S12Ta2 |
| М | 584.64 | 1261.42 |
| Сингония, пр. гр. | Гексагональная, P61 | Моноклинная, P21/с |
| Температура, K | 296(2) | 150(2) |
| a, Å | 9.813(3) | 13.8012(15) |
| b, Å | 9.813(3) | 11.7849(12) |
| c, Å | 39.048(13) | 29.638(3) |
| α, град | 90 | 90 |
| β, град | 90 | 102.878(4) |
| γ, град | 120 | 90 |
| V, Å3 | 3256(2) | 4699.3(9) |
| Z | 6 | 4 |
| μ, мм–1 | 5.641 | 5.218 |
| Размер кристалла, мм | 0.21 × 0.12 × 0.12 | 0.3 × 0.25 × 0.2 |
| F(000) | 1716.0 | 2488.0 |
| Область сбора данных 2θ, град | 4.794–51.626 | 2.82–52.744 |
| Диапазон индексов h, k, l | –11 ≤ h ≤ 7, –3 ≤ k ≤ 12, –47 ≤ l ≤ 37 |
–17 ≤ h ≤ 17, –14 ≤ k ≤ 14, –37 ≤ l ≤ 37 |
| Число измеренных, независимых и наблюдаемых (I > 2σ(I)) отражений | 7792, 3549, 3136 | 48 169, 9611, 8347 |
| GOOF | 0.986 | 1.044 |
| Rint | 0.0448 | 0.0304 |
| R1, wR2 (I > 2σ(I)) | R1 = 0.0367, wR2 = 0.0609 | R1 = 0.0387, wR2 = 0.0967 |
| R1, wR2 (все отражения) | R1 = 0.0444, wR2 = 0.0635 | R1 = 0.0456, wR2 = 0.1021 |
| Параметр Флэка | 0.012(12) | |
| Число уточняемых параметров | 199 | 463 |
| Число ограничений | 1 | 0 |
| Δρmax/Δρmin, e Å–3 | 0.64/–0.51 | 2.71/–1.42 |
Квантово-химические расчеты проводили методом DFT в программном комплексе ADF2019 [16, 17] с использованием полноэлектронного базиса TZ2P и функционалов VWN [18] (приближение локальной плотности) и BP86 [19–21] (обобщенное градиентное приближение) и с учетом релятивистских эффектов методом ZORA [22].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Внедрение CS2 по связи M–N в амидах ранних переходных металлов является общим методом синтеза их дитиокарбаматов [23, 24]. Ранее по реакции Ta(NMe2)5 с избытком CS2 мы получили два сольвата [Ta(MeDtc)4](MeDtc) с додекаэдрическим окружением центрального атома [11]. Наряду с основным продуктом – [Ta(MeDtc)4](MeDtc) – в реакции Ta(NMe2)5 и CS2 в толуоле был выделен [Ta(MeDtc)3(η2-CH2NMe)] (I) в качестве побочного с низким выходом. Очевидно, что его образование является следствием стерической перегрузки координационного узла в промежуточном продукте реакции [Ta(MeDtc)3(NMe2)2] с последующим элиминированием Me2NH (схема 1 ).
Схема 1 .
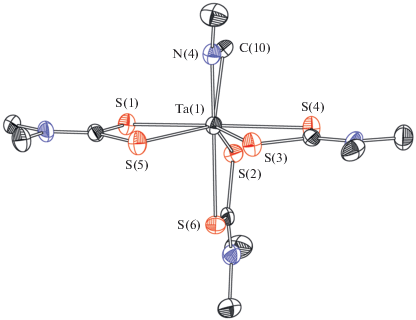
Комплекс I кристаллизуется в гексагональной пространственной группе P61. Геометрия координационного полиэдра близка к додекаэдрической, зафиксированной ранее в катионах [Ta(MeDtc)4]+ [11]. Строение комплекса I представлено на рис. 1. Углы между плоскостями хелатных циклов соседних лигандов (MeDtc– и CH2NMe2–) близки к 90° и лежат в интервале 88.1°–92.7°. Для каждого дитиокарбаматного лиганда наблюдается два несколько различающихся расстояния Ta–S (2.59 и 2.64 Å), что характерно для данного класса лигандов (табл. 2). Хелатные углы ∠STaS (66.93(10)°–67.36(9)°) также близки к известным из литературы. Расстояние Ta(1)–N(4) (1.955(10) Å) несколько меньше такового в Ta(NMe2)5 (средн. 2.017 Å); расстояние Ta(1)–C(10) равно 2.206(11) Å. Отличительной особенностью I является малый хелатный угол ∠N(4)Ta(1)C(10) (39.1(4)°), который близок к значениям для других комплексов с терминально координированным лигандом CH2NMe2– (39.4°–40.0°). Для сравнения, N-протонированный азаметаллациклопропановый комплекс молибдена(IV) [Mo(Me2Рz)3(HMe2Рz)(η2-CH2NHMe)] (II; HMe2Рz = = 3,5-диметилпиразол) характеризуется столь же малым хелатным углом лиганда CH2NHMe– (39.0(2)°) [25]. Вместе с тем расстояние Mo–N (2.145(3) Å) в II сильно увеличено по сравнению с Ta–N в I (1.955(10) Å) при практически одинаковых ионных радиусах Mo4+ и Ta5+. Еще одним отличием является сумма углов при азаметаллациклопропановом атоме N: для I она составляет 358.0° и однозначно указывает на отсутствие протона при данном атоме, тогда как для II она (без учета атома H) равна 318.5°.
Таблица 2.
Основные длины связей (Å) и углы (град) в структурах I и I · 0.5C7H8
| I | I · 0.5C7H8 | ||||
|---|---|---|---|---|---|
| молекула 1 | молекула 2 | ||||
| Связь | d, Å | Связь | d, Å | Связь | d, Å |
| Ta(1)–N(4) | 1.955(10) | Ta(1)–N(7) | 1.925(5) | Ta(2)–N(8) | 1.968(6) |
| Ta(1)–C(10) | 2.206(11) | Ta(1)–C(71) | 2.169(6) | Ta(2)–C(81) | 2.172(8) |
| Ta(1)–S(4) | 2.587(3) | Ta(1)–S(11) | 2.5627(14) | Ta(2)–S(41) | 2.6185(15) |
| Ta(1)–S(10) | 2.586(3) | Ta(1)–S(12) | 2.6001(15) | Ta(2)–S(42) | 2.5913(16) |
| Ta(1)–S(2) | 2.594(3) | Ta(1)–S(21) | 2.5667(15) | Ta(2)–S(51) | 2.6134(16) |
| Ta(1)–S(5) | 2.636(3) | Ta(1)–S(22) | 2.6403(15) | Ta(2)–S(52) | 2.5437(15) |
| Ta(1)–S(3) | 2.639(3) | Ta(1)–S(31) | 2.5885(16) | Ta(2)–S(61) | 2.5968(16) |
| Ta(1)–S(6) | 2.644(3) | Ta(1)–S(32) | 2.6044(15) | Ta(2)–S(62) | 2.5706(17) |
| N(4)–C(10) | 1.412(15) | N(7)–C(71) | 1.318(10) | N(8)–C(81) | 1.330(11) |
| N(4)–C(11) | 1.430(15) | N(7)–C(72) | 1.466(8) | N(8)–C(82) | 1.441(11) |
| Угол | ω, град | Угол | ω, град | Угол | ω, град |
| S(1)Ta(1)S(5) | 66.93(10) | S(11)Ta(1)S(12) | 67.05(5) | S(42)Ta(2)S(41) | 66.44(5) |
| S(4)Ta(1)S(3) | 67.09(11) | S(21)Ta(1)S(22) | 68.34(5) | S(52)Ta(2)S(51) | 68.03(5) |
| S(2)Ta(1)S(60) | 67.36(9) | S(31)Ta(1)S(32) | 66.44(6) | S(62)Ta(2)S(61) | 66.43(5) |
| N(4)Ta(1)C(10) | 39.1(4) | N(7)Ta(1)C(71) | 36.9(3) | N(8)Ta(2)C(81) | 37.1(3) |
| N(4)C(10)Ta(1) | 60.8(6) | N(7)C(71)Ta(1) | 61.4(3) | N(8)C(81)Ta(2) | 63.1(4) |
| Ta(1)N(4)C(10) | 80.1(6) | C(71)N(7)Ta(1) | 81.7(4) | C(81)N(8)Ta(2) | 79.8(4) |
Комплекс I был получен с несколько большим выходом (15%) при взаимодействии Ta(NMe2)5 с CS2 в соотношении 1 : 3 в толуоле. Несмотря на соотношение реагентов, в данной реакции (как и при избытке CS2, см. [11]) преимущественно образуется малорастворимый [Ta(MeDtc)4](MeDtc) · · 0.5C7H8. После его удаления фильтрованием из толуольного раствора были получены кристаллы сольвата I · 0.5C7H8, в составе которого присутствуют две кристаллографически независимые молекулы I. Геометрические характеристики комплекса в сольватной и бессольватной формах близки (табл. 2). Данные ЯМР полностью согласуются с кристаллографическими данными.
Для исследования особенностей электронной структуры комплекса I были проведены квантово-химические расчеты. Сравнение усредненных значений оптимизированных структурных параметров с рентгеноструктурными данными представлено в табл. 3. Рассчитанные межатомные расстояния хорошо согласуются с данными РСА.
При оптимизации геометрии происходит незначительное повышение симметрии оптимизированной структуры по сравнению с исходной. Каждый из лигандов в оптимизированной структуре плоский (без учета атомов водорода), причем фрагмент CH2NMe2– лежит в одной плоскости с противолежащим дитиокарбаматом. Это приводит к ситуации, в которой из-за повышения симметрии орбитали HOMO и HOMO-1 можно рассматривать как практически вырожденные (рис. 2). Они близки по энергии (разница составляет менее 0.05 эВ), похожи по форме, но различаются по составу (табл. 4). Однако в формировании обеих орбиталей принимают участие как металл, так и (в той или иной степени) все лиганды. Этот смешанный характер HOMO и HOMO-1 кардинально отличается от формы и состава орбитали HOMO-2, которая практически полностью центрирована на атомах серы дитиокарбаматных лигандов с небольшим вкладом от атома азота фрагмента CH2NMe2–. Низшие вакантные орбитали LUMO и LUMO+1 не вырождены, обе являются лиганд-центрированными, однако в LUMO, в отличие от LUMO+1, вклад вносят все лиганды, включая азаметаллациклопропановый фрагмент. Состав НОМО и НОМО-1 преимущественно отвечает связыванию d-орбиталей Та с соответствующими орбиталями лиганда CH2NMe2–. Орбитали, отвечающие за связывание с атомами серы, располагаются ниже по энергии и на рис. 2 не показаны.
Рис. 2.
Схема энергетических уровней и граничные орбитали комплекса I (а); проекция HOMO и HOMO-1 (б) (для более наглядной демонстрации сигма-связывания атомы водорода не показаны).
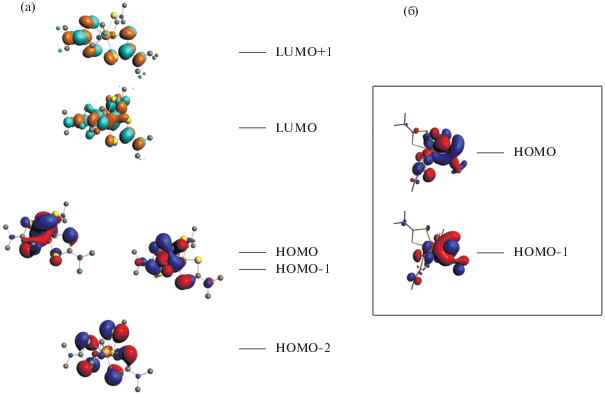
Таблица 4.
Энергия (эВ) и вклады АО в МО комплекса I
| Орбиталь | Энергия | Состав, % | ||||
|---|---|---|---|---|---|---|
| Ta | С | N | S | H | ||
| LUMO+1 | –1.62 | 57.03 | 18.70 | 19.27 | 1.02 | |
| LUMO | –1.74 | 25.78 | 34.11 | 21.78 | 5.47 | 0.90 |
| HOMO | –4.67 | 14.69 | 26.98 | 9.58 | 26.67 | 4.03 |
| HOMO–1 | –4.72 | 11.89 | 9.07 | 38.14 | 13.44 | 15.91 |
| HOMO–2 | –4.92 | 2.98 | 89.25 | |||
Топологический анализ электронной плотности методами ELF и QTAIM [26, 27] был выполнен для уточнения характера связывания Ta с лигандами обоих типов и связывания внутри азаметаллациклопропанового фрагмента (табл. 5). Из данных ELF и анализа критических точек следует, что для всех лигандов связи металл–лиганд носят характер донорно-акцепторного взаимодействия (координационная связь). Величина электронной плотности в критических точках связи небольшая, значение ∇2ρcp > 0, V(r) < 0, H(r) < 0. Критические точки во всех связях, включающих атом Та, смещены по линии связывания к атому металла.
Таблица 5.
Значения топологических дескрипторов теории QTAIM*
| Связь | Длина, Å | BP, Å | ρcp | ∇2ρcp | Gcp | Vcp | Hcp | Hcp/ρcp | |Vcp|/Gcp | |Vcp| |
|---|---|---|---|---|---|---|---|---|---|---|
| Ta–N** | 1.939 | 1.949 | 0.151 | 0.497 | 0.205 | –0.286 | –0.081 | –0.537 | 1.394 | 0.286 |
| Ta–С** | 2.207 | 2.216 | 0.097 | 0.161 | 0.086 | –0.131 | –0.045 | –0.468 | 1.530 | 0.131 |
| N–С** | 1.416 | 1.418 | 0.274 | –0.572 | 0.236 | –0.614 | –0.379 | –1.384 | 2.607 | 0.614 |
| Ta–S | 2.645 | 2.646 | 0.056 | 0.104 | 0.041 | –0.056 | –0.015 | –0.265 | 1.362 | 0.056 |
| Ta–S | 2.592 | 2.593 | 0.062 | 0.114 | 0.047 | –0.065 | –0.018 | –0.297 | 1.392 | 0.065 |
| Ta–S | 2.639 | 2.641 | 0.057 | 0.105 | 0.041 | –0.057 | –0.015 | –0.268 | 1.366 | 0.057 |
| Ta–S | 2.581 | 2.583 | 0.064 | 0.115 | 0.048 | –0.068 | –0.020 | –0.309 | 1.408 | 0.068 |
| Ta–S | 2.587 | 2.588 | 0.063 | 0.115 | 0.047 | –0.066 | –0.019 | –0.299 | 1.394 | 0.066 |
| Ta–S | 2.628 | 2.629 | 0.056 | 0.126 | 0.044 | –0.057 | –0.013 | –0.232 | 1.292 | 0.057 |
* ρ – электронная плотность; ∇2ρ – ее лапласиан; V, G, H – плотности потенциальной, кинетической [28] и полной энергий; значения ρ и ∇2ρ приведены в относительных единицах (${e \mathord{\left/ {\vphantom {e {a_{0}^{3}}}} \right. \kern-0em} {a_{0}^{3}}}$ and ${e \mathord{\left/ {\vphantom {e {a_{0}^{5}}}} \right. \kern-0em} {a_{0}^{5}}}$ соответственно). ** Связи в азаметаллациклопропановом фрагменте.
Таким образом, выделен азаметаллациклопропановый комплекс тантала [Ta(MeDtc)3(η2-CH2NMe)], охарактеризованный методами РСА, ЯМР- и ИК-спектроскопии Его электронная структура определена квантово-химическими расчетами методом DFT.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lappert M., Protchenko A., Power P., Seeber A. Metal Amide Chemistry. Wiley, 2008.
Winter C.H. // Aldrichimica Acta. 2000. V. 33. P. 3.
Nugent W.A., Ovenall D.W., Holmes S.J. // Organometallics. 1983. V. 2. P. 162.
Eisenberger P., Ayinla R.O., Lauzon J.M.P., Schafer L.L. // Angew. Chem., Int. Ed. 2009. V. 48. P. 8361.
Ahmed K.J., Chisholm M.H., Folting K., Huffman J.C. // Chem. Commun. 1985. P. 152.
Cai H., Chen T., Wang X. et al. // Chem. Commun. 2002. P. 230.
Wang H., Wang Y., Chan H.-S., Xie Z. // Inorg. Chem. 2006. V. 45. P. 5675.
Zhang F., Song H., Zi G. // Dalton Trans. 2011. V. 40. P. 1547.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. (Gordon A., Ford R., The Chemist’s Companion: A Handbook of Practical Data, Techniques, and References, N.Y.: Wiley, 1972).
Fulmer G.R., Miller A.J.M., Sherden N.H. et al. // Organometallics. 2010. V. 29. P. 2176.
Петров П.А., Рогачев А.В., Компаньков Н.Б. и др. // Коорд. химия. 2017. Т. 43. № 10. С. 617 (Petrov P.A., Rogachev. A.V., Kompankov N.B. et al. // Russ. J. Co-ord. Chem. 2017. V. 43. P. 652). https://doi.org/10.1134/S1070328417100074
APEX2 (version 1.08), SAINT (version 7.03), SAD-ABS (version 2.11), SHELXTL (version 6.12). Madison (WI, USA): Bruker AXS Inc., 2004.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Velde G.T., Bickelhaupt F.M., Baerends E.J. et al. // J. Comput. Chem. 2001. V. 22. P. 931.
ADF 2017. SCM. Theoretical Chemistry. Amsterdam (The Netherlands): Vrije Universiteit. http://www.scm. com.
Vosko S.H., Wilk L., Nusair M. // Can. J. Phys. 1980. V. 58. P. 1200.
Becke A.D. // Phys. Rev. A. 1988. V. 38. P. 3098.
Perdew J.P. // Phys. Rev. B. 1986. V. 33. P. 8822.
Perdew J.P. // Phys. Rev. B. 1986. V. 34. P. 7406.
Lenthe E.V., Ehlers A.E., Baerends E.J. // J. Chem. Phys. 1999. V. 110. P. 8943.
Bradley D.C., Gitlitz M.H. // Chem. Commun. 1965. P. 289.
Bradley D.C., Gitlitz M.H. // J. Chem. Soc. A. 1969. P. 1152.
Most K., Mösch-Zanetti N.C., Vidovic D., Magull J. // Organometallics. 2003. V. 22. P. 5485.
Bader R.F.W. Atoms in Molecules. A Quantum Theory. Clarendon, Oxford, 1990.
Popelier P. Atoms in Molecules. An Introduction. Harlow: Prentice Hall, 2000.
Abramov Yu.A. // Acta Crystallogr. A. 1997. V. 53. P. 264.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия