Координационная химия, 2021, T. 47, № 10, стр. 604-612
Гидраты трет-бутилпероксидов натрия и калия: кристаллическая структура и свойства
А. Г. Медведев 1, М. Ю. Шарипов 1, А. А. Михайлов 1, Д. А. Гришанов 1, А. В. Чураков 1, П. В. Приходченко 1, *
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: prikhman@gmail.com
Поступила в редакцию 05.05.2021
После доработки 17.05.2021
Принята к публикации 18.05.2021
Аннотация
Получены гидраты трет-бутилпероксидов натрия 2Na+ · 2C4H9${\text{O}}_{2}^{ - }$ · 7H2O (I) и калия 2K+ · 2C4H9${\text{O}}_{2}^{ - }$ · · 4H2O (II). Согласно результатам рентгеноструктурного анализа (CIF files CCDC № 2081025 (I), 2081024 (II)), исследуемые соединения являются координационными полимерами, в которых атомы щелочного металла имеют КЧ(Na) 6 и КЧ(К) 6 и 8. Кристаллические упаковки представлены слоями с явно выраженными гидрофобными поверхностями, состоящими из углеводородных групп, и внутренними гидрофильными областями, включающими молекулы воды, катионы щелочного металла и пероксогруппы анионов трет-бутилпероксида. Соединения охарактеризованы методами колебательной спектроскопии, спектроскопии ЯМР (1Н, 13С), термогравиметрии и дифференциально-сканирующей калориметрии.
Методы получения и свойства несольватированных органических пероксидов металлов первой группы Li, Na, K (солей органических гидропероксидов) были подробно рассмотрены в обзоре [1]. Органические пероксиды щелочных металлов используются как эффективные окислители [2, 3], в частности для ассиметричного эпоксидирования олефинов [4–6], а также как исходные соединения для синтеза органических пероксидов элементов других групп [7–9]. Нередко в синтезах пероксиды щелочных металлов получают in situ. Использование исходных жидких органических гидропероксидов в некоторых реакциях ограничено их низкой стабильностью.
Ранее были синтезированы органические пероксиды щелочных металлов, в том числе получены соли щелочных металлов (лития, натрия, калия) трет-бутилгидропероксида, не содержащие сольватных молекул [10–12]. Однако такие соединения гигроскопичны и вследствие этого не устойчивы [1]. По-видимому, этим объясняется отсутствие данных РСА для не содержащих других органических молекул трет-бутилпероксидов натрия и калия. К настоящему времени в Кембриджском банке структурных данных имеются сведения лишь о двух кристаллических структурах, содержащих трет-бутилпероксиды калия и натрия, которые стабилизированы NNNN-макроциклами [13] (рефкоды DERKET и DERXAC соответственно). В этой связи представляется актуальным синтез и характеризация гидратов трет-бутилпероксидов натрия и калия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений проводили с использованием коммерческих реагентов и растворителей без дополнительной очистки: амид натрия (95%, Acros Organics), терт-бутилгидропероксид (70%-ный раствор в воде, Acros Organics), калия гидроксид (“ч. д. а.”, Химмед), толуол (“ос. ч.”, Химмед), этанол (95%, Acros Organics), диэтиловый эфир (“ч. д. а.”, Химмед). Приготовление раствора трет-бутилгидропероксида в диэтиловом эфире осуществляли из водного раствора.
Синтез 2Na+ · 2C4H9${\mathbf{O}}_{{\mathbf{2}}}^{ - }$ · 7H2O (I). К раствору 0.234 г (6 ммоль) NaNH2 в 10 мл толуола добавляли при перемешивании 1.081 г (6 ммоль) 50%-го раствора трет-бутилгидропероксида в диэтиловом эфире. Реакционную смесь упаривали в вакууме на роторном испарителе при постепенном повышении температуры водяной бани до 50°С. Продукт растворяли в 5 мл этанола (95%) при нагревании и отфильтровывали. Через час образовывались бесцветные призматические кристаллы, которые отделяли от маточного раствора фильтрованием и сушили на воздухе. Выход I 0.70 г (67%).
ИК-спектр (ν, см–1): 3498 с, 3200 с. ш, 3065 с. ш, 2978 с, 2932 с, 2286 сл. ш, 1722 сл, 1680 ср, 1633 ср, 1472 ср, 1440 ср, 1384 ср, 1358 с, 1326 сл, 1253 ср, 1241 ср, 1195 с, 1085 сл. ш, 920 сл, 895 ср, 841 ср, 755 сл, 575 с. ш, 526 с. ш, 473 ср.
Спектр ПМР (CD3OD; δ, м.д.): 1.23 с. (9Н, СH3). Спектр ЯМР 13С (CD3OD; δ, м.д.): 25.06 м. (CH3), 79.13 (C).
Синтез 2K+ · 2C4H9${\mathbf{O}}_{{\mathbf{2}}}^{ - }$ · 4H2O (II). К раствору 0.975 г (7.58 ммоль) 70%-ного водного раствора терт-бутилгидропероксида добавляли при перемешивании раствор 0.5 г (7.58 ммоль) гидроксида калия в 5 мл этанола. Реакционную смесь упаривали в вакууме на роторном испарителе. Кристаллический продукт промывали сухим этанолом и сушили на воздухе. Выход II 0.85 г (68%).
ИК-спектр (ν, см–1): 3491 с, 3216 с. ш, 2970 с, 2929 c, 2877 с, 1670 ср. ш, 1634 ср. ш, 1472 сл, 1443 сл, 1383 сл, 1358 с, 1303 ср, 1241 ср, 1193 с, 1027 сл, 921 сл, 896 ср, 840 ср, 750 сл, 562 ср. ш, 524 ср, 472 сл.
Спектр ПМР (CD3OD; δ, м.д.): 1.23 с. (9Н, СH3). Спектр ЯМР 13С (CD3OD; δ, м.д.): 25.10 м. (CH3), 79.13 (C).
ИК-спектры соединений регистрировали на ИК-спектрофотометре с Фурье преобразованием Jasco FT/IR-4600LE методом нарушенного полного внутреннего отражения (НПВО) в области 400–4000 см–1.
Элементный анализ выполняли на автоматическом С, H, N-анализаторе EuroVector ЕА3000.
Термическую стабильность соединений исследовали методом термогравиметрии (ТГА) и дифференциально-сканирующей калориметрии (ДСК) на Shimadzu DSC-60 и DTG-60, соответственно, в атмосфере аргона в интервале температур 25–350°С при скорости нагрева образца 5°С/мин.
Спектры ПМР и ЯМР 13С записывали на спектрометре Bruker Avance 600 (14.1 Т), рабочая частота 600.03 (1Н) и 150.90 (13С) МГц, внутренний стандарт – ТМС.
Рентгенограммы порошков I и II записывали при комнатной температуре на дифрактометре Bruker D8 Advance с использованием CuKα-излучения (λ = 1.5418 Å). Рентгенограммы получали в диапазоне 2θ 5°–60° при следующих условиях съемки: рабочее напряжение на рентгеновской трубке 40 кВ, сила анодного тока 40 мА, радиус гониометра 280 мм, шаг гониометра по углу 0.02°, время накопления 0.5 с/шаг. Анализ полученных дифрактограмм проводили в программном пакете DiffracSuite.
РСА I и II выполнен на автоматическом дифрактометре Bruker D8 Venture, оборудованном детектором Photon II (MoKα-излучение, λ = 0.71073 Å графитовый монохроматор, ω-сканирование) при температуре 150 К. Учет поглощения введен по измерениям интенсивностей эквивалентных отражений [14]. Структуры I и II расшифрованы прямым методом и уточнены полноматричным анизотропным МНК по F 2 для всех неводородных атомов [15]. Все атомы водорода найдены из разностных рядов Фурье и уточнены изотропно. Кристаллографические данные и детали уточнения структур I и II приведены в табл. 1, основные длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные и детали уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C8H32O11Na2 | C8H26O8K2 |
| M | 350.31 | 328.49 |
| Размер образца, мм | 0.40 × 0.40 × 0.20 | 0.15 × 0.05 × 0.01 |
| Температура, K | 150 | 150 |
| Сингония | Моноклинная | Триклинная |
| Пр. гр. | С2/c | P1 |
| a, Å | 27.0861(11) | 5.988(2) |
| b, Å | 6.0315(2) | 10.621(4) |
| c, Å | 11.3877(5) | 13.448(5) |
| α, град | 90 | 70.631(11) |
| β, град | 98.1531(14) | 87.984(11) |
| γ, град | 90 | 85.981(11) |
| V, Å3 | 1841.60(13) | 804.9(5) |
| Z | 4 | 2 |
| ρ(выч), г/см3 | 1.263 | 1.355 |
| μ(MoKα), мм–1 | 0.152 | 0.61 |
| F(000) | 760 | 352 |
| Область θ, град | 3.04–30.48 | 2.91–30.77 |
| Всего отражений | 14 306 | 7636 |
| Независимых отражений (Rint) | 2692 (0.0323) | 3029 (0.0565) |
| Число уточняемых параметров | 160 | 267 |
| R1 (I > 2σ(I)) | 0.0284 | 0.0526 |
| wR2 (все данные) | 0.0769 | 0.0937 |
| GООF | 1.045 | 1.086 |
| Δρmin/Δρmax, e/Å3 | –0.162/0.401 | –0.377/0.533 |
Таблица 2.
Избранные длины связей (Å) и углы (град) для I и II*
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| I | |||
| Na(1)–O | 2.3246(5)–2.4943(8) | O(11)–O(12) | 1.4807(8) |
| II | |||
| K(1)–O | 2.591(2)–2.896(2) | O(11)–O(12) | 1.477(2) |
| K(2)–O | 2.672(2)–3144(2) | O(21)–O(22) | 1.483(2) |
| Угол | ω, град | Угол | ω, град |
| I | |||
| ONa(1)O(цис) | 84.18(2)–106.00(3) | C(1)O(11)O(12) | 110.41(6) |
| ONa(1)O(транс) | 160.08(2)–166.74(3) | ||
| II | |||
| OK(1)O(цис) | 68.62(7)–128.71(7) | OK(2)O(транс) | 130.12(7)–157.88(7) |
| OK(1)O(транс) | 144.35(7)–168.58(7) | С(11)О(11)О(12) | 110.8(2) |
| OK(2)O(цис) | 31.11(5)–110.05(6) | C(21)O(21)O(22) | 110.8(2) |
Структуры I и II депонированы в Кембриджском банке структурных данных (№ 2081025 и 2081024 соответственно; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
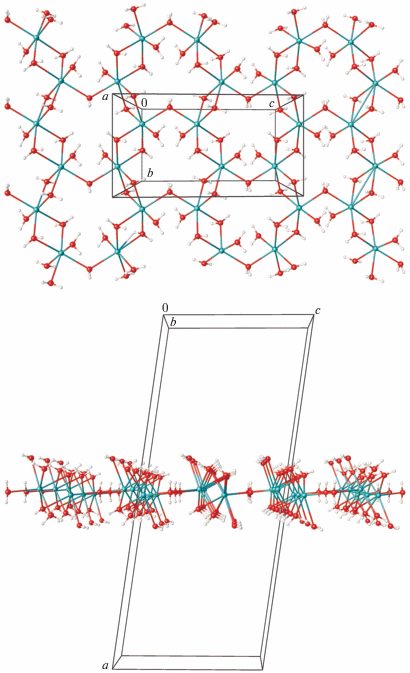
Бесцветные кристаллы гидрата натриевой соли трет-бутилпероксида 2Na+ · 2C4H9${\text{O}}_{2}^{ - }$ · 7H2O (I) были получены перекристаллизацией из 95%-ного этанола продукта, образовавшегося при взаимодействии растворов трет-бутилгидропероксида в диэтиловом эфире с раствором амида натрия в толуоле. Соединение кристаллизуется в пространственной группе С2/c (табл. 1). Катион натрия имеет искаженное октаэдрическое окружение, состоящее из атомов кислорода шести молекул воды с расстояниями Na–O от 2.3246(5) до 2.4943(8) Å (рис. 1). Значения углов ONaO, образованных атомами кислорода в транс-положениях лежат в интервале 160.08(2)°–166.74(3)°. При этом две молекулы воды в координационном окружении катиона выступают как мостиковые лиганды между соседними катионами натрия, образуя при этом бесконечные полимерные цепи $\left[ {{\text{Na(}}{{{\text{H}}}_{2}}{\text{O}}{{{\text{)}}}_{6}}} \right]_{n}^{ + }$ вдоль оси b с расстояниями Na…Na 3.499(1) и 3.501(1) Å. Третья молекула воды выступает как мостиковый лиганд между катионами натрия соседних цепей, объединяя цепи в 2D-слои в плоскости bc (рис. 2), с расстоянием Na…Na 3.990 Å.
Рис. 1.
Фрагмент кристаллической структуры I. Тепловые эллипсоиды приведены с 50%-ной вероятностью. H-связи показаны пунктиром. Симметрические преобразования, использованные для генерации эквивалентных атомов: i 1 – x, 1 – y, 1 – z; ii 1 – x, –y, 1 – z.
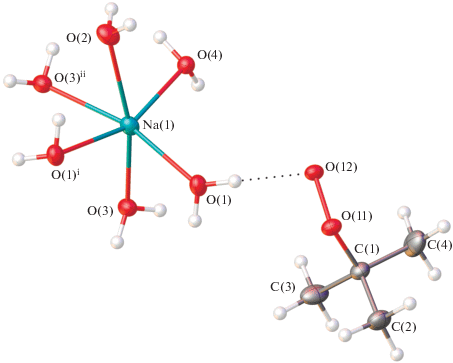
Расстояние O–O пероксогруппы в анионе C4H9${\text{O}}_{2}^{ - }$ составляет 1.4807(8) Å, что соответствует аналогичным расстояниям для органических пероксидов. Атомы кислорода аниона выступают в качестве акцептора водородной связи с соседними молекулами воды (рис. 3). Атом O(12) участвует в образовании четырех водородных связей средней силы с контактами O…O 2.6994(9)–2.7570(9) Å, атом О(11) – в образовании двух более слабых Н-связей (2.9992(10)–3.0515(9) Å). Насколько нам известно, соединение I является первым примером структуры, в которой анион органического пероксида не координируется с атомом металла.
Рис. 3.
Шесть водородных связей (показаны пунктиром), образуемых анионом органического пероксида в структуре I.
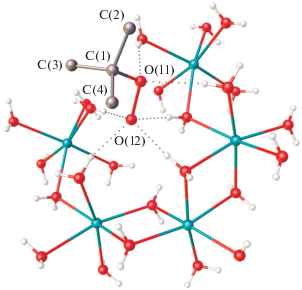
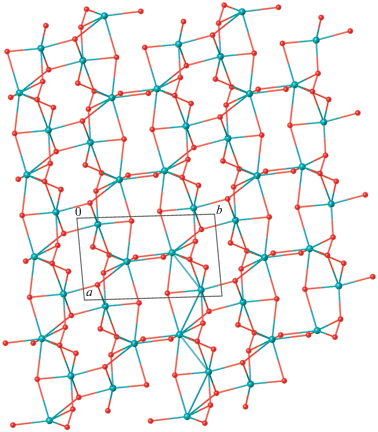
Кристаллическая упаковка I состоит из двойных слоев, перпендикулярных оси а, с гидрофобными поверхностями, сформированными углеводородными фрагментами анионов C4H9${\text{O}}_{2}^{ - },$ и гидрофильными внутренними областями, включающими пероксогруппы анионов и слои $\left[ {{\text{Na(}}{{{\text{H}}}_{2}}{\text{O}}{{{\text{)}}}_{6}}} \right]_{n}^{ + }$ (рис. 4). Соседние слои формируют трехмерные структуры за счет слабых ван-дер-ваальсовых взаимодействий.
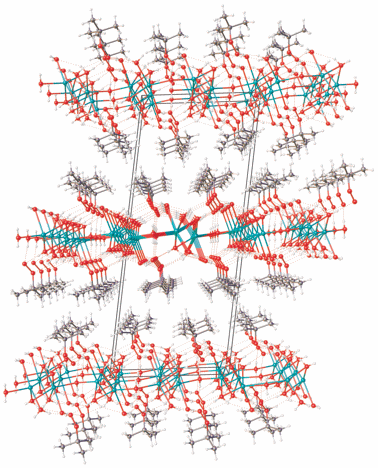
Взаимодействие трет-бутилгидропероксида с гидроксидом калия в воде приводит к образованию гидрата калиевой соли трет-бутилпероксида 2K+ · · 2C4H9${\text{O}}_{2}^{ - }$ · 4H2O (II). Соединение II кристаллизуется в пространственной группе P$\bar {1}$ (табл. 1). Кристаллографически независимая область включает два катиона калия, четыре молекулы воды и два аниона трет-бутилпероксида, один из которых координирован с катионами калия (тип координации μ2-η1,η2-OOtBu [16]) и участвует в образовании одной Н-связи как акцептор протона, второй участвует только в образовании водородных связей с молекулами воды (табл. 2, рис. 5). Катион К(1) имеет окружение из шести атомов кислорода, два из которых принадлежат координированным анионам трет-бутилпероксида C4H9${\text{O}}_{2}^{ - }$ (О(11)i и О(12)), остальные – четырем координированным молекулам воды О(2), О(3), О(4) и О(2)iv. Катион К(2) имеет окружение из восьми атомов кислорода, два из которых также принадлежат аниону ((О(11) и О(12)), шесть – молекулам воды. При этом атомы кислорода О(2)iv и О(3) молекул воды и аниона О(12) являются мостиковыми между катионами калия К(1) и К(2) с расстояниями К(1)…К(2), равными 3.638(1) и 3.731(1) Å, что приводит к образованию цепей вдоль оси а. Два катиона калия К(1) из соседних цепей, как и К(2), объединены двумя мостиковыми молекулами воды, формируя при этом слои, лежащие в плоскости ab (рис. 6), с расстояниями К(1)…К(1) и К(2)…К(2), равными 3.484(2) и 4.345(2) Å соответственно (табл. 2).
Рис. 5.
Фрагмент кристаллической структуры II. Тепловые эллипсоиды приведены с 50%-ной вероятностью. H-связи показаны пунктиром. Симметрические преобразования, использованные для генерации эквивалентных атомов: i 1 + x, y, z; ii 1 – x, 1 – y, 1 – z; iii –1 + x, y, z; iv 2 – x, –y, 1 – z.
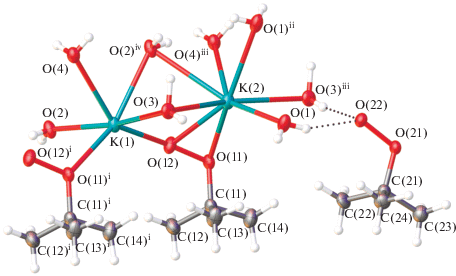
Рис. 6.
Слои в структуре II в плоскости ab, образованные координированными к атомам калия молекулами воды и анионами С4Н9${\text{O}}_{2}^{ - }.$ Атомы углерода и водорода не представлены для ясности.
Расстояние O(11)–O(12) для пероксогруппы в анионе C4H9${\text{O}}_{2}^{ - },$ координированном к катиону, составляет 1.477(2) Å, а в анионе, атомы кислорода которого участвуют в образовании только Н-связей, O(21)–O(22) 1.483(2) Å. Оба расстояния аналогичны таковому, найденному в структуре I. Атом О(22) выступает в роли акцептора четырех водородных связей, в то время как атом О(21) – двух (рис. 7). Расстояния О…О для Н-связей с участием атома О(22) составляют 2.699(3)–2.849(3) Å, в то время как для О(21)–2.791(3) и 3.042(3) Å. Атом О(11) участвует в образовании короткой Н‑связи с молекулой воды 2.554(3) Å.
Рис. 7.
Водородные связи c участием анионов трет-бутилпероксида в структуре II. H-связи показаны пунктиром.
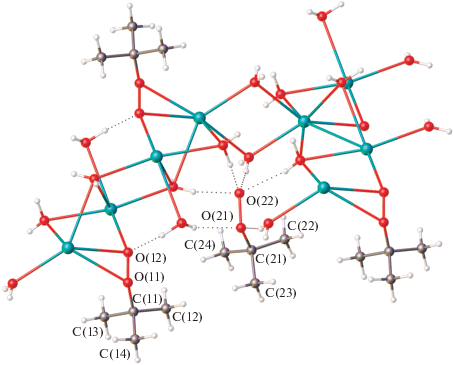
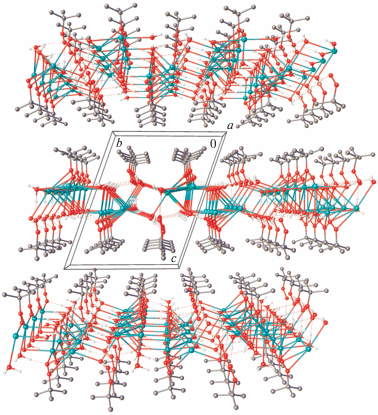
Кристаллическая структура II, как и I, состоит из двойных слоев, параллельных плоскости ab и имеющих гидрофобные поверхности и гидрофильные внутренние области (рис. 8).
Рентгенограммы порошков I и II соответствуют теоретическим рентгенограммам, рассчитанным по данным РСА в программе Mercury [17], и не содержат дополнительных рефлексов.
По данным ТГА, потеря массы образцами при нагревании до 350°С в атмосфере аргона составила 71.4 и 61.4% для порошков I и II соответственно. Нагрев образцов сопровождается плавлением с последующим испарением воды в интервале 60–100°С, что ранее наблюдалось для гидратов пероксокомплекса германия [18, 19] и теллура [20]. По данным ДСК, ряд экзотермических эффектов, соответствующих разложению пероксогрупп с выделением кислорода и, возможно, последующим реакциям с его участием, регистрируется в области 100–130°С. Для сравнения температура плавления безводного трет-бутилпероксида лития [(LiOOCMe3)2(HOOCMe3)2] составляет 67°С [12], что близко к найденным значениям для I и II, а растворы в ТГФ трет-бутилпероксидов калия и натрия, которые стабилизированы NNNN-макроциклами, устойчивы только при нагревании до 60°С [13], в то время как термические исследования твердых продуктов не проводились.
Таким образом, впервые получены и охарактеризованы методом РСА кристаллические гидраты трет-бутилпероксидов натрия 2Na+ · 2C4H9${\text{O}}_{2}^{ - }$ · · 7H2O (I) и калия 2K+ · 2C4H9${\text{O}}_{2}^{ - }$ · 4H2O (II). Показано, что амфифильность трет-бутилгидропероксида обуслoвливает формирование слоистых структур I и II, в которых чередуются лиофильные и лиофобные области.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Соколов Н.А., Александров Ю.А. // Успехи химии. 1978. Т. 47. № 2. С. 307 (Sokolov N.A., Aleksandrov Yu.A. // Russ. Chem. Rev. 1978. V. 47. № 2. P. 172).https://doi.org/10.1070/RC1978v047n02ABEH002210
Minko Y., Marek I. // Org. Biol. Chem. 2014. V. 12. № 10. P. 1535. https://doi.org/10.1039/C3OB42349B
Möller M., Husemann M., Boche G. // J. Organomet. Chem. 2001. V. 624. № 1–2. P. 47. https://doi.org/10.1016/S0022-328X(00)00596-9
Xia Q.-H., Ge H.-Q., Ye C.-P. et al. // Chem. Rev. 2005. V. 105. № 5. P. 1603. https://doi.org/10.1021/cr0406458
Porter M.J., Skidmore J. // Chem. Commun. 2000. № 14. P. 1215. https://doi.org/10.1039/B001780I
Elston C.L., Jackson R.F.W., MacDonald, S.J.F. et al. // Angew. Chem. Int. Ed. 1997. V. 36. № 4. P. 410. https://doi.org/10.1002/anie.199704101
Razuvaev G.A., Shushunov V.A., Dodonov V.A. Brilklna T.G. Organic Peroxides. V. III. New York: Wiley-Intersci, 1972. P. 141.
Rieche A., Dahlmann J., List D. // Justus Liebigs Ann. Chem. 1964. V. 678. № 1. P. 167. https://doi.org/10.1002/jlac.19646780118
Rieche A., Dahlmann J. // Justus Liebigs Ann. Chem. 1964. V. 675. № 1. P. 19. https://doi.org/10.1002/jlac.19646750104
Sosnovsky G., Brown J.H. // Chem. Rev. 1966. V. 66. № 5. P. 529. https://doi.org/10.1021/cr60243a003
Boche G., Möbus K., Harms K. et al. // Chem. Eur. J. 1996. V. 2. № 5. P. 604. https://doi.org/10.1002/chem.19960020521
Uhl W., Halvagar M.R., Claesener M. // Chem. Eur. J. 2009. V. 15. № 42. P. 11298. https://doi.org/10.1002/chem.200900746
Osseili H., Truong K.-N., Spaniol T. P. et al. // Chem. Eur. J. 2017. V. 23. № 68. P. 17213. https://doi.org/10.1002/chem.201704758
SADABS. Version 2016/2. Bruker AXS Area Detector Scaling and Absorption Correction Program. Madison, WI (USA): Bruker AXS Inc., 2006.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Berry R.E. Comprehensive Coordination Chemistry II. Pergamon, 2003. P. 625. https://doi.org/10.1016/B0-08-043748-6/01161-0
Macrae C.F., Sovago I., Cottrell S.J. et al. // J. Appl. Cryst. 2020. V. 53. P. 226. https://doi.org/10.1107/S1600576719014092
Medvedev A.G., Mikhaylov A.A., Churakov A.V. et al. // Inorg. Chem. 2015. V. 54. № 16. P. 8058. https://doi.org/10.1021/acs.inorgchem.5b01293
Grishanov D.A., Churakov A.V., Mikhaylov A.A. et al. // Inorg. Chem. 2019. V. 58. № 3. P. 1905. https://doi.org/10.1021/acs.inorgchem.8b02747
Mikhaylov A.A., Medvedev A.G., Churakov A.V. et al. // Chem. Eur. J. 2016. V. 22. № 9. P. 2980. https://doi.org/10.1002/chem.201503614
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия