Координационная химия, 2021, T. 47, № 10, стр. 635-639
Электронное строение комплексов палладия(II) с редокс-активными o-фенилендииминами
Т. М. Иванова 1, *, М. А. Кискин 1, **, А. А. Сидоров 1, К. И. Маслаков 2, С. В. Савилов 1, 2, И. Л. Еременко 1, 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: tiva@igic.ras.ru
** E-mail: mkiskin@igic.ras.ru
Поступила в редакцию 25.03.2021
После доработки 02.04.2021
Принята к публикации 05.04.2021
Аннотация
Методом рентгенофотоэлектронной спектроскопии (РФЭС) проведено исследование электронной структуры и характера перераспределения электронной плотности в комплексах палладия с редокс-активными лигандами в окисленной и не окисленной формах. По данным РФЭС, в результате окислительно-восстановительного процесса, протекающего “по лиганду”, редокс-активные лиганды находятся в различных состояниях. Показано, что процесс перехода из нейтральной в окисленную семихинонную форму, от [Pd(LMe)2]Cl2 · H2O к [Pd$\left( {{\text{L}}_{{{\text{Ph}}}}^{{{\text{ISQ}}}}} \right)$2], происходит в лиганде без участия ионов палладия, степень окисления которого остается неизменной – Pd(II). Значительное различие рентгеноэлектронных характеристик, полученных для окисленного транс-комплекса при 298 и 153 K, свидетельствует о специфичной электронной лабильности этого комплекса.
Комплексы металлов являются уникальными объектами, проявляющими функциональные полезные свойства, такие как оптические, электрохимические, магнитные, каталитические и др. Активные исследования в области координационных и металлорганических соединений, содержащих в своем составе редокс-активные лиганды, обусловлены интересом исследователей к управлению химическими и магнитными свойствами, в которых наблюдается редокс-изомерия (внутримолекулярный перенос электрона) [1–3]. Это определяется тем, что орбитали переходных металлов и граничные орбитали лигандов близки по энергии. При этом происходит сильное смешивание этих орбиталей, и в некоторых случаях отнесение состояния окисления отдельных компонентов, металла и лиганда, затруднительно. Из числа органических лигандов, формирующих подобные металлоциклы с ионами переходных металлов, можно выделить о-бензохиноны, о-бензоиминохиноны и о-бензохинондиамины, электронные и геометрические свойства которых в процессе переноса электрона могут существенно изменяться. о-Бензосемихинондииминовые системы, продукт одноэлектронного окисления о-фенилендиаминов, представлены в литературе ограниченным кругом работ, хотя интерес к таким комплексам довольно высок из-за перспективы их использования в электрокатализе, в качестве биоактивных добавок или элементов молекулярных электронных устройств за счет сравнительно легкого переноса электронов [4–6]. При синтезе комплексов переходных металлов с о-фенилендиамином и его производными могут образовываться комплексы с продуктами окисления соответствующих диаминов. Если при окислительно-восстановительных процессах, протекающих в комплексе, процессы восстановления (окисления) идут с участием “лигандов”, то рассматриваемые лиганды могут находиться в различных состояниях (редокс-активные лиганды), редокс-орбитали металла в этих процессах принимают слабое участие и состояние металла мало изменяется. Cовокупность основных факторов, электронная форма лиганда, степень окисления металла определяют строение и физико-химические свойства комплекса [7]. Интерпретация электронного строения комплексов с фенилендиамином в не окисленной форме, образующихся на начальной стадии процесса, не вызывает особых сложностей. Последующий переход к семихинондииминовым производным может сопровождаться сложностью интерпретации данных физических методов, что наблюдалось на примере неверной интерпретации строения производных палладия(II) и платины(II), справедливо отмеченной в [8, 9]. Серьезным сдерживающим фактором развития этого направления являются проблемы понимания электронной структуры комплексов (или металофрагментов), что требует дополнительных исследований. Одним из таких эффективных для данного случая методов является рентгенофотоэлектронная спектроскопия (РФЭС), определяющая прямую зависимость между энергией связи и эффективным зарядом атома, формирующая “карту” распределения электронной плотности в молекуле, электронов между орбитами и изменений числа некомпенсированных d-электронов.
Цель настоящей работы – исследование электронной структуры методом РФЭС комплексов палладия с редокс-активными лигандами в окисленной и не окисленной формах, т.е. формах с неоднозначной интерпретацией, и определение роли природы заместителя при иминном атоме азота.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
РФЭ-спектры получали на спектрометре A-xisUltraDLD (Kratos Analytical, Великобритания). Образцы исследовали в виде тонкого слоя порошка, впрессованного в двухстороннюю адгезионную ленту. Спектры регистрировали при постоянной энергии пропускания анализатора, равной 160 эВ для обзорного спектра и 40 эВ для спектров высокого разрешения. Размер анализируемой области составлял ~300 × 700 мкм2. Проведенная предварительно калибровка шкалы энергии спектрометра отвечала следующим значениям пиков стандартов (очищенных ионным распылением поверхностей металлов): Au 4f7/2 – 83.96 эВ, Cu 2p3/2 – 932.62 эВ, Ag 3d5/2 – 368.21 эВ. Для устранения эффекта зарядки образцов съемку спектров проводили с использованием нейтрализатора. Измерения проводили не менее двух раз при давлении ~10–9 Tорр. Точность определения энергий связи составляла 0.1 эВ. Спектры снимали при 298 и 153 K.Полученные спектры калибровали по энергии связи линии С1s электронов углерода, адсорбированного на поверхности образцов, которая отвечает связям C–С/С–H и принята равной 285.0 эВ. Разделение спектров на компоненты проводили по программе Casa XPS (версия 2.3.23, www.casaxps.com).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
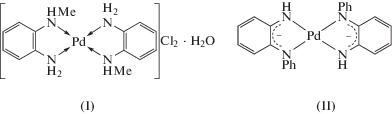
Впервые методом РФЭС проведено изучение: а) электронной структуры и характера перераспределения электронной плотности в комплексах палладия с редокс-активными лигандами, производными о-фенилендиамина; б) зависимости структуры спектров Pd3d от природы лиганда. В работе были исследованы следующие комплексы палладия(II): с координированными диаминами в составе бис-хелатного катионного комплекса с N-метил-о-фенилендиамином [Pd(LMe)2]Cl2 · H2O (I) и с окисленной формой производного о-фенилендиамина, N-фенил-о-фенилендиамина, в составе комплекса c лигандом LPh–[Pd$\left( {{\text{L}}_{{{\text{Ph}}}}^{{{\text{ISQ}}}}} \right)$2] (II) с двумя хелатно связанными анион-радикалами N-фенил-о-бензосемихинондиимина. Строение структур I и II представлено на схеме 1 . В качестве репера использовали [Pd(NH3)4]Cl2 (III) [10]. Данные элементного анализа комплексов I, II, в пределах чувствительности метода РФЭС, соответствуют их брутто-формуле.
Схема 1 .
Строение комплекса I было установлено ранее при комнатной температуре [11]. Соединение I является бис-хелатным дикатионным комплексом. Комплекс II – продукт окисления аналогичного I катионного комплекса, но содержащего N-фенил-о-фенилендиаминовые лиганды, в результате которого координированный диамин переходит в семихинондииминовую форму. На примере окисленной формы ${\text{L}}_{{{\text{Ph}}}}^{{{\text{ISQ}}}}$ можно сравнить электронные структуры и характер перераспределения электронной плотности в комплексах Pd(II). Для II было зафиксировано два полиморфа II-A и II-Б [12, 13]. В рамках эксперимента было установлено, что комплексы I, II устойчивы к рентгеновскому излучению в высоком вакууме. Баланс атомов в комплексах сохранялся как при 298 K, так и при 153 K. Определены энергии связи (Есв) для линий C1s, Pd3d, N1s уровней и атомные концентрации (АС%). Изменение температуры съемки спектров от комнатной 298 до 153 K (при охлаждении жидким азотом) дало возможность исследовать влияние структурных преобразований комплекса на формирование фотоэлектронных спектров и в результате на свойства вновь синтезированных комплексов. Эти данные подразумевают определение взаимосвязи между свойствами донорно-акцепторных редокс-активных комплексов и характеристиками фотоэлектронных спектров. Все полученные результаты приведены в табл. 1. РФЭ-спектры комплексов I, II, зарегистрированные при двух температурах (298 и 153 K), приведены на рис. 1.
Таблица 1.
РФЭ-характеристики комплексов палладия
| Комплекс (Т, К) | Eсв, эВ | ПШПВ | Eсв, эВ | |
|---|---|---|---|---|
| Pd3d5/2 (АС%)* | N1s (АС%) | C1s (АС%) | ||
| I (153) | 338.8(2.3) | 1.16 | 400.5(16.0) | C–H 285.0 (37.9) C–N 285.9 (26.2) (C–C)– 284.4(1.5) |
| II (153) | 338.6 (1.4) | 0.72 | 399.9 (4.7) 398.7 (4.6) |
C–H 285.0 (51.2) C–N 285.9 (19.1) (C–C)– 284.4 (9.5)** C–OH 286.9 (4.7) |
| I (298) | 338.8 (1.0) | 1.16 | 400.5 (15.0) | C–H 285.0 (39.4) C–N 286.0 (25.5) |
| II (298) | 338.2 (1.6) | 0.86 | 398.2 (5.0) 399.3 (1.3) 400.4 (1.5) |
C–H 285.0 (52.4) C–N 286.3 (9.8) (C–C)– 284.2 (23.6) |
| III (298) | 339.1 | 400.5 | [Pd(NH3)4]Cl2 [10] | |
Рис. 1.
Рентгеновские фотоэлектронные спектры палладия Pd3d (a), углерода С1s (б) и азота N1s (в) для комплексов I, II.
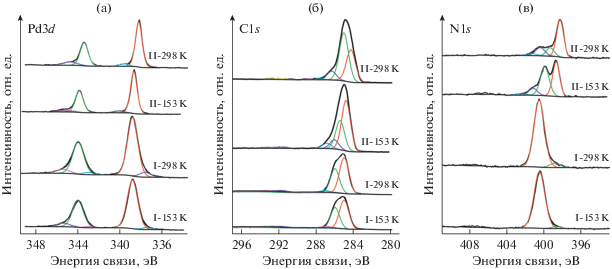
Линии палладия Pd3d в спектрах комплексов I, II представляют собой дублет (рис. 1а). Значения Есв основной линии Pd3d5/2 для этих комплексов находится в диапазоне 338.2–339.2 эВ, а спин-орбитального расщепления (∆) Pd3d5/2–Pd3d3/2 составляют 5.18–5.22 эВ; ширина линии на полувысоте (ПШПВ) для линии Pd3d5/2 находится в диапазоне 0.72–1.16 (табл. 1). Дополнительные линии в спектрах Pd3d представляют собой сателлиты встряски основных линий. Из энергетических характеристик, полученных нами для спектров палладия Pd3d, следует, что в комплексах I, II ионы палладия находятся в степени окисления Pd(II), что согласуется с данными для реперного образца III и c литературными данными [10, 14–16].
Для комплекса I при 298 и 153 K выявлена одна энергетически однородная симметричная линия палладия Pd(II) с Есв = 338.8 эВ и со значением ПШПВ, равным 1.16, свидетельствующим об энергетической однородности атомов палладия в этом комплексе (рис. 1а). Отличительной особенностью этого комплекса при обеих температурах является наличие в спектре синглетной линии азота с Есв = 400.5 эВ, относящейся как к (СH3)NH-, так и к H2N-группам (рис. 1в) [15]. В спектре углерода C1s имеется две линии, относящиеся к C–H- и C–N-группам (рис. 1б). Слабоинтенсивный широкий пик в спектрах C1s при энергии связи около 292 эВ обусловлен π–π*-сателлитом линии sp2-гибридизованных атомов ароматического кольца.
В комплексе II внутримолекулярный перенос заряда обусловлен перегруппировкой π-сопряженной системы макроциклического кольца и образованием хиноидной структуры. При 298 K в спектре азота основная синглетная линия N1s (рис. 1в) соответствует Есв 398.2 эВ и составляет 64% от общего содержания азота. Это может свидетельствовать о делокализации π-электронной плотности по органической молекуле и о вовлечении в процесс одноэлектронного окисления комплекса II атомов азота с двумя внутримолекулярными “антиферромагнитно-спаренными” иминосемихинонатными лигандами [17, 18]. Существенное изменение состояния атомов азота (табл. 1) при окислении (увеличение электронной плотности) должно приводить к высокой реакционной способности комплекса. Две более слабые линии в спектре N1s с Есв, равными 399.3 и 400.4 эВ, относятся к атомам азота в NН- и NPh-группах соответственно [10, 15]. Эти линии могут быть отнесены к окисленной форме (36%) комплекса с делокализацией π‑электронной плотности в NCCN-фрагменте. В N1s спектрах при энергии связи 407–408 эВ наблюдаются слабые линии, обусловленные присутствием сильноокисленных форм азота, предположительно со-кристаллизующегося N-фенил-о-фенилендиамина.
В спектре комплекса II при 153 K наблюдаются значительные изменения, которые проявляются в наличии двух основных линий азота N1s с Есв = = 398.7 и 399.9 эВ (рис. 1в) и с равным отношением атомной концентрации (табл. 1). Это может свидетельствовать об одной форме комплекса II. Значение Есв этих линий свидетельствует о более высокой электронной плотности на атомах азота при 298 K, чем при 153 K. При этом на атомах палладия было зафиксировано понижение электронной плотности (Есв Pd3d5/2 выше на 0.4 эВ, чем при комнатной температуре). В [19] было зафиксировано понижение электронной плотности на атомах палладия при низкой температуре с сохранением степени окисления. Поскольку ненасыщенный макроцикл имеет меньший размер полости при низкой температуре, длина связи Pd–N уменьшается, это приводит к более эффективному перекрыванию орбиталей азота и палладия. Орбитали переходных металлов и граничные орбитали лигандов близки по энергии и их смешивание приводит к переходу части электронной плотности с орбиталей палладия на орбитали азота.
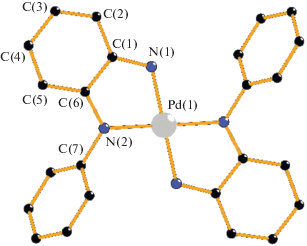
Анализ атомных концентраций функциональных атомов углерода макроциклического лиганда выявил значительные различия при низкой и высокой температурах. Факт, заслуживающий внимания, – атомная концентрация углерода при 298 K для “отрицательно заряженной” группы С–С– составляет 23.6 ат. % и более чем в два раза выше значения при 153 K (всего 9.5 ат. %). Значительное различие в атомных концентрациях атомов углерода в группе С–С– можно объяснить существенными структурными преобразованиями комплекса II (нумерация атомов дана согласно рис. 2); для сравнения взяты средние значения длин связей: укорачивается расстояние C(1)–N(1) (с 1.345 до 1.340 Å), а C(6)–N(2) остается неизменным, увеличиваются расстояние C(1)–C(6) (c 1.437 до 1.442 Å) и другие длины связей C–C в кольце C(1)–C(6). Также стоит отметить укорочение длин связей Pd–N (Pd(1)–N 1.970 и 1.997 при 298 K и 1.961 и 1.985 при 100 K). Такие структурные изменения указывают на локализацию отрицательного заряда в хелатном узле лиганда при понижении температуры. Это служит подтверждением того, что делокализация электронной плотности по всей молекуле имеет место. В сумме атомная концентрация углерода в комплексе II равна 85.9% при 153 K и 85.8% при 298 K, что свидетельствует о стабильности комплекса во время сьемки спектров (табл. 1).
Соединение II образовано двумя анион-радикалами соответствующего о-бензосемихинонди-имина, хелатно связанными с атомом Pd(II). Диамагнетизм этого соединения свидетельствует о сильном антиферромагнитном обмене между указанными анион-радикалами. Фактически можно говорить о единой π-системе всего бис-хелатного фрагмента комплекса. Структурно это проявляется в том, что связи C–C шестичленного углеродного цикла и связи C–N имеют длину, промежуточную между значениями, которые наблюдаются в хиноидной и бензоидной формах, а связи Pd–N укорочены по сравнению c одинарными связями в аминокомплексе I. Все это свидетельствует о повышении их кратности. Делокализация электронной плотности π-системы по такому фрагменту отражается и в эквивалентности атомов азота при комнатной температуре (64%). Но, кроме этого, при комнатной температуре наблюдается также и вклад состояния, при котором атомы азота не эквивалентны (36%). Понижение температуры, по-видимому, приводит к уменьшению равномерности в делокализации электронной плотности π-системы. Это проявляется в том, что в спектрах РФЭС наблюдается состояние с неэквивалентными атомами азота.
Таким образом, процесс перехода из нейтральной в окисленную семихинонную форму, от [Pd(LPh)2]Cl2Н2О к [Pd$\left( {{\text{L}}_{{{\text{Ph}}}}^{{{\text{ISQ}}}}} \right)$2], по-видимому, происходит в лиганде без участия ионов палладия, степень окисления которого остается неизменной – Pd(II). Редокс-орбитали металла в этих процессах принимают слабое участие. Данные РФЭС показали, что в результате окислительно-восстановительного процесса, протекающего “по лиганду”, лиганды находятся в различных состояниях (редокс-активные лиганды). Значительное различие рентгеноэлектронных характеристик, полученных для окисленного транс-комплекса II при 298 и 153 K, свидетельствует о его специфичной электронной лабильности. Это позволяет рассматривать комплекс II как перспективный катализатор для химических и редокс-активных биохимических систем.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Dooley M.S., McGuirl M.A., Brown D.E. et al. // Nature. 1991. V. 349. P. 262.
Pierpont C.G., Lange C.W. // Prog. Inorg. Chem. 1994. V. 41. P. 331.
Speier G., Tyeklar Z., Toth P. et al. // Inorg. Chem. 2001. V. 40. P. 5653.
Берберова Н.T., Смолянинов И.В., Охлобыстин А.О. и др. // Росс. хим. журн. 2005. Т. 49. № 5. С. 67.
Сидоров А.А., Понина М.О., Нефедов С.Е. и др. // Журн. неорган. химии. 1997. Т. 42. С. 952.
Талисманова М.О., Фомина И.Г., Сидоров А.А. // Изв. АН. Сер. хим. 2003. № 12. С. 2556.
Бутин К.П., Белоглазкина Е.К., Зык Н.В. // Успехи химии. 2005. Т. 74. № 6. С. 586.
Chaudhuri P., Verani C.N., Bill E. et al. // J. Am. Chem. Soc. 2001. № 123. P. 2213.
Ghosh P., Bill E., WeyhermuÈller T., Wieghardt K. // J. Am. Chem. Soc. 2003. № 125. P. 3967.
Нефедов В.И., Захарова И.А., Моисеев И.И. и др. // Журн. неорган. химии. 1973. Т. 18. № 12. С. 3264.
Фомина И.Г., Талисманов С.М., Устынюк Ю.А. и др. // Изв. АН. Сер. хим. 2001. С. 494.
Herebian D., Bothe E., Neese F. et al. // J. Am. Chem. Soc. 2003. № 125. P. 9116.
Eremenko I.L., Nefedov S.E., Sidorov A.A. et al. // J. Organomet. Chem. 1998. V. 551. P. 171.
Kumar Gobind, Blackburn J.R., Albridge R.G. et al. // Inorg. Chem. 1972. V. 11. № 2. P. 292.
Нефедов В.И. Рентгеноэлектронная спектроскопия химических соединений. М.: Химия, 1984. С. 149, 208.
Mattogno G., Polsonetti G., Tauszik G.R. // J. Electron. Spectrosc. Relat. Phenom. 1978. V. 14. № 3. P. 237.
Абакумов Г.А., Черкасов В.К., Бубнов М.П. и др. // Изв. АН. Сер. хим. 1992. С. 2315.
Lange C.W., Pierpont C.G. // Inorg. Chim. Acta. 1997. V. 263. P. 219.
Яцимирский К.Б., Казанский Л.П., Бойко А.Н., Павлищук В.В. // Теорет. и эксперим. химия. 1982. № 4. С. 490.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия