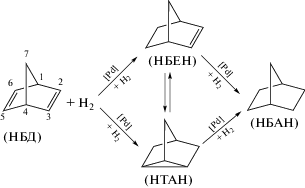
Координационная химия, 2021, T. 47, № 10, стр. 628-634
Особенности каталитического гидрирования карбоциклических соединений на основе норборнадиена
В. В. Замалютин 1, *, Е. А. Кацман 1, В. Я. Данюшевский 1, В. Р. Флид 1, **, В. В. Подольский 1, А. В. Рябов 1
1 МИРЭА – Российский технологический университет,
Институт тонких химических технологий им. М.В. Ломоносова
Москва, Россия
* E-mail: zamalyutin@mail.ru
** E-mail: vitaly-flid@yandex.ru
Поступила в редакцию 22.03.2021
После доработки 12.05.2021
Принята к публикации 13.05.2021
Аннотация
Исследовано газо- и жидкофазное гидрирование бицикло[2.2.1]гепта-2,5-диена (норборнадиена) (НБД) в присутствии промышленного палладиевого катализатора Pd/γ-Al2O3 (ПК-25) в среде н-гептана при 75–200°С. Идентифицированы продукты реакции, установлены основные маршруты ее протекания, изучен материальный баланс. Подтвержден эффект предпочтительной адсорбции НБД по сравнению с остальными компонентами системы на активном палладиевом центре. Рассмотрена связь между возможными способами координации НБД и строением продуктов. На основании совокупности экспериментальных и теоретических данных предложена параллельно-последовательная схема механизма процесса.
Теория адсорбции И. Ленгмюра [1, 2] создала условия для качественного понимания и количественного описания кинетики гетерогенно-каталитических химических реакций (ГКХР), а также многих ее закономерностей, включая конкурентное торможение субстратами или продуктами [3–6]. Необходимость адекватной количественной интерпретации кинетических результатов для некоторых сложных ГКХР привела к допущению о множественной адсорбции молекул реактантов на одном активном центре (АЦ) [7]. Такое предположение способно придать кинетическим моделям большую степень гибкости, чем они имели до этого на основе классических положений о механизмах ГКХР.
Одной из общеизвестных систем взглядов на механизмы ГКХР является рассмотрение их особенностей, основанных на аналогиях с гомогенным катализом. Они включают сходные черты по промежуточным продуктам реакции, по характеру связывания реагентов активным центром (например, координация–адсорбция), по роли среды (например, растворитель или поверхность) и т.п. Большой вклад в развитие таких представлений внесли классические работы И.И. Моисеева с сотрудниками по гомогенному катализу на гигантских кластерах металлов, близких по размеру и каталитическим свойствам к частицам металла на поверхности носителя [4, 8–10].
С другой стороны, адекватными примерами реализации множественной адсорбции являются работы по квантово-химическому моделированию взаимодействия фенилацетилена с Pd-поверхностью (111) [11, 12], а также экспериментальные исследования кинетики и особенностей механизма селективного гидрирования фенилацетилена в присутствии Pd/C [13]. Это явление наблюдается при деоксигенации жирных кислот в жидкой фазе на нанесенных палладиевых и никелевых катализаторах [14–16].
Реакции селективного гидрирования широко применяются в нефтехимической промышленности для очистки этилена и стирола от примесей ацетилена и фенилацетилена в газовой и жидкой фазах соответственно [17–19].
Несмотря на наличие значительного количества публикаций по ГКХР, имеющихся данных далеко не всегда достаточно для глубокого понимания строения и функционирования АЦ гетерогенного катализатора (ГК) и направленного подбора условий гидрирования, что необходимо при построении адекватных кинетических моделей.
Понимание закономерностей гетерогенного гидрирования бицикло[2.2.1]гепта-2,5-диена (норборнадиена) (НБД) может стимулировать не только развитие представлений о множественной адсорбции субстратов на одном АЦ ГК, но и создать предпосылки для селективного получения напряженных насыщенных карбоциклических структур с сохранением углеродного каркаса.
Двойные связи в НБД обладают повышенной реакционной способностью из-за особенностей пространственного строения и наличия гомосопряжения. Соединения, получаемые на основе НБД, в том числе продукты гидрирования, – перспективные полупродукты в органическом синтезе, в частности компоненты новых перспективных полимерных материалов или топлив с высокими удельными энергетическими показателями [20].
Практическая целесообразность разработки катализаторов и условий проведения реакций жидкофазного гидрирования напряженных полициклических соединений определяется необходимостью сохранения структуры углеродного каркаса, что актуально для НБД и его производных. Поэтому действие катализатора и условия гидрирования должны быть достаточно мягкими. Разработка таких катализаторов и изучение механизма их действия осуществляется на основе систематических структурных и кинетических исследований. Результаты предварительных экспериментов по газофазному гидрированию НБД при 100–200°С позволяют высказать качественные аналогии, наблюдаемые для некоторых реакций с участием ацетиленов и диенов на нанесенных палладиевых ГК. Несмотря на сравнительно большую технологичность гидрирования в газовой фазе, эти процессы приемлемы только для первых представителей рядов – НБД и бицикло[2.2.1]гепт-2-ен (норборнен, НБЕН). Более тяжелые норборненовые производные, такие как дициклопентадиен, 5-винилнорборнен, пента- и гексациклические димеры НБД и многие другие, могут участвовать только в жидкофазных процессах [21].
Цель настоящего исследования – изучение особенностей жидкофазного гидрирования НБД в реакторах периодического и проточного типов, а также создание предпосылок для разработки кинетической модели, адекватно описывающей превращение НБД в бицикло[2.2.1]гептан (норборнан, НБАН) в присутствии палладиевого катализатора корочкового типа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали НБД, который перед опытами сушили над натриевой проволокой и перегоняли, а также растворители н-гептан (эталонный, ХИММЕД) и н-нонан – внутренний стандарт (для хроматографии “х. ч.”, РЕАХИМ) – без дополнительной очистки. Газообразные водород марки А чистотой 99.99% ГОСТ 3022-80 и азот марки “ос. ч.” (1 сорт, чистотой 99.999%) применяли без дополнительной очистки.
В качестве ГК использовали промышленный катализатор ПК-25 (ТУ 38.102178-96) (ЗАО “Промкатализ”), применяющийся для селективного гидрирования (удаления) примесей ацетилена и диеновых углеводородов в жидких и газообразных продуктах пиролиза [22].
Методика восстановления катализатора ПК-25 в токе Н2 и анализ продуктов гидрирования НБД в проточном реакторе 1 и в реакторе периодического действия 2. Реакторы 1 (объем рабочей зоны 3 см3) или 2 (объем 100 см3) продували водородом (25°С, 20 мин). Навеску катализатора ПК-25 (0.50–1.50 г) восстанавливали в токе водорода (4 л/ч) в течение 180 мин при температурах опытов (100–200°С) в 1 или 75°С в 2. Визуально наблюдали почернение гранул катализатора.
Для идентификации всех компонентов смеси использовали хроматомасс-спектрометр Agilent 5973N с приставкой Agilent 6890 (тип ионизации – электронный удар, колонка Agilent 122-5536 DB-5ms).
Анализ реакционных проб проводили на хроматографе Кристалл 2000 (колонка VS-101 50 м × × 0.2 мм, фаза 100%-ный диметилполисилоксан). Время анализа 27 мин; температура детектора и испарителя 180°С; начальная температура колонки 70°С; температурный режим колонки 70°С (10 мин) – 15°С (мин) – 250°С (3 мин); газ-носитель гелий; поток 0.8 мл/мин; деление потока 1 : 125. ГЖХ (газо-жидкостная хроматография)-анализ исходного НБД показал наличие в нем ~5% НБЕН. Эти данные учитывали при анализе проб, отобранных в ходе эксперимента. Обработку результатов анализа проводили с помощью программы Хроматэк-аналитик методом внутреннего стандарта по н-нонану.
Методика проведения кинетических экспериментов в реакторе 1. Проточный кварцевый реактор (реакционный объем 3 см3) состоит из нескольких частей. В верхнюю часть, снабженную электрообогревом, загружали катализатор. Вторая и третья части реактора представляют собой шариковый холодильник и холодильник-сепаратор. В нижней части находится колба-приемник, помещенная в ледяную баню.
В верхнюю часть реактора непрерывно подавали смесь водорода и жидких реагентов с помощью перистальтического насоса. В колбе-приемнике в течение опыта собирается жидкая фракция, содержащая продукты гидрирования. Собранный катализат в конце эксперимента анализировали методом ГЖХ.
Методика проведения кинетических экспериментов в реакторе 2. При изучении кинетики жидкофазного гидрирования НБД для обеспечения интенсивного перемешивания использовали вибростенд, на который устанавливался термостатируемый реактор периодического действия объемом 100 мл с обратным холодильником и пробоотборником в нижней части реактора. Реактор соединяли с газометром, наполненным водородом. Контроль за ходом экспериментов осуществляли методами ГЖХ-анализа реакционных проб и волюмометрически по поглощению водорода. По результатам анализа для каждого эксперимента рассчитывали полный материальный баланс. Отбор проб осуществляли без нарушения реакционного режима. Их количество определяли условиями статистической обработки результатов с целью получения адекватной информации. Конверсия реагентов в кинетических экспериментах достигала 100%.
Специальными опытами подобраны режимы перемешивания. При интенсивности встряхивания выше 380 мин–1 обеспечивается протекание процесса без заметных диффузионных ограничений. С этой же целью оптимизировали форму и размеры гранул катализатора (0.1–0.2 мм).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для подбора условий полного гидрирования НБД в среде н-гептана в проточном реакторе и стабильности катализатора проведена серия опытов в токе водорода в интервале температур 100–200°С при варьировании расхода водорода и реагентов (табл. 1). Время контакта реакционной смеси составляло 0.1–0.3 ч. Результаты ГЖХ-анализа на выходе из реактора приведены в табл. 2. Основными продуктами являются НБАН (84–92%) и трицикло[2.2.1.02,6]гептан (нортрициклан, НТАН) (8–10%), а также некоторое количество НБЕН (1.5–5%) или его полное отсутствие. Другие соединения не обнаружены. Катализатор после 20-кратного использования не теряет своей активности. Таким образом, подобранные условия и режимы гидрирования позволяют полностью избегать деструкции углеродного каркаса в норборнановых структурах и сохранять активность катализатора на протяжении длительного времени.
Таблица 1.
Условия газофазного гидрирования НБД в проточном реакторе
| Условия опыта | Опыт 1 | Опыт 2 | Опыт 3 | Опыт 4 | Опыт 5 |
|---|---|---|---|---|---|
| Температура реактора, °С | 200 | 155 | 100 | 125 | 100 |
| Время опыта, мин | 150 | 150 | 120 | 120 | 120 |
| Расход по H2 (25°С), л/ч | 2.4 | 2.4 | 2.4 | 4.86 | 4.86 |
| Расход по исходной смеси, мл/ч | 9.52 | 9.52 | 9.52 | 17.6 | 24.1 |
Таблица 2.
Результаты газофазного гидрирования НБД в проточном реакторе
| Состав исходной смеси, % (по данным ГЖХ-анализа) | |||||
|---|---|---|---|---|---|
| Компонент | Опыт 1 | Опыт 2 | Опыт 3 | Опыт 4 | Опыт 5 |
| НБД | 95.06 | 95.38 | 95.37 | 95.37 | 95.42 |
| НБЕН | 4.94 | 4.62 | 4.63 | 4.63 | 4.58 |
| Состав конечной реакционной смеси, % (по данным ГЖХ-анализа) | |||||
| НБД | 0.69 | 0 | 0 | 0 | 1.09 |
| НБЕН | 2.10 | 0 | 0 | 1.52 | 4.94 |
| НТАН | 8.80 | 10.14 | 7.68 | 8.90 | 9.63 |
| НБАН | 88.41 | 89.86 | 92.32 | 89.58 | 84.34 |
| Количественные технологические показатели | |||||
| Опыт 1 | Опыт 2 | Опыт 3 | Опыт 4 | Опыт 5 | |
| Температура реактора, °С | 200 | 155 | 100 | 125 | 100 |
| Степень превращения, % | |||||
| XНБД | 99.3 | 100 | 100 | 100 | 98.8 |
| XНБЕН | 57.8 | 100 | 100 | 64.9 | 9.10 |
| Селективность по НБД, % | |||||
| φНБАН | 88.3 | 89.7 | 92.2 | 90.8 | 85.0 |
| φНБЕН | 9.44 | 0 | 0 | 0 | 9.92 |
| φНТАН | 2.26 | 10.3 | 7.80 | 9.20 | 5.08 |
Из результатов газофазного гидрирования НБД в проточном реакторе следует, что при полной конверсии НБД наблюдается высокая селективность по НБАН, которая возрастает с уменьшением температуры (табл. 2, опыты 1–3). При увеличении расхода по сырью (табл. 2, опыт 5) выход НБЕН как промежуточного продукта гидрирования НБД в конечной смеси повышается и достигает 5%. Во всех опытах наблюдается образование НТАН (до 10%), выход которого повышается с ростом температуры и не зависит от скорости подачи сырья (табл. 1, 2).
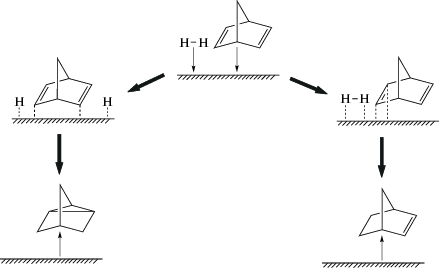
Несмотря на то что НТАН является минорным продуктом, механизм его образования представляет интерес с точки зрения вариативности способов координации НБД на активном центре катализатора. Теоретически можно допустить, что НТАН образуется при присоединении атомов водорода в положения 2 и 6 молекулы НБД, а также при изомеризации НБЕН Возможные превращения НБД в ходе газофазного гидрирования представлены на схеме 1 .
Схема 1 .
Для проверки этих гипотез проведен квантово-химический анализ вероятных превращений НБД и продуктов его гидрирования. При оптимизации геометрии и расчета термодинамических характеристик всех компонентов реагирующей системы использовали пакет квантово-химических программ Gaussian 09W (метод МР2/6-311G(d,p)). Для всех реакций рассчитаны величины ΔG° в газовой фазе (табл. 3).
Таблица 3.
Результаты расчета ΔG° в газовой фазе для превращений с участием НБД и продуктов его гидрирования
| Реакция | ΔG°, кДж/моль |
|---|---|
| НБД + H2 → НБЕН | –123.57 |
| НБЕН + H2 → НБАН | –101.44 |
| НБД + H2 → НТАН | –138.35 |
| НБЕН → НТАН | –14.78 |
| НТАН → НБЕН | 14.78 |
| НТАН + H2 → НБАН | –86.67 |
Результаты квантово-химических расчетов подтверждают, что изомеризация НБЕН в НТАН в исследуемых условиях термодинамически возможна, но маловероятна. Для проверки этой гипотезы были проведены модельные эксперименты. В проточный реактор при 200°С в токе азота и при отсутствии водорода подавали смесь, состоящую из 40% НБЕН и 60% н-гептана по массе. На выходе из реактора НТАН обнаружен не был. Таким образом, образование НТАН происходит только в результате одностадийного гидрирования НБД.
Для изучения особенностей кинетики гидрирования НБД проведена серия из шести опытов в реакторе периодического действия при одинаковой температуре. С целью проверки адекватности получаемых кинетических данных, каждый эксперимент дублировался. Условия некоторых опытов и результаты жидкофазного гидрирования НБД представлены в табл. 4 и 5 соответственно.
Таблица 4.
Условия некоторых опытов жидкофазного гидрирования НБД в реакторе периодического действия
| Условия опытов | Опыт 6 | Опыт 7 | Опыт 8 | Опыт 9 |
|---|---|---|---|---|
| Температура реактора, °С | 76 | |||
| Масса катализатора ПК-25, г | 1.4750 | 0.5050 | 0.5049 | 0.5070 |
| Форма катализатора | Гранулы 0.1–0.2 мм | |||
| Скорость встряхивания реактора, мин–1 | 380 | |||
Таблица 5.
Результаты жидкофазного гидрирования НБД в реакторе периодического действия
| Состав исходной смеси, % (по данным ГЖХ-анализа) | ||||
|---|---|---|---|---|
| Компонент | Опыт 6 | Опыт 7 | Опыт 8 | Опыт 9 |
| НБД | 95.49 | 95.63 | 48.06 | 95.92 |
| НБЕН | 4.51 | 4.37 | 51.94 | 4.08 |
| Состав конечной реакционной смеси, % (по данным ГЖХ-анализа) | ||||
| НБД | 0.00 | 0.00 | 0.00 | 0.00 |
| НБЕН | 0.00 | 0.00 | 0.00 | 0.00 |
| НТАН | 1.58 | 1.77 | 0.70 | 1.87 |
| НБАН | 98.42 | 98.23 | 99.30 | 98.13 |
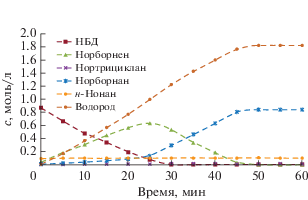
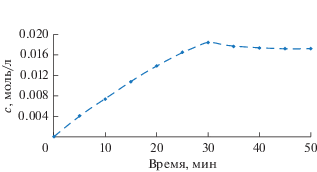
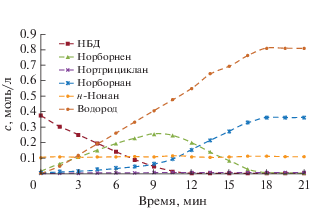
На рис. 1–3 представлены характерные кинетические кривые, получаемые при жидкофазном гидрировании НБД (76°С, растворитель н-гептан). Для каждой реакционной пробы методом внутреннего стандарта сводили материальный баланс (суммарная погрешность не более 5%). Во всех опытах в ходе гидрирования НБД наблюдали значительные количества промежуточного продукта – НБЕН. Время достижения максимальной концентрации НБЕН зависит от начальной концентрации НБД (рис. 2, 3) и практически совпадает с временем его полного расходования. Очевидно, при наличии в системе НБД промежуточный продукт в малой степени вступает во вторую стадию с образованием НБАН. После исчерпывания НБД скорость образования НБАН значительно увеличивается. Кинетический порядок по НБД и НБЕН близок нулю в широком временном интервале. Этот факт подтверждает, что подобно ацетиленовым соединениям НБД связан с активным палладиевым центром значительно прочнее, чем НБЕН и остальные компоненты реакции.
Рис. 2.
Кинетические кривые поглощенного водорода, НБД и продуктов его гидрирования при одинаковой начальной концентрации НБД и НБЕН в опыте 8 (табл. 5).
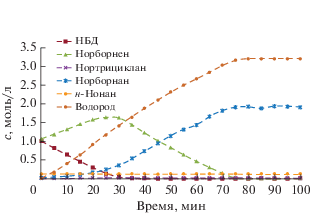
Рис. 3.
Кинетические кривые поглощенного водорода, НБД и продуктов его гидрирования при уменьшенной в два раза концентрации НБД относительно опытов 6 и 7 (табл. 5, опыт 9).
Анализ полученных кинетических кривых позволяет конкретизировать механизм этого процесса. Механизм гидрирования НБД (катализатор ПК-25) на основании экспериментальных и теоретических данных представлен на схеме 2 . Реакция имеет выраженный трехстадийный параллельно-последовательный характер.
Схема 2 .
Как в статической, так и в проточной системах реакция протекает с высокими показателями конверсии НБД и селективности по НБАН. Характерной особенностью процесса является наличие минорного продукта – НТАН (до 2%), образующегося непосредственно из НБД и не расходующегося на последующих этапах (рис. 4). На выход НТАН, очевидно, влияет только температура.
Характер кинетических кривых указывает на существенное торможение стадии гидрирования НБЕН в присутствии НБД. Это явление, вероятно, носит термодинамический характер из-за сильного связывания активного центра катализатора молекулой НБД. Аналогичный эффект наблюдается при гидрировании ацетиленов и диенов [4] и подтверждается сравнительными данными по энергиям адсорбции для фенилацетилена и стирола на Pd/C. Разница в значениях ΔG° адсорбции, полученных квантово-химическими методами для различных поверхностей палладия, составляет от 21 до 42 кДж/моль в пользу фенилацетилена [11, 12].
Вариативность форм координации (адсорбции) НБД (моно-/бидентатной, экзо/эндо) приводит к образованию различных продуктов, в частности хелатный характер его координации подтверждается образованием незначительных количеств НТАН.Возможные способы координации НБД на поверхности палладиевого катализатора представлены на схеме 3 .
Схема 3 .
Для более обоснованных выводов о характере координации НБД на активных палладиевых центрах и стерических особенностях процессов гидрирования норборненовых производных требуются дополнительные систематические исследования. Учитывая большой диапазон структурных особенностей соединений этого класса, в том числе связанных с пространственным экранированием двойных связей, для каждого объекта потребуется специфический подход к разработке структуры катализатора и условий проведения процесса.
Более подробные выводы о деталях механизма изучаемой реакции, в дальнейшем, предполагается сделать на основе структурной кинетической модели, построенной по данным специально спланированного эксперимента.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Langmuir I. // J. Am. Chem. Soc. 1918. V. 40. P. 1361.
Masel R. Principles of Adsorption and Reaction on So-lid Surfaces. N.Y.: John Wiley and Sons, Inc., 1996.
Nishimura S. Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis. N.Y.: John Wiley and Sons, Inc., 2001.
Berenblyum A.S., Danyushevsky V.Ya., Katsman E.A. // Kinetics and Catalysis. 2019. V. 60. № 4. P. 381.
Berenblyum A.S., Al-Wadhaf H.A., Katsman E.A., Flid V. R. // Kinetics and Catalysis. 2011. V. 52. № 2. P. 296.
Tagandurdyyeva N., Maltseva N.V., Vishnevskaya T.A. et al. // Fine Chem. Technol. 2020. V. 15. P. 7.
Кацман Е.А., Данюшевский В.Я., Шамсиев Р.С., Флид В.Р. Теория и практика гетерогенных катализаторов и адсорбентов / Под ред. Койф-мана О.И. М.: URSS, 2020. С. 15.
Moiseev I.I., Vargaftik M.N. Catalysis with giant palladium clusters // Perspectives in Catalysis / Eds. Thomas J.M., Zamaraev K.I. Oxford: Blackwell. 1991. P. 91.
Moiseev I.I., Vargaftik M.N. // Catalysis by Di- and Polynuclear Metal Complexes. N.Y.: Wiley–VCH, 1998. № 4. P. 395.
Moiseev I.I., Gekhman A.E., Tsodikov M.V. et al. // Multimetallic Catalyst in Organic Synthesis / Eds. Shibasaki M., Yamamoto Y. Weinheim: Wiley-VHS, 2004. P. 249.
Shamsiev R.S., Danilov F.O., Morozova T.A. // Russ. Chem. Bull. 2017. V. 66. № 3. P. 401.
Shamsiev R.S., Danilov F.O., Flid V.R., Shmidt E.Yu. // Russ. Chem. Bull. 2017. V. 66. № 12. P. 2234.
Беренблюм А.С., Аль-Вадхав Х.А., Кацман Е.А. // Нефтехимия. 2015. Т. 55. № 2. С. 125.
Berenblyum A.S., Podoplelova T.A., Katsman E.A. et al. // Kinetics and Catalysis. 2012. V. 53. № 5. P. 595.
Katsman E.A., Danyushevsky V.Ya., Kuznetsov P.S. et al. // Kinetics and Catalysis. 2017. V. 58. № 2. P. 147.
Katsman E.A., Danyushevsky V.Ya., Kuznetsov P.S. // Petroleum Chemistry. 2017. V. 57. № 12. P. 1190.
Басимова Р.А., Павлов М.Л., Мячин С.И. // Нефтехимия. 2009. Т. 5. № 5. С. 360.
Назаров М.В., Ласкин А.И., Ильясов И.Р. и др. // Катализ в промышленности. 2013. № 2. С. 39.
Стыценко В.Д., Мельников Д.П. // Журн. физ. химии. 2016. Т. 90. № 5. С. 691.
Flid V.R., Gringolts M.L., Shamsiev R.S., Finkelshtein E.Sh. // Russ. Chem. Rev. 2018. V. 87. P. 1169.
Shorunov S.V., Zarezin D.P., Samoilov V.O. et al. // Fuel. 2021. V. 283. P. 118935.
Каталог. Редкинский катализаторный завод. http://www.recatalys.ru/katalog/.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия