Координационная химия, 2021, T. 47, № 10, стр. 613-619
Лигандный обмен и депротонирование пиразола в реакции трехъядерного ацетата палладия(II) c биядерным пивалат-пиразол-пиразолатом цинка
М. Н. Варгафтик 1, С. Е. Нефедов 1, *
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: snef@igic.ras.ru
Поступила в редакцию 12.04.2021
После доработки 13.05.2021
Принята к публикации 27.05.2021
Аннотация
Обнаружено, что реакция Pd3(OOCMe)6 c Zn2(µ-Dmpz)2(HDmpz)2(OOCtBu)2 (HDmpz-3,5-диметилпиразол) в хлористом метилене при комнатной температуре приводит к лигандному обмену, сопровождающемуся депротонированием координированного атомами цинка пиразола с образованием гетерокарбоксилатного 1D-координационного полимера [Zn2(µ-OOCMe)(µ-OOCtBu)3]n (I) и трехъядерного комплекса, cольватированного 1,4-диоксаном Pd3(µ-Dmpz)6 ⋅ С4Н8О2 (II). Cоединения I, II исследованы методами химического анализа, ИК-спектроскопии и РСА (CIF files CCDC № 2076508 (I), 2076509 (II) соответственно).
Реакции обмена лигандов достаточно традиционны для координационной химии и направление таких реакций, а также состав конечных продуктов в первом приближении определяются теорией жесткости–мягкости Пирсона [1, 2].
В то же время одним из направлений реакций лигандного обмена является перенос протона с образованием новых типов анионов и выделением в реакционный раствор более устойчивого основания с протоном. В частности, пиразол и его аналоги способны связываться с атомом металла пиридиновым атомом азота гетероцикла и давать анион в результате депротонирования пиррольного NH-фрагмента. Образование аниона приводит к тому, что такой двуатомный трехэлектронодонорный пиразолат-анион становится мостиковым, формируя би-, полиядерные комплексы и кластеры. Такие соединения были получены практически для всех 3d-металлов: биядерные: M2(µ-Dmpz)2- (HDmpz)2(OOCR)2 (M = Zn, Cu, Co) [3], полиядерные металлоциклы: [Zn4(µ-Dmpz)6(µ-OH)2]2 и [Zn4(µ-Dmpz)6(µ-OH)2]4 [4]; Cu8(µ-Dmpz)8(µ-OH)8 [5], {Cu(µ-OH)(µ-Pz)}n (n = 6, 8, 9, 12, 14 [6, 7], {Cu(µ-OH)(µ-Pz)}n (n = 28, 31) [8]; (Bu4N)2[Ni8(μ4-OH)6(μ-Pz)12](CH8CN)4 [9]; (Bu4N)2[${\text{Co}}_{{\text{3}}}^{{{\text{III}}}}$(µ3-O)- (µ-4-NO2−Pz)6(NO2)3] [10], ${\text{Co}}_{{\text{4}}}^{{{\text{II}}}}$(µ4-O)(µ-Dmpz)6 [11], (Bu4N)2[CoIII(µ-OH)(µ-4-NO2−Pz)(µ-Dmpz)]10- (NO2)2 [10]; (Bu4N)2[CoIII(µ-OH)(µ-4-NO2–Pz)(µ-Dmpz)]12(NO2)2 [10]; комплексы железа(III) на основе кубана Fe4O4 – Fe8(µ4-O)4(µ-Pz)12Cl4 [12], Fe8(µ4-O)4(µ-Pz)12X4 (Pz = 4-Cl−Pz, 4-Me−Pz; X = = Br) [13]; комплексы марганца(III) на основе кубанового мотива – Mn8(μ3-O)4(μ-Pz)8(μ-OMe)4- (OMe)4 [14]. Отметим также, что есть несколько примеров, когда пиразолат-анион формирует гетерометаллические кластеры на основе Pt(II): Pt2Ag4(μ-Cl)2(μ-Ph2Pz)6, Pt2Ag2Cl2(μ-Ph2Pz)4(Ph2PzH)2, Pt2Cu2Cl2(μ-Ph2Pz)4(Ph2PzH)2, [Pt2Ag4(μ-Cl)(μ-Dmpz)(μ-Ph2Pz)6, Pt2Ag4(μ-Dmpz)2(μ-Ph2Pz)6 [15], Pt2M4(µ-Dmpz)8 (M = Ag, Cu) [16].
В настоящей работе сообщается о строении продуктов реакции ацетата палладия и биядерного пиразолат-пиразол-пивалата цинка, сопровождающейся лигандным обменом и депротонированием пиразола.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные комплексы получали согласно методикам, опубликованным в [17, 18].
Синтез {[Zn2(µ-OOCtBu)3](µ-OOCMe)}n (I) и Pd3(µ-Dmpz)6 ⋅ С4Н8О2 (С4Н8О2 = 1,4-диоксан) (II). К оранжевому раствору 0.2 г (0.089 мм) ацетата палладия в 5 мл хлористого метилена медленно по каплям добавляли бесцветный раствор 0.64 г (0.089 мм) Zn2(µ-Dmpz)2(HDmpz)2(OOCtBu)2 в 5 мл хлористого метилена. Полученную смесь перемешивали магнитной мешалкой при комнатной температуре в течение 1 ч. Цвет раствора постепенно менялся с оранжевого на желтый. К полученному раствору добавляли 3 мл гексана и по одной капле бензола и 1,4-диоксана. Раствор концентрировали при нагревании в вакууме водоструйного насоса до 5 мл и выдерживали в холодильнике при 5°С в течение 2 суток. Выпавшие при этом бесцветные и палевые кристаллы отделяли от маточного раствора декантацией, промывали холодным бензолом (2 × 5 мл), гексаном (5 мл) и сушили в токе аргона.
Крупные бесцветные (I) и палевые (II) кристаллы отделяли из смеси механически под микроскопом. Выход 0.12 г (28%).
ИК-спектр (ν, см–1): 3434 cл, 2964 ср, 2920 ср, 1629 ср, 1582 с, 1562 оч.с, 1557 оч.с, 1485 с, 1428 с, 1301 сл, 1228 ср, 1049 сл, 897 сл, 789 сл, 764 сл, 726 сл, 648 сл, 606 сл, 574 сл, 518 сл, 476 сл. Выход 0.09 г. (32%).
| Найдено, %: | С 42.24; | H 4.55; | N 17.44. |
| Для C34H44N12OPd3 (II) | |||
| вычислено, %: | С 42.41; | Н 4.64; | N 17.58. |
ИК-спектр (ν, см–1): 2996 ср, 2820 ср, 1992 сл.ш, 1682 ср, 1570 с, 1552 с, 1483 ср, 1444 ср, 1308 сл, 1228 ср, 860 ср.
ИК-спектры соединений регистрировали на ИК-спектрофотометре с Фурье-преобразованием Perkin-Elmer Spectrum 65 методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
РСА I, II выполнен по стандартной методике на автоматическом дифрактометре Bruker SMART Apex II, оборудованном CCD-детектором (МоКα-излучение, λ = 0.71073 Å, графитовый монохроматор, ω-сканирование). Уточнение структур выполнено с использованием комплекса программ SHELXTL PLUS (PC версия) [19–22]. Кристаллографические данные и детали уточнения структур I, II приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические параметры и детали уточнения структур I, II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C17H30O8Zn2 | C34H44N12OPd3 |
| М | 493.15 | 956.01 |
| Цвет | Бесцветный | Палевый |
| T, K | 150(2) | 150(2) |
| Сингония | Моноклинная | Pомбическая |
| Пр. гр. | P21/n | Ibam |
| a, Å | 9.644(6) | 24.7898(15) |
| b, Å | 12.911(7) | 15.6505(10) |
| c, Å | 19.776(11) | 19.320(2) |
| α, град | 90 | 90 |
| β, град | 98.511(9) | 90 |
| γ, град | 90 | 90 |
| V, Å3 | 2435(2) | 7495.7(11) |
| Z | 4 | 8 |
| ρ(выч.), мг/м3 | 1.345 | 1.694 |
| µ, мм–1 | 2.003 | 1.469 |
| F(000) | 1024 | 3824 |
| Размеры кристалла, мм | 0.20 × 0.18 × 0.16 | 0.26 × 0.24 × 0.22 |
| θ-Область сканирования, град | 2.08−26.00 | 2.61−28.00 |
| Интервалы индексов отражений | −11 ≤ h ≤ 11, −15 ≤ k ≤ 15, −24 ≤ l ≤ 24 |
−32 ≤ h ≤ 3 2, −20 ≤ k ≤ 19, −25 ≤ l ≤ 25 |
| Число отражений | 18 069 | 33 616 |
| Число независимых отражений (Rint) | 4758 (0.1590) | 4634 (0.0366) |
| GOOF | 1.233 | 1.095 |
| R (I > 2σ(I)) | R1 = 0.0997, wR2 = 0.2230 | R1 = 0.0494, wR2 = 0.1520 |
| R (по всем рефлексам) | R1 = 0.2233, wR2 = 0.2697 | R1 = 0.0590, wR2 = 0.1688 |
| Электронная плотность (max/min), e Å–3 | 1.521/–1.086 | 1.614/–2.054 |
Таблица 2.
Основные длины связей (Å) и валентные углы (град) в комплексе I*
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| I | |||
| Zn(2)–O(1) | 1.930(9) | Zn(2)–O(3) | 1.930(8) |
| Zn(2)–O(7) | 1.941(8) | Zn(2)–O(5) | 1.952(9) |
| Zn(1)–O(6) | 1.913(9) | Zn(1)–O(2) | 1.920(8) |
| Zn(1)–O(4) | 1.927(8) | Zn(1)–O(8)#1 | 1.942(8) |
| O(8)–Zn(1)#2 | 1.942(8) | ||
| II | |||
| Pd(1)–N(3) | 2.010(4) | Pd(1)–N(3)#1 | 2.010(4) |
| Pd(1)–N(1)#1 | 2.026(4) | Pd(1)–N(1) | 2.026(4) |
| Pd(1)–Pd(2)#1 | 2.9766(6) | Pd(1)–Pd(2) | 2.9766(6) |
| Pd(2)–N(5) | 1.957(4) | Pd(2)–N(6) | 1.960(4) |
| Pd(2)–N(4) | 1.962(4) | Pd(2)–N(2) | 1.970(4) |
| Pd(2)–Pd(2)#1 | 3.0059(10) | N(1)–N(2) | 1.348(5) |
| N(3)–N(4) | 1.373(5) | N(5)–N(5)#1 | 1.342(10) |
| N(6)–N(6)#1 | 1.369(10) | ||
| Угол | ω, град | Угол | ω, град |
| I | |||
| O(1)Zn(2)O(3) | 121.4(4) | O(1)Zn(2)O(7) | 109.9(4) |
| O(3)Zn(2)O(7) | 106.1(4) | O(1)Zn(2)O(5) | 106.4(4) |
| O(3)Zn(2)O(5) | 107.0(4) | O(7)Zn(2)O(5) | 104.9(4) |
| O(6)Zn(1)O(2) | 114.3(4) | O(6)Zn(1)O(4) | 115.6(4) |
| O(2)Zn(1)O(4) | 113.5(4) | O(6)Zn(1)O(8)#1 | 102.6(3) |
| O(2)Zn(1)O(8)#1 | 105.5(4) | O(4)Zn(1)O(8)#1 | 103.3(4) |
| C(1)O(1)Zn(2) | 137.5(9) | C(1)O(2)Zn(1) | 129.3(9) |
| C(6)O(3)Zn(2) | 136.7(9) | C(6)O(4)Zn(1) | 126.6(8) |
| C(11)O(5)Zn(2) | 132.3(11) | C(11)O(6)Zn(1) | 136.6(11) |
| C(16)O(7)Zn(2) | 109.8(7) | C(16)O(8)Zn(1)#2 | 132.0(8) |
| II | |||
| N(3)Pd(1)N(3)#1 | 93.0(2) | N(3)Pd(1)N(1)#1 | 172.99(15) |
| N(3)#1Pd(1)N(1)#1 | 83.97(15) | N(3)Pd(1)N(1) | 83.97(15) |
| N(3)#1Pd(1)N(1) | 172.98(15) | N(1)#1Pd(1)N(1) | 98.3(2) |
| N(3)Pd(1)Pd(2)#1 | 107.57(11) | N(3)#1Pd(1)Pd(2)#1 | 64.49(11) |
| N(1)#1Pd(1)Pd(2)#1 | 65.41(11) | N(1)Pd(1)Pd(2)#1 | 110.36(11) |
| N(3)Pd(1)Pd(2) | 64.49(11) | N(3)#1Pd(1)Pd(2) | 107.57(11) |
| N(1)#1Pd(1)Pd(2) | 110.36(11) | N(1)Pd(1)Pd(2) | 65.41(11) |
| Pd(2)#1Pd(1)Pd(2) | 60.65(2) | N(5)Pd(2)N(6) | 84.66(18) |
| N(5)-Pd(2)N(4) | 96.32(17) | N(6)Pd(2)N(4) | 170.53(18) |
| N(5)Pd(2)N(2) | 178.22(18) | N(6)Pd(2)N(2) | 94.37(17) |
| N(4)Pd(2)N(2) | 84.39(16) | N(5)Pd(2)Pd(1) | 112.60(14) |
| N(6)Pd(2)Pd(1) | 103.20(13) | N(4)Pd(2)Pd(1) | 67.70(11) |
| N(2)Pd(2)Pd(1) | 66.14(11) | N(5)Pd(2)Pd(2)#1 | 64.84(14) |
| N(6)Pd(2)Pd(2)#1 | 65.33(14) | N(4)Pd(2)Pd(2)#1 | 106.54(11) |
| N(2)Pd(2)Pd(2)#1 | 113.39(12) | Pd(1)Pd(2)Pd(2)#1 | 59.673(10) |
Структурные данные для комплексов депонированы в Кембриджском банке структурных данных (CCDC № 2076508 (I), 2076509 (II); http://www.ccdc.cam.ac.uk/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Обнаружено, что реакция ацетата палладия(II) с Zn2(µ-Dmpz)2(HDmpz)2(OOCtBu)2 в хлористом метилене при комнатной температуре приводит к образованию комплексов: бесцветного 1D-координационного полимера (КП) {[Zn2(µ-OOCtBu)3]-(µ-OOCMe)]}n (I, выход 28%) и трехъядерного пиразолат мостикового комплекса Pd3(µ-Dmpz)6 ⋅ ⋅ С4Н8О2 (II, выход 32%). Полученные результаты вполне соответствуют теории жесткости–мягкости Пирсона, когда мягкий катион Pd2+ связывается с мягким анионом Dmpz–, а промежуточный Zn2+ – с жестким OOCR– [2]. Отметим, однако, что реакция сопровождается депротонированием пиразола, причем атом водорода связывается с анионом карбоновой кислоты, что приводит в растворе к равновесию в связи с близкими значениями показателей кислотности (R = Me, tBu; pKa = 4.76, 5.05 при 25°С в H2O соответственно [23]) образующихся кислот.
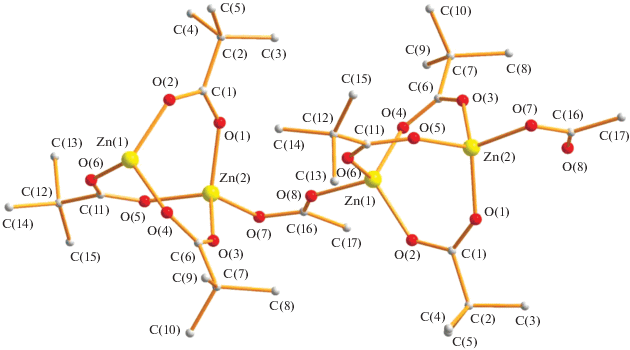
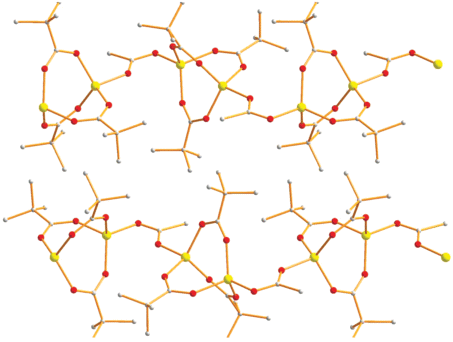
По данным РСА, в КП комплекса I (табл. 1, 2) биядерные фрагменты Zn2(µ-OOCtBu)3 (Zn…Zn 3.211(1) Å), имеющие три пивалатных мостика (Zn–O 1.913(9)–1.952(9) Å), связаны в полимер через ацетатный мостик (Z–O 1.941(8)–1.942(8) Å), при этом атом металла находится в искаженном тетраэдрическом окружении. Заметим, что близлежащие димеры в полимере находятся под углом 85.9° и через один они параллельны (рис. 1, 2) с расстояниями между атомами металлов близлежащих димеров в 1D-линии 4.455 Å, а расстояние между близлежащими атомами металлов соседних слоев составляет 8.774 Å.
Необходимо отметить, что 1D-КП, имеющие в своем составе фрагментs Zn2(µ-OOCR)3, связанные мостиком OOCR–, известны. Однако, в отличие от I, все они формируются за счет одинаковых карбоксилат-анионов. Так, например, были получены КП с R = Ph [24], изо-Pr [25], Mes [26], CH2tBu [25], CF3 [27], 2-Cl–Ph [28].
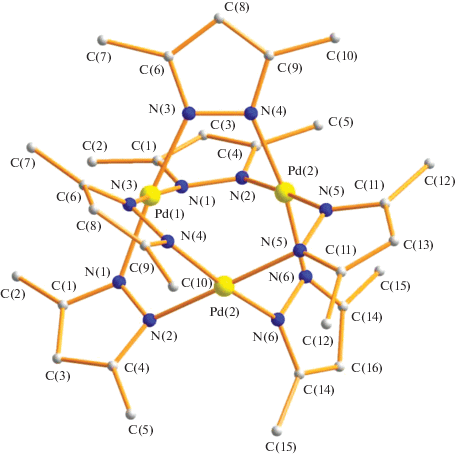
Вторым продуктом реакции оказался трехъ-ядерный пиразолат-мостиковый комплекс Pd3(µ-Dmpz)6 (II). По данным РСА, в II (табл. 1, 2) три атома металла находятся на расстояниях длиною Pd(1)…Pd(2) 2.9766(6) и Pd(2)…Pd(2) 3.0059(10) Å и соединены попарно двумя Dmpz-мостиками (Pd(1)–N(1) 2.026(4), Pd(1)–N(3) 2.010(4), Pd(2)–N(2) 1.970(4), Pd(2)–N(4) 1.962(4), Pd(2)–N(5) 1.957(4), Pd(2)–N(6) 1.960(4) Å). В итоге каждый атом металла оказывается в плоско-квадратном окружении четырех атомов азота, принадлежащих мостиковым анионам (рис. 3). Геометрия полученного пиразолата II мало отличается от известных трехядерных комплексов Pd3 с пиразолатными мостиками, имеющими разные заместители R в анионах. Так, исходя из PdCl2(CH3CN)2, HPz и 4-MePz или Pd(HPz)4Cl2, триэтиламина в ацетонитриле были получены и структурно охарактеризованы комплексы Pd3(µ-Pz)6 (Pd…Pd 3.0270(4), 3.0607(4), 3.0460(3) Å, Pd–N 1.985(3)–2.020(3) Å); Pd3(µ-Pz)6 ⋅ ⋅ 2MeCN (Pd…Pd 3.0293(4), 3.0559(3), 3.0560(3) Å, Pd–N 2.011(3)–2.024(3); Pd3(µ-4-MePz)6 ⋅ 2MeCN (в двух независимых молекулах) (Pd…Pd 3.0486(4)–3.0727(4), Pd–N 1.999(3)–2.029(3) Å) [29]. Показано, что реакция цис-PdCl2(3-Ph–PzH)2 со стехиометрическим количеством Et3N на первой стадии дает трехъядерный комплекс Pd3(µ-3-Ph–Pz)4(3-Ph–Pz–H)2Cl2 (Pd…Pd 3.95 Å), дальнейшее добавление основания приводит к треугольнику Pd3(µ-3-Ph–Pz)6 (Pd…Pd 2.997(1), 3.079(1), 3.087(1) Å, Pd–N 1.963(9)–2.027(8) Å) [30]. Заметим, что в комплексе II из-за наличия двух донорных метильных групп, т.е. наиболее сильного из рассмотренных соединений основания Dmpz–, расстояния Pd…Pd и Pd–N заметно укорочены.
Согласно предложению Р.Ж. Раптиса [30], сравнивая химическое поведение и особенности геометрии трехэлектронодонорных двухатомных пиразолат-анионов и трехатомных карбоксилат-анионов в однотипных полиядерных комплексах и кластерах для Pd3(µ-OOCR)6, обнаружено: R = Me (Pd…Pd 3.105(1)–3.203(1) Å, Pd–O 1.973(9)–2.014(9) Å [31];R = Et (Pd…Pd 3.135(1)–3.191(1) Å, Pd–Ocpедн 1.993(9) Å) [32]; R = tBu (Pd…Pd 3.131(1)–3.132(1) Å, Pd–Ocpедн 1.980(8) Å) [32–34]; R = CF3 (Pd…Pd 3.244(1)–3.266(1) Å, Pd–O 1.980(8) Å) и R = 2,4,6-C6H2(CH3)3 (Pd…Pd 3.131(1)–3.132(1) Å, Pd–Ocpедн 1.980(8) Å) [32]; R = = CH2Cl (Pd…Pd 3.2036(9), 3.1588(9), 3.2311(9) Å, Pd–O 1.987(6)–2.015(6) Å) [34]; R = цикло-C6H11 (Pd…Pd 3.1350(3), 3.2166(4), 3.2166(4) Å, Pd–O 1.9809(19)–1.987(2) Å) [34].
Таким образом, так же как и в пиразолатах, в карбоксилатах палладия(II) сохраняется тенденция зависимости длин связей Pd…Pd и Pd–O от электронной природы заместителя R в карбоксилат-анионе, значения длин связей в карбоксилатах, образованных трехатомными мостиками, в среднем для Pd…Pd несколько больше, чем в пиразолатах, а длины связей Pd–O или совпадают или укорочены.
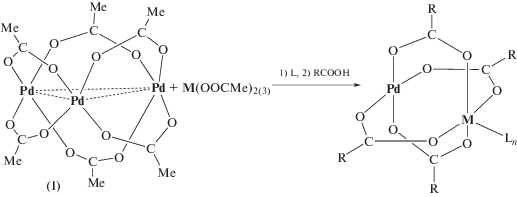
Необходимо отметить, что ранее в лаборатории академика И.И. Моисеева были подробно изучены реакции трехъядерного ацетата палладия(II) с карбоксилатами переходных и редкоземельных металлов и на этой основе синтезирован широкий ряд гетеробиметаллических ацетатных и пивалатных комплексов палладия(II) со структурой типа “китайского фонарика” (cхема 1) [35–43].
Схема 1 .
Заметим, однако, что подобные реакции с использованием трехъядерного пиразолатмостикового комплекса Pd(II) пока не изучались.
Таким образом, в результате проведенных исследований обнаружено, что реакция ацетата палладия(II) с биядерным пиразол-пиразолат-пивалатом цинка приводит не только к лигандному обмену, но и сопровождается депротонированием координированного пиразола с образованием трехъядерного пиразолатного комплекса палладия(II) и необычного гетерокарбоксилатного линейного 1D-КП цинка.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Cotton F.A., Wilkincon G., Murillo C.A. Bochmann M. Advanced Inorganic Chemistry. John Wiley & Sons, Inc., 1999. P. 493.
Пирсон Р.Дж. // Успехи химии. 1971. Т. 40. № 7. С. 1259. https://doi.org/10.1070/RC1971v040n07ABEH003854
Nefedov S.E. // Russ. J. Inorg. Chem. 2006. V. 51. S-uppl. 1. P. S49. https://doi.org/10.1134/S0036023606130031
Li H-X, Wu H.-Z., Zhang W.-H. et al. // Chem. Commun. 2007. P. 5052. https://doi.org/10.1039/b710787k
Ardizzoia G.A., Angaroni M.A., La Monica G. // Chem. Commun. 1990. P. 1021. https://doi.org/10.1039/c39900001021
Mezei G., Baran P., Raptis R.G. // Angew. Chem. Int. Ed. 2004. V. 43. P. 574. https://doi.org/10.1002/anie.200352636
Fernando R., Surmann S.A., Urech A.A. et al. // Chem. Commun. 2012. V. 48. P. 6860. https://doi.org/10.1039/C2CC32074F
Mezei G. // Chem. Commun. 2015. P. 51. https://doi.org/1034110.1039/C5CC03005F
Al Isawi W.A., Ahmed B.M., Hartman C.K. et al. // Inorg. Chim. Acta. 2017. V. 475. P. 65. https://doi.org/10.1016/j.ica.2017.08.013
Miras H.N., Chakraborty I., Raptis R.G. // Chem. Commun. 2010. V. 46. P. 2569. https://doi.org/10.1039/b920486e
Ehlert M.K., Rettig S.J., Storr A. et al. // Acta Crystallogr. C. Cryst. Struct. Commun. 1994. V. 50. P. 1023. https://doi.org/10.1107/S010827019301337X
Raptis R.G., Georgakaki I.P., Hockless D.C.R. // Angew. Chem., Int. Ed. 1999. V. 38. P. 1632. https://doi.org/10.1002/(SICI)1521-3773(19990601)38: 11<1632::AID-ANIE1632>3.3.CO;2-F
Baran P., Boca R., Chakraborty I. et al. // Inorg. Chem. 2008. V. 47. P. 645. https://doi.org/10.1021/ic7020337
Babic-Samardzija K., Baran P., Boca R. et al. // Polyhedron. 2018. V. 149. P. 142. https://doi.org/10.1016/j.poly.2018.04.033
Akatsu S., Kanematsu Y., Kurihara T. et al. // Inorg. Chem. 2012. V. 51. P. 7977. https://doi.org/10.1021/ic202663q
Umakoshi K., Kojima T., Saito K. et al. // Inorg. Chem. 2008. V. 47. P. 5033. https://doi.org/10.1021/ic702310t
Stephenson T.A., Morehouse S.M., Powell A.R. et al. // J. Chem. Soc. 1965. P. 3632. https://doi.org/10.1039/JR9650003632
Амельченкова Э.В., Денисова Т.О., Нефедов С.Е. // Журн. неорган. химии. 2006. V. 51. С. 1303 (Amel’chenkova E.V., Denisova T.O., Nefedov S.E. // Russ. J. Inorg. Chem. 2006. V. 51. P. 1218). https://doi.org/10.1134/S0036023606080110
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
SAINT. Area-Detector Integration Sofware. Madison (WI, USA). Bruker AXS Inc., 2012.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Ингольд К. Теоретические основы органической химии. М.: Мир, 1973. С. 1098.
Clark G.L., Kao H. // J. Am. Chem. Soc. 1948. V. 70. P. 2151. https://doi.org/10.1021/ja01186a046
Boyle T.J., Raymond R., Boye D.M. et al // Dalton Trans. 2010. V. 39. P. 8050. https://doi.org/10.1039/c002492a
Yamamura M., Nabeshima T. //Acta Crystallogr. E. 2015. V. 71. P. m14. https://doi.org/10.1107/S2056989014027418
Морозов И.В., Карпова Е.В., Глазунова Т.Ю. и др. // Коорд. химия. 2016. Т. 42. С. 609 (Morozov I.V., Karpova E.V., Glazunova T.Yu. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 647). https://doi.org/10.1134/S107032841610002X
Clegg W., Harbron D.R., Hunt P.A. et al. // Acta Crystallogr. C. 1990. V. 46. P. 750. https://doi.org/10.1107/S0108270189010152
Umakoshi K., Yamauchi Y., Nakamiya K. et al. // Inorg. Chem. 2003. V. 42. P. 3907. https://doi.org/10.1021/ic026196g
Baran P., Marrero C.M., Perez S., Raptis R.G. // Chem. Commun. 2002. P. 1012. https://doi.org/10.1039/b201301k
Skapski A.C., Smart M.L. // J. Chem. Soc. D. 1970. P. 658. https://doi.org/10.1039/c2970000658b
Bancroft D.P., Cotton F.A., Falvello L.R., Schwotzer W. // Polyhedron. 1988. V. 7. P. 615. https://doi.org/10.1016/S0277-5387(00)80368-X
Batsanov A.S, Timko G.A., Struchkov Yu.T. et al. // Russ. J. Coord. Chem. 1989. 15. P. 688.
Ефименко И.А., Подобедов Р.Е., Чураков А.В. и др. // Коорд. химия. 2011. Т. 37. С. 625 (Efimenko I.A., Podobedov R.E., Churakov A.V. et al. // Russ. J. Coord. Chem. 2011. 37. P. 625). https://doi.org/10.1134/S1070328411080021
Kozitsyna N.Yu., Nefedov S.E., Dolgushin F.M. et al. // Inorg. Chim. Acta. 2006. V. 359. P. 2072. https://doi.org/10.1016/j.ica.2006.05.002
Nefedov S.E., Yakushev I.A., Kozitsyna N.Yu. et al. // Inorg. Chem. Commun. 2007. V. 10. P. 948. https://doi.org/10.1016/j.inoche.2007.05.004
Nefedov S.E., Vargaftik M.N., Moiseev I.I. // Inorg. Chem. Commun. 2006. V. 9. P. 755. https://doi.org/10.1016/j.inoche.2006.04.024
Kozitsyna N.Yu., Nefedov S.E., Dolgushin F.M. et al. // Inorg. Chim. Acta. 2006. V. 359. P. 2072. https://doi.org/10.1016/j.ica.2006.05.002
Akhmadullina N.S., Cherkashina N.V., Kozitsyna N.Y. et al. // Inorg. Chim. Acta. 2009. V. 362. P. 1943. https://doi.org/10.1016/j.ica.2008.09.042
Марков А.А., Клягина А.П., Долин С.П. и др. // Журн. неорган. химии. 2009. Т. 54. № 6. С. 950 (Markov A.A., Klyagina A.P., Dolin S.P. et al. // Russ. J. Inorg. Chem. 2009. V. 54. P. 885). https://doi.org/10.1134/S0036023609060114
Nefedov S.E., Kozitsyna N.Yu., Vargaftik M.N., Moiseev I.I // Polyhedron 2009. V. 28. P. 172. https://doi.org/10.1016/j.poly.2008.10.006
Нефедов С.Е., Козицына Н.Ю., Ахмадуллина Н.С. и др. // Журн. неорган. химии. 2011. Т. 56. № 3. С. 399 (Nefedov S.E., Kozitsyna N.Yu., Akhmadullina N.S. et al. // Russ. J. Inorg. Chem. 2011. V. 56. P. 357). https://doi.org/10.1134/S0036023611030156
Nefedov S.E., Kozitsyna N.Yu., Akhmadullina N.S. et al. // Inorg. Chem. Commun. 2011. V. 14. P. 554. https://doi.org/10.1016/j.inoche.2011.01.023
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия