Координационная химия, 2021, T. 47, № 10, стр. 620-627
Синтез, строение и магнитные свойства бис-о-семихиноновых комплексов кобальта(III) c 1-арил-3,5-дифенилформазановыми лигандами
Н. А. Протасенко 1, *, А. И. Поддельский 1, Р. В. Румянцев 1, И. А. Якушев 2, 3, В. К. Черкасов 1
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
3 Национальный исследовательский центр Курчатовский институт
Москва, Россия
* E-mail: tessun@yandex.ru
Поступила в редакцию 11.02.2021
После доработки 26.04.2021
Принята к публикации 27.04.2021
Аннотация
Синтезированы и охарактеризованы новые гетеролигандные бис-3,6-ди-трет-бутил-о-бензосемихиноновые комплексы кобальта(III) с 1-(п-X-фенил)-3,5-дифенилформазановыми лигандами Co(3,6-SQ)2LX (Х = фтор (I), хлор (II), бром (III), иод (IV), метил (V)). Молекулярное строение соединений I, II и IV установлено методом РСА (CIF files CCDC № 2060727 (I), 2052592 (II), 2060728 (IV)). Координационное окружение центрального иона кобальта в исследованных комплексах – слабо-искаженный октаэдр, при этом степень искажения незначительно меняется в зависимости от заместителя. По данным РСА, магнитных и спектральных измерений установлено, что соединения I–V представляют собой комплексы низкоспинового кобальта(III), связанного с двумя анион-радикальными о-семихиноновыми лигандами и одним анионом формазана. Магнитное поведение комплексов I–V в интервале температур 50–300 К характеризуется преобладанием внутримолекулярных обменных взаимодействий антиферромагнитного типа, а в области ниже 50 К для комплексов II–V наблюдается ферромагнитное упорядочение, обусловленное межмолекулярными обменными взаимодействиями между парамагнитными лигандами.
Создание и дизайн гетероспиновых систем на основе координационных соединений переходных металлов со стабильными органическими радикалами представляет собой одно из актуальных направлений современной химии. Наличие нескольких парамагнитных центров в молекулах обусловливает повышенный интерес к их магнитным свойствам, поскольку такие соединения – удобные объекты для изучения тонких обменных взаимодействий, характер которых может регулироваться молекулярной геометрией, природой заместителей, стерическими факторами и др. [1–10]. Комплексы переходных металлов с радикальными органическими лигандами активно исследуются в качестве потенциальных структурных элементов для построения молекулярных магнетиков. Одним из перспективных классов соединений в этой области исследований являются координационные соединения, содержащие в своем составе радикальные редокс-активные лиганды на основе о-хинона. о‑Семихиноновые комплексы переходных металлов хорошо зарекомендовали себя в качестве модельных систем для изучения тонких обменных магнитных взаимодействий металл–лиганд и лиганд–лиганд. Для них были обнаружены такие явления как редокс-изомерия (внутримолекулярный перенос электрона) и спин-кроссовер [11, 12]. Уникальные свойства такого рода комплексов определяются делокализацией или переносом электрона (заряда) между металлом и парамагнитным органическим лигандом, при этом можно влиять на распределение зарядов в системе, варьируя природу иона металла, редокс-потенциал о-хинонового лиганда или путем введения в координационную сферу металла дополнительных лигандов [13–19]. В качестве дополнительных лигандов в таких комплексах, как правило, используются N-донорные нейтральные лиганды, например ароматические диимины (2,2'-дипирил [11], 1,10-фенантролин [20, 21] и их аналоги [19]), алифатические диамины [18, 22] и производные пиридина [23–25]. В данной работе в качестве N‑донорных лигандов выступают хелатирующие анионные лиганды класса формазанов. Недавно было установлено, что формазаны, находясь в координационной сфере металла, с одной стороны, способны обратимо восстанавливаться с образованием стабильной дианион-радикальной формы, а с другой, – подвергаться окислению до формазанильного радикала [26, 27]. Таким образом, формазаны подобно о-хинонам могут выступать в качестве редокс-активных лигандов, что открывает новые возможности для их применения в координационной химии и дизайне магнитоактивных соединений [28]. В ранее опубликованных нами работах представлена методика синтеза формазанатных производных переходных металлов из соответствующих карбонилов, приведены первые примеры гетеролигандных моно- и бис-о-семихинон-формазанатных комплексов кобальта на основе 1,3,5-трифенилформазанового лиганда, изучено их строение, магнитные и электрохимические свойства [29, 30].
В настоящей работе представлены результаты синтеза, спектральных, магнитных и структурных исследований пяти новых бис-о-семихиноновых комплексов кобальта(III) с 1-(п-X-фенил)-3,5-дифенилформазановыми лигандами (Х = фтор, хлор, бром, йод, метил).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в настоящей работе 3,6-ди-трет-бутил-о-бензохинон [31], 1,3,5-триарилформазановые [32] лиганды и трис-(3,6-ди-трет-бутил-о-бензосемихинолят)кобальта(III) [33] синтезировали согласно известным методикам. Растворители, необходимые для проведения экспериментов, очищали и обезвоживали согласно стандартным процедурам [34]. Коммерчески доступный карбонил кобальта (≥90% (Co), Sigma-Aldrich) использовали без дополнительной очистки.
ИК-спектры соединений регистрировали на Фурье-ИК-спектрометре ФСН-1201 (400–4000 см–1, вазелиновое масло). Элементный анализ (C, H, N) проводили на элементном анализаторе Elementar Vario EL cube. Магнетохимические измерения выполняли в Международном томографическом центре СО РАН на SQUID-магнетометре MPMSXL (Quantum Design) в интервале 2–310 K в магнитном поле 5 кЭ. Парамагнитные составляющие магнитной восприимчивости (χ) определяли с учетом диамагнитного вклада, оцененного из констант Паскаля. Эффективный магнитный момент (μэфф) вычисляли по формуле μэфф = [3kχT/(NA$\mu _{{\text{B}}}^{2}$)]1/2, где NA, μB и k – число Авогадро, магнетон Бора и постоянная Больцмана соответственно.
Синтез комплекса Co(3,6-SQ)2LF (I). К раствору 0.136 г (0.1 ммоль) трис-(3,6-ди-трет-бутил-о-бензосемихинолята)кобальта(III) в 10 мл толуола приливали раствор 0.060 г (0.18 ммоль) 1-(п-фторофенил)-3,5-дифенилформазана в 5 мл толуола. Реакционную смесь перемешивали при 50°С в течение суток. Цвет раствора становился темно-синим. После этого растворитель удаляли полностью, а оставшийся темный осадок перекристаллизовывали из диэтилового эфира при 4°С. В результате образуются сине-фиолетовые кристаллы в виде ромбов, которые отфильтровывали и сушили в вакууме (выход 85%).
ИК-спектр (ν, см–1): 1597 сл, 1551 сл, 1500 с, 1428 с, 1414 с, 1356 ср, 1343 ср, 1331 ср, 1308 с, 1279 с, 1233 ср, 1198 с, 1150 ср, 1026 сл, 993 ср, 976 ср, 957 ср, 916 сл, 831 с, 806 сл, 756 с, 721 ср, 692 с, 679 ср, 652 с, 598 сл, 563 ср, 528 с, 484 сл.
Синтез комплексов Co(3,6-SQ)2LCl (II), Co(3,6-SQ)2LBr (III) и Co(3,6-SQ)2LI (IV) выполняли из карбонила кобальта по методике, описанной в [29].
II: мелкие темно-синие призматические кристаллы из смеси гексан–CH2Cl2 (5 : 1) (выход 81%)
.ИК-спектр (ν, см–1): 1657 сл, 1601 ср, 1551 ср, 1480 ср, 1424 ср, 1414 ср, 1366 ср, 1358 ср, 1343 ср, 1329 ср, 1306 с, 1280 с, 1196 с, 1090 ср, 1026 сл, 1015 сл, 991 сл, 976 ср, 957 ср, 914 сл, 829 с, 762 с, 721 с, 694 с, 677 ср, 652 ср, 636 сл, 567 сл, 547 сл, 505 сл, 482 сл.
III: мелкие темно-синие призматические кристаллы из пентана (выход 83%).
ИК-спектр (ν, см–1): 1601 сл, 1551 сл, 1424 с, 1358 ср, 1345 ср, 1331 ср, 1308 с, 1281 с, 1194 с, 1071 сл, 1026 сл, 1013 сл, 991 сл, 976 ср, 959 ср, 914 сл, 897 сл, 827 с, 810 сл, 760 с, 721 сл, 694 с, 675 сл, 652 ср, 632 сл, 565 сл, 544 сл, 503 сл, 484 ср.
IV: сине-фиолетовые игольчатые кристаллы из смеси гексан–пентан (1 : 1) (выход 85%).
ИК-спектр (ν, см–1): 1601 ср, 1565 сл, 1551 с, 1424 с, 1358 с, 1348 с, 1331 с, 1279 с, 1198 с, 1171 сл, 1155 сл, 1101 сл, 1078 сл, 1055 сл, 1028 ср, 1007 с, 991 с, 976 с, 957 с, 914 ср, 897 сл, 827 с, 810 ср, 760 с, 719 ср, 694 с, 683 с, 673 ср, 652 с, 632 сл, 574 сл, 563 сл, 542 ср, 528 сл, 503 ср, 482 ср.
Синтез комплекса Co(3,6-SQ)2LMe (V) выполняли по методике, аналогичной для комплекса I.
V: мелкие темно-фиолетовые кубические кристаллы из смеси толуол–гексан (1 : 1) (выход 86%).
ИК-спектр (ν, см–1): 1680 сл, 1657 ср, 1603 сл, 1551 ср, 1503 сл, 1424 с, 1358 с, 1345 с, 1329 ср, 1306 с, 1280 с, 1269 с, 1198 с, 1169 сл, 1111 сл, 1080 сл, 1072 сл, 1026 сл, 993 ср, 978 ср, 959 с, 939 сл, 918 сл, 827 с, 760 с, 721 сл, 695 с, 679 с, 652 с, 563 сл, 530 сл, 503 сл, 480 ср.
РСА. Сбор дифракционных данных кристаллов соединений I и IV проведен на монокристальном рентгеновском дифрактометре Oxford Xcalibur Eos (ω-сканирование, графитовый монохроматор, MoKα-излучение, λ = 0.71073 Å). Экспериментальные наборы интенсивностей для I и IV интегрированы с помощью программы CrysAlisPro [35]. Учет поглощения проведен с использованием алгоритма SCALE3 ABSPACK [35]. Структуры I и IV решены по программе SHELXT [36] и уточнены полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов с помощью программы SHELXL [37]. Все водородные атомы в структурах I и IV, за исключением H(1SA) и H(1SB) в комплексе IV, помещены в геометрически рассчитанные положения и уточнены изотропно. В свою очередь, атомы H(1SA) и H(1SB) в комплексе IV локализованы объективно из разностного Фурье-синтеза и уточнены в изотропном приближении. В кристалле IV на каждую молекулу комплекса приходится 0.2 молекулы воды. Для уточнения разупорядоченных фрагментов в комплексах I и IV использовались инструкции EADP, ISOR, DFIX.
Сбор дифракционных данных кристаллов соединения II проведен на дифрактометре Bruker D8 Venture Photon в режиме φ и ω-сканирования в ЦКП ФМИ ИОНХ РАН при температуре 150 K (λ = 0.71073 Å, микрофокусный источник рентгеновского излучения Incoatec IµS 3.0). Первичное индицирование, уточнение параметров элементарной ячейки и интегрирование отражений произведен с использованием пакета программ Bruker APEX3 [38]. Поправка на поглощение интенсивности отражений произведена по программе SADABS [38]. Структура расшифрована прямыми методами и уточнена полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов, кроме сильно разупорядоченной части молекулы соединения II, атомы углерода которой уточнены в изотропном приближении. Для создания адекватной модели разупорядоченности в уточнении структуры II применены инструкции EADP, FLAT, SADI. Атомы водорода помещены в рассчитанные положения и уточнены в модели “наездника” с Uизо(H) = 1.5Uэкв(C) для атомов водорода метильных групп и 1.2Uэкв(C) для остальных атомов водорода. Расчеты выполнены с помощью программного пакета SHELXTL [37] в среде визуализации и обработки структурных данных OLEX2 [39].
Кристаллографические данные и параметры уточнения структур I, II и IV приведены в табл. 1, значения избранных длин связей – в табл. 2. Структурные данные депонированы в Кембриджском центре кристаллографических данных (CCDC № 2060727 (I), 2052592 (II), и 2060728 (IV); https://www.ccdc.cam.ac.uk/structures/).
Таблица 1.
Кристаллографические данные и параметры уточнения структур I, II и IV
| Комплекс | I | II | IV |
|---|---|---|---|
| T, К | 100(2) | 150(2) | 100(2) |
| Кристаллическая система | Триклинная | Триклинная | Триклинная |
| Пр. гр. | P1 | P1 | P1 |
| а, Å | 11.40191(19) | 11.2996(10) | 11.49220(10) |
| b, Å | 12.3023(2) | 14.3044(13) | 12.31140(10) |
| c, Å | 16.3713(3) | 14.7495(13) | 17.3415(2) |
| α, град | 80.5542(15) | 80.230(4) | 107.5340(10) |
| β, град | 79.0584(14) | 76.916(3) | 103.2140(10) |
| γ, град | 72.9732(16) | 71.776(3) | 97.4910(10) |
| V, Å3 | 2141.38(7) | 2193.0(3) | 2224.54(4) |
| Z | 2 | 2 | 2 |
| ρ(выч.), мг/м3 | 1.267 | 1.262 | 1.386 |
| µ, мм–1 | 0.452 | 0.499 | 1.126 |
| θ, град | 2.938–28.000 | 2.083–27.157 | 2.968–27.999 |
| Число наблюдаемых отражений | 39 595 | 22 028 | 40 151 |
| Число независимых отражений | 10 326 | 9623 | 10 706 |
| Rint | 0.0435 | 0.0452 | 0.0395 |
| S(F 2) | 1.026 | 1.040 | 1.044 |
| R1, wR2 (I > 2σ(I)) | 0.0403, 0.0930 | 0.0589, 0.1122 | 0.0339, 0.0851 |
| R1, wR2 (по всем параметрам) | 0.0579, 0.0994 | 0.0924, 0.1239 | 0.0454, 0.0897 |
| Δρmax/Δρmin, e Å–3 | 0.354/–0.391 | 0.469/–0.504 | 1.128/–0.566 |
Таблица 2.
Избранные длины связей (Å) и углы (град) в комплексах I, II и IV
| Связь | I | II | IV |
|---|---|---|---|
| Co(1)–O(1) | 1.8923(11) | 1.8738(19) | 1.8804(14) |
| Co(1)–O(2) | 1.9066(12) | 1.909(2) | 1.9015(15) |
| Co(1)–O(3) | 1.9198(12) | 1.9039(19) | 1.9024(15) |
| Co(1)–O(4) | 1.9024(11) | 1.8981(19) | 1.9143(14) |
| Co(1)–N(1) | 1.9021(14) | 1.898(2) | 1.9145(17) |
| Co(1)–N(4) | 1.9084(14) | 1.911(2) | 1.8969(18) |
| O(1)–C(1) | 1.3058(19) | 1.302(3) | 1.323(3) |
| O(2)–C(2) | 1.2958(19) | 1.292(3) | 1.293(3) |
| O(3)–C(15) | 1.2909(19) | 1.293(3) | 1.297(3) |
| O(4)–C(16) | 1.302(2) | 1.298(3) | 1.313(3) |
| N(1)–N(2) | 1.2924(19) | 1.292(3) | 1.296(2) |
| N(2)–C(35) | 1.344(2) | 1.346(3) | 1.345(3) |
| N(3)–C(35) | 1.345(2) | 1.347(3) | 1.352(3) |
| N(3)–N(4) | 1.2895(19) | 1.282(3) | 1.282(2) |
| F(1)–C(32) | 1.333(3) | ||
| Cl(1)–C(32) | 1.733(3) | ||
| I(1)–C(32) | 2.103(2) | ||
| Угол | I | II | IV |
| O(1)Co(1)O(2) | 85.33(5) | 85.48(8) | 85.80(6) |
| O(3)Co(1)O(4) | 84.52(5) | 84.73(8) | 84.88(6) |
| N(1)Co(1)N(4) | 85.69(6) | 85.24(10) | 85.26(8) |
| N(1)Co(1)O(3) | 177.48(6) | 177.52(9) | 175.11(7) |
| O(1)Co(1)O(4) | 171.95(5) | 171.02(9) | 169.73(7) |
| O(2)Co(1)N(4) | 175.15(5) | 173.09(9) | 175.37(7) |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
По реакциям, представленным на схеме 1 , синтезирована серия гетеролигандных шестикоординационных бис-о-семихинон-формазанатных комплексов кобальта(III). Полученные комплексы I–V в кристаллическом виде устойчивы к действию кислорода и влаги воздуха, легко растворимы в большинстве органических растворителей.
Схема 1 .
Состав и строение соединений I–V установлены по данным ИК-спектроскопии и элементного анализа. ИК-спектры полученных соединений характеризуются набором полос, характерных для лигандов, входящих в состав комплексов. Так, в ИК-спектре комплексов I–V, помимо интенсивных полос, обусловленных валентными колебаниями связей С–О о-семихиноновых лигандов (1350–1450 см–1), в области 1610–1540 см–1 наблюдаются полосы, соответствующие валентным колебаниям связей С=N и N=N координированных формазановых лигандов.
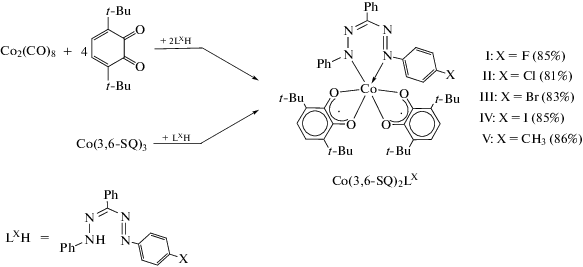
Молекулярное строение комплексов I, II и IV в кристаллическом состоянии установлено с помощью метода РСА. Как показано на рис. 1, молекулярное строение всех трех соединений схоже, окружение центрального атома кобальта – слабо искаженный октаэдр. Геометрические характеристики О,О'-хелатирующих диоксоленовых лигандов типичны для анион-радикальной о-бензосемихиноновой формы: длины связей С–О лежат в интервале 1.291(2)–1.323(3) Å (табл. 2), для связей С–С фенильного кольца наблюдается хиноидный тип искажения [40, 41]. Значения длин связей Со–О в комплексах I, II и IV лежат в интервале 1.8738(19)–1.9198(12) Å, что хорошо соотносится с аналогичными значениями для известных шестикоординационных о-семихиноновых комплексов низкоспинового кобальта(III) (1.8–1.9 Å, [33, 42]) и на ~0.1–0.2 Å короче, чем аналогичные связи в о-семихиноновых комплексах высокоспинового кобальта(II) (2.0–2.1 Å) [42–44].
Рис. 1.
Молекулярное строение комплексов I, II и IV по данным РСА. Метилы трет-бутильных групп и атомы водорода не показаны.
Двугранный угол между плоскостями о-семихиноновых лигандов уменьшается в ряду соединений I, II и IV и составляет 80.47°, 77.91° и 74.24° соответственно. При этом величина аналогичного угла в бис-о-семихиноновом комплексе с незамещенным формазаном составляет 77.90°.
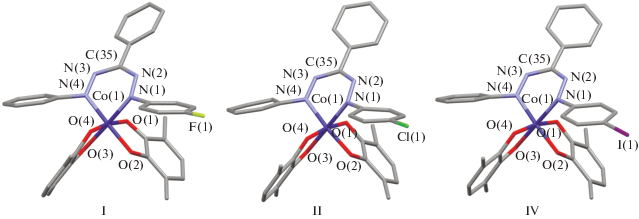
Связи N–N и N–C внутри хелатного цикла формазанатного лиганда делокализованы, что свидетельствует об анионной форме лиганда [29, 45–47]. Значения длин связи N–N лежат в интервале 1.282(3)–1.296(2) Å, а связи N–C – 1.344(2)–1.352(3) Å (табл. 2). Сам хелатный цикл N(1)N(2)C(35)N(3)N(4)Co(1) не плоский и изогнут по линии N(1)…N(4) так же, как и в бис-о-семихиноновом комплексе кобальта с незамещенным 1,3,5-трифенилформазаном [29]. Отметим, что вследствие взаимного отталкивания заместителей угол изгиба металлоцикла в комплексах I, II и IV с 1-(п-X-фенил)-3,5-дифенилформазановыми лигандами на несколько градусов больше, чем в аналогичном комплексе с незамещенным формазаном, и составляет 37.73° для I, 39.88° для II и 39.89° для IV соответственно. Фенильные заместители при атомах N(1) и N(5) формазанового лиганда в I и II повернуты относительно плоскости азогидразонной цепи на угол ~45°. Для соединения IV наблюдается асимметрия в расположении указанных заместителей: так, незамещенное фенильное кольцо при атоме N(4) располагается под углом 46.64° к плоскости формазанатного остова, тогда как фенильное кольцо при атоме N(1) с иодным заместителем в пара-положении повернуто на 33.01°, что может быть связано с упаковкой молекул в кристалле и наличием межмолекулярных взаимодействий между атомами иода соседних молекул комплекса. Соответствующее расстояние I–I составляет 4.334 Å (рис. 2), что лишь незначительно превышает сумму ван-дер-ваальсовых радиусов двух атомов иода (4.2 Å [48]).
Рис. 2.
Фрагмент кристаллической упаковки комплекса IV. Метилы трет-бутильных групп и атомы водорода не показаны.
Таким образом, введение атома галогена в пара-положение фенильного заместителя при атоме N(1) формазанатного лиганда незначительно влияет на молекулярное строение и геометрию образующихся смешанолигандных комплексов.
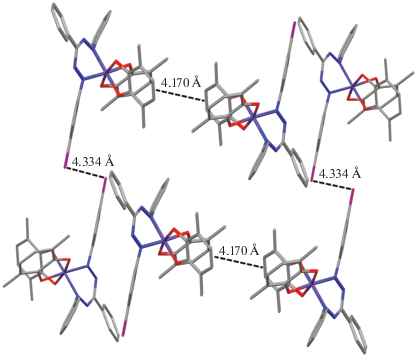
Были исследованы магнитные свойства комплексов I–V в интервале температур 2–300 К. Температурные зависимости эффективного магнитного момента для данных комплексов представлены на рис. 3. Высокотемпературное значение μэфф для комплекса I составляет 2.68 µB (300 К), что незначительно выше чисто спинового значения 2.45 µB, рассчитанного для системы из двух радикальных центров с S = 1/2 для каждого центра. Такое состояние системы возможно в случае комплекса Co(III), связанного с двумя анион-радикальными о-семихиноновыми лигандами и одним формазанат-анионом. С понижением температуры значение магнитного момента сначала плавно убывает в интервале 300–100 К и затем более резко снижается до 0.66 µB при 2 К, что указывает на антиферромагнитный характер обмена между радикальными центрами. Аналогичное поведение наблюдается и для бис-о-семихинонового комплекса кобальта(III) с незамещенным 1,3,5-трифенилформазанатом [29].
Рис. 3.
Температурные зависимости эффективных магнитных моментов комплексов I (⚪), II (◻), III (◆), IV (▼), V (⚫).
Высокотемпературное значение эффективного магнитного момента (300 К) для комплексов II–V также близко к таковому для спиновой системы из двух радикальных центров с S = 1/2. С понижением температуры значение µэфф для данных комплексов плавно убывает в интервале 300–50 К. Такое поведение характерно для бирадикальных систем с антиферромагнитным типом внутримолекулярных обменных взаимодействий. При дальнейшем понижении температуры, в отличие от комплекса I, наблюдается некоторое увеличение µэфф. Так для комплексов II и III небольшой рост эффективного магнитного момента отмечается только при температурах ниже 25 К, а для соединений IV и V рост начинается уже после 50 К. При этом нужно отметить, что максимальный скачок значения μэфф наблюдается для комплекса IV (рис. 3, кривая ▼). Для него μэфф плавно уменьшается с понижением температуры с 2.37 µB при 300 К до 1.31 µB при 50 К, затем его значение увеличивается до 1.9 µB при 25 К, а при дальнейшем охлаждении резко уменьшается до 0.48 µB при 2 К. Такое поведение комплексов при низких температурах, вероятно, может быть связано с ферромагнитным упорядочением спинов радикальных о-семихиноновых лигандов соседних молекул в кристаллической упаковке комплекса. Анализ имеющихся на данный момент структурных данных показывает, что в кристаллах молекулы этих комплексов упакованы в скошенные стопки, при этом парамагнитные о-семихиноновые лиганды из соседних стопок обращены друг к другу и располагаются параллельно (рис. 2). Для комплекса IV c наибольшим скачком магнитного момента наименьшее расстояние между о-семихиноновыми лигандами соседних молекул самое короткое и составляет 4.170 Å, а для комплекса I, где такого скачка вообще не наблюдается, – самое большое 4.661 Å. В комплексе II, где наблюдается незначительный рост магнитного момента при низких температурах, эта величина составляет 4.299 Å, а в ранее опубликованном комплексе с незамещенным 1,3,5-трифенилформазаном [29], где ферромагнитного упорядочения не наблюдается, данное расстояние составляет 4.556 Å.
Таким образом, проведенное исследование показало, что введение заместителя в пара-положение фенильного кольца при атоме N(1) формазанатного лиганда в бис-о-семихинон-формазанатных комплексах кобальта(III) оказывает влияние на кристаллическую упаковку молекул комплекса, что, в свою очередь, сказывается на характере межмолекулярных обменных взаимодействий и магнитном поведение данных комплексов при низких температурах. Более детальное изучение магнитных свойств такого рода комплексов станет предметом дальнейшего исследования.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Pierpont C.G. // Coord. Chem. Rev. 2001. V. 219–221. P. 415.
Khusniyarov M.M., Harms K., Burghaus O. et al. // Dalton Trans. 2008. P. 1355.
Poddel’sky A.I., Cherkasov V.K., Abakumov G.A. // Coord. Chem. Rev. 2009. V. 253. P. 291.
Shultz D.A. // Comments Inorg. Chem. 2010. V. 23. № 1. P. 1.
Kaim W., Beyer K., Filippou V. et al. // Coord. Chem. Rev. 2018. V. 355. P. 173.
Старикова А.А., Минкин В.И. // Успехи химии. 2018. Т. 87. № 11. С. 1049 (Starikova A.A., Minkin V.I. // Russ. Chem. Rev. 2018. V. 87. № 11. P. 1049).
Ершова И.В., Пискунов А.В., Черкасов В.К. // Успехи химии. 2020. Т. 89. № 11. С. 1157 (Ershova I.V., Piskunov A.V., Cherkasov V.K. // Russ. Chem. Rev. 2020. V. 89. № 11. P. 1157).
Protasenko N.A., Poddel’sky A.I. // Theor. Exp. Chem. 2020. V. 56. № 5. P. 338.
Perfetti M., Caneschi A., Sukhikh T.S. et al. // Inorg. Chem. 2020. V. 59. № 22. P. 16591.
Starikova A.A., Chegerev M.G., Starikov A.G. // Chem. Phys. Lett. 2021. V. 762. P. 138128.
Абакумов Г.А., Черкасов В.К., Бубнов М.П. и др. // Докл. РАН. 1993. Т. 328. С. 332.
Sato O., Tao J., Zhang Yu.-Z.H. // Angew. Chem., Int. Ed. 2007. V. 46. P. 2152.
Pierpont C.G. // Coord. Chem. Rev. 2001. V. 216–217. P. 99.
Jung O.-S., Jo D.H., Lee Y.-A. et al. // Angew. Chem., Int. Ed. 1996. V. 35. P. 1694.
Jung O.-S., Lee Y.-A., Park S. H. et al. // Bull. Chem. Soc. Jpn. 2001. V. 74. P. 305.
Attia A.S., Bhattacharya S., Pierpont C.G. // Inorg. Chem. 1995. V. 34. P. 4427.
Imaz I., Maspoch D., Rodriguez-Blanco C. et al. // Angew. Chem., Int. Ed. 2008. V. 47. P. 1857.
Hui L., Young Mee N., In Sung C. et al. // Bull. Chem. Soc. Jpn. 2007. V. 80. P. 916.
Bin-Salamon S., Brewer S.H., Depperman E.C. et al. // Inorg. Chem. 2006. V. 45. P. 4461.
Adams D.M., Dei A., Rheingold A.L. et al. // J. Am. Chem. Soc. 1993. V. 115. P. 8221.
Бубнов М.П., Скородумова Н.А., Богомяков А.С. и др. // Изв. АН Сер. хим. 2011. № 3. С. 440 (Bubnov M.P., Skorodumova N.A., Bogomyakov A.S. et al. // Russ. Chem. Bull. V. 60. P. 449).
Jung O.-S., Jo D.H., Lee Y.-A. et al. // Inorg. Chem. 1998. V. 37. P. 5875.
Kiriya D., Chang H.-C., Nakamura K. et al. // Chem. Mater. 2009. V. 21. P. 1980.
Schmidt R.D., Shultz D.A., Martin J D. et al. // J. Am. Chem. Soc. 2010. V. 132. P. 6261.
Witt A., Heinemann F.W., Sproules S. et al. // Chem. Eur. J. 2014. V. 20. P. 11149.
Chang M.-C., Dann T., Day D.P. et al. // Angew. Chem., Int. Ed. 2014. V. 53. P. 4118.
Maar R.R., Barbon S.M., Sharma N. et al. // Chem. Eur. J. 2015. V. 21. P. 15589.
Gilroy J.B., Otten E. // Chem. Soc. Rev. 2020. V. 49. P. 85.
Protasenko N.A., Poddel’sky A.I., Bogomyakov A.S. et al. // Inorg. Chem. 2015. V. 54. P. 6078.
Protasenko N.A., Poddel’sky A.I., Bogomyakov A.S. et al. // Inorg. Chim. Acta. 2019. V. 489. P. 1.
Белостоцкая И.С., Комиссарова Н.Л., Джуарян З.В. и др. // Изв. АН СССР Сер. хим. 1972. № 7. С. 1594.
Ashley J.N., Davis B.M., Nineham A.W. et al. // J. Chem. Soc. 1953. P. 3881.
Lange C.W., Couklin B.J., Pierpont C.G. // Inorg. Chem. 1994. V. 33. P. 1276.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 543 с. (Gordon A.J., Ford R.A. The Chemist’s Companion. N.Y.: Wiley Intersci. Publ., 1972. 537 p.).
Rigaku Oxford Diffraction. CrysAlis Pro software system. Version 1.171.37.35. Wroclaw (Poland): Rigaku Corporation, 2014.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
APEX3. SAINT and SADABS. Madison (WI, USA): Bruker AXS Inc., 2016.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Brown S.N. // Inorg. Chem. 2012. V. 51. № 3. P. 1251.
Pavlova N.A., Poddel’sky A.I., Bogomyakov A.S. et al. // Inorg. Chem. Commun. 2011. V. 14. № 10. P. 1661.
Dai J., Kanegawa S., Li Z., Kang S., Sato O. // Eur. J. Inorg. Chem. 2013. P. 4150.
Protasenko N.A., Poddel’sky A.I., Bogomyakov A.S. et al. // Polyhedron. 2013. V. 49. P. 239.
Zolotukhin A.A., Bubnov M.P., Arapova A.V. et al. // Inorg. Chem. 2017. V. 56. P. 14751.
Dale D. // J. Chem. Soc. A. 1967. P. 278.
Siedle A.R., Pignolet L.H. // Inorg. Chem. 1980. V. 19. P. 2052.
Gilroy J.B., Patrick B.O., McDonald R. et al. // Inorg. Chem. 2008. V. 47. P. 1287.
Бацанов С.С. // Неорган. материалы. 2001. Т. 37. № 9. С. 1031 (Batsanov S.S. // Inorg. Mater. 2001. V. 37. № 9. P. 871).
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия