Координационная химия, 2021, T. 47, № 11, стр. 679-688
Синтез, молекулярное и кристаллическое строение комплексов 1-(4-метоксифенил)-1,4-дегидро-5H-тетразол-5-тиона и 1-(2-метоксифенил)-1,4-дегидро-5H-тетразол-5-тиона с хлоридом кадмия
Р. К. Аскеров 1, *, В. К. Османов 2, О. Н. Ковалева 2, Е. В. Баранов 3, Г. К. Фукин 3, Д. Г. Фукина 4, А. В. Боряков 4, А. М. Магеррамов 1, А. В. Борисов 2
1 Бакинский государственный университет
Баку, Азербайджан
2 Нижегородский государственный технический университет им. Р.Е. Алексеева
Нижний Новгород, Россия
3 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
4 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: rizvankam@bk.ru
Поступила в редакцию 21.03.2021
После доработки 16.04.2021
Принята к публикации 19.04.2021
Аннотация
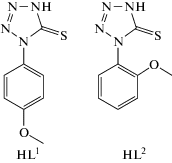
Реакцией 1-(4-метокси-фенил)-1,4-дегидро-5H-тетразол-5-тиона (HL1) и 1-(2-метокси-фенил)-1,4-дегидро-5H-тетразол-5-тиона (HL2) с хлоридом кадмия синтезированы новые комплексные соединения [Cd(μ-L1)2]n (I), [Cd(μ-L2)(μ-Cl)(μ-DMSO)]n (III), [Cd2(μ-L2)(μ-Cl)3(μ-DMSO)DMSO/EtOH]n(IV). Методом РСА определена молекулярная и кристаллическая структура комплексов (CIF files CCDC № 1993455 (I), 1869249 (III), 1993497 (IV)). Комплексы I, III и IV имеют одномерное полимерное строение. В кристаллической ячейке I, III и IV между одномерными полимерными цепочками существуют контакты О···Н, Cl···H и C···S. Комплексы III и IV содержат в своем составе молекулы диметилсульфоксида. Обнаружено, что при прочих равных условиях взаимодействие молекул HL1 или HL2 с хлоридом кадмия в этиловом спирте приводит к образованию комплексов I или II разного состава. Методом РЭМ установлено содержание атома хлора в комплексе II, тогда как в I, согласно данным РСА, хлор отсутствует.
N-замещенные меркаптотетразолы и другие пятичленные гетероциклические тиолы, содержащие атом азота рядом с группой C–SH за счет таутомерии могут существовать как в тионной, так и в тиольной формах [1–4]. Однако считается, что более устойчивой для меркаптотетразолов и других подобных гетероциклических соединений является тионная форма [1]. Кроме того, в присутствии оснований они могут образовывать тиолят-анионы. Обладая несколькими электронодонорными центрами, такие формы реагентов могут быть использованы в качестве полидентатных лигандов в реакциях комплексообразования с различными металлами для получения разнообразных комплексов и супрамолекулярных структур [5–13]. Формы N-замещенных меркаптотетразолов и способы их координации с атомами металлов (A–D) приведены на схеме 1 .
Ранее были изучены реакции 1-фенил-1,4-дегидро-5H-тетразол-5-тиона и 1-(4-фторфенил)-1,4-дегидро-5H-тетразол-5-тиона с хлоридом кадмия и методом РСА установлены структуры полученных комплексов [2, 5]. Оба комплекса являются полимерными и имеют цепочечное строение. В [3] представлена структура продукта реакции 1‑(2-метоксифенил)-1H-тетразол-5-тиолята натрия с хлоридом кадмия.
В настоящей работе, являющейся продолжением наших исследований [2, 3], синтезированы комплексы хлорида кадмия(II) с 1-(4-метоксифенил)-1,4-дегидро-5H-тетразол-5-тионом (HL1) и 1-(2-метоксифенил)-1,4-дегидро-5H-тетразол-5-тионом (HL2) (схема 2 ) – [Cd(μ-L1)2]n (I), [Cd(μ-L2)(μ-Cl)(μ-DMSO)]n (III), [Cd2(μ-L2)(μ-Cl)3(μ-DMSO)DMSO/EtOH]n(IV) – при различных условиях и изучено их строение методом РСА.
Схема 1 .
Схема 2 .
Изучить методом РСА строение комплекса II нам не удалось, однако с помощью метода растровой электронной микроскопии (РЭМ) с применением рентгеновского микроанализа было установлено, что в комплексе II содержатся атомы хлора в соотношении с атомами кадмия и серы Cl : S : Cd = = 1 : 1 : 1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные реагенты NaN3, CdCl2 (квалификации не ниже “х. ч.”), п-метоксифенилизотиоцианат (Acros Organics, Бельгия) использовали без дополнительной очистки. Тион HL2 получали по методике, приведенной в [3].
Синтез HL1 выполняли по методике, аналогичной для HL2. Выход (47%), белые кристаллы. Тпл = = 154–155°С, Тразл =160–1161°С. Спектр 1H ЯМР (DMSO-d6; 500 MГц; 298 K; δ, м.д.): 7.70 (м., 2Н, Ph), 7.12 (м., 2Н, Ph), 3.82 (c., 3H, OCH3).
Синтез комплекса I. К раствору 0.416 г (2 ммоль) тиона НL1 в 25 мл кипящего абсолютного этанола прибавляли раствор 0.184 г (1 ммоль) безводного CdCl2 в 15 мл абсолютного этанола. Реакционную смесь кипятили 5 ч и охлаждали до 20°С. Выпавший осадок отфильтровывали, промывали 50 мл этанола и сушили при 353 К. Вещество для РСА перекристаллизовывали из этанола. Выход I 0.205 г (39.7%), белый порошок. Тпл = 238–240°С (с разл.). Спектр ЯМР 1H (DMSO-d6; 500 MГц; 298 K; δ, м.д.): 7.63 (д., 2Н, J = 8.0 Гц, Ph), 7.08 (д., 2Н, J = = 8.0 Гц, Ph), 3.81 (c., 3H, OCH3).
Синтез комплекса II. К раствору 0.832 г (4 ммоль) тиона HL2 в 50 мл кипящего абсолютного этанола прибавляли раствор 0.368 г (2 ммоль) безводного CdCl2 в 25 мл абсолютного этанола. Реакционную смесь кипятили 5 ч и охлаждали до 20°С. Выпавший осадок отфильтровывали, промывали 50 мл этанола и сушили при 353 К. Выход II 0.685 г, белый порошок. Тпл = 224–225°С (с разл.). Спектр ЯМР 1H (DMSO-d6; 500 MГц; 298 K; δ, м.д.): 7.52 (м., 1Н, Ph), 7.34 (д.д., 1Н, J = 8.0, 1.6 Гц, Ph), 7.24 (д., 1Н, J = 8.5 Гц, Ph), 7.08 (м., 1Н, Ph), 3.81 (c., 3H, OCH3). Найдено, %: C 28.40; Н 2.87; N 15.42.
Синтез комплекса III. Соединение получено кристаллизацией комплекса II из ДМСО. Белые кристаллы. Тпл > 190°С (с разл.). ЯМР 1H (DMSO-d6; 500 MГц; 298 K; δ, м.д.): 7.52 (м., 1Н, Ph), 7.34 (д.д., 1Н, J = 8.0, 1.6 Гц, Ph), 7.24 (д., 1Н, J = 8.5 Гц, Ph), 7.08 (м., 1Н, Ph), 3.81 (c., 3H, OCH3).
Синтез комплекса IV. К раствору 0.416 г (2 ммоль) тиона HL2 в смеси 27 мл абсолютного этанола и 3.85 мл ДМСО при 20°С прибавляли раствор 0.184 г (1 ммоль) безводного CdCl2 в 15 мл абсолютного этанола. Реакционную смесь выдерживали 168 ч при 20°С, выпавший осадок отфильтровывали, промывали 50 мл этанола и сушили при 353 К. Вещество для РСА использовали без дополнительной перекристаллизации. Выход IV 0.158 г (23.8%), белый порошок. Тпл > 200°С (с разл.). Спектр ЯМР 1H (DMSO-d6; 500 MГц; 298 K; δ, м.д.): 7.52 (м., 1Н, Ph), 7.34 (д.д., 1Н, J = 8.0, 1.6 Гц, Ph), 7.24 (д., 1Н, J = 8.5 Гц, Ph), 7.08 (м., 1Н, Ph), 3.81 (c., 3H, OCH3).
Температуры плавления (разложения) определяли в вакуумированных запаянных капиллярах (приводятся без поправки). Спектры ЯМР 1H записывали на спектрометре Agilent DD2 400 с рабочей частотой 400 МГц в режиме внутренней стабилизации полярно-резонансной линии 2Н в CdCl3 при 20°С. Химические сдвиги указаны в миллионных долях (м.д.) относительно тетраметилсилана в качестве внутреннего стандарта. Микрофотографии образцов соединения II получали методом РЭМ на микроскопе JSM-IT300LV (JEOL) с диаметром пучка электронов около 5 нм и током зонда ниже 0.5 нА. Исследование топографии поверхности образцов проводили с использованием низкоэнергетичных вторичных электронов и отраженных электронов. Исследование элементного состава образцов проводили с помощью рентгеновского микрозондового анализа (РМА) с детектором X-MaxN 20 (Oxford Instruments). Рентгенофазовый анализ (РФА) соединения II (порошок) и CdCl2 проводили на дифрактометре Shimadzu XRD-6100 с использованием Ni-фильтра (CuKα, λ = 1.5418 Å) в интервале 2θ 10°–60° со скоростью 1°/мин. Элементный анализ выполняли на приборе vario EL cybe.
РСА соединений I и III получены на дифрактометре Bruker Smart Apex, для соединения IV – на дифрактометре Bruker D8 QUEST (ω-сканирование, MoKα-излучение, λ = 0.71073 Å). Экспериментальные наборы интенсивностей отражений собраны и интегрированы с помощью программ SMART [14] и SAINT [15] соответственно. Структуры решены прямым методом и уточнены полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении для неводородных атомов. Обнаружено, что в кристалле соединения IV молекула ДМСО разупорядочена с молекулой этанола в соотношении заселенностей 0.78 : 0.22 соответственно. Атом водорода сольватной молекулы этанола в соединении IV локализован из разностного синтеза электронной плотности и уточнен в изотропном приближении. Координаты остальных атомов водорода в I, III и IV рассчитаны из геометрических соображений и уточнены с фиксированными позиционными (модель “наездника”) и тепловыми параметрами (1.5Uизо(C) для метильных групп и Uизо(H) = 1.2Uизо(C) для всех остальных групп). Уточнение структуры и учет поглощения проведены с использованием программных пакетов SHELXTL [16] и SADABS [17]. Кристаллографические данные и параметры рентгеноструктурных экспериментов соединений I, III и IV приведены в табл. 1, основные длины связей и валентных углов – в табл. 2.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для соединений I, III и IV
| Параметры | Значение | ||
|---|---|---|---|
| I | III | IV | |
| Брутто-формула | C16H14N8O2S2Cd | C10H13N4O2S2ClCd | C12H19N4O3S2.22Cl3Cd2 |
| М | 526.87 | 433.21 | 669.47 |
| Температура, K | 296(2) | 296(2) | 100(2) |
| Размеры кристалла, мм3 | 0.270 × 0.173 × 0.095 | 0.130 × 0.100 × 0.070 | 0.200 × 0.080 × 0.080 |
| Сингония | Моноклинная | Моноклинная | Моноклинная |
| Пр. гр. | C2/c | P21 | P21/n |
| a, Å | 23.549(5) | 8.4924(4) | 12.3628(4) |
| b, Å | 11.342(3) | 7.5183(3) | 12.9467(5) |
| c, Å | 7.5391(18) | 11.9066(5) | 14.2464(5) |
| α, град | 90 | 90 | 90 |
| β, град | 106.592(4) | 90.2446(7) | 105.2140(10) |
| γ, град | 90 | 90 | 90 |
| V, Å3 | 1929.8(8) | 760.21(6) | 2200.32(14) |
| Z | 4 | 2 | 4 |
| ρ(выч.), г/см3 | 1.813 | 1.893 | 2.021 |
| µ, мм–1 | 1.380 | 1.891 | 2.527 |
| F(000) | 1048 | 428 | 1302 |
| Область сбора данных по θ, град | 28 | 30 | 30 |
| Измерено отражений | 9176 | 8627 | 35 817 |
| Независимых отражений | 2313 | 4230 | 6433 |
| Число уточняемых параметров | 132 | 184 | 281 |
| R1 (I > 2σ(I)) | 0.0419 | 0.0227 | 0.0234 |
| wR2 (все данные) | 0.0814 | 0.0409 | 0.0494 |
| GOОF | 1.001 | 1.001 | 1.036 |
| Tmin; Tmax | 0.6061; 0.7461 | 0.6837; 0.7461 | 0.652; 0.802 |
| Остаточная электронная плотность (ρmin/ρmax), e Å–3 | –0.747/1.268 | –0.371/0.491 | –0.670/0.788 |
Таблица 2.
Основные длины связей (d) и валентные (ω) углы в соединениях I, III и IV
| I | |||
|---|---|---|---|
| Связь | d, Å | Связь | d, Å |
| Cd(1)–N(4) | 2.233(3) | S(1)–C(1) | 1.725(4) |
| Cd(1)–S(1A) | 2.506(11) | N(4)–C(1) | 1.336(5) |
| Угол | ω, град | Угол | ω, град |
| N(4)Cd(1)N(4)' | 97.75(16) | N(4)Cd(1)S(1B)' | 117.19(9) |
| N(4)Cd(1)S(1A) | 112.86(9) | S(1A)Cd(1)S(1B)' | 100.01(5) |
| III | |||
| Связь | d, Å | Связь | d, Å |
| Cd(1)–S(1C) | 2.574(9) | Cd(1)–Cl(1C) | 2.718(9) |
| Cd(1)–N(4) | 2.34(2) | Cd(1)–O(2) | 2.369(3) |
| Cd(1)–Cl(1) | 2.604(9) | Cd(1)–O(2С) | 2.413(3) |
| Угол | ω, град | Угол | ω, град |
| N(4)Cd(1)O(2) | 90.07(9) | O(2С)Cd(1)Cl(1С) | 80.46(6) |
| N(4)Cd(1)O(2С) | 87.56(9) | S(1С)Cd(1)Cl(1) | 102.23(3) |
| O(2)Cd(1)O(2С) | 173.99(5) | N(4)Cd(1)Cl(1С) | 94.96(7) |
| N(4)Cd(1)S(1С) | 159.40(7) | O(2)Cd(1)Cl(1С) | 94.24(6) |
| O(2)Cd(1)S(1С) | 99.79(6) | O(2С)Cd(1)Cl(1) | 106.11(6) |
| O(2С)Cd(1)S(1С) | 84.21(6) | S(1С)Cd(1)Cl(1С) | 83.85(3) |
| N(4)Cd(1)Cl(1) | 80.34(7) | Cl(1)Cd(1)Cl(1С) | 171.61(3) |
| O(2)Cd(1)Cl(1) | 78.90(6) | ||
| IV | |||
| Связь | d, Å | Связь | d, Å |
| Cd(1)–O(2) | 2.373(15) | Cd(2)–Cl(1) | 2.560(6) |
| Cd(1)–N(3A) | 2.459(18) | Cd(2)–O(3) | 2.323(9) |
| Cd(1)–S(1) | 2.569(6) | Cd(2)–O(2) | 2.334(15) |
| Cd(1)–Cl(1) | 2.579(6) | Cd(2)–Cl(2) | 2.562(6) |
| Cd(1)–Cl(2A) | 2.598(5) | Cd(2)–Cl(3) | 2.564(6) |
| Cd(1)–Cl(3A) | 2.646(6) | Cd(2)–N(4) | 2.398(17) |
| Угол | ω, град | Угол | ω, град |
| O(2)Cd(1)N(3A) | 78.89(6) | O(3)Cd(2)O(2) | 82.3(3) |
| O(2)Cd(1)S(1) | 100.22(4) | O(3)Cd(2)N(4) | 164.7(2) |
| N(3A)Cd(1)S(1) | 175.49(5) | O(2)Cd(2)N(4) | 88.66(6) |
| O(2)Cd(1)Cl(1) | 81.76(4) | O(2)Cd(2)Cl(1) | 82.92(4) |
| N(3A)Cd(1)Cl(1) | 86.12(4) | N(4)Cd(2)Cl(1) | 88.53(4) |
| S(1)Cd(1)Cl(1) | 98.156(19) | O(3)Cd(2)Cl(2) | 83.3(3) |
| O(2)Cd(1)Cl(2A) | 159.81(4) | O(2)Cd(2)Cl(2) | 91.61(4) |
| N(3A)Cd(1)Cl(2A) | 81.34(4) | N(4)Cd(2)Cl(2) | 84.67(4) |
| S(1)Cd(1)Cl(2A) | 99.81(2) | Cl(1)Cd(2)Cl(2) | 171.38(19) |
| Cl(1)Cd(1)Cl(2A) | 92.87(2) | O(3)Cd(2)Cl(3) | 98.1(3) |
| O(2)Cd(1)Cl(3A) | 96.23(4) | O(2)Cd(2)Cl(3) | 179.45(4) |
| N(3A)Cd(1)Cl(3A) | 85.58(4) | N(4)Cd(2)Cl(3) | 90.97(5) |
| S(1)Cd(1)Cl(3A) | 90.13(2) | Cl(1)Cd(2)Cl(3) | 96.663(19) |
| Cl(1)Cd(1)Cl(3A) | 171.69(2) | Cl(2)Cd(2)Cl(3) | 88.759(19) |
| Cl(2A)Cd(1)Cl(3A) | 86.28(2) | ||
Структуры депонированы в Кембриджском банке структурных данных (CCDC № 1993455 (I), 1869249 (III), 1993497 (IV); https://www.ccdc.cam. ac.uk/structures/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Раннее было показано, что N-замещенные меркаптотетразолы с хлоридом кадмия образуют различные одномерные комплексы цепочечного строения [2–4].
В данной работе мы получили четыре новых комплекса I–IV при взаимодействии HL1 или HL2 с хлоридом кадмия. Строение полученных соединений I, III, IV установлено методом РСА.
В кристалле соединение I представляет собой одномерный полимерный комплекс состава [Cd(μ-L1)2]n (рис. 1а), идентичный по строению комплексам, полученным в [2, 5]. Структурообразующим звеном полимерного комплекса является комплекс кадмия Cd(L1)2 с двумя симметричным тионовыми лигандами L1 (рис. 1б), которые связаны между собой поворотной осью С2, проходящей через атом Cd(1). Полимерная цепочка I формируется синдиотактическим чередованием кадмиевых комплексов Cd(L1)2 Cd(1A), Cd(1), Cd(1B), Cd(1D) и т.д. вдоль кристаллографической оси c. Координационное окружение катиона кадмия Cd(1) представляет собой искаженный тетраэдр, в вершинах которого расположены два атома азота N(4), N(4)' двух симметричных лигандов L1 и два атома серы S(1A), S(1B)' от двух соседних комплексов Cd(L1)2 (A и B) в цепочке. Таким образом, мостиковый лиганд L1 в полимерной цепочке координируется бидентатно атомами N(4) и S(1) на двух соседних атомах кадмия. Расстояния Cd–S и Cd–N (2.506(11) и 2.233(3) Å соответственно) близки к аналогичным длинам связей в ранее опубликованных комплексах (2.497(11)–2.503(23) Å и 2.228(4)–2.245(70) Å) [2–4]. Углы SCdS и NCdN в I равны 100.01(5)° и 97.75(16)° соответственно.
Рис. 1.
Фрагмент 1D-цепочки полимерного комплекса I (атомы водорода не показаны, тепловые эллипсоиды приведены с 30%-ной вероятностью) (а); фрагмент каркаса одномерной цепи комплекса I в конформации “кресла” (б); фрагмент кристаллической упаковки комплекса I в проекции a0c (пунктирными линиями указаны контакты О···Н, атомы водорода, не участвующие в водородных контактах, удалены) (в).

Двугранный угол между плоскостями тетразольного и фенильного циклов в I составляет 50.14(16)°. 1D-цепочка комплекса I содержит восьмичленный цикл {–S–C=N→Cd–S–C=N→Cd} в конформации “кресло” (рис. 1в). Расстояние между атомами металлов Cd···Cd в I равно 4.196(8) Å. Метильная группа в п-метоксифенильном фрагменте в соединении I находится в плоскости фенильного цикла (среднеквадратичное значение (rms) = 0.0173 Å). Торсионный угол MeOCPhCPh составляет –2.4(6)°. Одномерные цепочки комплекса I в кристалле расположены вдоль оси с.
Полимерные цепочки I, параллельные оси с, укладываются ровными без сдвигов рядами вдоль оси а (рис. 1б). Между соседними рядами полимерных цепочек наблюдаются контакты O···H (расстояние О(1)···H(3A) равно 2.656(4) Å) [18, 19]).
В отличие от комплекса I нам не удалось установить методом РСА строение соединения II – продукта реакции HL2 с хлоридом кадмия. Поэтому для установления элементного состава был проведен анализ соединения II методом РЭМ с применением рентгеновского микроанализа. Оказалось, что в отличие от комплекса I и комплексов, полученных в [2, 5], соединение II содержит в своем составе атомы хлора. Исследование показало, что полученный порошок представляет собой частицы размером около 200 нм, которого недостаточно для проведения РСА, однако на картах распределения элементов видно, что элементы S, Cl и Cd расположены по образцу равномерно. Кроме того, исследование индивидуальных частиц показывает, что их состав совпадает между собой.
В табл. 3 представлены результаты определения состава соединения II без учета углерода. Показано, что соотношение атомов хлора, кадмия и серы составляет примерно Cl : S : Cd = 1 : 1 : 1, погрешность измерения 0.1 ат. %.
Таблица 3.
Результаты исследования состава соединение II методом РЭМ
| Элемент | S, ат. % | Cl, ат. % | Cd, ат. % |
|---|---|---|---|
| Усреднение | 31.98 | 33.14 | 34.88 |
| Стандартное отклонение | 0.23 | 0.12 | 0.3 |
| Нормировка на Cd | 0.92 | 0.95 | 1 |
Методом РФА примесей хлорида кадмия в соединении II (порошок) не обнаружено (рис. 2). Отсутствие на рентгенограмме рефлексов, отвечающих хлориду кадмия, а также однородность элементного состава свидетельствуют о том, что полученная фаза соединения II индивидуальна. В спектре ЯМР соединения II отсутствуют сигналы исходного лиганда HL2, что также говорит о том, что вещество II – индивидуальное соединение.
Результаты РСА комплекса III, полученного перекристаллизацией соединения II в диметилсульфоксиде, согласуются с результатами анализа РЭМ комплекса II. Комплекс III также содержит атомы хлора, кадмия и серы в соотношении 1 : 1 : 1. Кроме того, методом РСА было установлено, что комплекс III включает в себя молекулы ДМСО.
Соединение III имеет одномерное цепочечное строение состава [Cd(μ-L2)(μ-Cl)(μ-DMSO)]n. Координационное окружение катиона кадмия представляет собой искаженный октаэдр, в основании которого расположены два атома O(2) и O(2C) двух молекул ДМСО и два атома хлора Cl(1), Cl(1C). Аксиальные позиции занимают атомы N(4) и S(1C) двух лигандов L2. Угол N(4)Cd(1)S(1С) равен 159.39(7)°. Расстояния Cd(1)–S(1С) и Cd(1)–N(4) имеют значения 2.574(9) и 2.34(2) Å соответственно. Сумма валентных углов между экваториальными заместителями составляет 360°. Расстояния Cd(1)–Cl(1, 1С) и Cd(1)–O(2, 2С) равны 2.604(9), 2.718(9) и 2.369(3), 2.413(3) Å соответственно.
Двугранный угол между плоскостями тетразольного и фенильного циклов в III составляет 84.93(14)°. Метильная группа в o-метоксифенильном фрагменте в III находится в плоскости фенильного кольца (rms = 0.04 Å). Торсионный угол MeOCPhCPh равен 4.3(6)° (табл. 2).
Молекулы лиганда L2 в комплексе III проявляют бидентатные свойства, располагаясь поочередно сверху и снизу вдоль одномерной цепи, образуя мостиковые связи между двумя соседними атомами металла Cd (рис. 3а).
Рис. 3.
Фрагмент одномерного полимерного комплекса III (aтомы водорода не показаны) (a); фрагмент каркаса одномерной цепи комплекса III в конформации “кресла” (б); фрагмент кристаллической упаковки комплекса III на проекции a0c (пунктирными линиями указаны контакты Cl···H; атомы водорода, не участвующие в водородных контактах, удалены) (в).

Повторяющееся звено каркаса одномерной цепочки комплекса III находится в конформации “кресло” (рис. 3б). Атомы кадмия Cd(1A) и Cd(1C) выходят из средней плоскости (Cl(1)O(2)Сd(1)- Cl(1C)O(2C) (rms = 0.0352 Å)) на 0.909 и 0.738 Å соответственно. Двугранные углы между плоскостями Cd(1A)Cl(1)O(2) и Cl(1)O(2)Cd(1), Cd(1)O(2C)-Cl(1C) и O(2C)Cl(1C)Cd(1C) одинаковы 25.48(8)°. Расстояние между атомами кадмия в цепи III равно 3.77(5) Å.
В кристаллической упаковке одномерные цепочки комплекса III расположены вдоль оси b. Между соседними одномерными цепочками III наблюдаются Cl···H контакты (расстояние Cl(1)···H(9A) 2.866(11) Å и находится в интервале между сокращенным и ван-дер-ваальсовым взаимодействиями (между 2.67 и 2.97 Å [14]) (рис. 3в).
В отличие от III соединение IV было получено при взаимодействии HL2 с хлоридом кадмия в смеси этанол : диметилсульфоксид в соотношении 9 : 1 при длительном выдерживании при 20°С. Комплекс IV, так же как III, содержит молекулы ДМСО и атомы хлора.
Соединение IV кристаллизуется в моноклинной сингонии, в пространственной группе P21/n и имеет одномерное цепочечное строение состава [Cd2(μ-L2)(μ-Cl)3(μ-DMSO)DMSO/EtOH]n. Координационный полиэдр атома кадмия – искаженный октаэдр, причем комплекс IV содержит два различных координационных окружения центральных атомов Cd2+: Cd(1) и Cd(2). В окружении Cd(2) аксиальные позиции занимают атомы N(4) лиганда L2 и О(3) терминальной молекулы ДМСО. Тогда как в окружении Cd(1) в аксиальных позициях расположены атомы S(1) и N(3A) двух лигандов L2. В экваториальных позициях атомов Cd(1) и Cd(2) расположены по три атома хлора – Cl(1, 2A, 3A) и Cl(1–3) соответственно – и атом O(2) мостиковой молекулы ДМСО (рис. 4а).
Рис. 4.
Фрагмент одномерного полимерного комплекса IV (атомы водорода, а также терминальные молекулы EtOH, разупорядоченные с ДМСО, не показаны) (а); фрагмент каркаса одномерной цепи комплекса IV в конформации “ванны” (б); фрагмент кристаллической упаковки комплекса IV на проекции a0с (пунктирными линиями указаны контакты Cl···H, а атомы водорода, не участвующие в водородных контактах, удалены) (в); фрагмент кристаллической упаковки комплекса IV на проекции a0b (пунктирными линиями указаны контакты C···S, атомы водорода не приведены) (г).
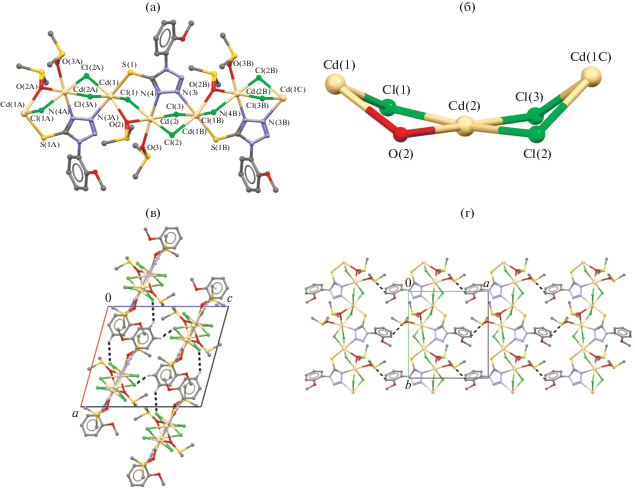
Длины связей Cd(2)–O(3) и Cd(2)–N(4) равны 2.323(9) и 2.3983(17) Å соответственно. Расстояния Cd(1)–S(1) и Cd(1)–N(3A) составляют 2.569(6), 2.459(18) Å и близки к аналогичным расстояниям в комплексе III (Cd(1)–S(1C) и Cd(1)–N(4) 2.574(9) и 2.34(2) Å). Аксиальные углы O(3)Cd(2)N(4) и S(1)Cd(1)N(3A) равны 164.7(2)° и 175.49(5)° соответственно. Расстояния Cd–Cl и Cd–O для Cd(2) и Cd(1) имеют величины 2.560(6)–2.564(6) и 2.334(2) Å, 2.579(7)–2.598(6) Å и 2.373(1) Å соответственно. Суммы валентных углов между экваториальными заместителями для Cd(2) составляет 360°.
Двугранный угол между плоскостями тетразольного и фенильного циклов в IV составляет 60.67(9)°. Метильная группа в o-метоксифенильном фрагменте комплекса IV находится в плоскости фенильного кольца (rms = 0.0027 Å). Торсионный угол MeOCPhCPh равен –1.3(4)° (табл. 2)
Молекулы лиганда L2 в комплексе IV проявляют тридентатные свойства и располагаются, как и в комплексе III, поочередно сверху и снизу вдоль одномерной цепи, образуя мостиковые связи между тремя атомами металла кадмия.
Повторяющееся звено каркаса одномерной цепи в комплексе IV имеет конформацию “ванны” при центральном атоме Cd(2) (рис. 4б). Атомы кадмия Cd(1) и Cd(1С) выходят из средней плоскости (Cl(1)O(2)Сd(2)Cl(3)Cl(2) (rms = 0.0688 Å)) на 0.994 и 1.332 Å. Двугранные углы между плоскостями Cd(1)Cl(1)O(2) и Cl(1)O(2)Cd(2), Cd(2)Cl(2)Cl(3) и Cl(2)Cl(3)Cd(1C) равны 29.90(6)° и 40.76(3)° соответственно. Расстояние между атомами кадмия (Сd(1)···Cd(2) и Сd(2)···Cd(1C)) в цепи IV равно 3.511(4) и 3.569(4) Å соответственно.
В кристалле одномерные цепочки комплек-са IV располагаются вдоль кристаллографической оси b. Между соседними одномерными цепочками IV наблюдаются контакты Cl···H (расстояния Cl(1)···H(4A) и Cl(2)···H(5A) составляют 2.750(6) и 2.742(8) Å и находятся в интервале между сокращенными и ван-дер-ваальсовыми взаимодействиями (между 2.67 и 2.97 Å [14]) (рис. 4в).
При детальном анализе кристаллической упаковки комплекса IV было обнаружено, что между соседними одномерными цепочками вдоль оси b наблюдаются сокращенные невалентные контакты C···S, которые образуют двумерную сетку в плоскости (001) (расстояние C(6)···S(3) составляет 3.106(4) Å, что существенно меньше сокращенных взаимодействий атомов S и C (3.40 Å) [14] (рис. 4г).
Таким образом, методом РСА было установлено, что лиганды HL1 и HL2, обладая несколькими электронодонорными центрами в реакциях комплексообразования с хлоридом кадмия, проявляют би- и тридентатные свойства, образуя одномерные полимерные комплексы I, III и IV. Установлено, что при прочих равных условиях в зависимости от используемых лигандов HL1 или HL2, которые в условиях реакции существуют в тионной форме, в реакциях комплексообразования с хлоридом кадмия в этиловом спирте образуются комплексы I или II различного состава и строения. Методом РЭМ выявлено, что в соединении II содержатся атомы хлора в соотношении 1 : 1 : 1 с атомами кадмия и серы, тогда как в комплексе I, структура которого установлена с помощью РСА, атомы хлора отсутствуют. Результаты РСА комплекса III показали, что наряду с содержанием атомов хлора, в реакциях комплексообразования участвуют молекулы ДМСО. Комплекс IV помимо атомов хлора также содержит молекулы ДМСО. Отсюда следует, что изначальное участие в координации атомов хлора в комплексах II, III и IV обусловлено строением лиганда L2, а именно положением метоксигруппы в фенильном фра-гменте L2, отличного от L1. По-видимому, положение MeO-группы также влияет на комплексообразование с участием молекул ДМСО, что и предопределяет строение одномерных полимерных комплексов III и IV, отличающихся от строения I. Кристаллическая упаковка комплексов I, III и IV формируется за счет контактов О···Н и укороченных Cl···H и C···S.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Штефан Е.Д., Введенский В.Ю. // Успехи химии. 1995. Т. 65. № 4. С. 326.
Аскеров Р.К., Магерамов A.M., Османов В.K. и др. // Журн. структур. химии. 2018. Т. 59. № 7. С. 1717.
Аскеров Р.К., Магерамов A.M., Османов В.K. и др. // Коорд. химия. 2019. Т. 45. № 2. С. 99 (Askerov R.K., Magerramov A.M., Osmanov V.K. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 2. P. 112). https://doi.org/10.1134/S1070328419020039
Han S.Y., Lee J.W., Kim H.-J. et al. // Bull. Korean Chem. Soc. 2012. V. 33. № 1. P. 55.
Song J.-F., Wang J., Li Si-Z., Li Y., Zhou R.-S. // J. Mol. Struct. 2017. V. 1129. P. 1.
Hernandez-Arganis M., Moya-Cabrera M., Jancik V. et al. // Inorganica Chimica Acta. 2018. V. 475. P. 83.
Hernandez-Arganis M., Toscano R.A., Moya-Cabrera M. et al. // Z. Anorg. Allg. Chem. 2004. V. 630. P. 1627.
Muhammad I., Andreas M., Neumann B. et al. // Dalton Trans. 2014. V. 43. № 39. P. 14737.
Li Y., Wang C.Q., Bian H.D. // J. Coord. Chem. 2012. V. 65. № 20. P. 3665.
Ilie A., Rat C.I., Scheutzow S. et al. // Inorg. Chem. 2011. V. 50. P. 2675.
Sanina N.A., Kozub G.I., Kondrat’eva T.A. et al. // J. Mol. Struct. 2013. V. 1041. P. 183.
Bharty M.K., Dani R.K., Kushawaha S.K. et al. // Polyhedron. 2015. V. 88. P. 208.
Taheriha M., Ghadermazi M., Amani V. // J. Mol. Struct. 2016. V. 1107. P. 57.
SMART. Bruker Molecular Analysis Research Tool. Version 5.632. Madison (WI, USA): Bruker AXS, 2005.
SAINT. Data Reduction and Correction Program. Version 8.34A. Madison (WI, USA): Bruker AXS, 2014.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Sheldrick G.M. SADABS. Program for Absorption Correction, Göttingen (Germany): Univ. of Göttingen, 1996.
Rowland R.S., Taylor R. // J. Phys. Chem. 1996. V. 100. P. 7384.
Зефиров Ю.В., Зоркий П.М. // Успехи химии. 1995. Т. 64. № 4. С. 446.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия