Координационная химия, 2021, T. 47, № 11, стр. 689-697
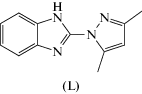
Синтез, магнитные и цитотоксические свойства комплексов галогенидов меди(II) с 2-(3,5-диметилпиразол-1-ил)бензимидазолом
А. Д. Иванова 1, Т. А. Кузьменко 2, А. И. Смоленцев 3, Л. А. Шелудякова 1, Л. С. Клюшова 4, А. С. Богомяков 3, 5, А. Н. Лавров 1, Л. Г. Лавренова 1, *
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
2 Институт физической и органической химии ЮФУ
Ростов-на-Дону, Россия
3 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
4 Институт молекулярной биологии и биофизики, Федеральный исследовательский центр
фундаментальной и трансляционной медицины
Новосибирск, Россия
5 Международный томографический центр СО РАН
Новосибирск, Россия
* E-mail: ludm@niic.nsc.ru
Поступила в редакцию 17.03.2021
После доработки 12.05.2021
Принята к публикации 13.05.2021
Аннотация
Синтезированы новые координационные соединения галогенидов меди(II) с 2-(3,5-диметилпиразол-1-ил)бензимидазолом (L) состава CuLCl2 (I), [CuL2Cl]Cl ⋅ H2O ⋅ C2H5OH (II), CuLBr2 (III). Соединения охарактеризованы с помощью ИК-спектроскопии, РФА и статической магнитной восприимчивости. Методом РСА определена кристаллическая структура II (CIF file CCDC № 2043452), изучены цитотоксические свойства лиганда L и комплексов I и II.
2-(3,5-Диметилпиразол-1-ил)бензимидазол представляет интерес для синтеза и исследования комплексов, обладающих как нетривиальными магнитными свойствами, так и биологической активностью. Производные бензимидазола обладают широким спектром фармакологических свойств. Известно, что комплексообразование биологически важных органических соединений приводит к значительному увеличению их эффективности [1–4]. Комплексы с производными бензимидазола проявляют противоопухолевую активность, а также действуют как противовирусные и противомикробные препараты [3, 5–9]. Комплексы хлорида меди(II) с производными бензимидазола имитируют активность супероксиддисмутазы (SOD), которая является одним из основных ферментов антиоксидантной системы [10, 11]. Металлоферменты, среди которых наибольшей активностью обладает Cu,Zn-SOD, катализируют реакцию дисмутации супероксидных анион-радикалов и уменьшают вероятность образования еще более активного синглетного кислорода. Кроме того, SOD играет важную роль в антивозрастных механизмах [12, 13].
Ранее мы синтезировали и изучили координационные соединения галогенидов 3d-металлов с 4H-1,2,4-триазоло[1,5-a]бензимидазолом, 2-метил-, 3-метил-, 4-метил- и 2,4-диметил-1,2,4-триазоло[1,5-a]бензимидазолами [14–16]. Было показано, что комплексы галогенидов меди(II) с данными лигандами обладают цитотоксическими свойствами. В продолжение этой работы представлялось целесообразным синтезировать комплексы галогенидов меди(II) с 2-(3,5-диметилпиразол-1-ил)бензимидазолом (L) и исследовать их магнитные и биологические свойства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали CuCl2 ⋅ 2H2O, CuBr2 квалификации “ч. д. а.”, этанол – ректификат. Все реагенты использовали без дополнительной очистки. 2-(3,5-Диметилпиразол-1-ил)бензимидазол синтезирован по методике, близкой к описанным в [17, 18].
Синтез CuLCl2 (I). Навески 1 ммоля (0.18 г) Cu-Cl2 ⋅ 2H2O и 1 ммоля (0.21 г) L растворяли отдельно при нагревании в 5 мл этанола и быстро смешивали полученные растворы. Образовывался раствор зеленого цвета, который постепенно темнел. При упаривании из раствора выпадал коричневый осадок. Раствор с осадком упаривали до 1/2 первоначального объема, охлаждали в кристаллизаторе со льдом, осадок отфильтровывали на фильтре Шотта, промывали 2 раза небольшими порциями (1–2 мл) этанола и высушивали на воздухе. Выход 0.26 г (71%).
Cинтез [CuL2Cl]Cl ⋅ H2O ⋅ C2H5OH (II). 0.5 ммоля (0.09 г) CuCl2 ⋅ 2H2O и 1.5 ммоля (0.32 г) L растворяли отдельно при нагревании в 5 мл этанола. При смешивании растворов выпадал осадок светло-зеленого цвета. Осадок отфильтровывали, промывали и высушивали так же, как в синтезе I. Выход 0.26 г (80%).
При длительном стоянии маточного раствора образовывались кристаллы соединения II, пригодные для РСА.
Синтез CuLBr2 (III). Навески 1 ммоля (0.22 г) CuBr2 и 1 ммоля (0.21 г) L растворяли отдельно при нагревании в 5 мл этанола. При смешивании растворов выпадал коричневый осадок. Раствор с осадком упаривали на водяной бане на 1/3 от первоначального объема, а затем охлаждали в кристаллизаторе со льдом. Осадок отфильтровывали, промывали и высушивали так же, как в синтезе I. Выход 0.39 г (88%).
Элементный анализ комплексов выполняли в аналитической лаборатории ИНХ СО РАН на приборе EUROEA 3000 фирмы EuroVector (Италия).
Дифрактометрическое исследование поликристаллических образцов выполняли на дифрактометре Shimadzu XRD 7000 (CuKα-излучение, Ni-фильтр, сцинтилляционный детектор) при комнатной температуре. Образцы растирали в гептане и наносили на полированную сторону стеклянной кюветы. Съемку проводили в диапазоне углов 5°–60° с шагом 0.03° и экспозицией 1 с/точку.
РСА выполнен по стандартной методике на автоматических четырехкружных дифрактометрах Bruker-Noniusx8 APEX для комплекса II (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор, двухкоординатные 4K CCD-детекторы). Поглощение учтено эмпирически по интенсивностям эквивалентных отражений (SADABS) [19]. Структура расшифрована прямым методом и уточнена полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов с помощью SHELXS [20], SHELXL [21] и графической оболочки OLEX2 [22]. Высокие параметры атомных смещений у сольватного EtOH, по-видимому, связаны с разупорядочением по нескольким близким позициям. Атомы водорода лиганда L локализованы геометрически и уточнены по модели “наездника”; атомы Н молекул воды локализованы из разностного синтеза Фурье и также уточнены в модели “наездника” с фиксированными значениями Uизо(H) = 1.5Uэкв(O); атомы водорода сольватного EtOH не были локализованы из разностного синтеза и расставлены из геометрических соображений. Основные кристаллографические данные и детали уточнения структуры II приведены в табл. 1.
Таблица 1.
Кристаллографические характеристики, детали дифракционного эксперимента и результаты уточнения структуры II
| Параметр | Значение |
|---|---|
| Брутто-формула | C26H32N8O2Cl2Cu |
| М | 623.03 |
| Сингония | Триклинная |
| Пр. гр. | P1 |
| a, Å | 10.6268(2) |
| b, Å | 13.0137(3) |
| c, Å | 13.0520(3) |
| α, град | 103.0220(10) |
| β, град | 113.3540(10) |
| γ, град | 108.9560(10) |
| V, Å3 | 1431.01(6) |
| Z | 2 |
| ρ(выч.), г см–3 | 1.446 |
| µ(MoKα), мм–1 | 0.989 |
| Размер кристалла, мм | 0.4 × 0.3 × 0.2 |
| Область сбора данных θ, град | 1.81 – 27.53 |
| Диапазоны h, k, l | –13 ≤ h ≤ 13, –15 ≤ k ≤ 16, –16 ≤ l ≤ 16 |
| Число измеренных отражений | 14 929 |
| Число независимых отражений (Rint) | 6520 (0.0213) |
| Число уточняемых параметров | 451 |
| F(000) | 646 |
| R (F 2 > 2σ(F 2)) | R1 = 0.0383, wR2 = 0.1107 |
| R (F 2) | R1 = 0.0445, wR2 = 0.1164 |
| GOOF | 1.033 |
| Δρmax/Δρmin, e Å–3 | 0.84/–0.61 |
Координаты атомов и величины параметров атомных смещений комплекса [CuLCl2] депонированы в Кембриджском банке структурных данных (КБСД № 2043452 http://www.ccdc.cam.ac.uk/ data_request/cif).
ИК-спектры поглощения снимали на спектрометрах Scimitar FTS 2000 и Vertex 80 в области 4000–100 см–1. Образцы готовили в виде суспензий в вазелиновом и фторированном маслах и полиэтилене.
Магнитные свойства поликристаллических образцов изучали на SQUID-магнетометре MPMS-XL фирмы Quantum Design в интервале температур 2–330 K и магнитных полей H = 0–10 кЭ. Для определения парамагнитной составляющей молярной магнитной восприимчивости (χp(T)) из измеренных значений полной молярной восприимчивости χ = M/H (M = намагниченность) вычитали вклады ларморовского диамагнетизма (χd) и ферромагнетизма микропримесей (χF): χp(T, H) = = χ(T, H) – χd – χF(T, H). Температурно-независимый вклад χd вычисляли согласно аддитивной схеме Паскаля, а для определения ферромагнитного вклада χF проводили измерения полевых зависимостей M(H) и зависимостей M(T) при различных значениях магнитного поля. В исследованных образцах χF < χd в полях H > 2 кЭ. Эффективный магнитный момент вычисляли по формуле μэфф = = [3kχpT/(${{N}_{{\text{A}}}}\mu _{{\text{B}}}^{2}$)]1/2 ≈ (8χpT)1/2, где NA, μB и k – число Авогадро, магнетон Бора и постоянная Больцмана соответственно.
Исследование цитотоксического действия лигандов и комплексов проводили на клеточной линии Hep-2 (карцинома гортани человека), предоставленной коллегами из Государственного научного центра вирусологии и биотехнологии “Вектор”. Клетки высевали на 96-луночные планшеты по 5 × 103 клеток на лунку и культивировали в среде Dulbecco’s Minimum Essential Medium (DMEM) с 10%-ным содержанием в ней эмбриональной бычьей сыворотки (FBS, HyClone) в увлажненной атмосфере с 5%-ным содержанием CO2 при 37°C. Через 24 ч добавляли исследуемые соединения, растворенные в этаноле или 50%-ном водно-этанольном растворе, в диапазоне концентраций 0.2–125 мкМ и инкубировали в течение 48 ч. Конечная концентрация растворителя в среде не превышала 1%. Затем клетки окрашивали флуоресцентными красителями Hoechst 33342 (в течение 30 мин при 37°C) и Propidium Iodide (в течение 10 мин при 37°C) [23]. По истечении указанного времени меняли среду в лунках для удаления избытка красителей. Съемку проводили на приборе IN Cell Analyzer 2200 (GE) в автоматическом режиме по 4 поля на лунку. Полученные изображения анализировали с помощью программного обеспечения IN Cell Investigator (GE Healthcare, UK) для определения процентного содержания каждой группы клеток (нормальные, апоптозные и мертвые) во всей популяции в результате действия препаратов. Результат представляли в виде процентного соотношения клеток из трех независимых экспериментов ± стандартное отклонение. Полумаксимальное ингибирование (IC50) определяли как концентрация соединения, при которой гибель клеток составляет 50%, и рассчитывали после аппроксимации нелинейной функцией кривых экспериментальной зависимости выживаемости клеток (%) от концентрации соединения (мкМ).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплексы I–III выделяли из водно-этанольных растворов при различных соотношениях металла и лиганда. Соотношения были подобраны экспериментально для получения фазы определeнного состава. По данным РФА, все соединения кристаллические, но среди них нет изоструктурных.
По данным РСА, комплекс [CuL2Cl]Cl ⋅ H2O ⋅ ⋅ C2H5OH (II) кристаллизуется в триклинной сингонии, пр. гр. $P\bar {1}$, Z = 2 (табл. 1). Независимая часть элементарной ячейки включает комплексный катион [CuL2Cl]+, внешнесферный хлорид-анион и по одной молекуле кристаллизационной воды и этилового спирта. Катион нецентросимметричен; координационное окружение центрального иона Cu2+ – искаженное тетрагонально-пирамидальное – образовано четырьмя атомами азота двух бидентатно-координированных лигандов L и хлорид-анионом (рис. 1). Длины связей Cu–N лежат в диапазоне 1.9761(18)–2.2650(18) Å, причем наибольшее значение наблюдается для атома N(1), находящегося в вершине координационной пирамиды.
Рис. 1.
Строение комплексного катиона [CuL2Cl]+ в структуре II. Приведены эллипсоиды атомных смещений 50%-ной вероятности.

Для количественного описания пятичленной координации, которая реализуется в комплексе II, можно использовать τ-дескриптор: τ = (α – β)/60, как ранее было предложено в [24] (α и β – два наибольших угла LML, α > β). Очевидно, что параметр τ в диапазоне от 0 до 1 определяет любую комбинацию состояний ТП (тетрагональная пирамида) и ТБП (тригональная бипирамида) в геометрии координационного полиэдра. В комплексе II два наибольших угла NCuN и NCuCl составляют 169.32(8)° и 145.96(6)° соответственно. Таким образом, τ-дескриптор, имеющий значение 0.389, позволяет количественно охарактеризовать координационный полиэдр [CuN4Cl] как близкий к ТП с достаточно большим (38.9%) вкладом состояния ТБП.
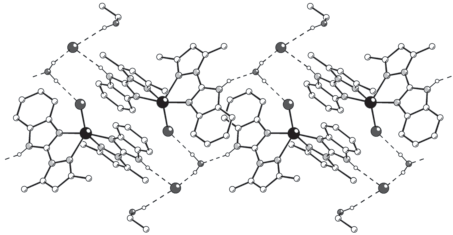
Значения основных валентных углов приведены в табл. 2. В структуре присутствуют сильные водородные связи четырех типов: N–H···O – между лигандами L и молекулами воды (расстояние N···O 2.732(2) Å), N–H···Cl – между лигандами L и хлорид-анионами (расстояние N···Cl 3.112(2) Å), O–H···Cl – между молекулами воды и хлорид-анионами (как внешне-, так и внутрисферными; расстояния O···Cl 3.103(2) и 3.155(2) Å) и O–H···Cl – между молекулами этилового спирта и внешнесферными хлорид-анионами (расстояние O···Cl 3.302(6) Å). Указанные водородные связи приводят к образованию цепочек, параллельных направлению [–1 1 0], в которых оказываются задействованными все структурные единицы (рис. 2). При этом в пределах цепочки лиганды L ориентированы попарно параллельно с минимальным межплоскостным расстоянием ~3.3 Å, что указывает на наличие π–π-взаимодействий.
Таблица 2.
Основные геометрические характеристики катиона [CuL2Cl]+ в структуре II
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Cu(1)–N(1) | 2.2650(18) | Cu(1)–N(7) | 1.9761(18) |
| Cu(1)–N(3) | 1.9800(17) | Cu(1)–Cl(1) | 2.2598(7) |
| Cu(1)–N(5) | 2.0872(18) | ||
| Угол | ω, град | Угол | ω, град |
| N(1)Cu(1)N(3) | 76.39(7) | N(5)Cu(1)N(7) | 78.74(7) |
| N(1)Cu(1)N(5) | 100.27(7) | N(1)Cu(1)Cl(1) | 113.72(5) |
| N(1)Cu(1)N(7) | 95.60(7) | N(3)Cu(1)Cl(1) | 94.14(5) |
| N(3)Cu(1)N(5) | 95.56(7) | N(5)Cu(1)Cl(1) | 145.96(6) |
| N(3)Cu(1)N(7) | 169.32(8) | N(7)Cu(1)Cl(1) | 95.58(6) |
Рис. 2.
Фрагмент цепи, образованной за счет водородных связей (пунктирные линии) между комплексными катионами [CuL2Cl]+, Cl–-ионами, молекулами воды и этилового спирта. Показаны только атомы H, участвующие в образовании водородных связей.
В ИК-спектре L в высокочастотной области 3300–2500 см–1 расположена широкая средней интенсивности полоса поглощения NH-групп, участвующих в образовании водородных связей. Слабовыраженные максимумы ν(CH) кольца и ν(CH3) наблюдаются в диапазоне 3100–2800 см–1. Спектры комплексов I–III подобны. Полосы ν(NH) и ν(CH) в них становятся более четкими по сравнению со спектром L, что, вероятно, связано с изменением характера H-связей при комплексообразовании.
Число и положение полос в области 1620–1480 см–1 (колебания кольца, R) существенно изменяются по сравнению со спектром L (табл. 3). Это позволяет сделать вывод, опираясь на данные РСА для II, о координации атомов азота циклов к иону Cu2+ во всех полученных комплексах. В интервале низких частот (400–200 см–1) проявляются полосы, отсутствующие в спектре L, которые отнесены к ν(Cu–N) и ν(Cu–Hal).
Таблица 3.
Частоты колебаний (см–1) ИК-спектров лиганда и комплексов в области колебаний кольца (R) и низкочастотном диапазоне
| Соединение | Отнесение | |||
|---|---|---|---|---|
| L | I | II | III | |
| 1626 1593 1572 1558 1482 |
1579 1512 1480 |
1614 1576 1567 1504 |
1579 1511 1481 |
Rкольца |
| 292 276 |
253 | 274 | ν(Cu–N) | |
| 315 | 318 | ν(Cu–Cl) | ||
| 246 | ν(Cu–Br) | |||
Таким образом, данные элементного анализа и ИК-спектроскопии свидетельствуют о том, что координационный узел в комплексах I и III формируется за счет атомов азота L, координированных по бидентатно-циклическому типу, и двух галогенид-ионов, которые входят во внутреннюю сферу. Во внутренней сфере комплекса II находятся две молекулы L и один хлорид-ион, во внешней сфере – второй хлорид-ион и молекулы воды и этанола. Характер ИК-спектров согласуется с данными РСА для комплекса II.
Температурные зависимости μэфф и обратной магнитной восприимчивости (1/χp) для комплексов I и II представлены на рис. 3. Для комплекса I значение μэфф при 300 K составляет 1.85 µB и практически не меняется при понижении температуры до 50 K, после чего уменьшается, достигая 1.38 µB при 5 K. Для комплекса II значение μэфф при 300 K составляет 1.80 µB и не меняется при охлаждении до гелиевых температур. Зависимости 1/χp(T) для комплексов I и II линейны и хорошо описываются законом Кюри–Вейсса с оптимальными значениями параметров C и θ, равными 0.433 K см3/моль и –2.8 K для комплекса I и 0.408 K см3/моль и –0.7 K для комплекса II. Значения μэфф при 300 K и постоянных Кюри C для комплексов I и II хорошо согласуются с теоретическими чисто спиновыми значениями 1.86 µB и 0.433 K см3/моль для одного иона меди(II) со спином S = 1/2 при g = 2.15. Уменьшение μэфф ниже 50 K и значение постоянной Вейсса θ для комплекса I указывают на наличие слабых антиферромагнитных обменных взаимодействий. Для комплекса II значимые обменные взаимодействия отсутствуют, на что указывает постоянное значение μэфф в широком температурном интервале и малая величина постоянной Вейсса θ.
Рис. 3.
Температурные зависимости µэфф и 1/χp для комплекса CuLCl2 (a) и [CuL2Cl]Cl ∙ H2O ∙ EtOH (б). Пунктирная линия на панели (а) показывает результат обработки данных согласно зависимости Кюри–Вейсса.

Магнитные свойства комплекса CuLBr2 (III) существенно отличаются от таковых в комплексах, содержащих хлорид-ионы. Хотя в интервале температур 50–330 К восприимчивость χp(T), как и в комплексах I и II, хорошо описывается законом Кюри–Вейсса с близким значением µэфф, при понижении температуры зависимость χp(T) существенно отклоняется от парамагнитного поведения и проходит через максимум при температуре Tм ≈ 20 К (рис. 4). Уменьшение восприимчивости при низкой температуре, так же как и большая отрицательная величина константы Вейсса θ ≈ –25 K свидетельствуют о существенно более сильных антиферромагнитных обменных взаимодействиях в этом комплексе. Широкий и плавный максимум в зависимости χp(T) является характерным признаком низкоразмерных магнетиков и свидетельствует о формировании магнитных цепочек из ионов Cu2+ с сильным внутрицепочечным и слабым межцепочечным обменным взаимодействием. Величину внутрицепочечного антиферромагнитного обменного взаимодействия J можно качественно оценить из значений Tм и θ на уровне J/kB ≈ 20 К. Отметим, что спиновые корреляции в цепочках начинают развиваться уже с температур ~50 К, что проявляется в значительном уменьшении μэфф (рис. 4).
Рис. 4.
Температурная зависимость µэфф для комплекса CuLBr2, измеренная в магнитном поле H = = 1 кЭ (⚫) и 10 кЭ (⚪). На вставке показаны температурные зависимости χp в области низких температур.

Рис. 5.
Репрезентативное изображение, показывающее морфологические изменения клеток Hep-2 после инкубации с 1 мкМ CuLCl2 (I), обнаруженные методом двойного окрашивания Hoechst 33342/PI.

Исследовано влияние лиганда L и комплексов хлоридов и бромидов меди(II) с ним на клеточную линию Hep-2. На риc. 5 представлены морфологические изменения клеток Hep-2. Значения IC50 приведены в табл. 4. Лиганд L не оказал цитотоксического действия по отношению к данной клеточной линии в исследованном диапазоне концентраций (0.2–125 мкМ). Полученные данные показали, что комплекс I наиболее токсичен, его воздействие привело к гибели клеток на уровне 50% (1 мкМ), среди которых процент клеток, проявивших морфологические изменения в ядрах, характерные для апоптоза, составил 30% (рис. 6). Цитотоксичность комплексов II и III оказалась сопоставима. Значения IC50 составляют 3.6 ± 0.3 (II) и 3.1 ± 0.3 (III) мкМ.
Рис. 6.
Результаты обработки клеток Hep-2 растворами соединений в течение 48 ч: ▲ – живые клетки, ◼ – апоптозные клетки, ⚫ – мeртвые клетки.

В [19–21] мы изучили цитотоксичность ряда комплексов с триазоло[1,5-a]бензимидазолами, отличающимися от L наличием еще одного конденсированного гетероцикла. Отметим, что исследованные в данной работе соединения меди(II) c 2‑(3,5-диметилпиразол-1-ил)бензимидазолом имеют существенно более высокую цитотоксичность, чем полученные ранее (табл. 4).
Таким образом, получены новые соединения галогенидов меди(II) с 2-(3,5-диметилпиразол-1-ил)бензимидазолом (L) состава [CuLCl2], [CuL2Cl]Cl ⋅ H2O ⋅ C2H5OH и [CuLBr2]. На клеточной линии Hep-2 изучены цитотоксические свойства лиганда L и синтезированных комплексов. Полученные данные показали, что комплекс CuLCl2 наиболее токсичен, его воздействие приводит к гибели клеток на уровне 50% (1 мкМ). Процент клеток, проявивших морфологические изменения в ядрах, характерные для апоптоза, составил 30%. Сравнение полученных данных с литературными показало, что цитотоксичность CuLCl2 сопоставима с таковой для цисплатина. Значение IC50 составляет (1.1 ± 0.1) мкМ [25].
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Yurdakul S., Kurt M. // J. Mol. Struct. 2003. V. 650. P. 181.
Singh V.P., Katiyar A., Singh S. // J. Coord. Chem. 2009. V. 62. P. 1336.
Gumus F., Algul O., Eren G. et al. // Eur. J. Med. Chem. 2003. V. 38. P. 473.
Sau D.K., Butcher R.J., Chaudhuri S., Saha N. // Mol. Cell. Biochem. 2003. V. 253. P. 21.
Spasov A.A., Yozhitsa I.N., Bugaeva L.I., Anisimova V.A. // Pharm. Chem. J. 1999. V. 33. P. 232.
Gocke M., Utku S., Gur S. et al. // Eur. J. Med. Chem. 2005. V. 40. P. 135.
Bharti N., Shailendra M.T., Garza M.T.G. et al. // Bioorg. Med. Chem. Lett. 2002. V. 12. P. 869.
Mothilal K.K., Karunakaran C., Rajendran A., Murugesan R. // J. Inorg. Biochem. 2004. V. 98. P. 322.
Podunavac-Kuzmanovic S.O., Cvetcovic D.M. // J. Serb. Chem. Soc. 2007. V. 72. P. 459.
Sączewski F., Dziemidowicz-Borys E.J., Bednarski P.J. et al. // J. Inorg. Biochem. 2006. V. 100. P. 1389.
Волыхина В.Е., Шафрановская Е.В. // Вестник Витебск. гос. мед. ун-та. 2009. Т. 8. № 4. С. 1.
Farmer K.J., Sohal R.S. // Free Radic. Biol. Med. 1989. V. 7. P. 23.
Rusting R.L. // Sci. Am. 1992. V. 267. P. 88.
Lavrenova L.G., Kuz’menko T.A., Ivanova A.D. et al. // New J. Chem. 2017. V. 41. P. 4341.
Дюкова И.И., Кузьменко Т.А., Комаров В.Ю. и др. // Коорд. химия. 2018. Т. 44. № 6. С. 393 (Dyukova I.I., Kuz’menko T.A., Komarov V.Y. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 755). https://doi.org/10.1134/S107032841812014X
Dyukova I.I., Lavrenova L.G., Kuz’menko T.A. et al. // Inorg. Chim. Acta. 2019. V. 486. P. 406.
Клюев Н.А., Повсяной Н.В., Александров Г.Г., Гуменный В.П // Химия гетероцикл. соед. 1983. № 1. С. 92 (Klyuyev N.A., Povstyanoi M.V., Aleksandrov G.G., Gumennyi V.P. // Khim. Geterotsikl. Soed. 1983. № 1. P. 88).
Hawes C., Kruger P. // Supramol. Chem. 2015. V. 27. № 11–12. P. 757.
APEX2 (version 1.08), SAINT (version 7.03), SADABS (version 2.11), SHELXTL (version 6.12). Madison (WI, USA): Bruker AXS Inc., 2004.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Crystallogr. 2009. V. 42. P. 339.
Lee Y.-J., Shacter E. // Blood. 1997. V. 89. P. 4480.
Addison A.W., Rao T.N., Reedijk J. et al. // Dalton Trans. 1984. V. 7. P. 1349.
Makhinya A.N., Eremina J.A., Sukhikh T.S. et al. // ChemistrySelect. 2019. V. 4. P. 5866.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия