Координационная химия, 2021, T. 47, № 2, стр. 69-80
Влияние условий синтеза на состав и строение комплексов хрома(III) с анионами циклобутан-1,1-дикарбоновой кислоты
Е. С. Бажина 1, *, М. А. Шмелев 1, А. А. Корлюков 2, М. А. Кискин 1, И. Л. Еременко 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: evgenia-VO@mail.ru
Поступила в редакцию 24.06.2020
После доработки 30.07.2020
Принята к публикации 03.08.2020
Аннотация
Исследовано взаимодействие Cr(NO3)3 · 9H2O с калиевой солью циклобутан-1,1-дикарбоновой кислоты (K2(Cbdc)) в соотношении 1 : 3. Показано, что в зависимости от условий реакции и природы растворителей, используемых для синтеза и кристаллизации, из реакционной системы могут быть выделены соединения различного состава и строения. Проведение реакции в воде с последующей перекристаллизацией из этанола и метанола приводит к выделению 2D-полимерных комплексов [KCr(Сbdc)2(H2O)2]n (I) и {[K4Cr2(OMe)2(Сbdc)4(MeOH)6] · MeOH}n (II) соответственно. Добавление к этой же реакционной смеси избытка KOH и перекристаллизация из спиртов приводит к формированию кристаллов 3D-полимерного соединения [K3Cr(Cbdc)3(H2O)2]n (III). Проведение реакции в метаноле с последующей медленной диффузией диэтилового эфира позволяет получить комплекс [K3Cr(Cbdc)3(MeOH)2(H2O)2]n (IV), имеющий 2D-полимерное строение. Кристаллические структуры соединений I–IV установлены методом РСА (CIF file CCDC № 2006090 (I), 2006109 (II), 2006116 (III) и 2006117 (IV)).
В последние годы интерес к синтезу комплексов переходных металлов с карбоксилатными лигандами повышается, прежде всего, благодаря проявляемым этими соединениями магнитным [1–5] и люминесцентным свойствам [6–8], а также их каталитической [9, 10] и биологической активности (антибактериальным, противогрибковым и противоопухолевым свойствам) [11–13]. Мостиковые карбоксилатные лиганды широко используются для сборки координационных полимеров и пористых металлоорганических каркасов и создания на их основе ион-селективных и электрохимических сенсоров [14–16], катализаторов [17] и сорбентов для разделения и хранения газов [18–20].
Замещенные аналоги малоновой кислоты (H2R1R2Mal), благодаря сочетанию хелатирования и различных типов мостиковой координации, позволяют получать гетерометаллические комплексы и координационные полимеры, построенные на основе анионных “блоков” с двумя хелатно координированными анионами кислоты {M(R1R2Mal)2}2– (M = VO2+, Co2+, Ni2+, Cu2+, Zn2+). В этих соединениях в качестве мостиковых фрагментов, связывающих малонатные блоки, обычно выступают акватированные катионы s-, 3d-, 4d- и 4f-элементов, при этом геометрия заместителей в малонатном лиганде оказывает влияние на растворимость образующихся комплексов, их строение и свойства [21]. Использование анионов замещенных малоновых кислот, в отличие от незамещенной кислоты, позволяет проводить некоторые реакции синтеза в органических средах, что обуславливает возможность получения соединений иного строения [22, 23].
Анионы циклобутан-1,1-дикарбоновой кислоты (H2Cbdc) проявляют те же способы координации, что и анионы малоновой кислоты и других ее замещенных аналогов, но, благодаря наличию циклического углеводородного заместителя, способны повышать устойчивость гетерометаллических комплексов, что было продемонстрировано на примере систем с катионами оксованадия(IV). В этом случае использование анионов Cbdc2– позволило выделить и структурно охарактеризовать гетерометаллические соединения K–V(IV) и K–Ln(III)–V(IV), в то время как реакции с другими замещенными малоновыми кислотами не приводили к формированию кристаллов целевых соединений [24, 25]. Являясь гибким мостиковым лигандом, способным принимать различные конформации, анион Cbdc2– удобен для конструирования координационных полимеров Mn(II), Cu(II), Zn(II), Cd(II) с N-донорными лигандами, обладающих полезными функциональными свойствами [26–30].
Гетерометаллические соединения переходных металлов с анионами Cbdc2–, известные на сегодняшний день, получены для оксованадия(IV), меди(II) и никеля(II) [21, 24, 25, 31]. Для хрома(III) комплексы с малонатными лигандами ограничены только соединениями незамещенной малоновой кислоты [32–39].
В настоящей работе исследовано взаимодействие нитрата хрома(III) с калиевой солью циклобутан-1,1-дикарбоновой кислоты (K2Cbdc) в соотношении 1 : 3 в водной и органических средах. Изучено влияние условий проведения реакции и природы используемых растворителей на состав и кристаллическую структуру формирующихся комплексов хрома(III) с анионами Cbdc2–.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез новых соединений выполняли на воздухе с использованием дистиллированной воды, этанола (95%), метанола (99.9%), диэтилового эфира (99.7%), Cr(NO3)3 · 9H2O (99%, Acros Organics), КОН (99+%), H2Cbdc (99%, Fluorochem). ИК-спектры соединений регистрировали в интервале частот 4000–400 см–1 на ИК-спектрофотометре с Фурье-преобразованием Spectrum 65 (PerkinElmer), оборудованном приставкой Quest ATR Accessory (Specac), методом нарушенного полного внутреннего отражения (НПВО). Элементный анализ выполняли на CHNS-анализаторе EuroЕА 3000 (EuroVector).
Синтез [KCr(Сbdc)2(H2O)2]n (I). К раствору Cr(NO3)3 · 9H2O (0.2 г, 0.5 ммоль) в 10 мл дистиллированной воды при 100°C добавляли раствор K2Cbdc, полученный нейтрализацией H2Cbdc (0.216 г, 1.5 ммоль) и KOH (0.168 г, 3 ммоль) в 20 мл воды при 100°C. Реакционную смесь перемешивали в течение 2 ч при 100°C и оставляли полученный раствор зеленого цвета при 22°C на 10 сут. К образовавшемуся стеклообразному продукту и бесцветным кристаллам добавляли 20 мл EtOH и перемешивали в течение 3 ч при 70°C. Раствор зеленого цвета отфильтровывали от аморфного осадка белого цвета и выдерживали в колбе Эрленмейера при медленном испарении при 22°C в течение 1 мес. Кристаллы бледно-сиреневого цвета, пригодные для РСА, отделяли от маточного раствора фильтрованием и сушили на воздухе. Выход соединения I 0.042 г (20.4% в расчете на Cr(NO3)3 · 9H2O).
ИК-спектр (НПВО; ν, см–1): 3091 ш.ср (ν(O–H)), 3008 ср, 2962 ср, 2866 ср, 1599 с (νas(СОО–)), 1568 c (νas(СОО–)), 1447 ср, 1379 c (νs(СОО–)), 1256 ср, 1245 ср, 1228 с, 1161 сл, 1118 с, 1058 сл, 998 ср, 949 ср, 919 с, 839 ср, 757 с, 722 с, 661 с, 547 с, 509 с, 449 с, 416 с.
Синтез {[K4Cr2(OMe)2(Сbdc)4(MeOH)6] · MeOH}n (II). К раствору Cr(NO3)3 · 9H2O (0.15 г, 0.375 ммоль) в 15 мл дистиллированной воды при 100°C добавляли раствор K2Cbdc, полученный нейтрализацией H2Cbdc (0.162 г, 1.12 ммоль) и KOH (0.126 г, 2.25 ммоль) в 20 мл воды. Реакционную смесь перемешивали в течение 1 ч при 100°C и оставляли полученный раствор зеленого цвета при 22°C на 1 мес. К образовавшемуся стеклообразному продукту и бесцветным кристаллам добавляли 20 мл MeOH и перемешивали в течение 3 ч при 70°C. Раствор зеленого цвета отфильтровывали от аморфного осадка белого цвета и выдерживали в колбе Эрленмейера при медленном испарении при 22°C в течение 2 нед. К выделившимся зеленым и бесцветным кристаллам добавляли 20 мл MeOH и смесь растворяли при 70°C. Раствор зеленого цвета отфильтровывали от аморфного осадка белого цвета и выдерживали в колбе Шленка при 22°C в течение 2 мес. Образовавшиеся кристаллы зеленого цвета, пригодные для РСА, отделяли от маточного раствора декантацией и сушили на воздухе. Выход соединения II 0.051 г (25.1% в расчете на Cr(NO3)3 · 9H2O).
ИК-спектр (НПВО; ν, см–1): 3543 сл (ν(O–H)), 3409 о. сл (ν(O–H)), 3178 о. сл (ν(O–H)), 3008 о. сл, 2963 сл, 2866 о.сл, 1657 сл, 1592 с (νas(СОО–)), 1575 с (νas(СОО–)), 1449 ср, 1419 ср, 1371 с (νs(СОО–)), 1258 с, 1242 ср, 1225 ср, 1158 сл, 1116 с, 1097 с, 1052 с, 1014 с, 956 ср, 915 с, 884 сл, 867 ср, 849 ср, 782 с, 719 с, 685 ср, 660 ср, 614 ср, 541 с, 505 с, 492 с, 448 с, 423 ср.
Синтез [K3Cr(Cbdc)3(H2O)2]n (III). К раствору Cr(NO3)3 · 9H2O (0.1 г, 0.25 ммоль) в 10 мл дистиллированной воды при 100°C добавляли раствор K2Cbdc, полученный взаимодействием H2Cbdc (0.108 г, 0.75 ммоль) и KOH (0.113 г, 2 ммоль) в 20 мл воды. После перемешивания в течение 1 ч при 100°C раствор зеленого цвета оставляли при 22°C на 1 нед. К полученному стеклообразному продукту и бесцветным кристаллам добавляли 20 мл EtOH и перемешивали в течение 3 ч при 70°C. Образовавшийся раствор зеленого цвета отфильтровывали от аморфного осадка белого цвета и выдерживали в колбе Эрленмейера при медленном испарении при 22°C в течение 2 нед. Кристаллы зеленого цвета, пригодные для РСА, отделяли от маточного раствора декантацией, промывали EtOH и сушили на воздухе. Выход соединения III 0.070 г (44.3% в расчете на Cr(NO3)3 · 9H2O).
ИК-спектр (НПВО; ν, см–1): 3545 сл (ν(O–H)), 3407 сл (ν(O–H)), 3262 сл (ν(O–H)), 3011 о. сл, 2992 о.сл, 2969 о.сл, 2950 о.сл, 1657 сл, 1600 с (νas(СОО–)), 1575 с (νas(СОО–)), 1451 сл, 1419 ср, 1371 с (νs(СОО–)), 1328 с, 1257 ср, 1225 ср, 1187 о. сл, 1164 о. сл, 1118 с, 1053 о.сл, 1014 сл, 955 сл, 915 с, 891 сл, 878 сл, 849 о. сл, 770 ср, 718 ср, 652 ср, 617 ср, 542 с, 507 ср, 459 с, 447 с, 412 с.
Синтез [K3Cr(Cbdc)3(MeOH)2(H2O)2]n (IV). К раствору Cr(NO3)3 · 9H2O (0.15 г, 0.375 ммоль) в 10 мл MeOH при 70°C добавляли раствор K2Cbdc, полученный нейтрализацией H2Cbdc (0.162 г, 1.12 ммоль) и KOH (0.126 г, 2.25 ммоль) в 30 мл MeOH. Реакционную смесь перемешивали в течение 1 ч при 70°C, охлаждали до 22°C и отфильтровывали раствор зеленого цвета от белого аморфного осадка. Раствор (5 мл) в небольшом сосуде помещали в герметично закрывающийся контейнер с 10 мл Et2O на дне и выдерживали при 22°C в течение 7 сут. Кристаллы зеленого цвета, пригодные для РСА, отделяли от маточного раствора декантацией и сушили на воздухе. Выход соединения IV 0.043 г (16.7% в расчете на Cr(NO3)3 · 9H2O).
ИК-спектр (НПВО; ν, см–1): 3545 сл (ν(O–H)), 3400 сл (ν(O–H)), 3266 сл (ν(O–H)), 3010 о. сл, 2987 сл, 2956 сл, 2865 о. сл, 2831 о. сл, 1593 с (νas(СОО–)), 1436 сл, 1358 с (νs(СОО–)), 1256 ср, 1242 ср, 1230 ср, 1160 сл, 1118 с, 1097 ср, 1042 ср, 1021 ср, 1007 ср, 957 сл, 917 с, 874 о. сл, 855 о. сл, 769 с, 740 ср, 718 ср, 661 ср, 545 с, 504 с, 474 с, 451 с, 416, 410 с.
РСА монокристаллов I–IV выполнен на дифрактометре Bruker SMART APEX II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [40]. Введена полуэмпирическая поправка на поглощение по программе SADABS [41]. Структуры расшифрованы прямыми методами и уточнены полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Атомы водорода OH-групп в структурах I–III локализованы из разностных Фурье-синтезов. Расчеты проведены по комплексу программ SHELX-2014 [42] с использованием Olex2 1.3 [43]. В структуре II атом K(3), атом кислорода O(21) координированной к нему молекулы MeOH и атом С(18) одного из циклобутановых фрагментов лиганда разупорядочены по двум положениям с заселенностями, равными соответственно 0.078(2) и 0.922(2) (для K(3a) и K(3)), 0.312(10) и 0.688(10) (для O(21a) и O(21b)), 0.842(6) и 0.158(6) (для C(18a) и C(18b)). Кристаллографические параметры и детали уточнения структур I–IV приведены в табл. 1, основные длины связей и углы – в табл. 2.
Таблица 1.
Кристаллографические данные и параметры расчетов структуры кристаллов I–IV
| Параметр | Значение | |||
|---|---|---|---|---|
| I | II | III | IV | |
| М, г/моль | 411.35 | 541.57 | 631.65 | 695.74 |
| Т, K | 296 | 120 | 296 | 150 |
| Сингония | Моноклинная | Триклинная | Моноклинная | Триклинная |
| Пр. гр. | P21/c | P1 | P21/c | P1 |
| a, Å | 9.1802(9) | 11.2052(7) | 8.4516(8) | 8.6240(9) |
| b, Å | 8.1659(10) | 12.6600(7) | 17.3830(15) | 10.9551(11) |
| c, Å | 10.7250(12) | 17.6107(10) | 17.1707(14) | 15.6353(16) |
| α, град | 90 | 78.7070(10) | 90 | 73.204(2) |
| β, град | 99.687(4) | 86.6970(10) | 103.176(3) | 79.928(2) |
| γ, град | 90 | 67.7540(10) | 90 | 77.236(2) |
| V, Å3 | 792.53(15) | 2267.1(2) | 2456.2(4) | 1369.4(2) |
| Z | 2 | 4 | 4 | 2 |
| ρ(выч.), г см–3 | 1.724 | 1.587 | 1.708 | 1.687 |
| μ, мм–3 | 1.035 | 0.930 | 1.043 | 0.949 |
| θmin–θmax, град | 3.15–25.99 | 1.77–30.68 | 2.34–26.37 | 1.97–28.31 |
| F(000) | 422 | 1124 | 1292 | 718 |
| Tmin/Tmax | 0.621/ 0.746 | 0.489/ 0.746 | 0.674/ 0.746 | 0.833/ 0.981 |
| Интервалы индексов отражений | –11 ≤ h ≤ 11, –9 ≤ k ≤ 10, –12 ≤ l ≤ 11 | –15 ≤ h ≤ 16, –18 ≤ k ≤ 17, –25 ≤ l ≤ 25 | –10 ≤ h ≤ 10, –21 ≤ k ≤ 21, –21 ≤ l ≤ 21 | –11 ≤ h ≤ 11, –14 ≤ k ≤ 14, –20 ≤ l ≤ 20 |
| Измерено отражений | 5068 | 30 594 | 22 482 | 14 612 |
| Независимых отражений | 1549 | 13 996 | 5023 | 6750 |
| Rint | 0.0758 | 0.0259 | 0.1273 | 0.0241 |
| Отражений с I > 2σ(I) |
1231 | 12061 | 3075 | 5637 |
| GООF | 1.057 | 1.036 | 1.038 | 1.171 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0530, wR2 = 0.1442 |
R1 = 0.0410, wR2 = 0.1067 |
R1 = 0.0797, wR2 = 0.1469 |
R1 = 0.0556, wR2 = 0.1255 |
| R-факторы по всем отражениям | R1 = 0.0652, wR2 = 0.1541 |
R1 = 0.0493, wR2 = 0.1112 |
R1 = 0.1391, wR2 = 0.1719 |
R1 = 0.0668, wR2 = 0.1294 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.605/ 0.675 | –1.280/ 0.865 | –0.547/ 0.783 | –0.681/ 0.976 |
Таблица 2.
Основные длины связей (d) и углы (ω) в соединениях I–IV
| Связь | d, Å | |||
|---|---|---|---|---|
| I | II | III | IV | |
| Cr–O (Cbdc) | 1.903(2), 1.984(2) | 1.9390(14)–1.9727(13) | 1.941(4)–1.968(4) | 1.936(3)–2.005(3) |
| К–O (Cbdc) | 2.765(2)–3.302(2) | 2.5675(15)–3.3539(15) | 2.618(5)–3.277(6) | 2.618(3)–3.172(3) |
| К–O (H2O) | 2.661(6), 2.817(5), 2.851(5) | 2.830(3)–3.286(3) | ||
| К–O (MeOH) | 2.615(2)–2.8061(19) | 2.642(4), 2.817(3) | ||
| Угол | ω, град | |||
| OCrO (смежн.) | 74.39(9)–105.61(9) | 79.04(5)–97.14(6) | 85.87(17)–98.28(18) | 85.70(11)–96.12(12) |
Структурные параметры депонированы в Кембриджском центре кристаллографических данных (ССDC № 2006090 (I), 2006109 (II), 2006116 (III) и 2006117 (IV)); deposit@ccdc.cam.ac.uk; www: http:// www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
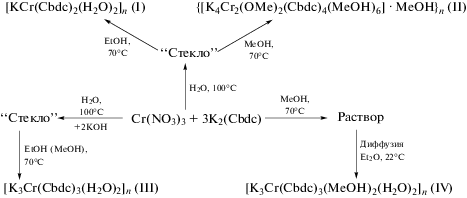
Взаимодействие Cr(NO3)3 · 9H2O с K2Сbdc (получена реакцией H2Cbdc и KOH в воде) в мольном соотношении 1 : 3 в водном растворе при 100°C приводило к образованию бесцветных кристаллов нитрата калия и стеклообразного продукта зеленого цвета. Перекристаллизация такой смеси из этанола при 70°C с последующим отделением нитрата калия в виде осадка белого цвета позволила получить сиреневые кристаллы соединения [KCr(Сbdc)2(H2O)2]n (I), имеющего 2D-полимерное строение. При перекристаллизации этой смеси из метанола не удалось выделить кристаллы, пригодные для РСА. Однако использование предварительного концентрирования реакционной смеси и повторная перекристаллизация из метанола с отделением выпавших кристаллов нитрата калия позволили получить зеленые кристаллы 2D-полимера {[K4Cr2(OMe)2(Сbdc)4(MeOH)6] · · MeOH}n (II). Реакция Cr(NO3)3 · 9H2O с K2Сbdc в воде в соотношении 1 : 3 с добавлением 2 моль KOH также привела к образованию стеклообразного продукта, при перекристаллизации которого из MeOH или из EtOH, удалось выделить из раствора зеленые кристаллы 3D-полимера [K3Cr(Cbdc)3- (H2O)2]n (III). Взаимодействием Cr(NO3)3 · 9H2O c K2Cbdc в соотношении 1 : 3 в метаноле и последующей медленной диффузией диэтилового эфира в реакционный раствор получены кристаллы 2D-полимерного соединения [K3Cr(Cbdc)3(MeOH)2-(H2O)3]n (IV) (схема 1 ).
Схема 1 .
Центросимметричная структура I (центр инверсии находится на атоме Cr) образована моноядерными хромсодержащими анионами [Cr(Cbdc)2- (H2O)2]– и связывающими их катионами K+. Атом Cr находится в октаэдрическом координационном окружении: он хелатно координирует два дианиона Cbdc2–, атомы O (O(2), O(4)) которых находятся в экваториальной плоскости полиэдра, и две молекулы воды, атомы O (O(5)) которых занимают аксиальные позиции (Cr(1)–O(5) 2.126(2) Å) (табл. 2, рис. 1а). Координационный полиэдр металла сильно искажен – величины смежных углов OCrO значительно отклоняются от 90° (табл. 2). В кристаллической упаковке I анионные фрагменты {Cr(Cbdc)2(H2O)2} связаны в слоистую структуру за счет координации атомов K карбоксилатными атомами O (O(1), O(2), O(3), O(4)) (табл. 2), причем связи, образуемые атомом K с O(1) и O(4) (3.293(3) и 3.302(2) Å соответственно) оказываются длиннее, чем аналогичные связи с атомами O(2) и O(3) (2.765(2) и 2.990(3) Å). В кристалле I каждый хромсодержащий фрагмент окружен четырьмя кристаллографически эквивалентными атомами K так, что кратчайшее расстояние Cr···K составляет 4.0830 Å, а расстояния Cr···Cr одинаковы и равны 6.7399 Å (рис. 1б). Полимерный слой дополнительно стабилизируется водородными связями с участием атомов O(1) и O(3) карбоксильных групп и координированных молекул воды (табл. 3).
Рис. 1.
Строение анионного фрагмента [Cr(Cbdc)2(H2O)2]–, окружение атомов K (а) и формирование слоистой структуры в кристаллах I (б). Пунктирными линями показаны удлиненные связи K–O (а). Циклобутановые фрагменты анионов кислоты (а, б)) и атомы водорода молекул воды (б) не показаны.
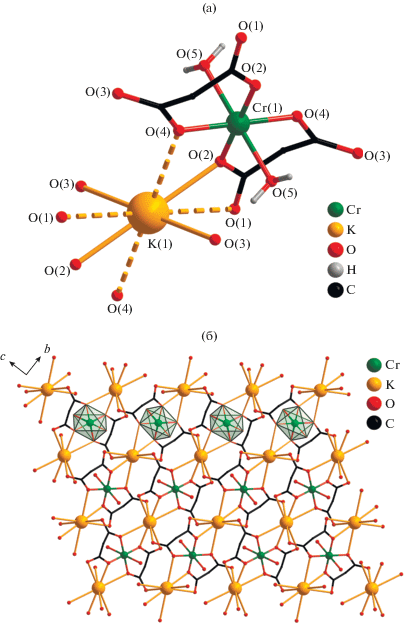
Таблица 3.
Геометрические параметры водородных связей в структурах I–IV*
| D–H···A | Расстояние, Å | Угол D–H···A, град |
||
|---|---|---|---|---|
| D–H | H···A | D···A | ||
| I | ||||
| O(5)–H(5a)···O(1)i | 0.87 | 1.77 | 2.581(3) | 155 |
| O(5)–H(5b)···O(3)ii | 0.87 | 1.70 | 2.540(3) | 160 |
| II | ||||
| O(23)–H(23)···O(5) | 0.85 | 1.90 | 2.7310(19) | 169 |
| O(19)–H(19)···O(4)i | 0.86 | 1.93 | 2.783(2) | 175 |
| O(20)–H(20)···O(17)ii | 0.85 | 1.89 | 2.709(2) | 161 |
| O(21b)–H(21b)···O(15) | 0.85 | 2.07 | 2.876(4) | 157 |
| O(24)–H(24)···O(2)iii | 0.84 | 1.94 | 2.7688(19) | 170 |
| O(22)–H(22)···O(7)iv | 0.85 | 2.02 | 2.763(2) | 145 |
| III | ||||
| O(13)–H(13a)···O(8)i | 0.85 | 2.35 | 2.926(8) | 125 |
| O(13)–H(13b)···O(12)ii | 0.85 | 2.48 | 2.799(7) | 104 |
| O(14)–H(14a)···O(8)iii | 0.85 | 2.14 | 2.815(8) | 136 |
| O(14)–H(14b)···O(10)iv | 0.85 | 2.57 | 2.899(7) | 104 |
| IV | ||||
| O(5w)–H(5wa)···O(7)i | 0.90 | 1.88 | 2.769(4) | 167 |
| O(1s)–H(1s)···O(12)ii | 0.95 | 1.90 | 2.708(7) | 142 |
| O(5w)–H(5wb)···O(7)iii | 0.87 | 2.23 | 3.072(4) | 164 |
| O(2s)–H(2s)···O(4) | 0.83 | 1.86 | 2.670(5) | 166 |
| O(4w)–H(4wa)···O(5w)i | 0.84 | 2.05 | 2.772(5) | 142 |
| O(4w)–H(4wb)···O(2s) | 0.92 | 2.10 | 2.939(5) | 152 |
* Коды симметрии: ix, 1/2 – y, 1/2 + z; iix, 3/2 – y, 1/2 + z (I). ix – 1, y, z; ii –x + 2, –y, –z + 1; iiix, y – 1, z + 1; iv –x + 1, –y + 2, –z (II). i 1 – x, 1 – y, 1 – z; iix, 3/2 – y, –1/2 + z; iii 1 – x, –1/2 + y, 3/2 – z; iv –x, –1/2 + y, 3/2 – z (III). i 2 – x, 1 – y, 1 – z; iix, 1 + y, z; iii 1 + x, y, z (IV).
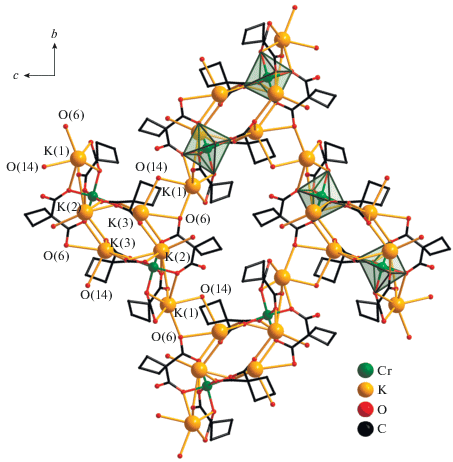
Основным структурным блоком соединения II является биядерный тетраанион [Cr2(OMe)2(Cbdc)4]4–, в котором два атома Cr координируют по два хелатных дианиона Cbdc2– и связаны между собой двумя μ-мостиковыми группами OMe (Cr–O 1.9783(14)–1.9921(14) Å). Координационный полиэдр Cr представляет собой октаэдр, который искажен вследствие различий в длинах связей Cr–O (табл. 2). В структуре II два типа таких блоков, содержащих кристаллографически независимые атомы Cr(1) и Cr(2) и характеризующихся незначительно отличающимися длинами связей Cr–O, а также четыре типа неэквивалентных атомов K (K(1), K(2), K(3), K(4)). Атом K(3) разупорядочен по двум положениям K(3a) и K(3) с заселенностями ~0.1 и ~0.9 соответственно. Расстояния Cr(1)···Cr(1) и Cr(2)···Cr(2) близки и равны, соответственно, 3.0658 и 3.0574 Å. Чередующиеся биядерные фрагменты {Cr(1)2(OMe)2(Cbdc)4} и {Cr(2)2- (OMe)2(Cbdc)4} связаны атомами K(1), K(2), K(3) и K(4) в полимерные цепочки (табл. 2, рис. 2а). Каждый из четырех неэквивалентных атомов K координирует по одной молекуле MeOH (O(19), O(20), O(21), O(24)), а атомы K(1) и K(4), K(2) и K(3) связаны между собой μ-мостиковыми молекулами MeOH O(22) и O(23) соответственно (K(1)···K(4) 3.5220, K(2)···K(3) 4.4179, K(4)···K(3), 4.7184, K(1)···K(3) 3.796, K(4)···K(2) 6.0034 Å) (табл. 2). Атом K(4) дополнительно образует связь с атомом O(9) мостиковой группы OMe фрагмента {Cr(1)2(OMe)2(Cbdc)4} (2.8905(13) Å), в то время как аналогичное расстояние между атомом K(3) и атомом O(18) группы OMe фрагмента {Cr(2)2(OMe)2- (Cbdc)4} значительно больше (3.3896(15) Å). Связывание цепочек в полимерные слои происходит за счет координации карбоксилатных атомов (O(8) и O(13)) атомами K(1) и K(2) соседних цепочек (K–O 2.6001(14), 2.7982(16) Å; K(2)···K(2) 4.2338 Å) (рис. 2б). Полимерный слой дополнительно стабилизируется сеткой водородных связей с участием атомов кислорода карбоксильных групп (O(2), O(4), O(5), O(7), O(15) и O(17)) и координированных молекул метанола (табл. 3).
Рис. 2.
Строение анионных фрагментов [Cr2(MeO)2(Cbdc)4]4–, связывание их в цепочку атомами K (а) и формирование слоистой структуры в кристаллах II (б). Позиции атомов K(3а) и O(21а) (а), циклобутановые фрагменты анионов кислоты и атомы водорода молекул метанола не показаны (а, б). Пунктирной линей показана удлиненная связь K–O (а).
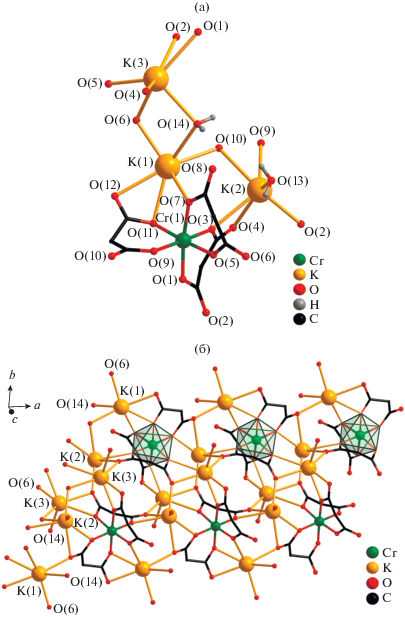
Структура III образована анионными фрагментами [Cr(Cbdc)3]3–, в которых атом Cr находится в октаэдрическом координационном окружении и координирует три аниона Cbdc2–, формирующих с атомом металла шестичленные хелатные циклы (табл. 2), тремя типами кристаллографически независимых атомов K (K(1), K(2), K(3)) и двумя молекулами H2O (рис. 3а). Фрагменты {Cr(Cbdc)3} попарно связаны в полимерные слои ленточного типа за счет координации карбоксилатных атомов O анионов Cbdc2– атомами K(1), K(2), K(3) (Cr(1)···K(1) 3.7601, K(1)···K(2) 4.429, K(1)···K(3) 4.434, K(3)···K(2) 4.249 Å) (табл. 2, рис. 3б). Кратчайшее расстояние Cr···Cr в слое составляет 8.280 Å. Атомы K(1) и K(3) участвуют в объединении полимерных слоев в 3D-каркасную структуру за счет связывающей их мостиковой молекулы воды (K(1)–O(14) 2.830(5), K(3)–O(14) 2.862(6) Å) и атома кислорода O(6) карбоксилат-аниона (K(1)–O(6) 2.620(5) Å) (рис. 4). Атом K(2) монодентатно координирует вторую молекулу H2O (K(2)–O(13) 2.652(6) Å) и не участвует в связывании слоев (рис. 3а, 4). Полимерная структура III дополнительно стабилизируется за счет водородных связей с участием атомов кислорода карбоксильных групп (O(8), O(10) и O(12)) и координированных молекул воды (табл. 3).
Рис. 3.
Строение анионного фрагмента [Cr(Cbdc)3]3–, окружение связанных с ним атомов K (а) и формирование полимерного слоя в структуре III (б). Циклобутановые фрагменты анионов кислоты (а, б) и атомы водорода молекул воды (б) не показаны.
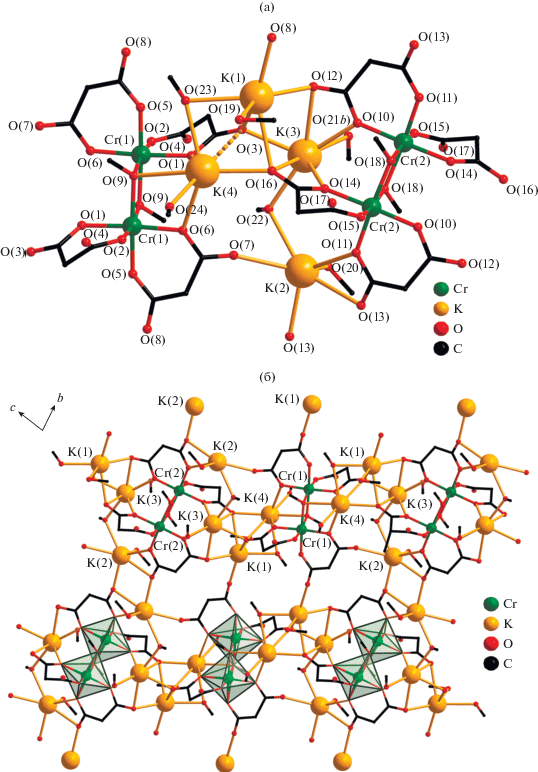
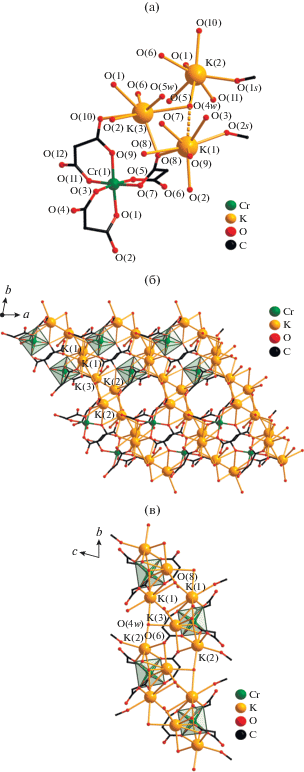
Кристаллическая структура IV, как и III, образована моноядерными анионами [Cr(Cbdc)3]3–, в которых атом Cr хелатно координирует три лиганда Cbdc2–, тремя типами кристаллографически независимых атомов K (K(1), K(2), K(3)) и двумя молекулами воды. Но в отличие от III, структура IV содержит еще две молекулы метанола (табл. 2, рис. 5а). Атом Cr в IV, как и в III, находится в октаэдрическом координационном окружении; величины смежных углов OCrO незначительно отклоняются от 90° (табл. 2). В кристалле IV трисхелатные фрагменты {Cr(Cbdc)3} попарно связаны в полимерные цепочки атомами K(1), K(2) и K(3) (Cr(1)···K(2) 3.5561, K(1)···K(3) 4.1906, K(2)···K(3) 3.5961 Å). Атомы K(1) и K(2) координируют по одной терминальной молекуле MeOH (O(1s) и O(2s)), а атом K(3) – молекулу H2O (O(5w)) (табл. 2, рис. 5а). Объединение цепочек в слоистую структуру происходит за счет координации атомами K(1) и K(2) карбоксилатных атомов O(8) и O(6) соответственно, относящихся к фрагментам {Cr(Cbdc)3} соседних цепочек, а также за счет мостиковых молекул воды O(4w), связывающих атомы K(2) и K(3), принадлежащие соседним цепочкам (K(2)···K(3) 4.3718 Å) (рис. 5б, 5в). Кратчайшее расстояние Cr···Cr в слое составляет 7.515 Å между атомами металла двух соседних цепочек. Слоистая структура IV дополнительно стабилизируется за счет водородных связей с участием атомов кислорода карбоксильных групп (O(4), O(7) и O(12)) и координированных молекул воды и метанола (табл. 3).
Рис. 5.
Строение моноядерного аниона [Cr(Cbdc)3]3–, окружение связанных с ним атомов K (а) и фрагмент кристаллической упаковки соединения IV: проекция на плоскость ab (б) и bc (в). Циклобутановые фрагменты анионов кислоты и атомы водорода молекул воды и метанола не показаны. Пунктирной линей показана удлиненная связь K–O (а).
Таким образом, показано, что у соединений K−Cr(III) с анионами Cbdc2– (в отличие от ранее полученного комплекса K−V(IV) [24]) появляется растворимость в метаноле и этаноле. Это позволило исследовать влияние указанных растворителей, а также избытка KOH, введенного в данную реакцию, на состав и строение формирующихся продуктов. Установлено, что использование этанола при перекристаллизации стеклообразного продукта, полученного взаимодействием Cr(NO3)3 с K2Cbdc (1 : 3) в воде, приводит к выделению соединения I, содержащего бисхелатные фрагменты [Cr(Cbdc)2(H2O)2]–, несмотря на достаточное для образования трисхелатного комплекса количество анионов Cbdc2– в реакционной системе. Аналогичная перекристаллизация из метанола приводит к формированию необычной 2D-полимерной структуры соединения II, образованной биядерными анионными фрагментами [Cr2(μ-OMe)2 (Cbdc)4]4–. Соединения III и IV, содержащие трисхелатные фрагменты [Cr(Cbdc)3]3–, могут быть выделены, соответственно, при добавлении в реакцию в воде избытка KOH с последующей перекристаллизацией из спиртов или при проведении реакции в метаноле с последующей медленной диффузией диэтилового эфира. Однако в случае III формируется 3D-полимерная структура, а в случае IV, вследствие координации молекул метанола, – 2D-полимер.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Fiorini G., Carrella L., Rentschler E., Alborés P. // Dalton Trans. 2020. V. 49. P. 932.
Darii M., Kravtsov V.Ch., Krämer K. et al. // Cryst. Growth Des. 2020. V. 20. P. 33.
Arizaga L., Cañon-Mancisidor W., Gancheff J.S. et al. // Polyhedron. 2019. V. 174. P. 114165.
Yin J.-J., Chen C., Zhuang G.-L. et al. // Inorg. Chem. 2020. V. 59, P. 1959.
Lockyer S.J., Fielding A.J., Whitehead G.F.S. et al. // J. Am. Chem. Soc. 2019. V. 141. P. 14633.
Li W.-D., Chen S.-S., Han S.-S., Zhao Y. // J. Solid State Chem. 2020. V. 283. P. 121133.
Zhao L., Meng L., Liu X. et al. // RSC Adv. 2019. V. 09. P. 40203.
Zhang J.-W., Liu W.-H., Wang C.-R. et al. // Inorg. Chim. Acta. 2020. V. 502. P. 119343.
Liang F., Ma D. // J. Mol. Struct. 2020. V. 1208. P. 127814.
Dridi R., Cherni S.N., Fettar F. et al. // J. Mol. Struct. 2020. V. 1205. P. 127573.
Świderski G., Wojtulewski S., Kalinowska M. et al. // Polyhedron. 2020. V. 175. P. 114173.
Nayak M., Singh A.K., Prakash P. et al. // Inorg. Chim. Acta. 2020. V. 501. P. 119263.
Obaleye J.A., Ajibola A.A., Bernardus V.B. et al. // Inorg. Chim. Acta. 2020. V. 503. P. 119404.
Liu Y., Shi W.-J., Lu Y.-K. et al. // Inorg. Chem. 2019. V. 58. P. 16743.
Huo J., Li H., Yu D., Arulsamy N. // Inorg. Chim. Acta. 2020. V. 502. P. 119310.
Zhang Y., Zhao D., Liu Z. et al. // J. Solid State Chem. 2020. V. 282. P. 121086.
Markad D., Khullar S., Mandal S.K. // Inorg. Chem. 2019. V. 58. P. 12547.
Yan P., Yang J., Hao X. et al. // CrystEngComm. 2020. V. 22. P. 275.
Cui H., Ye Y., Arman H. et al. // Cryst. Growth Des. 2019. V. 19. P. 5829.
Yang H., Wang Y., Krishna R. et al. // J. Am. Chem. Soc. 2020. V. 142. P. 2222.
Бажина Е.С., Гоголева Н.В., Зорина-Тихонова Е.Н. и др. // Журн. структур. химии. 2019. Т. 60. № 6. С. 893 (Bazhina E.S., Gogoleva N.V., Zorina-Tikhonova E.N. et al. // J. Struct. Chem. 2019. V. 60. P. 855).
Бажина Е.С., Александров Г.Г., Ефимов Н.Н. и др. // Изв. АН. Сер. хим. 2013. № 4. С. 962 (Bazhina E.S., Aleksandrov G.G., Efimov N.N. et al. // Russ. Chem. Bull. (Int. Ed.). 2013. V. 62. P. 962).
Бажина Е.С., Александров Г.Г., Кискин М.А. и др. // Изв. АН. Сер. хим. 2016. № 1. С. 249 (Bazhina E.S., Aleksandrov G.G., Kiskin M.A. et al. // Russ. Chem. Bull. (Int. Ed.). 2016. V. 65. P. 249).
Бажина Е.С., Александров Г.Г., Кискин М.А. и др. // Коорд. химия. 2017. Т. 43. № 11. С. 641 (Bazhina E.S., Aleksandrov G.G., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2017. V. 43. P. 709). https://doi.org/10.1134/S107032841711001X
Bazhina E.S., Aleksandrov G.G., Kiskin M.A. et al. // Eur. J. Inorg. Chem. 2018. P. 5075.
Ushakov I.E., Goloveshkin A.S., Zorina-Tikhonova E.N. et al. // Mendeleev Commun. 2019. V. 29. P. 643.
Liu A., Wang C.-C., Wang C.-Z. et al. // J. Colloid Interf. Sci. 2018. V. 512. P. 730.
Hu M., Peng D.-L., Zhao H. et al. // J. Coord. Chem. 2015. V. 68. P. 1947.
Lee D.N., Kim Y. // Acta Crystallogr. E. 2015. V. 71. P. m150.
Baldomá R., Monfort M., Ribas J. et al. // Inorg. Chem. 2006. V. 45. P. 8144.
Bazhina E.S., Gogoleva N.V., Aleksandrov G.G. et al. // Chem. Select. 2018. P. 13765.
Butler K.R., Snow M.R. // Dalton Trans. 1976. P. 251.
Scaringe R.P., Hatfield W.E., Hodgson D.J. // Inorg. Chem. 1977. V. 16. P. 1600.
Lethbridge J.W. // Dalton Trans. 1980. P. 2039.
Radanovic D.J., Trifunovic S.R., Grujic S.A. et al. // Inorg. Chim. Acta. 1989. V. 157. P. 33.
Hernandez-Molina M., Lorenzo-Luis P.A., Ruiz-Perez C. et al. // Inorg. Chim. Acta. 2001. V. 313. P. 87.
Lemmer M., Lerner H.-W., Bolte M. // Acta Crystallogr. E. 2002. V. 58. P. m447.
Ghosh D., Powell D.R., Van Horn J.D. // Acta Crystallogr. E. 2004. V. 60. P. m764.
Delgado F.S., Sanchiz J., Lopez T. et al. // CrystEngComm. 2010. V. 12. P. 2711.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS, Inc., 1997.
Sheldrik G.M. SADABS. Program for Scanning and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 2004.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия