Координационная химия, 2021, T. 47, № 2, стр. 92-108
Влияние фторированных ароматических фрагментов на структуру карбоксилатных комплексов кадмия и цинка на примере пентафторбензоатов и 2,3,4,5-тетрафторбензоатов
М. А. Шмелев 1, *, Г. Н. Кузнецова 1, Ф. М. Долгушин 1, 2, Ю. К. Воронина 1, Н. В. Гоголева 1, М. А. Кискин 1, В. К. Иванов 1, А. А. Сидоров 1, И. Л. Еременко 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: shmelevma@yandex.ru
Поступила в редакцию 27.05.2020
После доработки 01.06.2020
Принята к публикации 05.06.2020
Аннотация
Получена серия карбоксилатных комплексов кадмия и цинка с анионами пентафторбензойной (HРfbz) и 2,3,4,5-тетрафторбензойной (HТfbz) кислот и N-донорными лигандами (Phen = 1,10-фенантролин) и хинолином (Quin)): [Cd(Pfbz)2(Phen)]n (I), [Cd(Рfbz)2(Рhen)2] · 2MeCN (II), [Zn(H2O)- (Рfbz)2(Рhen)] (III), [Zn2Cd(Рfbz)6(Рhen)2] ⋅ 2C6H6 (IV), [Cd2(H2O)2(Tfbz)4(Рhen)2] (V), [Cd2(H2O)2- (Tfbz)4(Quin)2] (VI), [Cd(Tfbz)2(Phen)2] ⋅ HTfbz (VII). Строение новых комплексов I–VII определено методом РСА (CIF files CCDC № 1871300, 2005461, 2005462, 2005464, 2005466, 2005465, 2005459 соответственно). Показано, что для большинства полученных соединений типичны внутримолекулярные стэкинг-взаимодействия между координированными молекулами ароматических N-донорных лигандов и фторированными заместителями карбоксилатных анионов. Такие взаимодействия приводят к образованию необычных, причем разных в случае пентафторбензоатов и тетрафторбензоатов, соединений, в частности координационного полимера I и биядерных комплексов V и VI с координированными молекулами воды. Выделенные соединения цинка и кадмия имеют разное строение и состав.
Задачи синтеза соединений заданного строения связаны не только с молекулярным дизайном, но и с использованием различных типов нековалентных взаимодействий (водородные, галогеновые связи, стэкинг-взаимодействия и др.) на геометрию и кристаллическую упаковку комплексов [1–4]. Исследования в этом направлении могут быть направлены на поиск факторов, обеспечивающих устранение какого-либо типа слабых взаимодействий или, наоборот, его усиления. Среди супрамолекулярных эффектов можно выделить π–π-взаимодействия (стэкинг) между ароматическими фрагментами лигандов. В кристаллической структуре соединений это отражается в параллельном или близкому к параллельному расположению ароматических фрагментов на расстояниях 3.3–3.6 Å [5, 6].
Роль внутримолекулярных и межмолекулярных π–π-взаимодействий между ароматическими системами неоднократно отмечалась нами при описании структур и кристаллических упаковок карбоксилатных комплексов [7–11]. При этом обычно обнаруживалось формирование супрамолекулярных, полимерных или дискретных структур в кристалле или заметное искажение геометрии молекул в случае внутримолекулярного стэкинга.
Известно, что для систем, в которых тем или иным способом сочетаются фторзамещенные и нефторированные ароматические фрагменты, очень типично параллельное расположение всех ароматических циклов и их сближение на расстояния менее 3.5 Å. Например, упаковки бензола и гексафторбензола имеют одинаковый “лестничный” тип кристаллической упаковки, тогда упаковка сокристаллизата C6H6 · C6F6 оказывается более плотной и слоистой [12–14].
Ранее был получен только один подобный координационный полимер кадмия [Cd(Н2О)(Pfbz)2- (Bipy)]n (Bipy = 2,2'-бипиридин) [15], который в отличие от описанных ранее моноядерных и биядерных ацетатов кадмия ([Cd(H2O)(O2CR)2(Bipy)] и [Cd2(H2O)2(O2CR)4(Bipy)2] [16, 17] с аналогичным соотношением Cd : O2CR : L = 1 : 2 : 1, является 1D-координационным полимером. Стабилизацию полимерной структуры авторы связывают с контактами C–H…F, водородными связями и стэкинг-взаимодействиями между фторированными и нефторированными ароматическими фрагментами координированных Bipy и Pfbz. Аналогичная стабилизация полимерных структур наблюдается и в случае пентафторбензоатных комплексов кадмия с молекулами 2,4-лутидина, изохинолина в анионном координационном полимере с катионами 7,8-бензохинолиния [14]. Важно обратить внимание на то, что в данных соединениях с атомами кадмия одновременно связаны лиганды, содержащие незамещенные и перфторированные ароматические заместители. Кроме сочетания ароматических фрагментов указанного типа еще одним фактором, обеспечивающим формирование координационных полимеров, было использование именно комплексов кадмия, поскольку он образует более длинные связи с атомами своего координационного окружения по сравнению с 3d-металлами.
Цель настоящей работы – исследование строения соединений кадмия, формирующихся при сочетании координированных пентафторбензоатных анионов и молекул 1,10-фенантролина (Рhen). Хелатно связанная молекула Рhen имеет конденсированную протяженную ароматическую систему, что создает благоприятные условия для перекрывания с перфторированным ароматическим фрагментом. 2,3,4,5-Тетрафторбензоатные комплексы кадмия были получены для сравнения с ними уникальных свойств именно перфторированных ароматических фрагментов. Комплексы цинка были получены для того, чтобы установить, образует ли он те же соединения, что и кад-мий.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом новых комплексов, выполняли на воздухе с использованием дистиллированной воды, этанола (96%), ацетонитрила (99.9%), бензола (“х. ч.”). Для получения новых соединений использовали следующие реагенты: Cd(NO3)2 ⋅ 4H2O (99%, Acros organics), Zn(NO3)2 ⋅ 6H2O (98%, Acros organics), КОН (“ч. д. а.”), HРfbz (99%, P&M Invest), HТfbz (98%, P&M Invest), моногидрат Рhen (99%, Alfa Aesar), хинолин (Quin, “х. ч.”). [{Cd(Pfbz)(H2O$)_{4}^{ + }$}n ⋅ n(Pfbz)–] получали по описанной ранее методике [18] взаимодействием Cd(OH)2 с HPfbz в воде. Zn(OH)2 и Cd(OH)2 получали реакцией стехиометрических количеств KOH и Zn(NO3)2 ⋅ 6H2O или Cd(NO3)2 · · 4H2O в воде.
ИК-спектры соединений регистрировали на ИК-спектрофотометре с Фурье-преобразованием Spectrum 65 (PerkinElmer) методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 4000–400 см–1. Элементный анализ выполняли на CHNS-анализаторе EuroЕА 3000 (EuroVector).
Синтез [Cd(Pfbz)2(Phen)]n (I). К раствору соединения [{Cd(Pfbz)(H2O$)_{4}^{ + }$}n ⋅ n(Pfbz)–] (0.200 г, 0.332 ммоль) в 35 мл MeCN прибавляли Phen (0.060 г, 0.332 ммоль) и перемешивали при 70°С в течение 7 мин. Бесцветный раствор выдерживали при комнатной температуре и медленном испарении. Образовавшиеся через 3 сут бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным MeCN (T ≈ 5°C) и сушили на воздухе. Выход соединения I 0.154 г (64.8%) в расчете на соединение [{Cd(Pfbz)- (H2O$)_{4}^{ + }$}n ⋅ n(Pfbz)–].
ИК-спектр (НПВО; ν, см–1): 3059 сл, 2292 сл, 2252 ср, 1621 сл, 1594 ср, 1546 ср, 1490 с, 1471 ср, 1427 с, 1374 с, 1343 c, 1290 с, 1223 сл, 1141 cp, 1101 ср, 1039 c, 918 ср, 879 ср, 845 ср, 814 ср, 772 ср, 728 с, 689 ср, 676 ср, 637 сл, 550 cр, 425 cл, 411 ср.
Синтез [Cd(Pfbz)2(Phen)2] · 2MeCN (II) проводили по методу, аналогичному для I, с использованием Phen (0.120 г, 0.664 ммоль). Образовавшиеся через 5 сут бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным MeCN (T ≈ 5°C) и сушили на воздухе. Выход соединения II 0.133 г (42.3%) в расчете на соединение [{Cd(Pfbz)(H2O$)_{4}^{ + }$}n ⋅ n(Pfbz)–].
ИК-спектр (ν, см–1): 3321 сл, 3068 сл, 2984 сл, 1987 сл, 1618 с, 1590 с, 1514 с, 1484 с, 1425 с, 1357 с, 1344 с, 1338 с, 1279 ср, 1224 сл, 1145 сл, 1102 ср, 1092 ср, 1051 сл, 986 с, 916 с, 848 с, 828 ср, 811 сл, 784 сл, 775 сл, 749 с, 739 ср, 722 с, 692 ср, 637 ср, 581 ср, 549 ср, 505 сл, 466 ср.
Синтез [Zn(H2O)(Рfbz)2(Рhen)] (III). К суспензии Zn(OH)2 (0.075 г, 0.757 ммоль) в 25 мл воды добавляли HРfbz (0.322 г, 1.515 ммоль) и перемешивали при 80°С до полного растворения реагентов. Бесцветный раствор упаривали досуха и полученный осадок растворяли в 20 мл MeCN при 70°С. К реакционной смеси добавляли навеску Рhen (0.136 г, 0.757 ммоль) и перемешивали 5 мин при 70°С. Полученный бесцветный раствор выдерживали при комнатной температуре и медленном испарении. Образовавшиеся через 5 сут бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным MeCN (T ≈ 5°C) и сушили на воздухе. Выход соединения III 0.362 г (69.7%) в расчете на Zn(OH)2.
ИК-спектр (ν, см–1): 3437 ср, 3036 сл, 1645 ср, 1604 ср, 1551 с, 1528 с, 1476 ср, 1338 с, 1296 ср, 1142 сл, 1120 ср, 988 с, 939 ср, 808 ср, 774 с, 713 ср, 672 ср, 607 ср, 513 с, 488 ср, 459 сл.
Синтез [Zn2Cd(Рfbz)6(Рhen)2] ⋅ 2C6H6 (IV). К суспензии Zn(OH)2 (0.075 г, 0.757 ммоль) в 25 мл воды добавляли HРfbz (0.322 г, 1.515 ммоль) и перемешивали при 80°С до полного растворения реагентов. Полученный бесцветный раствор упаривали досуха и образовавшийся осадок растворяли в 30 мл MeCN при 70°С. К реакционной смеси добавляли навеску соединения [{Cd(Pfbz)- (H2O$)_{4}^{ + }$}n ⋅ n(Pfbz)–] (0.456 г, 0.757 ммоль) и перемешивали при 70°С до растворения исходных реагентов. Добавляли 10 мл C6H6, Рhen (0.136 г, 0.757 ммоль) и перемешивали 10 мин при 70°С. Бесцветный раствор выдерживали при комнатной температуре и медленном испарении. Образовавшиеся через 8 сут бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным C6H6 (T ≈ 5°C) и сушили на воздухе. Выход соединения IV 0.824 г (53.7%) в расчете на Zn(OH)2.
ИК-спектр (ν, см–1): 2988 сл, 1623 с, 1521 с, 1488 с, 1429 с, 1379 с, 1283 ср, 1225 ср, 1146 сл, 1107 с, 990 с, 928 ср, 870 ср, 845 ср, 822 ср, 768 ср, 744 с, 726 с, 705 ср, 644 ср, 612 ср, 584 сл, 507 ср.
Синтез [Cd2(H2O)2(Тfbz)4(Рhen)2] (V). К суспензии Cd(OH)2 (0.050 г, 0.342 ммоль) в 20 мл воды добавляли HТfbz (0.133 г, 0.685 ммоль) и перемешивали при 80°С до полного растворения реагентов. Полученный бесцветный раствор упаривали досуха и образовавшийся осадок растворяли в 15 мл MeCN при 70°С. К полученному раствору добавляли Рhen (0.062 г, 0.342 ммоль) и перемешивали 5 мин при 70°С. Бесцветный раствор выдерживали при комнатной температуре и медленном испарении. Образовавшиеся через 2 сут бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным MeCN (T ≈ 5°C) и сушили на воздухе. Выход соединения V 0.122 г (51.2%) в расчете на Cd(OH)2.
ИК-спектр (ν, см–1): 3304 с, 3065 ср, 2975 ср, 1980 сл, 1579 с, 1516 с, 1471 с, 1424 ср, 1374 с, 1345 с, 1322 ср, 1286 ср, 1260 ср, 1222 сл, 1998 сл, 1181 сл, 1143 сл, 1095 с, 1029 с, 909 с, 896 ср, 863 ср, 844 с, 803 ср, 772 с, 759 с, 727 ср, 720 ср, 710 с, 692 с, 635 ср, 626 ср, 521 сл, 496 сл, 469 сл.
Синтез [Cd2(H2O)2(Тfbz)4(Quin)2] (VI) проводили по методу, аналогичному для V, с использованием Quin (0.116 мл, 1.027 ммоль). Образовавшиеся через 3 сут бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным MeCN (T ≈ 5°C) и сушили на воздухе. Выход соединения VI 0.106 г (47.9%) в расчете на Cd(OH)2.
ИК-спектр (ν, см–1): 3080 ср, 1719 ср, 1578 с, 1518 с, 1473 с, 1391 с, 1359 с, 1350 с, 1322 ср, 1286 сл, 1262 ср, 1254 ср, 1224 ср, 1202 ср, 1143 ср, 1096 ср, 1025 с, 908 ср, 883 сл, 864 ср, 802 ср, 795 с, 771 ср, 759 ср, 752 с, 686 ср, 639 ср, 617 сл, 555 сл, 521 сл, 469 сл, 455 сл.
Синтез [Cd(Tfbz)2(Рhen)2] . HTfbz (VII) проводили по методу, аналогичному для V, с использованием Рhen (0.124 мг, 0.684 ммоль). Образовавшиеся через 8 сут бесцветные кристаллы, пригодные для РСА, отделяли декантацией, промывали холодным MeCN (T ≈ 5°C) и сушили на воздухе. Выход соединения VII 0.158 г (32.9%) в расчете на HТfbz.
ИК-спектр (ν, см–1): 3079 ср, 2972 ср, 1952 сл, 1728 сл, 1684 ср, 1574 с, 1523 с, 1500 ср, 1476 с, 1430 ср, 1388 с, 1338 ср, 1315 ср, 1288 сл, 1244 сл, 1230 сл, 1195 ср, 1162 сл, 1147 сл, 1118 сл, 1028 с, 951 ср, 913 с, 863 ср, 807 с, 799 ср, 784 с, 750 с, 729 ср, 703 с, 688 ср, 627 ср, 610 ср, 565 сл, 520 сл, 481 ср, 470 сл.
РСА монокристаллов соединений I–VII выполнен на дифрактометре Bruker Apex II или Bruker Apex II DUO, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [19]. Для всех соединений введена полуэмпирическая поправка на поглощение по программе SADABS [20]. Структуры расшифрованы прямыми методами и уточнены полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”, атомы водорода OH-групп локализованы из разностных Фурье-синтезов. Расчеты проведены по комплексу программ SHELX [21] с использованием OLEX 2 [22]. Геометрия полиэдров металлов определена с использованием программы SHAPE 2.1 [23, 24]. Кристаллографические параметры и детали уточнения структур II–VIII приведены в табл. 1, 2; их основные расстояния и углы – в табл. 3, 4; основные расстояния и углы внутри- и межмолекулярных взаимодействий – в табл. 5, 6.
Таблица 1.
Кристаллографические параметры и детали уточнения структур I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| М | 714.74 | 977.07 | 685.73 |
| Т, K | 120(2) | 296(2) | 296(2) |
| Сингония | Моноклинная | Моноклинная | Триклинная |
| Пр. гр. | C2/с | P21/с | P1 |
| a Å | 24.0270(15) | 16.9021(7) | 10.7251(5) |
| b Å | 13.3587(9) | 10.0614(5) | 11.1900(4) |
| c Å | 7.4456(5) | 24.1962(12) | 11.6845(4) |
| α, град | 90 | 90 | 75.3920(10) |
| β, град | 95.4295(13) | 103.918(2) | 79.511(2) |
| γ, град | 90 | 90 | 65.2760(10) |
| V, Å3 | 2379.1(3) | 3994.0(3) | 1227.90(8) |
| Z | 4 | 4 | 2 |
| ρ(выч.), г см3 | 1.995 | 1.625 | 1.855 |
| μ, мм–1 | 1.037 | 0.645 | 1.121 |
| θmax, град | 27.997 | 26.000 | 30.03 |
| Tmin/Tmax | 0.761/0.922 | 0.685/0.746 | 0.649/0.746 |
| Число измеренных рефлексов | 18 016 | 37 974 | 16 251 |
| Число независимых рефлексов | 2786 | 7840 | 7387 |
| Число рефлексов с I > 2σ(I) | 2758 | 5988 | 5776 |
| Rint | 0.0221 | 0.0606 | 0.0485 |
| Число уточняемых параметров | 9858 | 2843 | 6142 |
| GOOF | 1.094 | 1.059 | 1.028 |
| R1 (I > 2σ(I)) | 0.0176 | 0.0513 | 0.0488 |
| wR2 (I > 2σ(I)) | 0.0451 | 0.1308 | 0.1171 |
| Δρmin/Δρmax, е Å–3 | –0.255/0.710 | –0.757/0.707 | –0.350/0.373 |
Таблица 2.
Кристаллографические параметры и детали уточнения структур IV–VII
| Параметр | Значение | |||
|---|---|---|---|---|
| IV | V | VI | VII | |
| М | 2026.18 | 1393.55 | 1291.45 | 1053.05 |
| Т, K | 296(2) | |||
| Сингония | Триклинная | Триклинная | Триклинная | Моноклинная |
| Пр. гр. | P1 | P1 | P1 | P21/n |
| a Å | 13.1039(8) | 8.533(19) | 8.169(5) | 22.5145(14) |
| b Å | 16.3964(10) | 10.45(2) | 12.183(7) | 7.9644(4) |
| c Å | 17.8982(13) | 14.72(4) | 12.299(8) | 23.1560(15) |
| α, град | 83.418(3) | 77.20(9) | 75.68(2) | 90 |
| β, град | 75.851(3) | 86.06(11) | 74.99(2) | 104.127(2) |
| γ, град | 82.578(3) | 76.95(7) | 86.64(2) | 90 |
| V, Å3 | 3683.8(4) | 1247(5) | 1145.5(12) | 4026.6(4) |
| Z | 2 | 1 | 1 | 4 |
| ρ(выч.), г см3 | 1.827 | 1.855 | 1.872 | 1.737 |
| μ, мм–1 | 1.076 | 0.978 | 1.055 | 0.656 |
| θmax, град | 28.395 | 25.997 | 30.16 | 25.998 |
| Tmin/Tmax | 0.593/0.746 | 0.448/ 0.746 | 0.902/0.949 | 0.968/ 0.993 |
| Число измеренных рефлексов | 37 985 | 8972 | 15 869 | 19 560 |
| Число независимых рефлексов | 18545 | 4790 | 4466 | 7865 |
| Число рефлексов с I > 2σ(I) | 9598 | 3701 | 4117 | 5079 |
| Rint | 0.0471 | 0.0438 | 0.0664 | 0.0758 |
| Число уточняемых параметров | 4180 | 4521 | 6036 | 3870 |
| GOOF | 0.947 | 1.042 | 0.982 | 0.971 |
| R1 (I > 2σ(I)) | 0.0528 | 0.0823 | 0.0422 | 0.0552 |
| wR2 (I > 2σ(I)) | 0.1182 | 0.2207 | 0.1223 | 0.1214 |
| Δρmin/Δρmax, е Å–3 | –1.989/0.785 | –1.069/1.751 | –0.924/1.067 | –0.486/0.435 |
Таблица 3.
Основные геометрические характеристики комплексов I, II, V–VII
| Связь | d, Å | ||||
|---|---|---|---|---|---|
| I | II | V | VI | VII | |
| Cd–N(L) | 2.366(1) | 2.387(3)– 2.459(3) | 2.403(8), 2.428(8) | 2.352(3) | 2.343(4)–2.449(4) |
| Cd–O(H2O) | 2.298(7) | 2.332(3) | |||
| Cd–O(O2CR) | 2.425(1)–2.466(1) | 2.281(3)–2.609(4) | 2.241(8)–2.551(8) | 2.325(3)–2.500(4) | 2.219(3), 2.383(3) |
| Cd…Cd | 4.008(3) | 9.728(1) | 4.043(7), 5.569(12) | 4.160(2), 5.174(3) | 7.9644(4) |
| Угол | ω, град | ||||
| CdCdCd | 136.48(2) | ||||
Таблица 4.
Основные геометрические характеристики комплексов III и IV
| Связь | d, Å | |
|---|---|---|
| III | IV | |
| Zn–N(Рhen) | 2.103(2), 2.160(2) | 2.073(3), 2.149(3) |
| Zn–O(H2O) | 2.028(2) | |
| Zn–O(O2CR) | 1.991(2), 2.058(2) | 2.015(3)–2.045(2) |
| Cd–O(O2CR) | 2.240(2)–2.317(3) | |
| Zn…Cd | 7.111(7) | |
| Zn…Zn | 6.663(7) | 3.541(6) |
| Угол | ω, град | |
| ZnCdZn | 177.76(2) | |
Таблица 5.
Геометрические параметры водородных связей и контактов С–H…F в кристалле соединений I–VII
| Водородная связь | Расстояние, Å | D – H–A, град | ||
|---|---|---|---|---|
| D–H | H…A | D…A | ||
| I | ||||
| C(8)–H(8A)…F(3) | 0.95 | 2.52 | 3.417(2) | 158 |
| C(10)–H(10A)…F(6) | 0.95 | 2.47 | 3.416(2) | 175 |
| II | ||||
| C(1B)–H(1BA)…F(14A) | 1.10 | 2.48 | 3.36(2) | 137 |
| C(1D)–H(1DA)…F(12A) | 1.10 | 2.33 | 3.16(3) | 131 |
| C(1D)–H(1DB)…F(10A) | 1.10 | 2.17 | 3.26(2) | 169 |
| C(16)–H(16)…F(14B) | 0.93 | 2.53 | 3.44(2) | 168 |
| C(1D)–H(1DB)…F(11A) | 1.10 | 2.49 | 3.20(2) | 121 |
| C(1D)–H(1DB)…F(10B) | 1.10 | 2.37 | 3.44(2) | 163 |
| III | ||||
| O(1)–H(1A)…O(3) | 0.82(4) | 1.91(4) | 2.724(3) | 172(4) |
| O(1)–H(1B)…O(5) | 0.93(3) | 1.70(3) | 2.601(3) | 162(3) |
| C(11)–H(6)…F(4) | 0.93 | 2.43 | 3.243(4) | 146 |
| IV | ||||
| C(50)–H(50)…F(14) | 0.93 | 2.39 | 3.145(4) | 139 |
| C(72)–H(72)…F(11) | 0.93 | 2.47 | 3.244(6) | 138 |
| C(74)–H(74)…F(28) | 0.93 | 2.45 | 3.100(4) | 127 |
| V | ||||
| O(5)–H(5A)…O(1) | 0.91 | 1.89 | 2.710(11) | 148 |
| O(5)–H(5B)…O(4) | 0.92 | 1.83 | 2.735(13) | 169 |
| C(19)–H(19)…F(5) | 0.93 | 2.52 | 3.214(17) | 132 |
| VI | ||||
| O(5)–H(5A)…O(2) | 0.87 | 1.88 | 2.720(7) | 163 |
| O(4S)–H(5B)…O(3) | 0.87 | 2.21 | 2.910(6) | 137 |
| VII | ||||
| O(5)–H(5)…O(2) | 0.82 | 1.77 | 2.555(5) | 161 |
| C(34)–H(34)…F(11) | 0.93 | 2.39 | 2.795(9) | 106 |
| C(38)–H(38)…F(12A) | 0.93 | 2.55 | 3.374(8) | 148 |
Таблица 6.
Таблица π…π-взаимодействий в кристаллических упаковках комплексов I–VII
| Взаимодействие | Cg–Cg*, Å | Cg–Perp*, Å | α, град | β, град | γ, град |
|---|---|---|---|---|---|
| I | |||||
| Рhen–Рfbz | 3.782(9) | 3.241(6) | 9.78(7) | 21.8 | 31.1 |
| II | |||||
| Рhen–Рhen | 3.885(3) | 3.408(2) | 1.1(3) | 28.7 | 28.7 |
| Рhen–Рhen | 3.797(3) | 3.456(2) | 1.4(3) | 24.7 | 24.4 |
| III | |||||
| Рhen–Рfbz | 3.752(2) | 3.528(1) | 4.32(13) | 19.9 | 19.9 |
| Рhen–Рhen | 3.640(1) | 3.416(1) | 1.69(10) | 12.3 | 12.1 |
| IV | |||||
| Рhen–C6H6 | 3.792(3) | 3.6683(17) | 10.1(3) | 13.1 | 14.7 |
| Рhen–C6H6 | 3.704(3) | 3.4543(10) | 9.3(2) | 20.9 | 12.1 |
| V | |||||
| Рhen–Рfbz | 3.506(11) | 3.424(5) | 15.5 | 12.4 | 6.5(4) |
| Рhen–Рfbz | 3.456(11) | 3.423(5) | 2.1 | 7.9 | 6.5(5) |
| Рhen–Рhen | 3.491(11) | 3.461(3) | 7.6 | 7.4 | 0.3(4) |
| VI | |||||
| Quin–Hfbz | 3.845(5) | 3.536(3) | 17.8 | 23.2 | 8.5(3) |
| Hfbz–Hfbz | 3.571(5) | 3.506(3) | 0.0(4) | 10.9 | 10.9 |
| Quin–Quin | 3.658(4) | 3.540(3) | 14.6 | 13.9 | 0.9(3) |
| VII | |||||
| Рhen–Рhen | 3.721(3) | 3.405(2) | 0.0(3) | 23.8 | 23.8 |
| Рhen–Тfbz | 3.810(3) | 3.369(2) | 6.7(2) | 22.4 | 27.0 |
| Рhen–Тfbz | 3.439(3) | 3.284(2) | 6.8(2) | 10.6 | 17.3 |
Координаты атомов и другие параметры соединений I–VII депонированы в Кембриджском банке структурных данных (CCDC № 1871300, 2005461, 2005462, 2005464, 2005466, 2005465, 2005459 соответственно; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТЫ И ИХ ОБСУЖДЕНИЕ
В качестве исходного соединения кадмия использовали [{Cd(Pfbz)$\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)_{{\text{4}}}^{ + }$}n ⋅ n(Pfbz)–] [18], при взаимодействии которого с Phen, в зависимости от соотношения Cd : Phen = 1 : 1 или 1 : 2, формируется координационный полимер I или молекулярный комплекс II соответственно. Цинк при стехиометрическом соотношении исходных реагентов образовывал молекулярный моноядерный комплекс III. Реакция Zn(Pfbz)2 (полученного in situ) с последующим добавлением [{Cd(Pfbz)(H2O$)_{4}^{ + }$}n ⋅ ⋅ n(Pfbz)–] и Phen (Zn : Cd : Phen = 1 : 1 : 1) привела к образованию гетерометаллического комплекса IV. В случае 2,3,4,5-тетрафторбензоатов были полученымолекулярные комплексы V, VI и VII. Синтез и строениекомплексов I–VII представлены насхеме 1 .
Схема 1 .
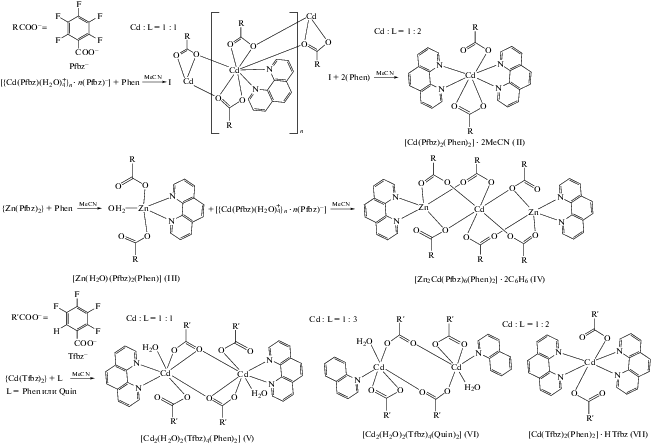
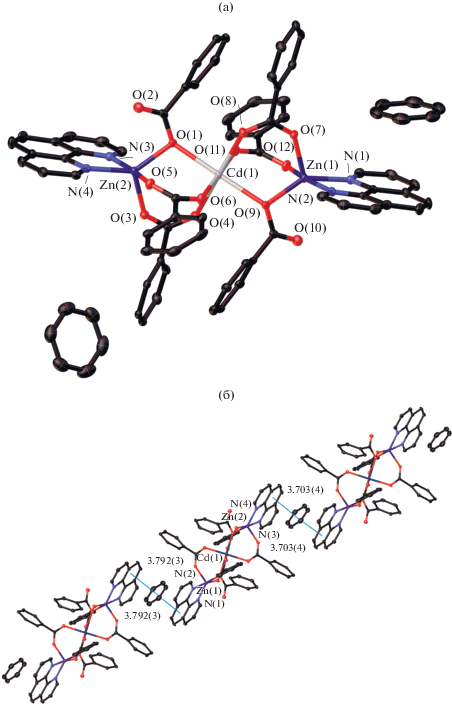
Мы использовали 1,10-фенантролин для увеличения вероятности формирования межмолекулярных взаимодействий в кристалле комплексов, поскольку отмечается большая тенденция его участия в образовании межмолекулярных взаимодействий в кристаллических упаковках, чем в комплексах с 2,2'-бипиридином [6]. Соединение I (рис. 1), построено из эквивалентных симметричных (ось второго порядка проходит через атом кадмия) моноядерных фрагментов {Cd(Рfbz)2(Рhen)}. Атомы Cd связаны хелатно-мостиковыми пентафторбензоатными анионами так, что из четырех карбоксилатных анионов координированных каждым атомом Cd, два образуют с металлом хелатный цикл. Каждый атом металла достраивает свое окружение координацией атомов N молекулы Рhen до квадратной антипризмы (CdN2O6). Основные расстояния и углы комплекса I представлены в табл. 3.
В кристалле комплекса I наблюдается параллельная ориентация всех ароматических фрагментов Рf-bz и Рhen внутри одной полимерной цепи, что может свидетельствовать о наличии стэкинг-взаимодействий. Такое расположение ароматических фрагментов, по-видимому, приводит к разблокированию металлоцентра и создает условия благоприятные для формирования координационного полимера. Вероятно, стабилизация полимерной структуры связана со стэкинг-взаимодействиями коор-динированных молекул Рhen и пентафторфенильных заместителей внутри цепочки. Атомы водорода молекул Рhen участвуют в контактах C–H...F с атомами фтора Рfbz-анионов трех соседних полимерных цепочек. Основные расстояния и углы внутри- и межмолекулярных взаимодействий комплекса I представлены в табл. 5, 6.
Использование Рhen приводит к формированию более “плотной” упаковки полимера по сравнению с описанным в литературе соединением [Cd(H2O)(Рfbz)2(Вipy)]n [15], где атомы металла связаны только одним мостиковым Рfbz-анионом и расстояние между ними составляет 5.079 Å против 4.008 Å в случае соединения I.
Соединение I сохраняет свой состав и строение при перекристаллизации его из этанола или бензола.
Из литературы известно, что для комплексов кадмия с анионами монокарбоновых кислот и 1,10-фенантролином состава [Cd(O2CR)2(Рhen)] характерно формирование молекулярных структур [25–31]. Так, 2,4,5-трифторбензоатный, 2‑фторбензоатный и бензоатный комплексы кадмия содержат карбоксилатные анионы, имеющие очень близкие к пентафторбензоатному аниону геометрические характеристики при точно таком же составе, как в I, и являются биядерными молекулярными комплексами [26, 29]. Комплексы кадмия с анионами 2-гидрокси-1-нафтойной, 1‑нафтойной и 6-гидрокси-1-нафтойной кислот с 1,10-фенантролином аналогичного состава также биядерные молекулярные комплексы [28, 31, 32]. Однако известно несколько полимерных структур для комплексов кадмия, в которых молекулы Рhen сочетаются с различными ароматическими анионами монокарбоновых кислот (2,4,6-триметилбензойной [33], 3-(2-фурил)акриловой [34], 3,5-диметилбензойной [35]) состава [Cd(RCOO)2(Рhen)]n или [Cd(H2O)(RCOO)2(Рhen)]n. 2-Фуранакрилатный полимер построен с участием хелатно-мостиковых карбоксилатных анионов, расстояние Cd…Cd соответствует минимальному среди рассматриваемых соединений (4.174 Å), при этом соседние координационные полиэдры атомов металла имеют общее ребро. В 3,5-диметилбензоатном полимере соседние атомы кадмия связаны также двумя мостиковыми карбоксилатными анионами, но они не образуют одновременно хелатных циклов, поэтому координационные полиэдры соседних атомов Cd не имеют общих атомов и наблюдается более растянутая или “рыхлая” полимерная цепочка. 3,4,6-Триметилбензоатный полимер образован атомами кадмия, связанными только одним мостиковым карбоксилатным анионом, второй же карбоксилат-анион связан монодентатно только с одним металлоцентром, координационное окружение которого достраивает молекула воды. В кристалле формируется максимально “растянутый” и, вероятно, наименее прочно связанный полимер, но именно в этом случае наблюдается параллельная ориентация ароматических фрагментов Рhen и аниона монокарбоновой кислоты, аналогичная в I.
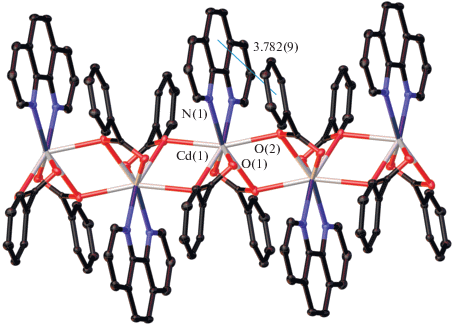
С увеличением количества Рhen в координационной сфере атома кадмия меняется и ядерность комплекса, соединение II (рис. 2) моноядерное, как и большинство известных карбоксилатных комплексов аналогичного состава [30, 36–46].
В структуре комплекса II атом Cd достраивает свое окружение до одношапочного октаэдра координацией хелатно и монодентатно связанных Рfbz анионов и четырех атомов N двух молекул Рhen (CdO3N4). Основные расстояния и углы комплекса II представлены в табл. 3.
Анализ кристаллической упаковки II выявил, что одна из координированных молекул Рhen участвует в стэкинг-взаимодействиях с двумя ароматическими фрагментами Рhen двух соседних молекул комплекса. Атомы водорода Рhen и сольватных молекул ацетонитрила участвуют в контактах C–H…F с атомами F Рfbz-анионов. Основные расстояния и углы внутри- и межмолекулярных взаимодействий комплекса II представлены в табл. 5, 6.
На примере комплекса II наблюдаются неблагоприятные условия для образования полиядерной и полимерной структур, что, по-видимому, связано с уменьшением конформационной подвижности молекулы и экранированием металлоцентра (или резким уменьшением возможности разблокирования металлоцентра, необходимого для формирования полиядерной структуры).
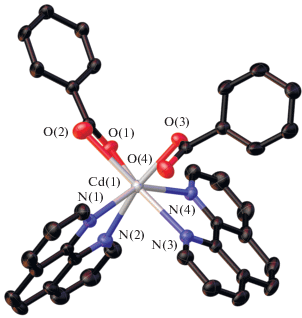
В условиях кристаллизации, аналогичных синтезу I, цинк не образует координационных полимеров, нам удалось выделить только моноядерный комплекс III (рис. 3). В структуре III атом Zn координирует три атома кислорода двух монодентатно связанных Рfbz-анионов и молекулы воды и два атома N молекулы Рhen, достраивая свое окружение до квадратной пирамиды (ZnO3N2, τ(Zn) = 0.1). Моноядерное строение для комплексов состава {Zn(H2O)(Рhen)(RCOO)2} типично [47–50]. Основные длины связей комплекса III представлены в табл. 4.
Рис. 3.
Фрагмент кристаллической упаковки комплекса III: его димерная молекула (а), супрамолекулярные стопки ароматических фрагментов Рhen и Рfbz вдоль оси b (б). Атомы фтора не показаны. Показаны атомы водорода, участвующие в водородном связывании.
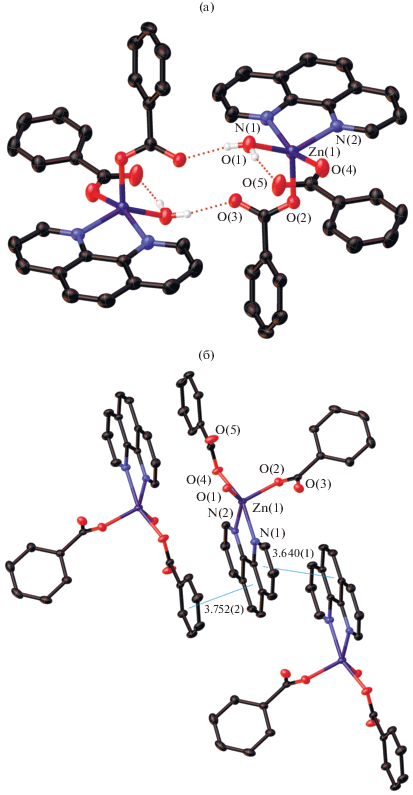
В упаковке комплекса III атомы водорода координированных молекул воды задействованы во внутри- и межмолекулярных водородных связях с атомами O Рfbz-анионов, что приводит к димеризации молекул комплекса (рис. 3а). Аналогично соединению I, наблюдаются стэкинг-взаимодействия Рfbz-анионов и ароматических колец Рhen двух соседних молекул III. Кроме того, в кристалле присутствуют π–π-взаимодействия между Рhen двух соседних моноядерных фрагментов, в результате в упаковке III формируются супрамолекулярные стопки ароматических фрагментов Рhen и Рfbz вдоль оси b (рис. 3б). Атомы водорода молекул Рhen задействованы в межмолекулярных контактах C–H…F с атомами фтора Рfbz-анионов. Основные расстояния и углы внутри- и межмолекулярных взаимодействий комплекса III представлены в табл. 5, 6.
При охлаждении более концентрированных растворов (реакционную смесь упаривали до 5 мл) соединения III образовывались прозрачные гели, подверженные синерезису. Тогда как для комплекса III молекулярное строение представляется вполне закономерным и ожидаемым, его способность формировать в концентрированных растворах в бензоле, ацетонитриле и этаноле гели оказалась весьма неожиданной. По-видимому, можно допустить, что в растворах может наблюдаться образование ассоциатов и формирование олигомеров, имеющих структурный мотив, который наблюдается в пентафторбензоатном координационном полимере кадмия [Cd(H2O)(Рfbz)2(Вipy)]n [15].
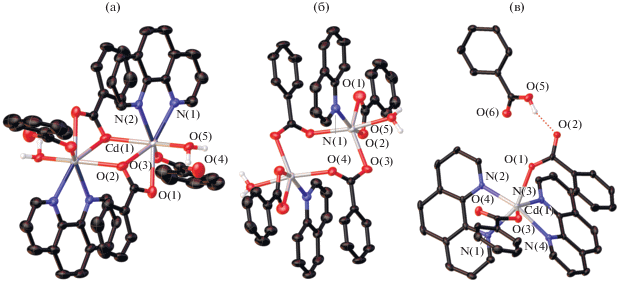
Состав комплекса III аналогичен I, и его строение проанализировано в сравнении. При наложении структур комплексов I и III было выявлено, что, в отличие от фрагмента полимерной цепочки I, где за счет внутримолекулярных взаимодействий Рfbz-анионы лежат в плоскостях, близких с плоскостью Рhen, и угол между плоскостями Рfbz-анионов и молекул Рhen составляет 9.87° и 10.18°, в структуре моноядерного комплекса III место одного из Рfbz-анионов комплекса I занимает координированная молекула воды, а второй Рfbz-анион сильно отклоняется от плоскости Рhen (угол между плоскостями составляет 75.43°), тем самым блокируя часть координационных мест металлоцентра (рис. 4). Также в случае комплекса III наблюдается значительное увеличение расстояния M…M с 4.008(3) Å для I до 4.969(6) Å для III. Это может быть связано с более слабыми межмолекулярными взаимодействиями и влиянием координированной атомом цинка молекулы воды на структуру и кристаллическую упаковку комплекса III.
Рис. 4.
Наложение фрагмента полимерной цепочки комплекса I (зеленый) и молекула комплекса III (красный). Атомы водорода не показаны. Атомы углерода в структуре I показаны шарами.
Также интересным представляется сравнить соединение III с бипиридиновым комплексом [Cd(H2O)(Рfbz)2(Вipy)]n [15] аналогичного состава. Несмотря на схожесть состава, строение комплексов сильно различается уже на уровне длин связей М–O(N) и валентных углов O(N)MO(N). Данные отличия слишком значительны, чтобы объяснять их исключительно разностью атомных радиусов цинка и кадмия. В частности, если в комплексе цинка максимальный угол между Рhen и Рfbz, то в комплексе кадмия – между двумя Рf-bz; углы между плоскостями лигандов составляют в комплексе цинка 3.55° и 75.87° между Рhen и Рfbz и 73.99° между плоскостями Рfbz, в комплексе кадмия – между плоскостями бипиридина и Рfbz 14.06° и 20.33°, а между Рfbz – 31.46°. Углы между центроидами N-донорных заместителей и водой составляют 121.83° в комплексe цинка и 83.28° – в комплексе кадмия. Таким образом, комплексы имеют совершенно различное геометрическое строение, что может быть как причиной, так и следствием полимерного и молекулярного строения этих соединений.
Мы также исследовали возможность получения структурного аналога I при замещении половины атомов кадмия на атомы цинка. Попытка синтеза гетерометаллического полимерного {ZnCd} пентафторбензоатного комплекса с Рhen и кристаллизация из бензола привела к получению молекулярного трехъядерного соединения IV (рис. 5а). В структуре соединения IV каждый концевой атом цинка связан с центральным атомом кадмия, находящимся в октаэдрическом окружении, двумя мостиковыми Рfbz-анионами и одним мостиковым атомом кислорода третьего Рfbz-аниона. Концевые атомы цинка достраивают свое окружение до октаэдрического координацией атомов N молекулы Рhen. Основные длины связей комплекса IV представлены в табл. 4.
Рис. 5.
Строение комплекса IV (а) и фрагмент его кристаллической упаковки (б). Атомы водорода и фтора не показаны.
Заметим, что из литературы известно два сходных трехъядерных гетерометаллических комплекса состава {Zn2Cd(O2CR)6(L)2} с анионами бензойной кислоты и 1,2-бипиридинэтаном [51], а также анионами кротоновой кислоты и хинолином [52].
Сольватные молекулы C6H6 участвуют в стэкинг-взаимодействиях с ароматическими фрагментами Рhen двух соседних молекул комплекса одновременно, формируя супрамолекулярные стопки параллельно плоскости ac (рис. 5б). Основные геометрические характеристики внутри- и межмолекулярных взаимодействий комплекса IV представлены в табл. 5, 6.
Получение соединений I, III и IV показывает, что в цинк-кадмиевой системе могут формироваться весьма неожиданные структуры, полную информацию о которых можно будет получить после детального исследования.
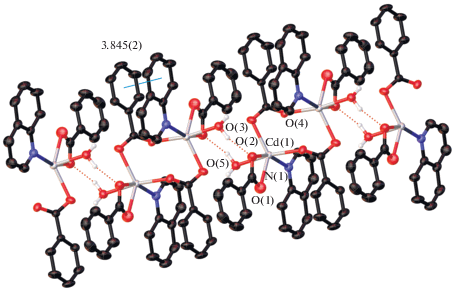
Выше было сказано, что 2,4,5-трифторбензоатный, 2-фторбензоатный и бензоатный комплексы кадмия, имеющие такой же состав, как в I, являются биядерными молекулярными комплексами [26, 29, 53]. Мы предположили, что в случае 2,3,4,5-тетрафторбензоатных соединений может наблюдаться пограничная ситуация. Строение и состав 2,3,4,5-тетрафторбензоатного комплекса с Рhen V (рис. 6а) существенно отличались от всех известных биядерных комплексов кадмия с хелатирующими лигандами [17, 26, 31, 54–56]. Во фрагменте {Cd2(Тfbz)4(Рhen)2} расположение ароматических лигандов такое же, как в соединении I. Однако координация молекулы воды атомом Cd, по-видимому, блокирует возможность формирования 1D-структуры. В случае тетрафторбензоатного комплекса вероятность получения пограничной ситуации между формированием полимера типа I и известными биядерными комплексами с хелатирующими лигандами подтвердилась. Этот результат показал целесообразность получения и тетрафторбензоатного комплекса с монодентатным ароматическим лигандом. В биядерном комплексе с хинолином VI (рис. 6б) также наблюдалась геометрия фрагмента {Cd2(Тfbz)4(Рhen)2}, но координационное место в окружении атома кадмия достроено молекулой воды, что, вероятно, также блокирует возможность формирования полимерной структуры.
Рис. 6.
Строение комплексов V (а), VI (б) и VII (в). Атомы фтора не показаны. Показаны атомы водорода, участвующие в водородном связывании.
Интересно отметить, что в случае пентафторбензоатного комплекса с 2,4-лутидином, как и с хинолином, формально являющимся α-замещенным пиридином, образуется координационный полимер, построенный на основе биядерных фрагментов, в которых атомы кадмия связывают четыре мостиковых карбоксильных аниона [18]. Иными словами, в случае монодентатного лиганда мы наблюдаем образование (как и для 1,10-фенантролина) аналогичного биядерного металлокарбоксилатного фрагмента, который также стабилизирован в форме молекулярного соединения за счет координации молекул воды.
В комплексах V и VI атомы кадмия связаны между собой двумя мостиковыми (комплекс VI) или двумя хелатно-мостиковыми (комплекс V) Тfbz-анионами. Атомы кадмия в VI достраивают свое окружение до октаэдрического координацией атома N молекулы Quin, молекулы воды и хелатно связанного Tfbz-аниона (CdO5N). Атомы металла комплекса V достраивают свое окружение до одношапочной тригональной призмы (CdO5N2) координацией молекулы Phen, воды и атома кислорода мостикового Pfbz-аниона, координирующегося одним атомом О. Основные длины связей и углы для комплексов V и VI представлены в табл. 3.
В упаковке комплексов V и VI за счет водородного связывания координированных молекул воды с атомами кислорода Tfbz-анионов соседних биядерных фрагментов формируются супрамолекулярные цепочки вдоль оси а (рис. 7).
Рис. 7.
Фрагмент кристаллической упаковки комплекса VI. Атомы фтора не показаны. Показаны атомы водорода, участвующие в водородном связывании.
Каждая молекула N-донорного лиганда комплексов V и VI участвует во внутримолекулярных стэкинг-взаимодействиях с Tfbz-анионом, а также взаимодействует с N-донорным лигандом соседней молекулы комплекса. В упаковке комплекса VI формируются дополнительные межмолекулярные стэкинг-взаимодействия между парами Tfbz-анионов, тогда как в кристаллической упаковке соединения V аналогичные явления не наблюдаются. Атомы фтора анионов карбоновой кислоты участвуют в контактах C–H…F с атомами водорода молекул воды и N-донорных лигандов.
Молекулы Phen и ароматические фрагменты Pfbz- или Tfbz-анионов в I и V участвуют в аналогичных внутримолекулярных стэкинг-взаимодействиях. Дистанция между плоскостями Phen и Tfbz в V сокращается по сравнению с пентафторбензоатным полимером I, а расстояние Cd…Cd в случае V увеличивается. Расстояния контактов C–H…F в V и I имеют близкие значения.
Для V наблюдается укорочение расстояния Cd…Cd (4.043(7) Å) по сравнению с VI (4.160(2) Å). Различие в типах координации Tfbz-анионов и расстояниях между атомами металлов в V и VI может быть связано с более сильными внутримолекулярными взаимодействиями между ароматическими фрагментами N-донорного лиганда и карбоксилатными анионами, о чем также свидетельствует сокращение расстояния между плоскостями ароматических лигандов (расстояния между центроидами и угол между плоскостями составляют 3.846 Å и 8.78° для VI; 3.634 Å и 6.57° для V). Основные углы и расстояния внутри- и межмолекулярных взаимодействий для комплексов V и VI представлены в табл. 5, 6.
Строение изученных комплексов I и V в целом похоже, несмотря на то что I – полимер, а V – биядерный комплекс. Координационное место, занятое в V молекулой воды, в полимере принадлежит атому кислорода карбонильной группы хелатного лиганда. При возможности удаления молекулы воды геометрия биядерных фрагментов, вероятно, была бы “идеальной” для самосборки 1D-координационного полимера. Однако есть еще одно, возможно, очень значимое различие. Так, если в полимерной цепочке все ароматические фрагменты лигандов расположены почти параллельно (углы между Рhen и Тfbz составляют 9.83° и 11.66°, а между двумя Рfbz – 15.19°), то в биядерном комплексе один из Тfbz развернут практически перпендикулярно плоскостям остальных лигандов (углы между Рhen и Тfbz составляют 6.31° и 88.87°, а между двумя Рfbz – 82.63°). Как и следовало ожидать, такая разница в расположении ароматических фрагментов приводит к разнице в топологии π…π-перекрываний в кристалле.
Как и в случае пентафторбензоатного комплекса кадмия II, при взаимодействии 2,3,4,5-тетрафторбензоата кадмия с двухкратным избытком Рhen (Cd : L = 1 : 2) формируется моноядерный комплекс VII (рис. 6в). В структуре VII атом кадмия достраивает свое окружение до тригональной призмы координацией четырех атомов N двух молекул Рhen и двух атомов О двух Тfbz-анионов (CdO2N4). Основные расстояния и углы комплекса VII представлены в табл. 3.
Не участвующая в координации к атому металла молекула HТfbz связана водородной связью с атомом кислорода карбоксильной группы Тfbz-аниона. Координированные молекулы Рhen задействованы в меж- и внутримолекулярных стэкинг-взаимодействиях с ароматическими фрагментами координированных Тfbz-анионов. Основные расстояния и углы внутри- и межмолекулярных взаимодействий комплекса VII представлены в табл. 5, 6.
Таким образом, мы получили три соединения (II, IV, VI), в которых на один атом металла приходится одна координированная молекула фенантролина. Для карбоксилатов цинка, как и для других аналогичных комплексов 3d-металлов такого состава характерно моноядерное строение [57–63], т.е. в случае пентафторбензоатов цинка нам пока не удается зафиксировать в кристаллическом состоянии какого-либо нетипичного для 3d-металлов строения. Это, по-видимому, связано с меньшими длинами связей, образуемых этими металлами. При сравнении комплексов II и VI можно отметить, что строение биядерного фрагмента, “вырезанного” из полимерной цепочки II и комплекса VI достаточно близко. Так, координированные молекулы Рhen и ароматические фрагменты Рfbz- или Тfbz-анионов участвуют в аналогичных внутримолекулярных стэкинг-взаимодействиях. Однако в случае пентафторбензоатного соединения формируется координационный полимер, а в случае тетрафторбензоата наблюдается стабилизация биядерного молекулярного комплекса за счет координации молекул воды. Маловероятно, что в растворе, из которого кристаллизуется координационный полимер, кадмий присутствует в виде аналога комплекса VI, поскольку такой комплекс был бы, вероятно, устойчив, как, например, вышеупомянутые [Cd(H2O)(Рfbz)2-(Вipy)]n. Более того, представляется маловероятным существование кадмия в виде биядерных комплексов [Cd2(Рhen)2(OOCR)4], характерных для трифторбензоатного, монофторбензоатного и бензоатного соединений кадмия, в которых карбоксилатные анионы и хелатирующие лиганды экранируют металлоцентры, обеспечивая устойчивость молекулярной структуры. Недавно полученные нами данные показали, что для самых различных типов пентафторбензоатных комплексов при координации монодентатных или хелатирующих лигандов характерно разблокирование металлоцентров за счет внутримолекулярных стэкинг-взаимодействий и формирование координационных полимеров [18], а для образования стабильного молекулярного комплекса требуется координация двух молекул хелатирующего N-донорного лиганда, как наблюдалось для соединения III. В данном случае можно предположить, что в растворе, из которого кристаллизуется координационный полимер II, кадмий присутствует в виде комплекса, имеющего иное строение по сравнению с известными тетрафторбензоатным и трифторбензоатным биядерными соедиениями. В отличие от 3d-металлов кадмий с хелатирующими лигандами может формировать не только биядерные комплексы с двумя мостиковыми (или хелатно-мостиковыми) карбоксилатными анионами, но четырехмостиковые комплексы со структурой китайского фонарика [64–66]. Можно допустить, что формирование координационного полимера происходит за счет взаимодействия биядерных комплексов со структурой китайского фонарика. Косвенно наше предположение можно подтвердить примером формирования координационного полимера из четырехмостиковых фрагментов [Cd2(2,4-Lut)4(Рfbz)4] [18]. Источником воды в случае VI, VII, вероятно, был необезвоженный продажный растворитель, а также исходная соль кадмия. С другой стороны, именно этот растворитель мы использовали и для синтеза II, III, однако полученные комплексы кадмия не содержали координированных молекул воды. В случае удаления молекулы воды геометрия биядерных фрагментов была бы “идеальной” для самосборки 1D-координационного полимера. Координированная молекула воды оказалась весьма прочно связанной: после двухчасового кипячения толуольного раствора соединения VI был выделен только исходный комплекс VI.
Очевидно, для того чтобы обсуждаемые стэкинг-взаимодействия фторированных ароматических фрагментов и ароматических N-донорных лигандов приводили к формированию структуры координационного полимера, необходимо добиваться не только внутримолекулярных взаимодействий, приводящих к разблокированию металлоцентров, но и отсутствия в реакционной среде (в реакционном растворе) молекул, стабилизирующих реакционноспособные металлофрагменты в форме устойчивых молекулярных комплексов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Baykov S.V., Filimonov S.I., Rozhkov A.V. et al. // Cryst. Growth Des. 2020. V. 20. № 2. P. 995.
Adonin S.A, Bondarenko M.A., Novikov A.S., Sokolov M.N. // Crystals. 2020. V. 10. № 4. P. 289.
Бондаренко М.А., Адонин С.А., Новиков А.С. и др. // Коорд. химия. 2020. Т. 46. № 5. С. 264 (Bondarenko M.A., Adonin S.A., Novikov A.S. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 5. P. 302). https://doi.org/10.1134/S1070328420040016
Адонин С.А., Новиков А.С., Федин В.П. // Коорд. химия. 2020. Т. 46. № 1. С. 40 (Adonin S.A., Novikov A.S., Fedin V.P. // Russ. J. Coord. Chem. 2020. V. 46. № 1. P. 37). https://doi.org/10.1134/S1070328420010017
Malenov D.P., Janjić G.V., Medaković V.B. et al. // Coord. Chem. Rev. 2017. V. 345. P. 318.
Goldberg A., Kiskin M., Shalygina O. et al. // Chem. Asian J. 2006. V. 11. № 4 P. 604.
Шмелев М.А., Гоголева Н.В., Макаров Д.А. и др. // Коорд. химия. 2020. Т. 46. № 1. С. 3 (Shmelev M.A., Gogoleva N.V., Makarov D.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 1. P. 3). https://doi.org/10.1134/S1070328420010017
Шмелев М.А., Гоголева Н.В., Долгушин Ф.М. и др. // Коорд. химия. 2020. Т. 46. № 7. С. 437 (Shmelev M.A., Gogoleva N.V., Dolgushin F.M. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 7. P. 493). https://doi.org/10.1134/S1070328420070076
Фомина И.Г., Сидоров А.А., Александров Г.Г. и др. // Изв. АН. Сер. хим. 2004. № 7. С. 1422.
Талисманова М.О., Сидоров А.А., Александров Г.Г. и др. // Изв. АН. Сер. хим. 2001. № 11. С. 2149.
Гольдберг А.Е., Кискин М.А., Козюхин С.А. и др. // Изв. АН. Сер. хим. 2011. № 5. С. 987.
Cockcroft J.K., Rosu-Finsen A., Fitch A.N. et al. // Cryst-EngComm. 2018. V. 20. P. 6677.
Collings J.C., Roscoe K.P., Robins E.G. et al. // New J. Chem. 2012. V. 26. P. 1740.
Imai Y., Kawaguchi K., Sato T. et al. // Mol. Cryst. Liq. Cryst. 2008. V. 487. P. 153.
Kong Y.-J., Li P., Han L.-J. et al. // Acta Crystallogr. C. 2017. V. 73. P. 424.
Neto J.A.do N., da Silva C.C., Ribeiro L. et al. // Z. Krist. Cryst. Mater. 2019. V. 234. P. 119.
Ye Bao-Hui, Chen Xiao-Ming, Xue Feng et al. // Inorg. Chim. Acta. 2000. V. 299. P. 1.
Шмелев М.А., Гоголева Н.В., Кузнецова Г.Н. и др. // Коорд. химия. 2020. № 8. С. 497 (Shmelev M.A., Gogoleva N.V., Kuznetsova G.N. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 8. P. 557). https://doi.org/10.1134/S1070328420080060
SMART (control) and SAINT (integration). Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. SADABS. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J et al. // J. A-ppl. Crystallogr. 2009. V. 42. P. 339.
Alvarez S., Llunell M. // Dalton Trans. 2000. № 19. P. 3288.
Casanova D., Llunell M., Alemany P., Alvarez S. // Chem. Eur. J. 2005. V. 11. P. 1479.
Nath J., Tarai A., Baruah J.B. // ACS Omega. 2019. V. 4. P. 18444.
Li Hong-Jin, Gao Zhu-Qing, Gu Jin-Zhong // Acta Crystallogr. E. 2011.V. 67. P. m 919.
Zhang Z.Y., Bi C.F., Fan Y.H. et al. // Russ. J. Coord. Chem. 2015. V. 41. P. 246. https://doi.org/10.1134/S1070328415030094
Hu Min, Yang Xiao-Gang, Zhang Qiang et al. // Z. Anorg. Allg. Chem. 2011. V. 637. P. 478.
Lou Qi-Zheng // Z. Kristallogr. New Cryst. Struct. 2007. V. 222. P. 105.
Haldar R., Prasad K., Samanta P.K. et al // Cryst. Growth Des. 2016. V. 16. P. 82.
Dai P.X., Yang E.C., Zhao X.J. // Russ. J. Coord. Chem. 2015. V. 41. P. 16. https://doi.org/10.1134/S1070328415010029
Liu Chun-Sen, Hu Min, Guo Liang-Qi // Crystallogr. E. 2009. V. 65. P. m1432.
Li Wei, Li Chang-Hong, Yang Ying-Qun et al. // Wuji Huaxue Xuebao (Chin. J. Inorg. Chem.). 2007. V. 23. P. 2013.
Li Wei, Li Chang-Hong, Yang Ying-Qun, Li Dong-Ping // Wuji Huaxue Xueba (Chin. J. Inorg. Chem.). 2008. V. 24. P. 2060.
Chen Man-Sheng, Zhang Chun-Hua, Kuang Dai-Zhi et al. // Acta Crystallogr. 2007. V. 63. P. m965.
Pan Tian-Tian, Liu Jia-Geng, Xu Duan-Jun // Acta Crystallogr. E. 2006. V. 62. P. m1597.
Yu Yu-Ye // Acta Crystallogr. E. 2011. V. 67. P. m246.
Banrabah R., Viossat B., Lemoine P. // Z. Kristallogr. NCS. 2011. V. 226. P. 291.
Qiu Yongcai, Wang Kunnan, Liu Yan et al. // Inorg. Chim. Acta. 2007. V. 360. P. 1819.
Sen S., Saha M.K., Kundu P. et al. // Inorg. Chim. Acta. 1999. V. 288. P. 118.
Zhang Bing-Yu, Nie Jing-Jing, Xu Duan-Jun // Acta Crystallogr. E. 2008. V. 64. P. m937.
Roy S., Bauza A., Frontera A. et al. // CrystEngComm. 2015. V. 17. P. 3912.
Lou Qi-Zheng, Zhang Bi-Song // Z. Kristallogr. NCS. 2007. V. 222. P. 199.
Gao Zhu-Qing, Li Hong-Jin, Gu Jin-Zhong et al. // J. Solid State Chem. 2016. V. 241. P. 121.
Pan Tian-Tian, Su Jian-Rong, Xu Duan-Jun // Acta Crystallogr. E. 2006. V. 62. P. m2183.
Wen Decai, Xie Jing, Jiang Xiurong // Acta Crystallogr. E. 2008. V. 64. P. m851.
Ali Nida, Tahir M.N., Ali Saqib et al. // J. Coord. Chem. 2014. V. 67. P. 1290.
Hijazi Abu Ali, Darawsheh M.D., Rappocciolo E. // Polyhedron. 2013. V. 61. P. 235.
Liu Ji-Zhong, Zhang Zhong, Shi Zhan-Wang, Gao Peng // Acta Crystallogr. E. 2011. V. 67. P. m30.
Nie Jing-Jing, Xu Xun, Xu Duan-Jun // Acta Crystallogr. E. 2011. V. 65. P. m855.
Lee Young Min, Song Young Joo, Poong Jung In et al. // Inorg. Chem. Commun. 2010. V. 13. P. 101.
Clegg W., Little I.R., Straughan B.P. // Inorg. Chem. 1988. V. 27. P. 1916.
Ge Chun-Hua, Zhang Rui, Fan Ping et al. // Chin. Chem. Lett. 2013. V. 24. P. 73.
Gogoleva N.V., Shmelev M.A., Evstifeev I.S. et al. // Russ. Chem. Bull. 2016. V. 65. P. 181.
Nikolaevskii S.A., Evstifeev I.S., Kiskin M.A. et al. // Polyhedron. 2018. V.152. P. 61.
Wu W.P., Wang J., Lu L., Wu Y. // Russ. J. Coord. Chem. 2016. V. 42. P. 217. https://doi.org/10.1134/S107032841603009X
Ren Hong, Song Tianyou, Xu Jianing et al. // Transition Met. Chem. 2006. V. 31. P. 992.
Ni Sheng-Liang, Zhou Feng, Qi Jin-Li // Acta Crystallogr. E. 2011. V. 67. P. m779.
Liu Chun-Sen, Sanudo E.C., Yan Li-Fen et al. // Transition Met. Chem. 2009. V. 34. P. 51.
Zheng Miao, Zheng Yue-Qing, Zhang Bi-Song // J. Coord. Chem. 2011. V. 64. P. 3419.
Bhattacharyya M.K., Saha U., Dutta D. et al. // RSC Advances. 2019. V. 9. P. 16339.
Song Wen-Dong, Yan Jian-Bin, Hao Xiao-Min // Acta Crystallogr. E. 2008. V. 64. P. m919.
Gomez V., Corbella M. // Eur. J. Inorg. Chem. 2009. P. 4471.
Li Jun-Xia, Du Zhong-Xiang // J. Cluster Sci. 2020. V. 31. P. 507.
Li Long, Diao Kaisheng, Ding Yuqiu, Yin Xianhong // Mol. Cryst. Liq. Cryst. 2013. V. 575. P. 173.
Yang Ying-Qun, Li Chang-Hong, Li Wei, Kuang Yun-Fei // Wuji Huaxue Xuebao (Chin. J. Inorg. Chem.). 2010. V. 26. P. 1890.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия