Координационная химия, 2021, T. 47, № 3, стр. 169-176
Изучение взаимодействия фуллерена С60 с палладий-содержащими кластерами молибдена {Mo3PdS4} спектроскопическими и расчетными методами
Ю. А. Ларичева 1, Н. Ю. Шмелев 1, 2, А. Л. Гущин 1, *, М. Н. Соколов 1, 3
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
3 Казанский федеральный университет
Казань, Россия
* E-mail: gushchin@niic.nsc.ru
Поступила в редакцию 24.07.2020
После доработки 27.08.2020
Принята к публикации 01.09.2020
Аннотация
Получение гибридных материалов, в которых комбинировались бы физико-химические свойства разных классов соединений, является сложным, но перспективным направлением развития современной науки. В настоящей статье совокупностью физико-химических методов показано образование новых гибридных кластерных катионов [Mo3Pd(C60)S4Cl3(R2Bipy)3]+ и [{Mo3PdS4Cl3(R2Bipy)3}2(C60)]2+ (Bipy = = 2,2-бипиридин), содержащих координированную к атому палладия молекулу фуллерена C60, при взаимодействии [Mo3S4Cl3(R2Bipy)3]PF6 c Pd2(Dba)3 (Dba = дибензилиденацетон) и C60. Продукты реакций изучены методами ИК-, ЯМР- (1H, 31Р и C–H корреляции) спектроскопии и масс-спектрометрии. Для корректной интерпретации спектроскопических данных, а также для выяснения электронного строения фуллерен-содержащих соединений проведены квантово-химические расчеты методом DFT.
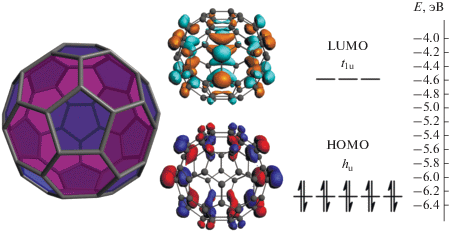
Уникальное строение и обусловленные им физико-химические свойства фуллеренов делают их объектами многочисленных исследований с тех пор, как были разработаны методы их синтеза [1]. Наиболее доступным и распространенным является “фуллерен par excellence” – С60. В дальнейшем под термином “фуллерен” мы будем подразумевать именно молекулу С60. Пространственная структура этой молекулы и особенности электронного строения (рис. 1, справа), такие как пятикратное вырождение низколежащей по энергии HOMO-орбитали (hu), и трехкратное вырождение LUMO-орбитали (t1u), а также относительно небольшой разрыв между граничными орбиталями (~1.6 эВ), обуславливают привлекательные свойства фуллерена и соединений на его основе: окислительно-восстановительные [2–4], каталитические [5–7], оптические [8], фотовольтажные [9], магнитные [10], а также токсичность [11], противомикробную активность [12] и другие [13–16] свойства.
Рис. 1.
Молекулярная структура фуллерена С60 (слева): шестичленные кольца закрашены фиолетовым цветои, пятичленные – синим; вид граничных орбиталей и уровни энергии фуллерена С60 (справа).
Существует четыре основных типа реакций, которые приводят к образованию комплексов переходных металлов с фуллеренами [16]. Первый включает координацию металла по связи между шестичленными кольцами (6–6) (рис. 1, слева), которая имеет олефиновый характер, с образованием η2-координационныx комплексов. Второй тип реакции состоит в восстановлении фуллерена с образованием соли фуллерида. Третий заключается в функционализации фуллерена “мостиковыми” группами, к которым координируется металл, а четвертый представляет собой образование сокристаллизатов фуллерена и металлокомплекса и может включать в себя некоторую степень переноса заряда между отдельными компонентами.
При η2-координации фуллерена к палладию(0) обратное донирование электронной плотности с d-орбиталей металла на π*-орбитали фуллерена преобладает над σ-донированием. Фуллерен по своей акцепторной способности занимает промежуточное положение между этиленом и электронно-дефицитными алкенами – тетрацианоэтиленом и тетрафторэтиленом. Низкая степень окисления Pd(0) и сильная π-акцепторная природа С60 обуславливают сильное связывание Pd-фуллерен. Рассчитанные энергии диссоциации связи Pd–C выше, чем для соответствующих комплексов с этиленом, но ниже, чем для комплексов с сильными акцепторами – тетрацианоэтиленом или тетрафторэтиленом [17].
В [18–24] описано большое количество примеров гетерометаллических кубановых комплексов {M3M'S4}n+, которые чаще всего образуются при взаимодействии трехъядерных кластеров молибдена или вольфрама {M3S4} с комплексами различных переходных металлов M' в низких степенях окисления (0–II) (рис. 2).
Рис. 2.
Схема реакции [3 + 1] образования палладий-содержащих кубановых комплексов с бипиридиновыми лигандами (R = nC9H19, tBu).
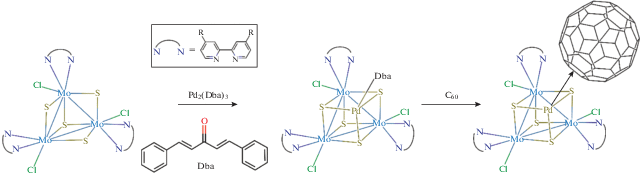
Такие гетерометаллические кластеры нередко демонстрируют высокую каталитическую активность в различных реакциях органического синтеза [22]. В частности, палладий-содержащие {M3PdS4}-кластеры, впервые описанные в работах японских ученых [25, 26], катализируют реакции аллилирования ароматических соединений [27–29], нуклеофильного присоединения по тройной связи [25, 30], а также способны стабилизировать в координационной сфере палладия такие формы кислот, как As(OH)3, P(OH)3, PhP(OH)2, Ph2P(OH), P(OH)2H [31, 32]. Учитывая устойчивость известных моноядерных комплексов Pd с фуллереном, а также интересные свойства как фуллерена, так и гетерометаллических Pd-содержащих кластеров, целью данного исследования было получение кластерных комплексов [Mo3Pd(Dba)S4Cl3(R2Bipy)3]+ и изучение их взаимодействия с фуллереном C60 с последующим выделением новых гибридных соединений. В ходе исследований было обнаружено, что координация фуллерена действительно происходит, но из-за достаточно большого количества у фуллерена доступных координационных центров продуктами этих реакций всегда является смесь комплексов. Несмотря на приложенные усилия, выделить индивидуальные соединения и получить пригодные для РСА кристаллы не удалось. Подобное поведение сложных несимметричных пространственно-затрудненных соединений фуллерена является распространенной проблемой.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные соединения [Mo3S4Cl3(Dbbipy)3]PF6 и [Mo3S4Cl3(Dnbipy)3]PF6 (Dbbipy = 4,4'-ди-трет-бутил-2,2'-бипиридин и Dnbipy = 4,4'-ди-н-нонил-2,2'-бипиридин) синтезировали согласно опубликованным методикам [33, 34]. Остальные реагенты и растворители приобретали из коммерческих источников и имели квалификацию не ниже “ч. д. а.”. Растворители абсолютировали перегонкой согласно стандартным процедурам, если не оговорено отдельно. Синтез комплексов проводили либо на воздухе, либо в атмосфере аргона (о. ч.) с использованием техники Шленка.
ИК-спектры в области 4000–400 см–1 записывали в таблетках KBr на спектрометрах Scimitar FTS 2000 и Vertex 80 Fourier. Электроспрей масс-спектры получали на масс-спектрометрах Agilent (6130 Quadrupole MS, 1260 infinity LC) и Micromass Q-Tof Premier. Спектры ЯМР записывали на приборах Agilent 500 и 600 DD2, а также Bruker Avance 500 c использованием внутренних стандартов для 1H, 13C (TMS) и 31Р (H3PO4). Элементный анализ на C, H, N, S проводили на приборе Euro EA 3000.
Оптимизацию геометрии кластерного комплекса [Mo3Pd(C60)S4Cl3(Bipy)3]+ проводили в программном комплексе ADF2017 [35] с использованием полноэлектронного базиса TZ2P для всех элементов и функционалов VWN и BP. Учет релятивистских эффектов производили методом скалярной аппроксимации нулевого порядка ZORA. Отрицательные частоты при оптимизации не обнаружили. На основе полученной геометрии рассчитывали спектры ЯМР в растворе хлороформа для оптимизированной структуры [Mo3Pd(C60)S4Cl3(Bipy)3]+ в программном комплексе GAUSSIAN G16.A03 [36] с использованием для всех атомов гибридного функционала B3LYP-GD3BJ/6-31+g(d,p). Отрицательные частоты также не обнаружили.
Взаимодействие [Mo3S4Cl3(Dbbipy)3](PF6) с Pd2(Dba)3 · CHCl3 и С60. Смесь твердых веществ Pd2(Dba)3 · CHCl3 (0.035 г, 33.9 μмоль), [Mo3S4Cl3- (Dbbipy)3](PF6) (0.1 г, 67.8 μмоль) и C60 (50 мг, 67.8 μмоль) сушили под вакуумом в течение часа, затем растворяли в токе аргона в 20 мл деаэрированного толуола. Смесь кипятилась с обратным холодильником в течение 5 ч. Полученный раствор упаривали на роторном испарителе досуха, перерастворяли в CH2Cl2 и высаживали гексаном. В результате был получен твердый продукт черного цвета, который был промыт эфиром и высушен в вакууме.
| Найдено, %: | N 3.7; | С 54.0; | H 3.3; | S 5.3. |
| Для Mo3S4PdCl3C114H72N6PF6 | ||||
| вычислено, %: | N 3.7; | С 59.5; | H 3.2; | S 5.6. |
ИК-спектр (ν, см–1): 3400 сл, пл, 3221 (сл), 3058 сл, 2962 ср, 2871 сл, 1735 сл, 1650 ср, 1615 с, 1482 ср, 1448 ср, 1410 ср, 1337 ср, 1307 сл, 1253 ср, 1184 ср, 1098 ср, 1023 сл, 982.7 ср, 837 о.с, 766 ср, 735 сл, 699 с, 603 сл, 555 ср, 534 сл, 525 ср, 474 сл, 433 сл. ЯМР 1Н (CD3CN; 500 MHz; δ, м.д.): 9.81 (d., J = 6.11 Гц, 3H), 9.47 (d., J = 6.11 Гц, 3H), 8.35 (d., J = 1.60 Гц, 3H); 8.23 (d., J = 1.70 Гц, 3H); 7.56 (d.d., J = 6.11, J = 2.08 Гц, 3H), 7.40 (d.d., J = 6.00, J = 1.80 Гц, 3H), 1.46 (s., 27H) 1.43 (s., 27H). ЯМР 31P (CD3CN; 500 MГц; δ, м.д.): –144.27.
ESI-MS (+; CH2Cl2/CH3OH; m/z): 2153.4 [Mo3Pd(C60)S4Cl3(Dbbipy)3]+, 1792.6 [{Mo3PdS4Cl3-(Dbbipy)3}2(C60)]2+, 1328.1 [Mo3S4Cl3(Dbbipy)3]+, 1055.1 [Mo3Pd(C60)S4Cl2(Dbbipy)3]2+.
Взаимодействие [Mo3S4Cl3(Dnbipy)3]PF6 с Pd2(Dba)3 · CHCl3 и С60. Смесь Pd2(Dba)3 · CHCl3 (74 мг, 0.14 ммоль), [Mo3S4Cl3(Dnbipy)3]PF6 (400 мг, 0.28 μмоль) и C60 (220 мг, 0.28 ммоль) в 40 мл толуола кипятили в инертной атмосфере в течение 2 сут. Дальнейшая процедура обработки аналогична предыдущему синтезу.
| Найдено, %: | N 3.0; | С 67.9; | H 4.7; | S 3.5. |
| Для C144H132F6N6S4PCl3Mo3Pd | ||||
| вычислено, %: | N 3.1; | С 63.6; | H 4.9; | S 4.7. |
ИК-спектр (ν, см–1): 2922 с, 2850 с, 1614 с, 1553 сл, 1487 сл, 1461 ср, 1418 ср, 1288 сл, 1243 сл, 1182 ср, 1102 сл, 1024 ср, 912 сл, 842 о.с, 737 сл, 704 ср, 577 ср, 557 ср, 536 сл, 526 с, 491 сл, 436 сл. ЯМР 1Н (CD3CN; 500 MHz; δ, м.д.): 9.83 s., 9.81 s., 9.8 s., 9.79 s., 9.51 s., 9.50 s., 9.49 (d., J = 3.18 Гц), 9.46 s., 9.45 s., 9.38 s., 9.37 s., 8.36 s., 8.35 s., 8.31 s., 8.30 s., 8.25 s., 8.24 s., 8.20 s., 8.16 (d., J = 1.59 Гц), 8.10 (d., J = 1.83 Гц), 7.56 (d., J = 1.71 Гц), 7.55 (d., J = 1.71 Гц), 7.46 (d., J = 1.96 Гц), 7.44 (d., J = 1.96 Гц), 7.43 (d., J = 1.96 Гц), 7.41 (d., J = 1.71 Гц), 7.40 (d., J = 2.20 Гц), 7.38 (d., J = 1.83 Гц), 1.88 (d.d., J = 7.21, J = 7.34 Гц), 1.72 m., 1.62 m., 1.52 m., 1.46 m., 1.45 s., 1.43 s., 1.42 s., 1.40 s., 1.37 s., 1.30 s., 1.27 s. ЯМР 13С (CD3CN; 500 MГц; δ, м.д.): 13.85 и 13.92 (s., CH3), 22.65 и 22.72 (s., CH2), 29.39 (m., CH2), 31.85 и 31.92 (s., CH2), 35.58 и 35.64 (s., CH2), 122.79–126.72 (s., Bipy), 141.90 и 143.00 (s., C60), 153.01–157.76 (s., Bipy, C60). ESI-MS (+; CH2Cl2/CH3OH): m/z = 2575.4 [Mo3Pd(C60)S4Cl3(Dnbipy)3]+, 2215.8 {[Mo3PdS4Cl3(Dnbipy)3]2(C60)]2+, 1855.3 [Mo3PdS4Cl3(Dnbipy)3]+, 1748.4 [Mo3S4Cl3(Dnbipy)3]+.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В данной работе мы изучали возможность координации С60 к палладию в составе кубановых комплексов [Mo3Pd(Dba)S4Cl3(R2Bipy)3]+, полученных in situ без выделения и характеризации (рис. 2). Ранее мы описали образование похожего кубанового комплекса [Mo3Pd(Tu)S4Сl3(Dbbipy)3]Cl, в котором координационное место при палладии занимает молекула тиомочевины (Tu) [37]. Кубановые комплексы [(Cp*M)3S4Pd(Dba)]PF6 (M = Mo, W), содержащие фрагмент Pd(Dba), также известны и их свойства описаны в [28, 29, 38].
Реакции проводили в условиях, схожих с использованными при получении [Mo3Pd(T)S4-Сl3(Dbbipy)3]Cl, только в качестве растворителя использовался толуол из-за низкой растворимости фуллерена в хлорированных углеводородах и ацетонитриле. Таким образом, в реакционную смесь вводили растворы комплексов [Mo3S4Cl3(Dbbipy)3]PF6 или [Mo3S4Cl3(Dnbipy)3]PF6 со стехиометрическими количествами Pd2(Dba)3 · CHCl3 и С60 в толуоле. Кипячение реакционной смеси в атмосфере аргона приводило в обоих случаях к образованию растворов насыщенного темного цвета. Твердые продукты выделяли в виде черного порошка после наслаивания гексана на растворы в хлористом метилене. Однако пригодных для РСА кристаллов получить не удалось. Поэтому для идентификации полученных соединений использовали комплекс физико-химических методов анализа.
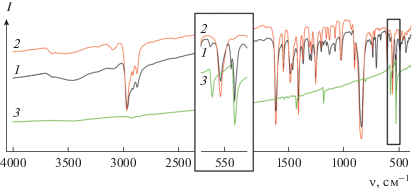
Из литературы известно, что при координации фуллерена к металлоцентру происходит характерное расщепление интенсивной полосы при ~510 см–1, которая наряду с полосами при 1400, 1180 и 580 см–1 наблюдается в ИК-спектре чистого фуллерена С60. Расщепление полосы при 510 см–1 на 534 и 525 и 536 и 526 см–1 наблюдалось в ИК-спектрах, записанных для продуктов взаимодействия фуллерена с [Mo3S4Cl3(Dnbipy)3]+ и [Mo3S4Cl3(Dbbipy)3]+ соответственно (рис. 3). Из характерного расщепления можно сделать вывод о произошедшей координации фуллерена.
Рис. 3.
Сравнение ИК-спектров [Mo3S4Cl3(Dnbipy)3]PF6 (1), продукта его реакции с Pd2(Dba)3 · CHCl3 и С60 (2) и исходного фуллерена (3).
Данные элементного анализа на C, H, N, S показали существенное расхождение по углероду для обоих продуктов при удовлетворительном соответствии для остальных элементов. Полученные значения на 3–4% ниже рассчитанных на формулу [Mo3Pd(C60)S4Cl3(R2Bipy)3]PF6, что могло быть вызвано “недостатком” фуллерена С60 по отношению к кластеру. Результаты ЯМР и масс-спектров подтвердили это предположение и показали, что при взаимодействии [Mo3S4Cl3(Dbbipy)3]PF6 или [Mo3S4Cl3(Dnbipy)3]PF6 с Pd2(Dba)3 · CHCl3 и С60 образуется смесь продуктов.
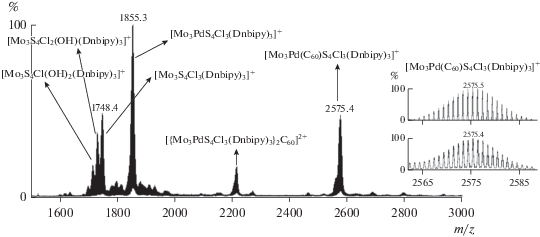
В электроспрей масс-спектрах, помимо сигнала от однозарядной частицы [Mo3Pd(C60)S4Cl3(L)3]+ (m/z: 2575.4 для L = Dnbipy и 2153.4 для L = Dbbipy), присутствует также сигнал от продукта координации одной молекулы фуллерена к двум кластерам {Mo3PdS4}, {[Mo3PdS4Cl3(L)3]2(C60)}2+ (m/z: 2215.8 для L = Dnbipy и 1792.6 для L = Dbbipy) (рис. 4). Способность фуллерена выступать в качестве политопного лиганда и образовывать нейтральные, аморфные, стабильные на воздухе вещества состава (C60)Pdn (n = 1–7) хорошо известна [39]. В масс-спектрах также наблюдаются сигналы, соответствующие однозарядным катионам [Mo3PdS4Cl3(L)3]+ и [Mo3S4Cl3(L)3]+, появление которых может быть связано с фрагментацией [Mo3Pd(C60)S4Cl3(L)3]+ в условиях эксперимента. Кроме того, наблюда-ются однозарядные катионы [Mo3S4Cl2(ОН)(L)3]+ и [Mo3S4Cl(ОН)2(L)3]+ в результате замещения хлора на гидрокси-группу, что типично для масс-спектров кластеров такого типа [40, 41].
Рис. 4.
Электроспрей масс-спектр продуктов взаимодействия [Mo3S4Cl3(Dnbipy)3]PF6 Pd2(Dba)3 · CHCl3 и С60.
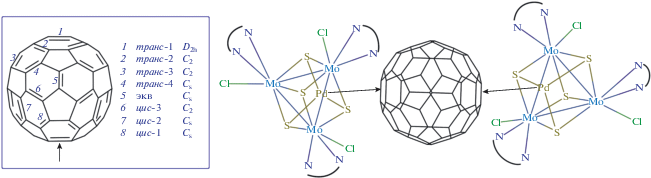
С учетом симметрии присоединение палладия второго кластерного фрагмента к фуллерену может происходить восемью разными способами (рис. 5, врезка). Поскольку кластерный фрагмент {Mo3PdS4Cl3(Bipy)3} достаточно объемный, мы предполагаем, что стерически менее затрудненным будет внедрение палладия по двум η2-связям, расположенным в молекуле С60 друг напротив друга (рис. 5, тип 1).
Рис. 5.
Предполагаемое строение комплекса [{Mo3PdS4Cl3(Bipy)3}2(C60)]2+ и возможные симметрически неэквивалентные пути присоединения второго металла к фуллерену.
Мы предприняли попытку разделить образующуюся смесь продуктов методом колоночной хроматографии. Для этого твердую смесь продуктов растворяли в CH2Cl2, наносили на хроматографическую колонку с силикагелем (40/100), промывали CH2Cl2, ацетоном и элюировали CH3CN. Полученные растворы упаривали досуха на роторном испарителе, а затем снова растворяли в CH2Cl2 и наслаиванием избытка гексана получали твердые продукты черного цвета, которые промывали эфиром и высушивали. Но несмотря на все приложенные усилия, данная процедура не позволила получить индивидуальные соединения. Напротив, согласно спектроскопическим данным, эти манипуляции вместо очистки приводят к разложению полученных продуктов и/или образованию нерастворимых соединений, сложно поддающихся анализу. Таким образом, индивидуальные продукты координации фуллерена к палладий-содержащим кластерам выделить не удалось, но факт координации был доказан различными методами.
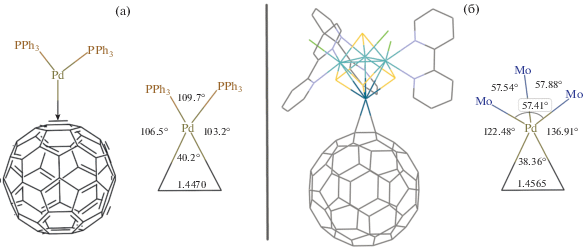
Для дополнительного подтверждения нашей интерпретации полученных экспериментальных данных, а также для анализа электронного строения были сделаны квантово-химические расчеты методом DFT. Все расчеты выполнены для комплекса [Mo3Pd(C60)S4Cl3(Bipy)3]+, в котором углеводородные заместители на бипиридиновых лигандах были заменены на атомы водорода. Рассчитанные для оптимизированной геометрии [Mo3Pd(C60)S4Cl3- (Bipy)3]+ длины связей согласуются с известными кристаллографическими данными для комплексов палладия с фуллереном и палладий-содержащих кубановых кластеров (табл. 1). Координация фуллерена по η2-типу приводит к удлинению связи С–С в соответствующих 6:6-фрагментах, что согласуется с литературными данными [17]. В оптимизированном фрагменте длина связи составляет 1.456 Å по сравнению со средней величиной для остальных сочлененных 6:6-фрагментов (1.397 Å). Длины связей Pd–С в оптимизированной структуре составляют 2.227 и 2.210 Å. Различие в длинах связей Pd–С типично для комплексов палладия с С60 и составляет обычно от 0.05 до 0.2 Å в зависимости от природы остальных лигандов при палладии [13]. Геометрия координационного узла {PdS3(η2-C2)} представляет собой искаженную тригональную бипирамиду (рис. 6), в которой палладий имеет окружение из трех атомов μ3-S металлокластера и двух атомов углерода фуллеренового лиганда.
Таблица 1.
Сравнение основных длин связей в комплексах [Mo3S4Cl3(Dbbipy)3]+ (кристаллографические данные) и [Mo3Pd(Tu)S4Cl3(Bipy)3]+ (DFT-оптимизация) с оптимизированным фрагментом [Mo3Pd(C60)S4Cl3(Bipy)3]+
| Длина связи, Å | [Mo3S4Cl3(DbBipy)3]+ | [Mo3Pd(Tu)S4Cl3(Bipy)3]+ | [Mo3Pd(C60)S4Cl3(Bipy)3]+ |
|---|---|---|---|
| Mo–Mo | 2.8115 | 2.8017 | 2.8375 |
| Мo–(µ3-S) | 2.3582 | 2.3422 | 2.3529 |
| Mo–N | 2.242 | 2.1713 | 2.2717 |
| Mo–Cl | 2.486 | 2.4219 | 2.4506 |
| Mo–Pd | 2.7966 | 2.7634 | 2.9478 |
| Pd–(µ3-S) | 2.375 | 2.3620 | 2.4262 |
Рис. 6.
Оптимизированная структура и координационное окружение атома Pd в комплексах (η2-C60)Pd(PPh3)2 [42] (а) и [Mo3Pd(C60)S4Cl3(Bipy)3]+ (б).
Сравнение оптимизированной структуры [Mo3Pd(C60)S4Cl3(Bipy)3]+ со структурами гетерометаллических кластеров, полученными нами ранее [37], показало, что наличие фуллерена в координационном окружении палладия приводит к вытягиванию кластерного ядра {Mo3PdS4}4+ вдоль оси идеализированной симметрии С3, проходящей через треугольник Mo3 и атом Pd. При этом также увеличиваются средние значения длин связей Mo–Mo, Mo–N, Mo–Pd и Pd–(µ3-S). Средние значения длин связей Mo–(µ3-S) и Mo–Cl несколько больше, чем соответствующие значения в кристаллической структуре [Mo3Pd(Tu)S4Cl3- (Dbbipy)3]Cl, но меньше, чем в оптимизированном комплексе [Mo3Pd(Tu)S4Cl3(Bipy)3]+.
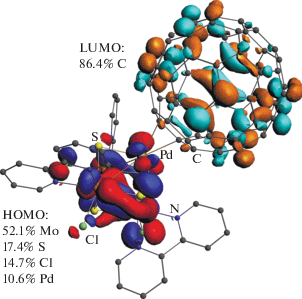
Вид оптимизированной молекулярной структуры и природа граничных орбиталей, полученные из расчетов, представлены на рис. 7. HOMO-орбиталь является полностью кластер-центрированной (E = –7.051 эВ, состав АО: 52.1% Mo, 17.4% S, 14.7% Cl и 10.6% Pd), в то время как LU-MO-орбиталь (E = –5.898 эВ, состав АО: 89.4% С) состоит только из орбиталей углерода фуллеренового лиганда, что согласуется с π-акцепторной природой фуллерена. Такое распределение электронной плотности позволяет предположить, что эти гибридные соединения будут сочетать в себе как свойства кластера {Mo3PdS4}, так и фуллерена, а также будут обладать потенциально интересными физико-химическими свойствами.
Рис. 7.
Вид оптимизированной молекулярной структуры и природа граничных орбиталей комплекса [Mo3Pd(C60)S4Cl3(Bipy)3]+.
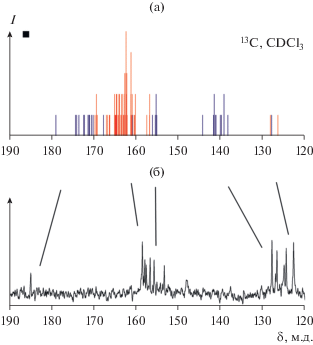
Известно, что в спектрахЯМР 13С области, в которых могут проявляться сигналы от атомов углерода фуллерена и пиридиновых колец бипиридинового лиганда, взаимно пересекаются. В спектре свободного фуллерена присутствует один синглетный сигнал при 143.2 м.д. Координация фуллерена к одному атому металла приводит к неэквивалетности атомов углерода и усложнению спектра с появлением до 20 сигналов в районе 100 м.д. и в области 137–157 м.д. [4, 43]. В спектрах ЯМР 13С смеси продуктов наблюдаются 10 синглетных сигналов разной интенсивности в области 140–160 м.д., которые можно интерпретировать как сигналы от фуллерена и бипиридинового лиганда. Поэтому отдельный интерес вызывала возможность с помощью квантово-химических расчетов не только сравнить экспериментальный и симулированный спектры, но и выделить конкретные сигналы, относящиеся к атомам углерода разных фрагментов. Для экономии времени и вычислительных ресурсов оптимизированная в ПК ADF геометрия использовалась для расчета спектров ЯМР в ПК Gaussian. В полученных расчетных спектрах сигналы от неэквивалентных атомов углерода координированного к кластеру фуллерена попадают в область 140–155 м.д. При этом каждому симметрически-неэквивалентному атому углерода соответствует индивидуальный сигнал (рис. 8). Однако диапазоны сигналов от фуллерена и бипиридина не разделяются достаточно, для того чтобы можно было с помощью расчетных данных выделить конкретные сигналы в экспериментальном спектре.
Рис. 8.
Сравнение расчeтного (а) и экспериментального (б) спектров ЯМР 13С для продукта взаимодействия [Mo3S4Cl3(Dnbipy)3]PF6 с Pd2(Dba)3 · CHCl3 и С60. На расчeтном спектре красным цветом выделены сигналы от углеродов С60, синим – бипиридинового лиганда.
В ходе данного исследования было показано, что взаимодействие кластерных комплексов [Mo3S4Cl3-(Dnbipy)3]PF6 и [Mo3S4Cl3(Dbbipy)3]PF6 с Pd2(Dba)3 · · CHCl3 и С60 приводит к образованию смеси продуктов состава [Mo3Pd(C60)S4Cl3(R2Bipy)3]PF6 и {[Mo3PdS4Cl3(R2Bipy)3]2(C60)](PF6)2. Несмотря на то что индивидуальные продукты не были выделены, координация фуллерена к палладий-содержащему кубановому кластеру была доказана с использованием совокупности спектроскопических методов и квантово-химических расчeтов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Krätschmer W., Lamb L.D., Fostiropoulos K.H.D.R. // Nature. 1990. V. 347. № 6291. P. 354.
Moody A. // Chem. Ind. 1991. P. 346.
Echegoyen L., Herranz M.A. Fullerenes: From Synthesis to Optoelectronic Properties / Eds. Guid. D.M., Martin N. Dordrecht: Springer, 2002. P. 267.
Balch A.L., Olmstead M.M. // Chem. Rev. 1998. V. 98. № 6. P. 2123.
Pan Y., Liu X., Zhang W. et al. // Appl. Catal. B. 2020. V. 265. P. 118579.
Sulman E., Matveeva V., Semagina N. et al. // J. Mol. Catal. A. 1999. V. 146. № 1–2. P. 257.
Meng Ze-Da, Zhang Feng-Jun, Zhu Lei et al. // Mater. Sci. Eng. C. 2012. V. 32. № 8. P. 2175.
Signorini R., Bozio R., Prato M. Fullerenes: From Synthesis to Optoelectronic Properties / Eds. Guidi D.M., Martin N. Dordrecht: Springer, 2002. P. 295.
Rispens M.T., Hummelen J.C. Fullerenes: From Synthesis to Optoelectronic Properties / Eds. Guidi D.M., Martin N. Dordrecht: Springer, 2002. V. 60. P. 387.
Makarova T. // Front. Magn. Mater. 2005. P. 209.
Johnston H.J., Hutchison G.R., Christensen F.M. et al. // Toxicol. Sci. 2009. V. 114. № 2. P. 162.
Kausar A. // Polym. Plast. Technol. Eng. 2017. V. 56. № 6. P. 594.
Конарев Д.В., Любовская Р.Н. // Успехи химии.2016 . Т. 85. № 1. С. 1215. (Konarev D.V, Lyubovskaya R.N. // Russ. Chem. Rev. 2016. V. 85. № 11. P. 1215).
Megiatto J.D., Guldi D.M., Schuster D.I. // Chem. Soc. Rev. 2020. V. 49. № 1. P. 8.
Kleandrova V.V., Luan F., Speck-Planche A.C.M.N.D.S. // Curr. Bioinform. 2015. V. 10. № 5. P. 565.
Rašović I. // Mater. Sci. Technol. 2017. V. 33. № 7. P. 777.
Espinet P. A., Albeniz A.C. // Comprehensive Organomet. Chem. III. 2007. № 1995. P. 315.
Ohki Y., Hara R., Munakata K. et al. // Inorg. Chem. 2019. V. 58. № 8. P. 5230.
Petrov P.A., Sukhikh T.S. // Russ. J. Coord. Chem. 2019. V. 45. № 5. P. 333. https://doi.org/10.1134/S1070328419040079
Pedrajas E., Sorribes I., Guillamón E. et al. // Chem. − A Eur. J. 2017. V. 23. № 53. P. 13205.
Ohki Y., Uchida K., Hara R. et al. // Chem. – A Eur. J. 2018. V. 24. № 64. P. 17138.
Гущин А.Л., Ларичева Ю.А., Соколов М.Н. и др. // Успехи химии. 2018. Т. 87. № 7. С. 670 (Gushchin A.L., Laricheva Y.A., Sokolov M.N. et al. // Russ. Chem. Rev. 2018. V. 87. № 7. P. 670). https://doi.org/10.1070/RCR4800
Oriwaki K.M., Oshida R.Y., Kashi H.A. // X-ray Struct. Anal. Online. 2014. V. 30. P. 11.
Гущин, А.Л., Соколов, М.Н., Наумов, Д.Ю., Федин В.П. // Журн. структур. химии. 2008. V. 49. № 4. P. 775.
Murata T., Mizobe Y., Gao H. et al. // J. Am. Chem. Soc. 1994. V. 116. № 8. P. 3389.
Murata T., Gao H., Mizobe Y. et al. // J. Am. Chem. Soc. 1992. V. 114. № 21. P. 8287.
Tao Y., Zhou Y., Qu J. et al. // Tetrahedron Lett. 2010. V. 51. № 15. P. 1982.
Tao Y., Wang B., Wang B. et al. // Org. Lett. 2010. V. 12. № 12. P. 2726.
Tao Y., Wang B., Zhao J. et al. // J. Org. Chem. 2012. V. 77. № 6. P. 2942.
Wakabayashi T., Ishii Y., Ishikawa K. et al. // Angew. Chem. Int. Ed. 1996. V. 35. № 18. P. 2123.
Sokolov M.N., Chubarova E. V., Virovets A. V. et al. // J. Clust. Sci. 2003. V. 14. № 3. P. 227.
Sokolov M.N., Virovets A. V, Dybtsev D.N. et al. // Communications. 2001. № 4. P. 4816.
Pino-Chamorro J.A., Laricheva Y.A., Guillamón E. et al. // New J. Chem. 2016. V. 40. № 9. P. 7872.
Pedrajas E., Sorribes I., Gushchin A.L. et al. // ChemCatChem. 2017. V. 9. № 6. P. 1128.
ADF 2017. SCM, Theoretical Chemistry. Amsterdam (The Netherlands): Vrije Universiteit, 2017.
Frisch M. J., Trucks G. W., Schlegel et al. Gaussian I. 2016.
Laricheva Y.A., Gushchin A.L., Abramov P.A. et al. // Polyhedron. 2018. V. 154. P. 202.
Takei I., Suzuki K., Enta Y. et al. // Organometallics. 2003. V. 22. № 10. P. 1790.
Nagashima H., Nakaoka A. Saito Y. et al. // Chem. Commun. 1992. № 4. P. 377.
Basallote M.G., Fernández-Trujillo M.J., Pino-Chamorro J.Á. et al. // Inorg. Chem. 2012. V. 51. № 12. P. 6794.
Algarra A.G., Basallote M.G., Fernandez-Trujillo M.J. et al. // Inorg. Chem. 2010. V. 49. № 13. P. 5935.
Yanov I., Leszczynski J., Sulman E. et al. // Int. J. Quantum Chem. 2004. V. 100. № 5. P. 810.
Brady F.J., Cardina D.J., Domin M. // J. Organomet. Chem. 1995. V. 491. № 1–2. P. 169.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


