Координационная химия, 2021, T. 47, № 3, стр. 177-181
Комплекс оксованадия(iv) с 1-гидроксиэтан-1,1-дифосфоновой кислотой и бис(2-пиридил-1,2,4-триазол-3-ил)метаном
В. Ф. Шульгин 1, *, Ю. И. Балуда 1, А. Н. Гусев 1, М. А. Крюкова 2
1 Крымский федеральный университет им. В.И. Вернадского
Симферополь, Россия
2 Институт химии Санкт-Петербургского государственного университета
Санкт-Петербург, Россия
* E-mail: shulvic@gmail.com
Поступила в редакцию 21.08.2020
После доработки 08.10.2020
Принята к публикации 14.10.2020
Аннотация
Описан синтез комплекса оксованадия(IV) с анионом 1-гидроксиэтан-1,1-дифосфоновой кислоты (Н4EDP) и бис(2-пиридил-1,2,4-триазол-3-ил)метаном (H2L). Установлено, что взаимодействие VOSO4 с Н4EDP и H2L с последующей нейтрализацией реакционной смеси Et3N ведет к образованию тетраядерного комплекса [(VO)4(H2L)2(EDP)2(H2O)2] · 4H2O (I), исследованного методами ИК-спектроскопии и ЭПР. Молекулярная и кристаллическая структура комплекса I исследована методом РСА (CIF file CCDC № 2022772).
Фосфонаты и бифосфонаты переходных металлов и лантанидов вызывают повышенный интерес исследователей как основа новых гибридных материалов [1–10]. В сравнении с традиционными неорганическими материалами бифосфонаты металлов могут быть получены в мягких условиях; они проявляют более высокую термическую и химическую стабильность [1]. Лиганды данного типа способны к реализации различных способов связывания с катионами металлов [2], что в сочетании с разнообразием координационных полиэдров ведет к образованию нетривиальных молекулярных и супрамолекулярных структур. Введение дополнительных органических экстралигандов, таких как ароматические или алифатические амины, создает дополнительные возможности для управления структурой и свойствами образующихся гибридных материалов [7].
Цель настоящей работы – изучение взаимодействия сульфата оксованадия(IV) с 1-гидроксиэтан-1,1-дифосфоновой кислотой (Н4EDP) и бис(2-пиридил-1,2,4-триазол-3-ил)метаном (H2L). Ранее было показано, что спейсерированный триазол H2L – удобная матрица для синтеза комплексов различной ядерности и топологии [11]. Координационные соединения и гибридные материалы на основе бисфосфонатов ванадия ранее описаны в [8–10].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали бис(2-пиридил-1,2,4-триазол-3-ил)метан, полученный по ранее описанной методике [11] и 1-гидроксиэтан-1,1-дифосфоновую кислоту (этидроновая кислота, моногидрат), препарат фирмы MERCK, а также VOSO4 · 7H2O (“х. ч.”).
Синтез [(VO)4(H2L)2(EDP)2(H2O)2] · 4H2O (I). К суспензии, содержащей 0.152 г (0.5 ммоль) Н2L в 10 мл воды, добавляли раствор 0.224 г (1 ммоль) Н4EDP и перемешивали при температуре 70–80°С до полного растворения реагентов. К полученному раствору добавляли раствор 0.137 г (0.5 ммоль) VOSO4 в 5 мл воды и охлаждали при перемешивании, после медленно добавляли 5 ммоль триэтиламина до рН 6–7. Образовавшийся осадок выдерживали 3 сут под маточным раствором при комнатной температуре. Выделившиеся синие кристаллы отделяли фильтрованием и сушили на воздухе. Выход 40% (в расчете на сульфат оксованадия(IV)).
По данным элементного анализа состав комплекса отвечает формуле [(VO)4(H2L)2(EDP)2(H2O)2] · · 4H2O (I). Из образовавшегося осадка отобрали монокристалл комплекса I, пригодный для РСА.
В ИК-спектрах поглощения комплекса I, наряду с полосами поглощения спейсерированного 2-пиридил-1,2,4-триазола (1615, 1575, 1512, 1474, 1405, 1294 см–1), наблюдаются широкие полосы с максимумами поглощения при 1094, 965, 794, 754 и 710 cм–1, обусловленные валентными колебаниями связей атомов ванадия и фосфора с атомами кислорода [8, 12]. В области 3500–3000 см–1 наблюдается широкая огибающая, включающая полосы валентных колебаний воды, деформационные колебания которых наблюдаются в виде слабой полосы с максимумом при 1645 см–1.
РСА проведен на дифрактометре Agilent Technologies SuperNova Dual, оснащенном плоским CCD детектором, при температуре 100 K с использованием монохроматического CuKα-излучения (λ = 1.54184 Å) по стандартной процедуре [13]. Параметры элементарной ячейки уточняли методом наименьших квадратов. Структура расшифрована прямым методом и уточнена с помощью программы SHELX [14], встроенной в программный пакет OLEX2 в полноматричном анизотропном приближении для всех неводородных атомов.
Кристаллографические параметры и детали уточнения структур для I: C34H44N16O24P4V4, М = = 1388.49, размер кристалла 0.2 × 0.1 × 0.1 мм, синие кристаллы, T = 100(2) K, триклинная сингония, пр. гр. $\bar {P},$ a = 13.2081(3) b = 13.4290(2) c = = 17.5381(3) Å, α = 91.4236(15)°, β = 101.3159(16)°, γ = 101.1159(17)°, V = 2986.71(10) Å3, Z = 2, ρ = = 1.544 г/см3, μ = 6.875 мм–1, θ = 6.722°–153.04°, –15 ≤ h ≤ 16, –16 ≤ k ≤ 16, –21 ≤ l ≤ 21; всего 59 468 отражений, независимых отражений 12 358, отражений с I ≥ 2σ(I) 10 648, Rint = 0.0748, Tmin/Tmax = = 0.357/1.000, F = 1.058, R1 = 0.0544, wR2 = 0.1537 (для всех данных), R1 = 0.0637, wR2 = 0.1623 (для I ≥ 2σ(I)), Δρmin/Δρmax = –0.47/0.82 е Å–3.
Координаты атомов и другие параметры структуры I депонированы в Кембриджском банке структурных данных (CCDC № 2022772); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
Элементный анализ выполняли на автоматическом анализаторе EURO Vector 3000A. ИК-спектры записывали на ИК-спектрометре с Фурье-преобразованием Spectrum Two, снабженном приставкой однократно нарушенного полного внутреннего отражения (Perkin Elmer). Спектры ЭПР записывали на приборе SpinscanX (ADANI, Беларусь).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Установлено, что исследуемый комплекс имеет сложную молекулярную структуру, построенную из четырех кристаллографически независимых атомов ванадия, двух молекул H2L и двух мостиковых дифосфонат-анионов (рис. 1).
Рис. 1.
Общий вид комплексной молекулы I. Атомы водорода, метильные и гидроксильные группы дифосфонатных лигандов не показаны для ясности.
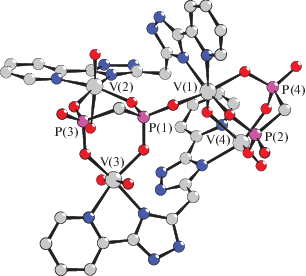
Расстояния между атомами ванадия составляют: V(1)…V(2) 5.39, V(1)…V(3) 6.01, V(1)…V(4) 3.59, V(2)…V(3) 4.76, V(2)…V(4) 7.33, V(2)…V(4) 6.76 Å. Длины связей атомов ванадия и фосфора с донорными атомами лигандов приведены в табл. 1 и имеют значения, типичные для известных комплексов оксованадия(IV) с фосфонатными лигандами [9, 10].
Таблица 1.
Наиболее важные длины связей с участием атомов ванадия и атомов фосфора в структуре I
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| V(1)–N(2) | 2.108(3) | V(2)–N(36) | 2.146(3) |
| V(1)–N(17) | 2.327(3) | V(2)–N(47) | 2.101(3) |
| V(1)–O(3) | 2.004(2) | V(2)–O(13) | 1.957(2) |
| V(1)–O(6) | 1.989(2) | V(2)–O(24) | 1.599(2) |
| V(1)–O(11) | 1.958(2) | V(2)–O(41) | 2.222(3) |
| V(1)–O(19) | 1.614(2) | V(2)–O(7) | 1.987(2) |
| V(3)–N(18) | 2.109(3) | V(4)–N(26) | 2.100(3) |
| V(3)–N(25) | 2.160(3) | V(4)–N(63) | 2.151(4) |
| V(3)–O(1) | 1.971(2) | V(4)–O(8) | 1.984(2) |
| V(3)–O(4) | 2.260(2) | V(4)–O(14) | 1.591(3) |
| V(3)–O(10) | 1.978(2) | V(4)–O(16) | 1.957(3) |
| V(3)–O(21) | 1.603(2) | V(4)–O(19) | 2.309(2) |
| P(5)–O(1) | 1.527(2) | P(6)–O(5) | 1.506(2) |
| P(5)–O(6) | 1.517(2) | P(6)–O(8) | 1.531(2) |
| P(5)–O(13) | 1.522(2) | P(6)–O(11) | 1.544(2) |
| P(7)–O(7) | 1.518(2) | P(8)–O(3) | 1.543(2) |
| P(7)–O(10) | 1.521(2) | P(8)–O(15) | 1.496(3) |
| P(7)–O(28) | 1.535(2) | P(8)–O(16) | 1.541(3) |
Молекулы спейсерированных триазолов связывают атомы ванадия попарно, координируясь c атомами азота пиридильного фрагмента и триазольного гетероцикла. Длины связей атома ванадия с триазольными атомами азота близки и варьируют в дипазоне 2.100–2.109 Å, длины большинства связей атомов ванадия с пиридильными атомами азота лежат в диапазоне 2.146–2.160 Å, но связь пиридильного атома азота N(17) с атомом ванадия V(1) удлинена и составляет 2.327(3) Å. Плоскости триазольных гетероциклов повернуты относительно друг друга на 60° и 68° (рис. 2а).
Рис. 2.
Способ связывания спейсерированного 2-пиридил-1,2,4-триазола (а) и дифосфонат-анинов (б) в структуре I (атомы водорода метильных групп не показаны для ясности)
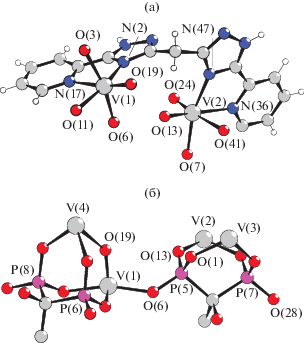
Дифосфонат-анионы связывают попарно атомы ванадия V(1), V(4), а также V(2) и V(3) и выполняют функции мостиковых лигандов, при этом один дифосфонат-анион связывает атомы V(1), V(2) и V(3), выполняя μ3-мостиковую функцию (рис. 2б).
Длины связей фосфор-кислород лежат в узком диапазоне 1.541–1.544 Å, длины связей Р=О лежат в диапазоне 1.497–1.507 Å. Атомы ванадия V(2) и V(3) имеют искаженное октаэдрическое окружение, которое образовано двумя атомами азота, двумя атомами кислорода мостикового дифосфонат-аниона, атомом кислорода молекулы воды и оксогруппой.
Длина связи V=O составляет 1.599–1.603 Å, связи атома ванадия с координированной молекулой воды равны 2.222(2) и 2.260(3) Å для атомов V(2) и V(3) соответственно. Атомы V(1) и V(4) связаны мостиковым атомом кислорода оксогруппы атома V(1), длины связей составляют 1.613(2) Å для V(1)–О(19) и 2.309(2) Å для V(4)–О(19), валентный угол V(1)О(19)V(4) равен 131.5°. Хелатные циклы, образованные дифосфонатным лигандом и атомом ванадия, изогнуты и имеют конформацию “ванна” для V(2) и конформацию “кресло” для V(1), V(3) и V(4).
В кристаллической структуре комплекса I наблюдается перенос одного атома водорода от триазольного кольца на дифосфонат-анион и связывание двух комплексных молекул в центросимметричный димер за счет разупорядоченной водородной связи, в которой атомы водорода локализованы в двух позициях с заселенностью 1/2, расстояния О(28)–Н(28) и О(28)'–Н(28) равны 1.14 и 1.32 Å, а расстояние О(28)…O(28)' составляет 2.43 Å и угол О(28)Н(28)О(28)' равен 160°. Остальные атомы водорода равномерно распределены между четырьмя триазольными циклами. Частично депротонирование лигандов и делокализация атомов водорода между триазольными циклами наблюдалось ранее в комплексах спейсерированных пиридил-1,2,4-триазолов [11, 15]. Фактически состав комплекса I отвечает формуле [(VO)4(H2L)(HL)-(EDP)(НEDP)(H2O)2]2 · 8H2O. Образование димеров за счет связывания фосфорильных групп водородными связями было описано при исследовании кристаллической структуры некоторых дифосфоновых кислот и дифосфонатов металлов [2].
Некоординированные молекулы воды занимают полости кристаллической решетки и связаны прочными водородными связями между собой. Кристаллическая структура комплекса характеризуется сложной системой водородных связей, образованных с участием молекул воды, гетероциклических атомов азота и атомов кислорода дифосфонатных лигандов (табл. 2). Интересной особенностью кристаллической структуры комплекса является сближенность атомов кислорода, связанных с атомами ванадия V(2) и V(3), расстояние О(21)…О(41) составляет 2.811 Å.
Таблица 2.
Геометрические параметры водородных связей в структуре I
| Контакт D–H⋅⋅⋅A | Расстояние, Å | Угол DHA, град | Координаты атомов А | ||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| O(4)–H(4A)∙∙∙O(48) | 0.86 | 1.86 | 2.643(4) | 152 | –1 + x, y, z |
| O(4)–H(4B)∙∙∙N(25) | 0.85 | 2.32 | 2.881(4) | 124 | x, y, z |
| O(9)–H(9)∙∙∙O(4) | 0.82 | 2.01 | 2.824(3) | 172 | x, y, z |
| N(20)–H(20)∙∙∙O(29) | 0.86 | 1.82 | 2.667(4) | 169 | –x, –y, 1 – z |
| O(22)–H(22A)∙∙∙O(6) | 0.85 | 2.39 | 2.900(3) | 119 | –x, –y, 1 – z |
| O(22)–H(22A)∙∙∙O(11) | 0.85 | 1.98 | 2.806(3) | 164 | 1 + x, y, z |
| O(22)–H(22B)∙∙∙O(9) | 0.85 | 2.18 | 3.023(4) | 175 | 1 + x, y, z |
| O(28)–H(28)∙∙∙O(28)' | 1.14 | 1.32 | 2.432(3) | 160 | x, y, z |
| O(29)–H(29B)∙∙∙O(3) | 0.91 | 2.06 | 2.967(3) | 179 | 1 + x, y, z |
| N(40)–H(40)∙∙∙O(5) | 0.86 | 1.71 | 2.567(4) | 171 | –1 – x, 1 – y, –z |
| O(48)–H(48A)∙∙∙N(31) | 0.85 | 2.02 | 2.860(4) | 172 | –x, 1 – y, –z |
| O(61)–H(61B)∙∙∙O(5) | 0.85 | 2.00 | 2.819(4) | 164 | 1 + x, y, z |
| O(48)–H(48B)∙∙∙O(22) | 0.84 | 1.95 | 2.767(4) | 165 | x, y, z |
| O(61)–H(61A)∙∙∙O(22) | 0.84 | 2.06 | 2.809(5) | 147 | x, y, z |
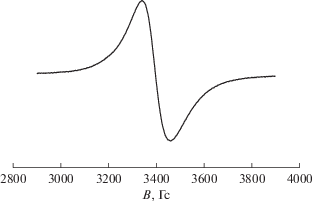
В спектре ЭПР поликристаллического комплекса (рис. 3) наблюдается одиночная уширенная линия с g-фактором 1.96, типичная для комплексов оксованадия(IV) (S = 1/2) [16].
Результаты проведенного исследования показывают, что совместная координация спейсерированного 1,2,4-триазола и дифосфонат-аниона, выполняющих мостиковую функцию, приводит к реализации нетривиальной молекулярной и кристаллической структуры, которая может быть использована при конструировании новых гибридных материалов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Maeda K. // Microporous and Mesoporous Mater. 2004. V. 73. P. 47.
Matczak-Jon E., Videnova-Adrabinska V. // Coord. Chem. Rev. 2005. V. 249. P. 2458.
Fu R., Hu S., Wu X. // Cryst. Growth Des. 2014. V. 14. P. 6197.
Mao J.-G. // Coord. Chem. Rev. 2007. V. 251. P. 1493.
Bao S-S., Zheng L.-M. // Coord. Chem. Rev. 2016. V. 319. P. 63.
Ma Yu-Juan, Hu Ji-Xiang, Han Song-De et al. // J. Am. Chem. Soc. 2020. V. 142. P. 2682.
Pan Jie, Ma Yu-Juan, Han Song-De et al. // Cryst. Growth Des. 2019. V. 19. P. 2919.
Rocha J., Paz F.A.A., Shi Fa-Nian et al. // Eur. J. Inorg. Chem. V. 2009. P. 4931.
Александров Г.Г., Сергиенко В.С., Афонин Е.Г. // Кристаллография. 2001. Т. 46. С. 53.
Ban R., Liang Y., Ma P. et al. // Inorg. Chem. Commun. 2016. V. 71. P. 65.
Gusev A.N., Shul’gin V.F., Ryush I.O. et al. // Eur. J. Inorg. Chem. 2017. P. 704.
Pan Ling-ling, Yuan Yi-xuan, Xiao Y. et al. // J. Mol. Structure. 2008. V. 892. P. 272.
SMART (control) and SAINT (integration) Sofware. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Гусев А.Н., Шульгин В.Ф., Кискин М.А. // Журн. cтруктур. химии. 2019. Т. 60. № 3. С. 353.
Куска Х., Роджерс М. ЭПР комплексов переходных металлов. М.: Мир, 1970. 220 с.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия