Координационная химия, 2021, T. 47, № 3, стр. 153-158
36-ЯДЕРНЫЕ КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ НИКЕЛЯ(II) С МАЛОНАТ-АНИОНАМИ И ВНУТРЕННИМИ АКВАКАТИОНАМИ МАГНИЯ И НАТРИЯ
Е. Н. Зорина-Тихонова 1, *, А. В. Вологжанина 2, К. А. Бабешкин 1, Н. Н. Ефимов 1, П. В. Дороватовский 3, М. А. Кискин 1, А. А. Сидоров 1, И. Л. Еременко 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
3 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: ezorinatikhonova@gmail.com
Поступила в редакцию 15.10.2020
После доработки 20.10.2020
Принята к публикации 21.10.2020
Аннотация
Методом автоклавного синтеза получен новый диметилмалонатный анионный комплекс {Ni36(H2O)12(ОН)20(HMe2Mal)(Me2Mal)29@[Mg(H2O)6]}5– (Me2Mal2– – дианион диметилмалоновой кислоты), содержащий внутренний акватированный ион [Mg(H2O)6]2+ и внешний катион [Mg3(OH)(H2O)10(C2H5OH)3]5+. Соединение, кристаллы которого выделены из реакционной смеси и охарактеризованы методом РСА, имеет формулу [Mg3(OH)(H2O)10(C2H5OH)3]{Ni36(H2O)12- (ОН)20(HMe2Mal)(Me2Mal)29@[Mg(H2O)6]} · 25H2O (I) (CIF file CCDC № 2038910). Из этанольно-ацетонитрильного раствора получен новый анионный комплекс {Ni36(H2O)12(ОН)19(O)(Сbdc)30@- [Na(H2O)6]}8– (Сbdc2– = дианион циклобутан-1,1-дикарбоновой кислоты), содержащий внутренний акватированный ион [Na(H2O)6]+ и внешнесферные катионы тетрабутиламмония. Выделенные из реакционной смеси кристаллы охарактеризованы РСА и соответствуют формуле (NBu4)8{Ni36(H2O)12(ОН)19(O)(Сbdc)30@[Na(H2O)6]} (CIF file CCDC № 2038909) (II). Найдено, что магнитное поведение комплекса I обусловлено конкурирующими ферро- и антиферромагнитными обменными взаимодействиями между парамагнитными ионами никеля(II).
Ранее мы показали, что синтез гомометаллических соединений никеля(II) с анионами диметилмалоновой кислоты и органическими катионами (триэтиламмоний, тетрабутиламмоний) приводит к формированию молекулярных сферических 36-ядерных полианионных соединений [1, 2]. Использование в качестве катиона атомов калия в сочетании с 18-краун-6 или атомов серебра(I) ведет к формированию соединений полимерного строения [3, 4]. В соединении с атомами калия в качестве простейшего фрагмента выступает 36-ядерный полианион [3], а с атомами серебра(I) наблюдается образование 2D-структуры на основе бисхелатных фрагментов {Ni(Me2Mal)2}2–, [Ag2Ni(H2O)2(Me2Mal)2]n [4]. Также известны гетерометаллические комплексы никеля(II) c анионами циклобутан-1,1-дикарбоновой кислоты (H2Сbdc), например слоистый Ni(II)-Ag(I) полимер, аналог вышеупомянутого 2D полимера [4], ионный комплекс [Ni(H2O)6][Cu(Сbdc)2(H2O)] и 1D-полимер [Ni(VO)(Сbdc)2(EtOH)2(H2O)3]n [5].
В настоящей работе представлены разные методы химического конструирования карбоксилатных анионных полиядерных фрагментов, содержащих ионы никеля(II), натрия или магния и дианионы диметилмалоновой (H2Me2Mal) или циклобутан-1,1-дикарбоновой кислот. Изучено строение этих молекул и их магнитное поведение (для диметилмалонатного соединения), а также рассмотрено влияние на строение анионов {Ni36}n– присутствие разных по заряду внутренних катионов [M(H2O)6]n+ (n = 1 или 2).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез комплексов I и II проводили на воздухе с использованием этилового спирта (96%), ацетонитрила (99%), дистиллированной воды и коммерчески доступных реагентов: NiSO4 ∙ 6H2O (Химмед, “ч.”), Ni(OAc)2 ∙ 4H2O (Riedel-de-Haën, 98%), MgSO4 ∙ 7H2O (Реахим, “ч.”), Ba(OH)2 · H2O (Sigma-Aldrich, 98%), NBu4OH (40%-водный раствор, Alfa Aesar), NaOH (Химмед, “ч.”), H2Me2Mal (Sigma-Aldrich, 98%), H2Сbdc (Sigma-Aldrich, 99%).
Синтез [Mg3(OH)(H2O)10(C2H5OH)3]{Ni36(H2O-κO)12(μ3-ОН)20(μ4-HMe2Mal-κ2O,O')(μ4-Me2Mal-κ2O,O')23(μ4-Me2Mal)6@[Mg(H2O)6]} · 25H2O (I). Навески NiSO4 ∙ 6H2O (0.187 г, 0.7 ммоль), MgSO4 ∙ · 7H2O (0.175 г, 0.7 ммоль), H2Me2Mal (0.188 г, 1.4 ммоль) и Ba(OH)2 · H2O (0.269 г, 1.4 ммоль) в смеси вода/этанол (5/2 мл) помещали в автоклав с тефлоновым вкладышем, предварительно отфильтровав выпавший осадок BaSO4. Выдерживали 72 ч при 100°С. Образовавшиеся светло-зеленые кристаллы, пригодные для РСА, отделяли от маточного раствора декантацией, промывали холодным EtOH и сушили на воздухе. Выход соединения I 0.045 г (31% в расчете на исходное количество никеля (II)).
ИК-спектр (НПВО; ν, см–1): 3540 ср, 3365 ср, 2983 ср, 2944 сл, 1589 с, 1534 с, 1461 с, 1430 с, 1345 с, 1189 ср, 1138 ср, 936 сл, 893 ср, 840 ср, 787 ср, 732 с, 614 с, 559 ср, 500 ср, 458 с, 444 с, 430 с.
Синтез (NBu4)8{Ni36(H2O)12(μ3-ОН)19(μ3-O)(μ4-Сbdc-κ2O,O')24(μ4-Сbdc)6@[Na(H2O)6]} (II). Навески 40%-ного водного раствора гидроксида тетрабутиламмония (3.120 г раствора, 4.8 ммоль) и H2Сbdc (0.347 г, 2.4 ммоль) растворяли в этаноле, добавляли 0.30 г (1.2 ммоль) Ni(OAc)2 ∙ 4H2O, 0.01 г (0.25 ммоль) NaOH. Реакционную смесь перемешивали при нагревании (Т = 50°С) в течение часа. Полученный раствор (45 мл) светло-зеленого цвета концентрировали до 20 мл, добавляли 10 мл ацетонитрила, выдерживали на воздухе при температуре 20°С. Образовавшиеся через сутки кристаллы II, пригодные для РСА, отфильтровывали и высушивали на воздухе при Т = 20°С. Выход II 0.057 г (19% в расчете на исходное количество никеля(II)).
| Найдено, %: | С 41.23; | Н 5.96; | N 1.43. |
| Для C308H523N8O158NaNi36 (М = 9002.86) | |||
| вычислено, %: | С 41.09; | Н 5.86; | N 1.24. |
ИК-спектр (НПВО; ν, см–1): 3544 ср, 2963 ср, 2941 ср, 2876 сл, 1594 с, 1548 с, 1450 с, 1413 с, 1355 с, 1257 ср, 1242 ср, 1167 ср, 1099 ср, 1015 ср, 948 ср, 903 ср, 854 ср, 798 ср, 751 с, 683 ср, 633 ср, 533 ср, 479 ср, 460 ср, 417 с.
РСА. Экспериментальный набор отражений для комплекса I получен на дифрактометре Bruker APEX II (двухкоординатный CCD детектор, Mo-Kα-излучение, λ = 0.71073 Å, графитовый монохроматор). Поглощение учтено эмпирически по программе SADABS [6]. Структуры решены по программе SHELXT [7]. Все неводородные атомы локализованы в разностных синтезах электронной плотности и уточнены по $F_{{hkl}}^{2}$ (SHELXL-14 [8] и OLEX2 [9]). Набор интенсивностей для комплекса II получен на станции K4.4 “БЕЛОК” Курчатовского источника синхротронного излучения (НИЦ “Курчатовский институт”, Москва, РФ) (λ = 0.9699 Å, детектор RAYONIX CCD 165) при 100.0(2) K. Поглощение учтено эмпирически по программе SCALA [10].
За исключением двух метильных групп в структуре I и четырех неупорядоченных циклобутановых групп в кристалле II, неводородные атомы полиядерного аниона уточнены в анизотропном приближении. Также при уточнении тепловых параметров некоторых атомов в структуре I использоваы команды SIMU, ISOR и EADP, при уточнении катионов и разупорядоченных анионов в структуре II – команды DFIX, RIGU и EADP. Атомы водорода найдены геометрически и уточнены в изотропном приближении в модели жесткого тела, с Uiso(H) = 1.5Ueq(Xi) для метильных групп и молекул воды, или 1.2Ueq(Xi) для остальных атомов, где Ueq(X) – эквивалентные тепловые параметры атомов, с которыми связан атом водорода. В структуре I присутствуют разупорядоченные молекулы растворителя, вклад которых в интенсивность отражений оценен с помощью программы SQUEEZE/PLATON [11].
Кристаллографические характеристики и детали дифракционного эксперимента приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| T, K | 120 | 100 |
| Сингония | Кубическая | Моноклинная |
| Пр. гр. | $Pm\bar {3}n$ | P21/с |
| Z | 2 | 2 |
| a, Å | 25.4062(6) | 23.060(5) |
| b, Å | 25.4062(6) | 26.521(5) |
| c, Å | 25.4062(6) | 35.047(5) |
| β, град | 90 | 92.23(3) |
| V, Å3 | 16399(1) | 21417(7) |
| ρ(выч.), г см–3 | 1.510 | 1.395 |
| μ, см–1 | 21.16 | 35.65 |
| F(000) | 7710 | 9408 |
| 2θmax, град | 59 | 77 |
| Число измеренных отражений | 87 919 | 200 691 |
| Число независимых отражений | 3828 | 44 897 |
| Число отражений с I > 2σ(I) | 2758 | 23 377 |
| Количество уточняемых параметров | 219 | 2218 |
| R1, wR2 (I > 2σ(I)) | 0.083, 0.2023 | 0.1013, 0.1842 |
| R1, wR2 (по всем данным) | 0.1151, 0.2200 | 0.1822, 0.2120 |
| GOОF | 1.240 | 1.208 |
| Остаточная электронная плотность (min/max), e Å–3 |
–2.797/2.774 | –1.226/2.549 |
Координаты атомов, величины тепловых параметров и список всех отражений для исследованных структур депонированы в Кембриджском банке структурных данных (ССDC № 2038910 (I), 2038909 (II); deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/structures).
Магнитное поведение комплекса I исследовали методом статической магнитной восприимчивости на магнетометре PPMS-9 (QuantumDesign) в диапазоне 2–300 К в постоянном магнитном поле напряженностью 5 кЭ. Все исследования магнитного поведения проводили на поликристаллическом измельченном образце, запаянном в полиэтиленовый пакет и замороженном в минеральном масле для предотвращения ориентации кристаллитов под действием магнитного поля. Парамагнитную составляющую магнитной восприимчивости (χ) определяли с учетом диамагнитного вклада образца, минерального масла и держателя.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кристаллы соединения [Mg3(OH)(H2O)10- (C2H5OH)3]{Ni36(H2O-κO)12(μ3-ОН)20(μ4-HMe2Mal-κ2O,O')(μ4-Me2Mal-κ2O,O')23(μ4-Me2Mal)6@-[Mg(H2O)6]} · 25H2O (I) получены автоклавным методом, кристаллы комплекса (NBu4)8{Ni36(H2O)12-(μ3-ОН)19(μ3-O)(μ4-Сbdc-κ2O,O')24(μ4-Сbdc)6@-[Na(H2O)6]} (II) – кристаллизацией на воздухе.
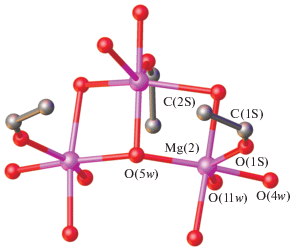
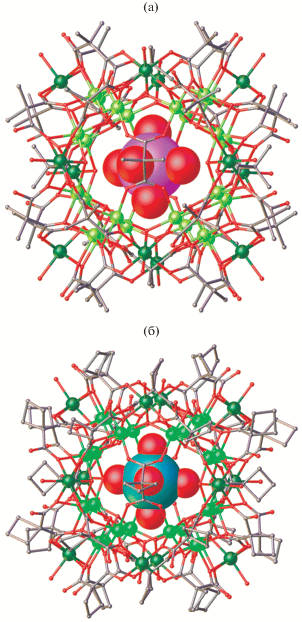
Проведенное рентгеноструктурное исследование соединений I и II показало, что они, как и ранее изученные полиядерные диметилмалонаты никеля(II) и кобальта(II), содержат 36 атомов металла (24 “внутренних” и 12 “внешних”), шесть тетрадентатных μ4-мостиковых и 24 тридентатных μ4-мостиковых малонат-анионов, а также μ3-мостиковые гидроксогруппы, атомы водорода в которых направлены внутрь полиядерного аниона, и координированные “внешними” атомами металла(II) молекулы воды (рис. 1) [1–3, 12]. Следует отметить, что соединение II является прямым доказательством того, что подобные полианионные карбоксилатные 36-ядерные соединения с ионами 3d-металлов (по крайней мере, Co(II) и Ni(II)) и анионами замещенных малоновых кислот характерны не только для диметилмалонатных производных, но и для других малонатных анионов, например анионов циклобутан-1,1-дикарбоновой кислоты.
Рис. 1.
Молекулярное строение полиядерных анионов в I (а) и II (б). Атомы водорода не показаны, “внешние” атомы металла темнее “внутренних”. Инкапсулированные катионы ([Mg(H2O)6]2+ – одно из положений (а), [Na(H2O)6]+ (б) изображены в виде ван-дер-ваальсовых сфер).
Элементарная ячейка соединения I близка к таковой для ранее полученного комплекса никеля(II) с анионами диметилмалоновой кислоты и катионами триэтиламмония (NHEt3)3[Ni36(H2O)12.25- (ОН)20(HMe2Mal)4(Me2Mal)20(Me2Mal)6@(NHEt3)] ∙ · 39H2O (пр. гр. $Pm\bar {3}m,$ a = b = c ≈ 25.4 Å [1]). В обоих случаях независимая часть кристаллической ячейки содержит два независимых атома металла, 1.5 независимых аниона дикарбоновой кислоты, два гидроксоаниона и молекулу воды, а также инкапсулированный и внешнесферный катионы и молекулы некоординированной воды. Вместе с тем строение катионов, формально занимающих эквивалентные позиции, существенно отличается. Электронную плотность внутри аниона в I можно интерпретировать как разупорядоченный за счет высокой симметрии кристалла по четырем положениям катион [Mg(H2O)6]2+, участвующий в образовании водородных связей с атомами кислорода диметилмалонат-анионов, образующих внутреннюю полость.
Интерпретация химического состава внешнесферного катиона затруднена тем, что он находится в частном положении. Электронная плотность в позиции (0.75 : 0.5 : 0), которую можно считать атомом кислорода, находится в окружении четырех более тяжелых атомов на расстоянии 1.98(1) Å, связанных, в свою очередь, с рядом других легких атомов. Таким образом, центральный фрагмент катиона можно интерпретировать как тетраядерный катион [Mg4(μ4-O)]6+ или разупорядоченный по четырем положениям трехъядерный катион состава [Mg3(μ3-O)]4+, [Mg3(μ3-OH)]5+ или [Mg3(μ3-Н2O)]6+. Соображения электронейтральности свидетельствуют в пользу гексакатионов, но ранее структурно-охарактеризованные тетра-ядерные катионы [Mg4(μ4-O)]6+ имеют расположение атомов металла в форме тетраэдра, в центре которого расположен оксо-анион, а в рассматриваемой структуре атомы металла расположены по вершинам бисфеноида. В случае трехъядерного катиона уточнение с частично-заселенной позицией атома магния дает более низкое значение факторов расходимости и тепловые эллипсоиды атомов металла, близкие к таковым для атомов углерода и кислорода в структуре. В целом трехъядерный катион имеет треугольное расположение атомов металла с мостиковым атомом кислорода, расположенным над их плоскостью. Координационное окружение атомов магния дополнено концевой молекулой спирта и четырьмя молекулами воды (рис. 2). Таким образом, согласно данным РСА, внешнесферный катион имеет предположительно состав [Mg3(μ3-Н2O)(μ2-Н2O)2(H2O)8 (C2H5OH)3]6+ или [Mg3(μ3-OH)(μ2-Н2O)2(H2O)8 (C2H5OH)3]5+. В последнем случае оценить, какая из OH-групп полиядерного аниона “приобретает” протон и становится молекулой воды, практически невозможно, однако рентгеноструктурные данные комплекса I, а также ранее синтезированных 36-ядерных соединений никеля(II) [1–3], также свидетельствуют о том, что заряд аниона может варьироваться.
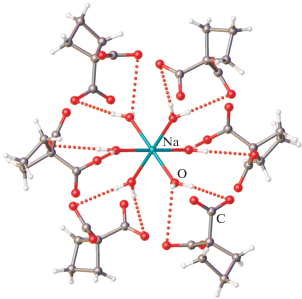
Комплекс II кристаллизуется в моноклинной сингонии и содержит в независимой части ячейки половину аниона, четыре внешнесферных катиона тетрабутиламмония, как и большинство ранее полученных комплексов. Вместе с тем внутренняя полость аниона содержит инкапсулированный катион [Na(H2O)6]+, участвующий в образовании водородных связей с шестью μ4-связанными анионами H2Сbdc (рис. 3), что позволяет приписать аниону заряд [An]8– с учетом инкапсулированного катиона ([An@[Na(H2O)6]]8–). Длины связей в гексааквакатионе изменяются от 2.308(10) до 2.333(9) Å, углы меняются в интервале 87.0(5)°–91.0(5)°.
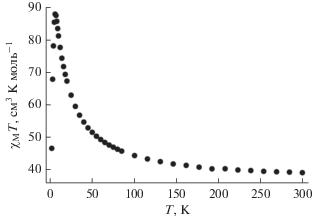
Для соединения I проведены измерения магнитных свойств в температурном диапазоне 2–300 K в магнитном поле напряженностью 5 кЭ. Значение χMT для I при 300 K, равное 39.0 см3 K моль–1, соответствует ожидаемому для 36 невзаимодействующих ионов никеля(II) со спином S = 1 и g = 2.08. С понижением температуры величина χMT монотонно возрастает до максимума 87.9 см3 K моль–1 при 6 K, последующее понижение температуры сопровождается резким снижением величины χMT с минимальным значением 46.5 см3 K моль–1 при 2 K (рис. 4). Такое магнитное поведение в области 300–6 K обусловлено реализацией доминирующих ферромагнитных обменных взаимодействий между ионами никеля(II) во фрагментах {Ni3(μ3-OH)(μ-OR)3}, что ранее показано на примере молекулярных комплексов никеля(II) [13–21]. Падение χMT связано с присутствием антиферромагнитных обменов и эффектом Зеемана. Ход кривой χMT(T) совпадает с ранее описанной для комплекса (NBu4)8[Ni36(H2O)12(ОН)20-(Me2Mal)30] ∙ 6H2O · 2EtOH, в котором нет внутренних катионных внедрений [2] и для которого были определены значения обменных взаимодействий.
Рис. 4.
Температурная зависимость χMT комплекса I в постоянном магнитном поле 5 кЭ в интервале 2–300 K.
Таким образом, получены новые карбоксилатные анионные комплексы никеля(II) c 36-ядерным металлоостовом и внутренними аквакатионами с различным зарядом. Можно полагать, что независимо от метода синтеза (автоклавный или растворный), а также от природы карбоксилатных дианионов (Me2Mal2– или Сbdc2–) формирование таких частиц вполне вероятно и в других подобных реакционных системах. Наличие полости в 36-ядерных полианионax позволяет инкапсулировать в нее акватированные катионы натрия или магния или сольватные молекулы, что подтверждают данные рентгеноструктурных экспериментов монокристаллов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Вологжанина А.В., Зорина-Тихонова Е.Н., Матюхина А.К. и др. // Коорд. химия. 2017. Т. 43. № 12. С. 703 (Vologzhanina A.V., Zorina-Tikhonova E.N., Matyukhina A.K. et al. // Russ. J. Coord. Chem. 2017. V. 43. P. 801). https://doi.org/10.1134/S1070328417120107
Zorina-Tikhonova E.N., Gogoleva N.V., Sidorov A.A. et al. // Polyhedron. 2017. V. 130. P. 67.
Зорина-Тихонова Е.Н., Гоголева Н.В., Сидоров А.А. и др. // Изв. АН. Сер. хим. 2015. № 3. С. 636 (Zorina-Tikhonova E.N., Gogoleva N.V., Sidorov A.A. et al. // Russ. Chem. Bull. (Int.Ed.). 2015. V. 64. P. 636).
Зорина-Тихонова Е.Н., Гоголева Н.В., Александров Е.В и др. // Изв. АН. Сер. хим. 2016. № 3. С. 759 (Zorina-Tikhonova E.N., Gogoleva N.V., Aleksandrov E.V. et al. // Russ. Chem. Bull. (Int. Ed.). 2016. V. 6. P. 759).
Bazhina E.S., Gogoleva N.V., Aleksandrov G.G. et al. // Chem. Select. 201. V. 3. P. 13765.
Sheldrick G.M. SADABS. Program for Empirical X‑ray Absorption Correction. Bruker-Nonius, 1990–2004.
Sheldrick G.M. // Acta Crystalogr. A. 2015. V. 71. № 1. P. 3.
Sheldrick G.M. // Acta Crystalogr. C. 2015. V. 71. № 1. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. № 2. P. 339.
Winn M.D., Ballard C.C., Cowtan K.D. et al. // Acta. Crystallogr. D. 2011. V. 67. № 4. P. 235.
Spek A.L. // Acta Crystalogr. C. 2015. V. 71. № 1. P. 9.
Zorina E.N., Zauzolkova N.V., Sidorov A.A. et al. // In-org. Chim. Acta. 2013. V. 396. P. 108.
Ghosh A.K., Shatruk M., Bertolasi V. et al. // Inorg. Chem. 2013. V. 52. P. 13894.
Ferguson A., Lawrence J., Parkin A. et al. // Dalton Trans. 2008. № 45. P. 6409.
Costes J.P., Novitchi G., Vendier L. et al. // Comptes Rendus Chimie. 2012. V. 15. P. 849.
Ghisolfi A., Monakhov K.Yu., Pattacini R. et al. // Dalton Trans. 2014. V. 43. P. 7847.
Paine T.K., Rentschler E., Weyhermuller T., Chaudhuri P. // Eur. J. Inorg. Chem. 2003. P. 3167.
Karmakar S., Khanra S. // CrystEngComm. 2014. V.16. P. 2371.
Mandal D., Hong C.S., Kim H.C. et al. // Polyhedron. 2008. V. 27. P. 2372.
Boskovic C., Rusanov E., Stoeckli-Evans H., Güdel H.U. // Inorg. Chem. Commun. 2002. V.5. P. 881.
Mukherjee P., Drew M.G.B., Tangoulis V. et al. // Inorg. Chem. Commun. 2009. V. 12. P. 929.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия