Координационная химия, 2021, T. 47, № 4, стр. 226-236
Изомеризация биядерных карбоксилатных комплексов кадмия [Cd2L2(O2CR)4]
Н. В. Гоголева 1, М. А. Шмелев 1, *, М. А. Кискин 1, А. Г. Стариков 2, А. А. Сидоров 1, И. Л. Еременко 1, 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 НИИ физической и органической химии Южного федерального университета
Ростов-на-Дону, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: shmelevma@yandex.ru
Поступила в редакцию 15.06.2020
После доработки 21.09.2020
Принята к публикации 01.10.2020
Аннотация
Рассмотрены биядерные комплексы кадмия, в которых атомы металла связаны двумя хелатно-мостиковыми карбоксилатными анионами – [Cd2L2(µ2-(Рiv)2(κO,κO'-(Рiv)2] (L = 2,4-лутидин, фенантридин, 2,2'-бипиридин, Рiv = пивалатный анион) и комплексы со структурой “китайского фонарика”, в которых атомы кадмия связаны четырьмя мостиковыми карбоксилатными анионами – [Cd2L2(µ2-(Рiv)4] (L = 2,3-циклододеценопиридин (Сdpy)) и [Cd2(L)2(µ2-(PfAc))4] (L = 1,10-фенантролин, PfAc = пентафторфенилацетатный анион). Для каждого из указанных биядерных комплексов состава [Cd2L2(Рiv)4] с монодентатными и хелатирующими N-донорными лигандами проведены расчеты двухмостиковых и четырехмостиковых изомеров методом теории функционала плотности с применением четырех различных приближений. На основании данных расчетов сопоставлена устойчивость изомеров и сделаны выводы о факторах, приводящих к формированию комплексов того или иного строения.
Строение карбоксилатов кадмия и двухвалентных 3d-металлов имеет много общего. Одинаковые монодентатные и хелатирующие производные пиридина часто формируют в случае 3d-металлов комплексы аналогичного строения. Так, α-замещенные пиридины образуют биядерные комплексы состава [М2L2(µ2-O2CR)4] (M = Mn(II), Fe(II), Co(II), Ni(II), Cu(II), Zn(II), Cd(II), L = α-замещенный пиридин, O2CR = анион монокарбоновой кислоты) со структурой “китайского фонарика” с четырьмя мостиковыми карбоксилатными анионами [1–7]. Хелатирующие производные пиридина (2,2'-бипиридин (Вipy)), 1,10-фенантролин (Рhen) и др.) способствуют стабилизации биядерных комплексов аналогичного состава [М2L2(O2CR)4] [8, 9], в которых атомы металлов связаны только двумя мостиковыми карбоксилатными анионами [М2L2(µ2-(O2CR)2(κO,κO'-(O2CR)2]. Следует отметить, что кадмий и 3d-металлы, помимо биядерных соединений, способны образовывать с производными пиридина моноядерные комплексы [10–12] и соединения другого строения, не рассматриваемые в данной работе. В отличие от 3d-металлов, ионы кадмия способны формировать с хелатирующими лигандами комплексы обоих (двух- [13–17] и тетрамостиковые соединения [10, 18, 19]) структурных типов.
Такая структурная вариативность в случае комплексов кадмия, по-видимому, может свидетельствовать о легкости изомеризации двухмостиковой структуры [М2L2(µ2-(O2CR)2(κO,κO'-(O2CR)2] в тетрамостиковую [М2L2(µ2-(O2CR)4] и наоборот. Способность к образованию нескольких типов структур с идентичным лигандным составом может оказаться полезной, например при разработке методов направленного синтеза каркасных координационных полимеров, в которых изомеризация биядерного фрагмента могла бы приводить к структурным фазовым переходам. Поскольку один из двух возможных изомеров всегда будет термодинамически устойчивее, в случае достаточно лабильных комплексов кадмия и двухвалентных 3d-металлов для выделения метастабильного изомера должны быть найдены подходящие условия, что сложно осуществимо на примере одного состава, но в случае карбоксилатов кадмия выполнимо при варьировании лигандов.
Цель настоящей работы – получение информации о строении изомеров биядерных пивалатных комплексов кадмия с Вipy, 2,3-циклододеценопиридином (Сdpy), 2,4-лутидином (Lut) и пентафторфенилацетатного комплекса с Рhen посредством проведения расчетов методом теории функционала плотности (DFT). Для комплексов со структурой “китайского фонарика” ([М2L2(µ2-(O2CR)4]) рассчитана структура гипотетического биядерного изомера такого же состава, но с двумя мостиковыми карбоксилатными анионами ([М2L2(µ2-(O2CR)2-(κO,κO'-(O2CR)2]), а для комплексов с двумя мостиковыми карбоксилатными анионами – структура гипотетического изомера типа “китайского фонарика”. С использованием результатов квантово-химического исследования сопоставлена устойчивость изомеров, соответствующих каждому из составов, и сделаны выводы о факторах, приводящих к формированию того или иного строения комплексов. Основную группу рассмотренных карбоксилатов представляют пивалаты, которые позволяют не только получить большинство требуемых типов биядерных структур, но и являются удобными стартовыми объектами для изучения химии карбоксилатных комплексов кадмия. Полученные результаты можно непосредственно сравнивать с накопленными данными по многочисленным аналогичным комплексам 3d-металлов [20–22]. Был рассмотрен единственный пентафторфенилацетатный комплекс, поскольку с пивалатными анионами нам не удалось выделить соединение со структурой типа “китайского фонарика” при использовании хелатирующих лигандов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом нового комплекса, выполняли на воздухе с использованием этанола (96%), ацетонитрила (99.9%), Cd(NO3)2 ⋅ 4H2O (99%, Acros organics), KОН (“ч. д. а.”), HPfAc (99%, Sigma-Aldrich), 1,10-фенантролин моногидрат (Рhen ⋅ H2O, 99%, Alfa Aesar). KPfAc получали in situ реакцией стехиометрических количеств KOH и HPfAc в EtOH и MeCN. ИК-спектр соединения регистрировали на ИК‑спектрофотометре с Фурье-преобразованием Spectrum 65 (PerkinElmer) методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 4000–400 см–1. Элементный анализ выполняли на CHNS-анализаторе EuroЕА 3000 (EuroVector).
Синтез [Cd2(Рhen)2(µ2-(PfAc))4]. К раствору Cd(NO3)2 ⋅ 4H2O (0.100 г, 0.325 ммоля) в 15 мл EtOH приливали раствор KPfAc (0.175 г, 0.649 ммоля) в 10 мл EtOH и 10 мл MeCN. Реакционную смесь перемешивали при нагревании (Т = 70°C) в течение 20 мин. Образовавшийся белый осадок KNO3 отфильтровывали, к фильтрату прибавляли Рhen (0.059 г, 0.325 ммоля) и перемешивали при 70°С в течение 25 мин, охлаждали до комнатной температуры и выдерживали при медленном испарении растворителя в течение 5 сут. Выпавшие бесцветные кристаллы, пригодные для РСА, отделяли от маточного раствора декантацией, промывали холодным ацетонитрилом (5°С) и сушили на воздухе. Выход 0.166 г (68.9% в расчете на Cd(NO3)2 ⋅ 4H2O).
ИК-спектр (НПВО; ν, см–1): 3675 cл, 2971 сл, 1635 с, 1590 ср, 1571 ср, 1519 ср, 1497 с, 1427 ср, 1415 ср, 1378 с, 1346 ср, 1313 ср, 1265 сл, 1223 сл, 1210 сл, 1201 ср, 1096 сл, 1089 сл, 1046 ср, 1008 с, 974 с, 917 с, 862 ср, 849 с, 782 сл, 775 ср, 730 с, 722 ср, 702 сл, 636 ср, 613 сл, 581 сл, 556 ср, 552 сл, 480 ср.
РСА монокристалла соединения [Cd2(Рhen)2-(µ2-(PfAc))4] выполнен на дифрактометре Bruker Apex II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [23]. Для всех соединений введена полуэмпирическая поправка на поглощение по программе SADABS [24]. Структуры расшифрованы прямыми методами и уточнены полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX [25] с использованием OLEX 2 [26]. Геометрия полиэдров металлов определена с использованием программы SHAPE 2.1 [27, 28]. Кристаллографические параметры и детали уточнения структуры [Cd2(Рhen)2(µ2-(PfAc))4] при T = 296(2) K: C56H24N4O8F20Cd2, Mw = 1485.59 г/моль, ромбические бесцветные кристаллы, 0.37 × 0.24 × 0.17 мм, пр. гр. C2/с, a = 28.219(9), b = 9.712(3), c = 21.727(8) Å, β = 112.37(2)°, V = 5507(3) Å3, Z = 4, ρ(выч.) = = 1.792 г см–3, μ = 0.900 мм–1, 1.73° ≤ θ ≤ 25.00°, сегмент сферы –0 ≤ h ≤ 21, 0 ≤ k ≤ 23, –26 ≤ l ≤ 14, 26 994 измеренных рефлексов, 5386 независимых рефлексов, 4581 отражений с I > 2.0σ(I), Rint = = 0.1299, GООF = 1.027, R1(I > 2σ(I)) = 0.0483, wR2(I > 2σ(I)) = 0.1107, R1 (все данные) = 0.0573, wR2 (все данные) = 0.1212, Δρmin/Δρmax, е Å–3 = = ‒1.750/1.398.
Координаты атомов и другие параметры соединения [Cd2(Рhen)2(µ2-(PfAc))4] депонированы в Кембриджском банке структурных данных (CCDC № 2005752; deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
Методика расчетов. Все расчеты проведены с помощью программы Гауссиан 16 [29]. В качестве начальных геометрий использованы данные РСА координационных соединений. Обсуждаемые в статье структуры комплексов вычислены посредством полной оптимизации без наложения симметрийных ограничений с использованием метода DFT. Высокая стереохимическая нежесткость исследуемых комплексов приводит к необходимости выбора приближения, способного корректно воспроизводить экспериментально наблюдаемые геометрические характеристики. С этой целью расчеты проведены с использованием функционала B3LYP [29], хорошо зарекомендовавшего себя при изучении аналогичных биядерных карбоксилатных комплексов металлов [20, 21, 30], и расширенного базиса Def2-TZVP, обеспечивающего разумный компромисс между уровнем приближения и временем проведения расчетов, а также позволяющего использовать эффективный остовный потенциал на атомах кадмия. Для моделирования эффектов упаковки использовали различные схемы учета дисперсионных взаимодействий: дальнодействующие поправки включались посредством функционала CAM-B3LYP [31], также применяли эмпирические поправки Гримме D3BJ [32], в том числе и в комбинации с CAM-B3LYP. Графические изображения молекулярных структур получали при помощи программы ChemCraft [33].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
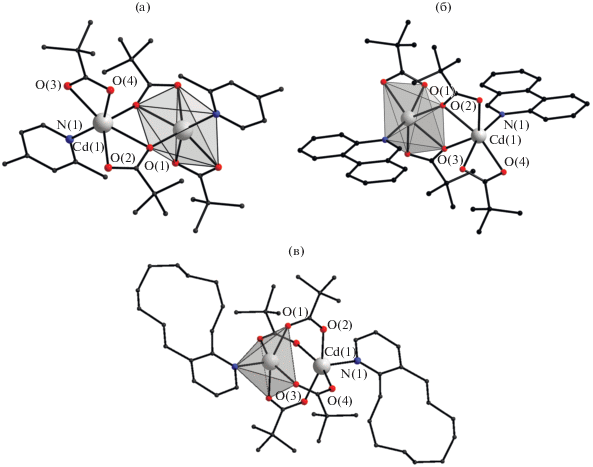
Ранее было показано, что в реакциях пивалатов Mn(II), Fe(II), Co(II), Ni(II) и Zn(II) с α-замещенными пиридинами образуются биядерные комплексы со структурой “китайского фонарика” [М2L2(µ2-(Рiv))4] (Рiv = анион пивалиновой кислоты, L = α-замещенный пиридин) [1–4, 22, 34–39], аналогичные комплексы формирует медь(II), для которой характеры подобные димерные комплексы и с большинством других монодентатных лигандов [38, 40–47]. Было показано, что взаимодействие пивалатов кадмия с 2,4-лутидином или фенантридином приводит к образованию биядерных комплексов того же состава [Cd2(L)2(Рiv)4] (L = 2,4-Lut, Phen) [10], но другого строения (рис. 1а, 1б). Атомы кадмия в этих соединениях связаны только двумя хелатно-мостиковыми карбоксилатными анионами, два других аниона хелатно связаны с каждым атомом кадмия. Использование более объемного лиганда Сdpy в аналогичной реакции привело к образованию комплекса [Cd2(Cdpy)2(µ2-(Piv))4], в котором все четыре карбоксилатных аниона мостиковые (рис. 1в) [10]. Очевидно, что формированию такой структуры способствовало увеличение объема заместителя, находящегося в α-положении пиридина, что демонстрирует роль стерических факторов в сборке металло-карбоксилатного остова с тем или иным типом координации анионов. Однако непосредственное сравнение геометрии координационных полиэдров металлоцентров и стерических эффектов, создаваемых N-донорными лигандами в комплексах [Cd2(2,4-Lut)2(Рiv)4], [Cd2(Phen)2(Рiv)4] и [Cd2(Cdpy)2(µ2-(Piv))4], недостаточно корректно, поскольку они имеют разное строение. Ранее мы сообщали о синтезе и исследовании строения биядерных пивалатных комплексов Mn(II), Fe(II), Co(II), Ni(II) и Cu(II) с Сdpy [38]; в комплексе никеля были обнаружены наибольшие искажения геометрии молекул со структурой “китайского фонарика”, проявляющиеся в значительном отклонении от линейного расположения донорных атомов N пиридиновых лигандов и Ni (угол NNiNi 151.67°). Для других ионов металлов угол NMM варьировался в диапазоне 161.15°–168.35°. Также о стерических напряжениях, создаваемых α-заместителями координированных пиридиновых фрагментов, свидетельствует отклонение пиридинового фрагмента от симметричной координации (различие между углами, которые образуют атом металла, координированный к нему атом азота и ближайший атом углерода пиридинового цикла).
Рис. 1.
Строение комплексов [Cd2(2,4-Lut)2(Рiv)4] (а), [Cd2(Phen)2(Рiv)4] (б) и [Cd2(Cdpy)2(µ2-(Piv))4] (в). Атомы водорода не показаны.
Биядерные пивалатные комплексы кадмия с Вipy и Рhen имеют ожидаемую двухмостиковую структуру [21, 48]. Отличие строения этих координационных соединений от комплексов с 2,4-лутидином и фенантридином заключается в том, что они содержат хелатно-связанную молекулу N-донорного основания в качестве апикального лиганда [Cd2(Вipy)2(µ2-(Рiv)2(κO,κO'-(Рiv)2] (рис. 2а), вследствие чего координационное число кадмия увеличивается с 6 до 7.
Рис. 2.
Строение комплексов [Cd2(Вipy)2(µ2-(Рiv)2(κO,κO'-(Рiv)2] (а) и [Cd2(Рhen)2(µ2-(PfAc))4] (б). Атомы водорода и фтора (б) не показаны.
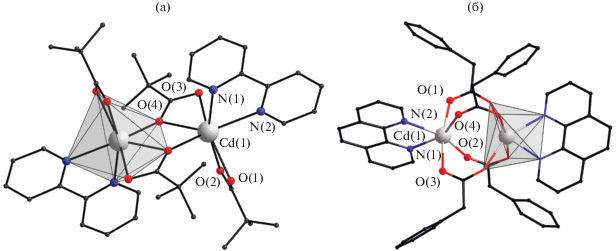
При использовании HPfAc и Рhen получен новый комплекс состава [Cd2(Рhen)2(µ2-(PfAc))4], в котором атомы кадмия связаны четырьмя мостиковыми анионами PfAc (Cd…Cd 3.506(1) Å, Cd–O 2.219(3)–2.369(3) Å) (рис. 2б). Атомы кадмия достраивают свое окружение до октаэдрического координацией двух атомов N молекулы Рhen (Cd–N 2.394(3), 2.403(3) Å).
Из литературы известны немногочисленные сообщения о получении биядерных комплексов кадмия с молекулами Вipy и анионами монокарбоновых кислот [18, 49], характеризующихся тетрамостиковой структурой. И только одно из известных соединений является молекулярным комплексом с анионами монокарбоновой кислоты [18], два других представляют собой катионы, образованные нейтральными цвиттер-ионными карбоксилатными лигандами (фосфорсодержащими аналогами бетаина), а роль хелатирующего лиганда играет нитрат-анион [49]. Таким образом, для каждой из возможных структур биядерных комплексов кадмия с монодентатным или хелатирующим лигандом имеются реальные структурно охарактеризованные соединения, которые можно рассматривать в качестве опорных точек в анализе.
Способность кадмия с хелатирующими и монодентатными производными пиридина формировать комплексы как со структурой “китайского фонарика”, так и содержащие биядерный двухмостиковый фрагмент может указывать на то, что энергетические характеристики таких структур достаточно близки и относительно небольшое изменение в строении лигандов или условий кристаллизации может приводить к образованию различных изомеров.
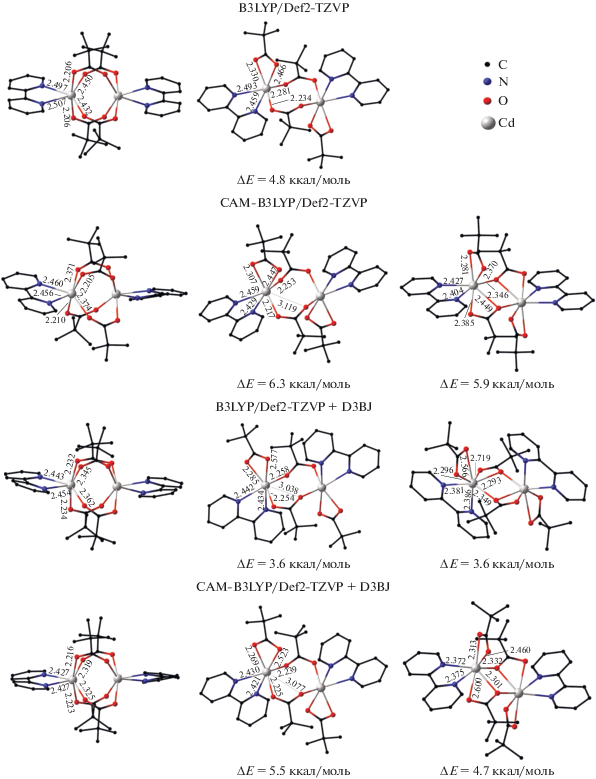
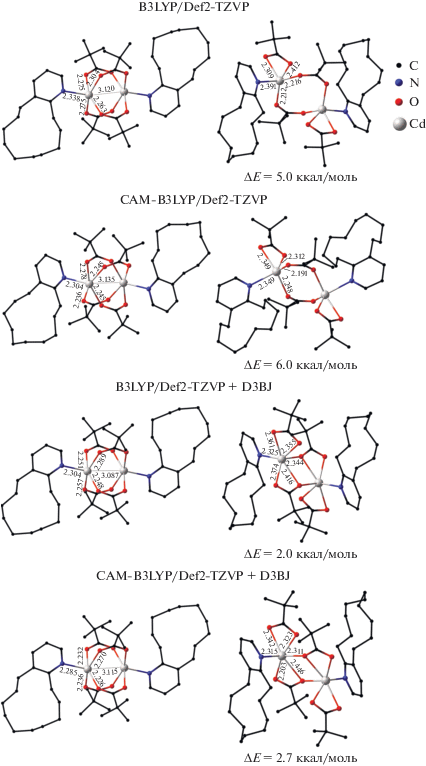
Первоначально были предприняты попытки локализовать структуры, отвечающие трем возможным изомерам комплекса с Вipy. Расчеты в приближении B3LYP без учета дисперсионных взаимодействий позволили найти изомеры с биядерным двухмостиковым и тетрамостиковым фрагментами (рис. 3). Оптимизация геометрии, наблюдаемой в кристалле структуры с двумя хелатно-мостиковыми фрагментами, привела к двухмостиковому изомеру. Включение в расчетную схему дальнодействующих дисперсионных взаимодействий (CAM-B3LYP) позволило найти третий изомер, который оказался ниже по энергии структуры с двухмостиковым фрагментом на 0.4 ккал/моль. Последующие вычисления, включающие дисперсионную поправку Гримме D3BJ и ее комбинацию с CAM-B3LYP, подтвердили возможность существования трех изомеров. Вычисленная разность энергий между изомерами с двумя мостиковыми фрагментами не превышает 0.8 ккал/моль (рис. 3), что позволяет ожидать безбарьерный переход между ними, например при упаковке молекул в кристалле. Согласно расчетам, наиболее выгодным изомером является “китайский фонарик”, полная энергия отвечающей ему структуры на 4–6 ккал/моль превышает данную характеристику для экспериментально наблюдаемого хелатно-мостикового изомера. Можно предположить, что значительное влияние на формирование соответствующего изомера оказывает среда, в которой протекает реакция.
Рис. 3.
Геометрические и энергетические характеристики изомеров комплекса [Cd2(Вipy)2(µ2-(Рiv)2(κO,κO'-(Рiv)2], вычисленные с использованием различных приближений. Здесь и на рис. 4–6 атомы водорода не показаны. За ноль принята энергия изомеров, приведенных в левом ряду.
Теоретическое изучение комплекса с Lut с использованием функционалов B3LYP и CAM-B3LYP показало отсутствие стационарных точек, соответствующих хелатно-мостиковой структуре, полученной в результате РСА (рис. 4), оптимизация геометрии которой приводит к двухмостиковому изомеру. Включение в расчетную схему дисперсионных поправок Гримме (D3BJ) позволяет получить экспериментально наблюдаемую структуру. Как и в рассмотренном выше комплексе с Вipy, наиболее выгодным конформером изолированной молекулы комплекса является структура типа “китайского фонарика”, стабилизированная в зависимости от использованного приближения на 2.4–3.9 ккал/моль. Столь незначительная разность энергий может приводить к формированию в кристаллическом состоянии любого изомера.
Рис. 4.
Геометрические и энергетические характеристики изомеров комплекса [Cd2(2,4-Lut)2(Рiv)4], вычисленные с использованием различных приближений.
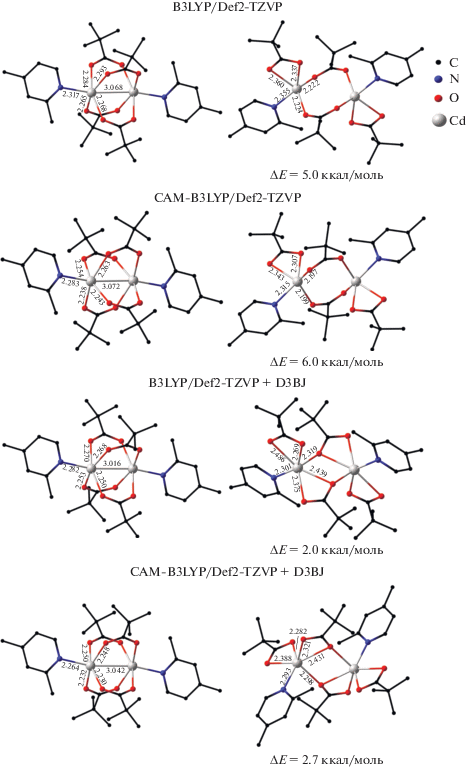
Расчеты аналогичного по составу комплекса с Сdpy показали, что стационарные точки, отвечающие хелатно-мостиковым структурам, стабилизируются только при включении дисперсионных поправок Гримме, использование других приближений приводит к двухмостиковым структурам (рис. 5). В полном согласии с данными РСА, основному состоянию этого координационного соединения отвечает структура типа “китайский фонарик”, которая на 2–6 ккал/моль предпочтительнее изомеров с двумя мостиковыми лигандами.
Рис. 5.
Геометрические и энергетические характеристики изомеров комплексов [Cd2(Cdpy)2(µ2-(Piv))4], вычисленные с использованием различных приближений.
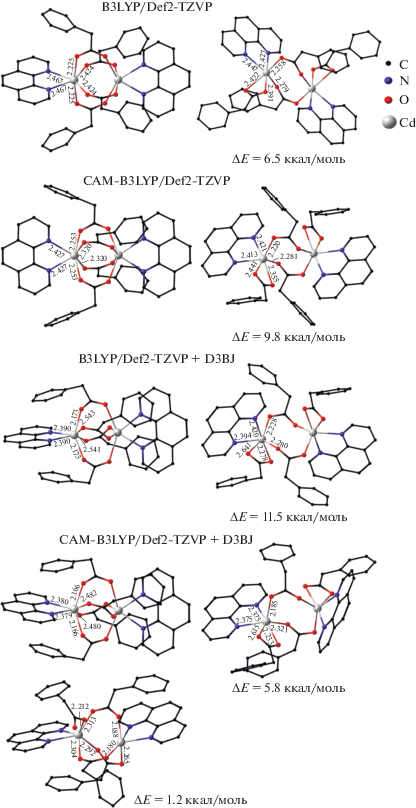
В заключение был проанализирован комплекс [Cd2(Рhen)2(µ2-(PfAc))4]. Из данных РСА следует, что он имеет структуру “китайского фонарика”, в котором атомы O карбоксильных групп характеризуются различными длинами связей с ионами металлов, а молекулы Рhen расположены перпендикулярно друг относительно друга. Оптимизация геометрии в различных приближениях сопровождается уменьшением угла между плоскостями Рhen и повороту пентафторфенильной группы, но сохраняет тетрамостиковое строение димера. Квантово-химическое изучение изомеров, в которых только два лиганда образуют мостики между ионами металлов, показало существование зависимости их строения от использованного приближения (рис. 6). Расчеты B3LYP и CAM-B3LYP ожидаемо привели к двухмостиковым структурам, а оптимизация в приближении B3LYP/Def2TZVP + GD3 сопровождалась трансформацией исходной (двухмостиковой) геометрии в структуру типа “китайского фонарика”. Одновременное включение двух схем учета дисперсионных взаимодействий (CAM-B3LYP/ Def2TZVP + GD3) приводит к структуре, в которой один из мостиковых карбоксилатных лигандов хелатно-мостиковый (рис. 6). С использованием данного приближения найден достаточно редкий трехмостиковый изомер, незначительная дестабилизация которого относительно структуры с четырьмя мостиковыми группами (1.2 ккал/моль) позволяет предположить возможность его присутствия в реакционной смеси. Существование подобных структур было ранее обнаружено в соединениях никеля [50]. Второй очень интересный пример – катионный комплекс [Zn2(Piv)3(Bipy)2]+, выделенный в составе ионного соединения [Zn2(Bipy)2(Piv)3][EuZn(Bipy)(NO3)3(Piv)3] [51]. Таким образом, независимо от использованного приближения, конформер пентафторфенилацетатного комплекса с Phen типа “китайский фонарик” значительно выгоднее (5.8–11.5 ккал/моль) двухмостиковых структур, что находится в согласии с экспериментом. Однa из вероятных причин существенного различия энергий изомеров этого соединения по сравнению с рассмотренными выше комплексами пивалатов с Lut и Cdpy – затрудненное вращение плоских ароматических заместителей по сравнению с аналогичным движением трет-бутильных групп. Можно предположить, что системы на основе ароматических лигандов (незамещенные, с донорными заместителями, с акцепторными заместителями, конденсированные) будут демонстрировать значительное разнообразие строения, во-первых, из-за большей разницы в энергии конформеров (внутримолекулярные взаимодействия), во-вторых, из-за большей вероятности реализации межмолекулярных взаимодействий.
Рис. 6.
Геометрические и энергетические характеристики изомеров комплекса [Cd2(Рhen)2(µ2-(PfAc))4], вычисленные с использованием различных приближений. Атомы фтора опущены для ясности.
Результаты проведенного квантово-химического (DFT) исследования биядерных карбоксилатов кадмия с монодентатными и хелатирующими N-донорными лигандами хорошо согласуются с экспериментальными данными, свидетельствующими о существовании различных изомеров, и подтверждают способность современных методов квантовой химии корректно предсказывать строение и возможность синтеза рассматриваемых типов карбоксилатных координационных систем. Сравнительно небольшое число рассмотренных в настоящей работе комплексов кадмия позволило провести их изучение с применением четырех различных приближений. Анализ результатов, полученных с помощью различных расчетных схем, показал, что наилучшее согласие вычисленных геометрий биядерных карбоксилатных комплексов кадмия с найденными в результате рентгеноструктурных исследований дает комбинация CAM-B3LYP/Def2TZVP c эмпирическими поправками Гримме GD3BJ. Данное приближение может быть рекомендовано для теоретического изучения аналогичных координационных соединений этого металла.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Гольдберг А.Е., Кискин М.А., Николаевский С.А. и др. // Коорд. химия. 2015. Т. 41. № 3. С. 163 (Goldberg A.E., Kiskin M.A., Nikolaevskii S.A. et al. // Russ. J. Coord. Chem. 2015. V. 41. P. 182). https://doi.org/10.1134/S1070328415030021
Eremenko I.L., Nefedov S.E., Sidorov A.A. et al. // Inorg. Chem. 1999. V. 38. P. 3764.
Фомина И.Г., Доброхотова Ж.В., Кискин М.А. и др. // Изв. АН. Сер. хим. 2007. № 9. С. 1650 (Fomina I.G., Dobrokhotova Zh.V., Kiskin M.A. et al. // Russ. Chem. Bull. (Int. Ed.). 2007. P. 1650).
Сидоров А.А., Фомина И.Г., Александров Г.Г. и др. // Изв. АН. Сер. хим. 2004. С. 460 (Sidorov A.A., Fomina I.G., Aleksandrov G.G. et al. // Russ. Chem. Bull. (Int. Ed.). 2004. P. 460).
Гольдберг А.Е., Кискин М.А., Козюхин С.А. и др. // Изв. АН. Сер. хим. 2011. № 5. С. 987 (Gol’dberg A.E., Kiskin M.A., Kozyukhin S.A. et al. // Russ. Chem. Bull. (Int. Ed.). 2011. P. 987).
Талисманова М.О., Сидоров А.А., Новоторцев В.М. и др. // Изв. АН. Сер. хим. 2011. С. 2149 (Talismanova M.O., Sidorov A.A., Novotortsev V.M. et al. // Russ. Chem. Bull. (Int. Ed.). 2011. P. 2149).
Кискин М.А., Фомина И.Г., Сидоров А.А., Александров Г.Г. и др. // Изв. АН. Сер. хим. 2004. С. 116 (Fomina I.G., Sidorov A.A., Aleksandrov G.G. et al. // Russ. Chem. Bull. (Int. Ed.). 2004. P. 116).
Nikiforov A.A., Blinou D.O., Dubrov E.N. et al. // Acta Crystallogr. E. 2019. V. 75. P. 1768.
Feng Li // Z. Kristallogr.-New Cryst. Struct. 2019. V. 234. P. 1227.
Гоголева Н.В., Шмелев М.А., Кискин М.А. и др. // Изв. АН. Сер. хим. 2016. № 5. С. 1198 (Gogoleva N.V., Shmelev M.A., Kiskin M.A. et al. // Russ. Chem. Bull. (Int. Ed.). 2016. V. 65. № 5. P. 1198).
Saxena P., Thirupathi N. // Polyhedron. 2015. V. 98. P. 238.
Yang Y.Q., Chen Z.M., Li W. et al. // Z. Kristallogr. – New Cryst. Struct. 2011. V. 226. P. 112.
Li W., Li C.H., Yang Y.Q. et al. // Wuji Huaxue Xuebao (Chin.) (Chin. J. Inorg. Chem.). 2010. V. 26. P. 166.
Nie J.J., Pan T.-T., Su J.-R. et al. // Acta Crystallogr. E. 2010. V. 66. P. m760.
Hu M., Yang X.G., Zhang Q. et al. // Z. Anorg. Allg. Chem. 2011. V. 637. P. 478.
Zha M.Q., Li X., Bing Y. // J. Coord. Chem. 2011. V. 64. P. 473.
Yang Y.Q., Li C.H., Li W. et al. // Wuji Huaxue Xuebao (Chin.) (Chin. J. Inorg. Chem.). 2009. V. 52. P. 1120.
Yang Y.Q., Li C.-H., Li W. et al. // Wuji Huaxue Xuebao (Chin.) (Chin. J. Inorg. Chem.). 2010. V. 26. P. 1890.
Li J.X., Du Z.X. // J. Cluster Sci. 2020. V. 31. P. 507.
Николаевский С.А., Ямбулатов Д.С., Старикова А.А. и др. // Коорд. химия. 2020. Т. 46. № 4. С. 241 (Nikolaevskii S.A., Yambulatov D.S., Starikova A.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 4. P. 260). https://doi.org/10.1134/S1070328420040053
Nikolaevskii S.A., Evstifeev I.S., Kiskin M.A. et al. // Polyhedron. 2018. V. 152. P. 61.
Николаевский С.А., Кискин М.А., Старикова А.А. и др. // Изв. АН. Сер. хим. 2016. № 12. С. 2812 (Nikolaevskii S.A., Kiskin M.A., Starikova A.A. et al. // Russ. Chem. Bull. (Int. Ed.). 2016. V. 65. № 12. P. 2812).
SMART (control) and SAINT (integration). Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. SADABS. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Alvarez S., Llunell M. // Dalton Trans. 2000. V. 19. P. 3288.
Casanova D., Llunell M., Alemany P. et al. // Chem. Eur. J. 2005. V. 11. P. 1479.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 16. Revision A. 03. Wallingford: Gaussian, 2016.
Николаевский С.А., Ямбулатов Д.С., Старикова А.А. и др. // Коорд. химия. 2019. Т. 46. № 4. С. 241 (Nikolaevskii S. A., Kiskin M. A., Starikov A. G. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 273). https://doi.org/10.1134/S1070328419040067
Yanai T., Tew D., Handy N. // Chem. Phys. Lett. 2004. V. 393. P. 51.
Grimme S., Ehrlich S., Goerigk L. // J. Comp. Chem. 2011. V. 32. P. 1456.
Chemcraft. Version 1.7. 2013. http://www.chemcraftprog.com.
Hirashima N., Husebye S., Kato M. et al. // Acta Chem. Scand. 1990. V. 44. P. 984.
Kumar U., Thomas J., Agrawal M., Thirupathi N. // Inorg. Chim. Acta. 2011. V. 370. P. 122.
Morooka M., Ohba S., Nakashima M. et al. // Acta Crystallogr. C. 1992. V. 48. P. 1888.
Overgaard J., Timco G.A., Larsen F.K. // Acta Crystallogr. E. 2008. V. 64. P. m.497.
Гоголева Н.В., Александров Г.Г., Павлов А.А. и др. // Коорд. химия. 2018. Т. 44. № 1. С. 3 (Gogoleva N.V., Aleksandrov G.G., Pavlov A.A. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 91). https://doi.org/10.1134/S1070328418020057
Kirillova N.I., Struchkov Yu.T., Porai-Koshits M.A. et al. // Inorg. Chim. Acta. 1980. V. 40. P. 115.
Yadava K., Gallo G., Bette S. et al. // IUCrJ. 2020. V. 7. P. 83.
Iqbal M., Karim A., Saqib Ali et al. // Polyhedron. 2020. V. 178. P. 114310.
Sanchez-Sala M., Pons J., Alvarez-Larena A. et al. // Polyhedron. 2018. V. 151. P. 545.
Guerrero M., Ayllon J.A., Calvet T. et al. // Polyhedron. 2017. V. 134. P. 107.
Muhammad N., Ikram M., Perveen F. et al. // J. Mol. Struct. 2019. V. 1196. P. 771.
Adonin S.A., Petrov M.A., Abramov P.A. et al. // Polyhedron. 2019. V. 171. P. 312.
Adonin S.A., Novikov A.S., Sokolov M.N. et al. // Inorg. Chem. Commun. 2019. V. 105. P. 221.
Soldevila-Sanmartin J., Sanchez-Sala M., Calvet T. et al. // J. Mol. Struct. 2018. V. 1171. P. 808.
Гоголева Н.В., Шмелев М.А., Евстифеев И.С. и др. // Изв. АН. Сер. хим. 2016. № 1. С. 181 (Gogoleva N.V., Shmelev M.A., Evstifeev I.S. et al. // Russ. Chem. Bull. (Int. Ed.). 2016. V. 65. P. 181).
Li S.-L., Mak T.C.W. // Dalton Trans. 1995. P. 1519.
Сидоров А.А., Фомина И.Г., Малков А.Е. и др. // Изв. АН. Сер. хим. 2000. № 11. С. 1915 (Sidorov A.A., Fomina I.G., Malkov A.E. et al. // Russ. Chem. Bull. (Int. Ed.). 2000. P. 1915).
Егоров Е.Н., Михалев Е.А., Кискин М.А. и др. // Изв. АН. Сер. хим. 2013. С. 2141 (Egorov E.N., Mikhalev E.A., Kiskin M.A. et al. // Russ. Chem. Bull. (Int. Ed.). 2013. P. 2141).
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


