Координационная химия, 2021, T. 47, № 7, стр. 431-438
Спиновое состояние 2,6-бис(пиразол-3-ил)пиридинового комплекса кобальта(II) с редокс-активным ферроценильным заместителем
Г. Л. Денисов 1, И. А. Никовский 1, Т. М. Алиев 1, А. В. Полежаев 1, 2, Ю. В. Нелюбина 1, 2, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
2 Московский государственный технический университет им. Н.Э. Баумана
Москва, Россия
* E-mail: unelya@ineos.ac.ru
Поступила в редакцию 12.12.2020
После доработки 08.01.2021
Принята к публикации 11.01.2021
Аннотация
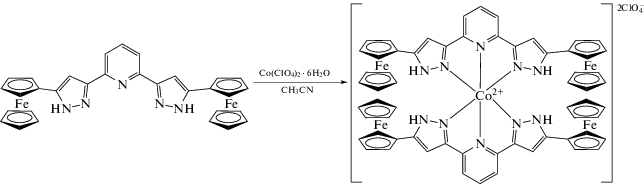
При взаимодействии нового 2,6-бис(пиразол-3-ил)пиридинового лиганда (L), содержащего редокс-активный ферроценильный заместитель, с солью двухвалентного кобальта получен комплекс кобальта(II) [Co(L)2](ClO4)2 (I), выделенный в индивидуальном виде и охарактеризованный методами элементного анализа, спектроскопии ЯМР, циклической вольтамперометрии и рентгеновской дифракции. Согласно данным РСА (CIF file CCDC № 2049714) и метода Эванса, позволяющего на основе спектров ЯМР определять спиновое состояние парамагнитных соединений в растворе, ион кобальта(II) в комплексе I находится в высокоспиновом состоянии и не претерпевает температурно-индуцированного спинового перехода в диапазоне температур 120–370 К.
Некоторые комплексы переходных металлов могут переключаться между двумя спиновыми состояниями при соответствующем внешнем воздействии [1, 2], например под действием температуры или давления, при облучении светом или приложении магнитного поля. Подобный спиновый переход сопровождается значительными изменениями магнитных и оптических свойств, что определяет перспективы практического применения соответствующих комплексов в дисплеях [3], электролюминесцентных устройствах [4], молекулярных переключателях [5], химических сенсорах [6, 7] и т.п.
Среди большого разнообразия соединений, способных претерпевать спиновой переход (в первую очередь под действием температуры), эта способность наиболее часто встречается у комплексов железа(II) и кобальта(II) в (псевдо)октаэдрическом окружении азотсодержащих лигандов [2]. Однако для всех указанных выше практических применений необходимо иметь контроль над спиновым состоянием иона металла, что достигается при помощи химической модификации лигандов тем или иным образом [8]. 2,6-Бис(пиразол-1-ил)пиридины [9] и изомерные им 2,6-бис(пиразол-3-ил)пиридины [10] являются одними из наиболее популярных классов органических лигандов для этой цели из-за широчайших возможностей их химической функционализации, позволяющей проводить “настоящий” [8] молекулярный дизайн 2,6-бис(пиразол-1-ил)пиридиновых [11] и 2,6-бис(пиразол-3-ил)пиридиновых [12] комплексов с заданными параметрами температурно-индуцированного спинового перехода при выборе заместителя с подходящими электронными свойствами.
Другим возможным способом контроля спинового состояния комплексов переходных металлов является введение в лиганд pH-чувствительных групп, которые при протонировании/депротонировании меняют свои электромерные характеристики и тем самым влияют на спиновое состояние иона металла [13]. Для этой же цели иногда выбирают редокс-активные заместители, например ферроцен [14], который сам по себе диамагнитен. Однако его окисление/восстановление позволяет обратимо переключать электронную структуру лиганда, что используется в катализе [15]. Введение редокс-активного ферроценильного заместителя в бис(пиразолил)пиридиновый лиганд может существенно расширить возможности управления спиновым состоянием иона металла за счет модификации бис(пиразолил)пиридина и получить первый такой комплекс со способностью к редокс-переключению и температурно-индуцированному спиновому переходу.
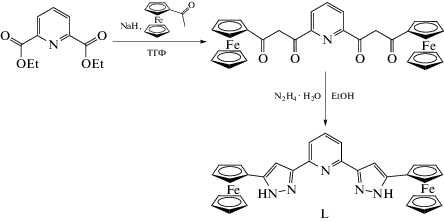
В настоящей работесинтезирован новый 2,6-бис(пиразол-3-ил)пиридин (L),содержащий в положении 5 пиразол-3-ильного кольца ферроценильную группу (схема 1 ). Приего смешении с перхлоратом кобальта(II)в качестве источника иона переходного металла удалось получить соответствующий комплекс [Co(L)2](BF4)2 (I) с высокими выходами.
Схема 1 .
Спиновое состояние иона кобальта(II) в комплексе I установлено по данным РСА его монокристалла при 120 K. Возможность протекания спинового перехода в растворе под действием температуры в диапазоне 230–370 K изучена с помощью традиционно используемого для этих целей метода Эванса, основанного на доступной спектроскопии ЯМР.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом бис(пиразол-3-ил)пиридинового лиганда и его комплекса, выполняли на воздухе с использованием коммерчески доступных органических растворителей, перегнанных в атмосфере аргона. Co(ClO4)2 ⋅ 6H2O (Sigma-Aldrich) использовали без дополнительной очистки. Этерификацию пиридин-2,6-дикарбоновой кислоты (Acros) этиловым спиртом проводили по литературной методике [16] в присутствии серной кислоты. Анализ на содержание углерода, азота и водорода проводили на микроанализаторе Carlo Erba, модель 1106.
Синтез 2,6-бис(5-ферроценил-1H-пиразол-3-ил)пиридина (L). Раствор диэтилового эфира пиридин-2,6-дикарбоновой кислоты (2.80 г, 12.5 ммоль) в сухом ТГФ смешивали с NaH (1.22 г, 30.5 ммоль, 50%-ная суспензия в минеральном масле). К полученной суспензии по каплям добавляли раствор ацетил ферроцена (6.27 г, 27.5 ммоль) в 50 мл ТГФ. Реакционную смесь кипятили с обратным холодильником в течение 4 ч, упаривали, а твердый осадок промывали горячим гексаном (2 × 30 мл), высушивали в вакууме, диспергировали в воде и доводили pH полученной суспензии до 5 добавлением 1 М соляной кислоты. Фиолетовый осадок отфильтровывали, высушивали в вакууме и диспергировали в этиловом спирте с добавлением гидразин гидрата (1.5 мл, 40 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 4 ч. Полученный осадок отфильтровывали, промывали этиловым спиртом и высушивали в вакууме. Выход 2.5 г (35%).
ЯМР 1H (ДМСО-d6; 400 МГц; δ м.д.): 4.09 (с., 5H, Fc), 4.35 (c., 2H, Fc), 4.80 (c., 2H, Fc), 7.14 (c., 2H, Pz), 7.88 (c., 3H, Py), 13.02 (c., 2H, NH).
Синтез [Co(L)2](ClO4)2 (I). Гексагидрат перхлората железа (0.0365 г, 0.1 ммоль) и 2,6-бис(5-ферроценил-1H-пиразол-3-ил)пиридин (0.116 г, 0.2 ммоль) перемешивали в ацетонитриле в течение 3 ч. Для очистки полученный раствор концентрировали и прикапывали диэтиловый эфир до появления посадка. Смесь выдерживали в течение 12 ч при −10°C. Осадок отфильтровывали и высушивали в вакууме. Выход 126 мг (91%). ЯМР 1H (ДМФА-d7; 300 МГц; δ, м.д.): 8.12 (уш.с., 20H, Fc), 8.16 (уш.с., 8H, Fc), 10.49 (уш.с., 8H, Fc), 33.41 (уш.с., 2H, p-Py−H), 53.90 (уш.с., 4H, Рyraz−CH), 83.72 (уш.с., 4H, NH).
Монокристаллы комплекса I, пригодные для РСА, получали диффузией паров диэтилового эфира в его раствор в метаноле.
РСА I проведен на дифрактометре Bruker APEX2 CCD (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структура расшифрована с использованием программы ShelXT [17] и уточнена в полноматричном МНК с помощью программы Olex2 [18] в анизотропном приближении по $F_{{hkl}}^{2}$. Положения атомов водорода рассчитаны геометрически, и они уточнены в изотропном приближении по модели наездника. Разупорядоченные молекулы растворителя (метанола и диэтилового эфира) описывали в виде диффузного вклада в общее рассеяние с помощью опции Solvent Mask программы Olex2 [18]. Основные кристаллографические данные и параметры уточнения представлены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для комплекса I
| Параметр | Значение |
|---|---|
| М | 1416.35 |
| T, K | 120 |
| Сингония | Триклинная |
| Пр. гр. | P1 |
| Z | 2 |
| a, Å | 11.258(4) |
| b, Å | 11.619(4) |
| c, Å | 27.555(10) |
| α, град | 86.435(7) |
| β, град | 86.869(7) |
| γ, град | 67.317(7) |
| V, Å3 | 3317(2) |
| ρ(выч.), г см‒3 | 1.418 |
| μ, см–1 | 12.37 |
| F(000) | 1442 |
| 2θmax, град | 54 |
| Число измеренных отражений | 34 531 |
| Число независимых отражений | 14 480 |
| Число отражений с I > 3σ(I) | 4496 |
| Количество уточняемых параметров | 784 |
| R1 | 0.0845 |
| wR2 | 0.2425 |
| GOОF | 0.862 |
| Остаточная электронная плотность (max/min), e Å‒3 | 0.886/–0.790 |
Структурные данные для комплекса I депонированы в Кембриджском банке структурных данных (CCDC № 2049714; http://www.ccdc.cam.ac.uk/).
Спектры ЯМР 1H регистрировали в ДМСО-d6 и ДМФА-d7 на спектрометрах Bruker Avance 300 и 400 с рабочими частотами для протонов 300.15 и 400 МГц соответственно. Значения химических сдвигов (δ, м.д.) в спектрах определяли относительно остаточного сигнала растворителя (1H 2.5 м.д. для ДМСО-d6 и 1H 8.03 м.д. для ДМФА-d7) или сигнала 1% примеси Me4Si (1H 0.0 м.д). Использовали следующие параметры: диапазон спектра – 120 м.д., время регистрации – 0.1 с, длительность релаксационной задержки – 0.1 с, длительность импульса – 9.5 мкс, количество накоплений – 64. Полученные спады свободной индукции для повышения соотношения сигнал/шум обрабатывали при помощи экспоненциального взвешивания с коэффициентом до 3.
Методом Эванса [19] оценивали температурную зависимость магнитной восприимчивости комплекса I в растворе ДМФА-d7 в интервале температур 230–370 К с использованием ампулы для ЯМР спектроскопии с коаксиальной вставкой. Внутреннюю (контрольную) трубку заполняли ДМФА-d7 с добавлением ~1% Me4Si, а внешняя трубка содержала раствор парамагнитного комплекса (~1–5 мг/см3) в ДМФА-d7 с той же концентрацией Me4Si. Молярную магнитную восприимчивость рассчитывали по разнице между химическим сдвигом Me4Si в чистом ДМФА-d7 и его сдвигом в растворе комплекса (Δδ, Гц) в ДМФА-d7 с использованием следующего уравнения:
M – молярная масса комплекса, г/моль; ν0 – частота спектрометра, Гц; Sf – коэффициент формы магнита (4π/3); c – концентрация комплекса, г/см3; ${{\chi }}_{{\text{M}}}^{{{\text{dia}}}}$ – молярный диамагнитный вклад в парамагнитную восприимчивость, рассчитанный с использованием констант Паскаля [20]. Концентрацию с пересчитывали для каждой температуры в соответствии с изменением плотности растворителя (ρ): cT = mкомпρ/mр-р, где mкомпρ – масса комплекса, а mр-р – масса раствора.
Комплекс I изучен также методом циклической вольтамперометрии (ЦВА). Циклические вольтамперограммы регистрировали на потенциостате-гальваностате Autolab PGSTAT128N под управлением программного обеспечения NOVA 2.0 в стандартной трехэлектродной ячейке. В качестве рабочего электрода применяли 3 мм стеклоуглеродный электрод, противоэлектрода – платиновая проволока, электрода сравнения – Ag/AgCl в насыщенном растворе KCl. Необходимую проводимость раствора достигали за счет добавления в исследуемый раствор TBAPF6 до концентрации 0.1 М. Все кривые ЦВА регистрировали со скоростью разверстки 100 мВ/с. Перед каждым экспериментом исследуемый раствор продували аргоном в течение 5 мин для удаления растворенного воздуха, а рабочий электрод тщательно полировали. Все измерения проводили при комнатной температуре.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для синтеза L (cхема 2) исходный диэтил-2,6-пиридиндикарбоксилат вводили в реакцию конденсации Кляйзена с ацетилферроценом под действием гидрида натрия в растворе ТГФ. Образовавшийся в результате продукт использовали без предварительной очистки в последующей конденсации с гидразин гидратом в этиловом спирте, которая привела к получению целевого лиганда L с умеренным выходом. Данное соединение отличается малой растворимостью даже в таких растворителях, как ДМСО или ДМФА, поэтому оно выпадает из раствора в ходе реакции и не нуждается в дальнейшей очистке.
Схема 2 .
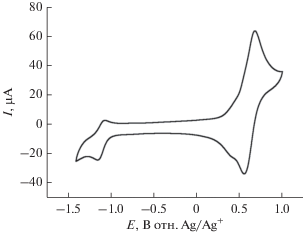
При дальнейшем взаимодействии синтезированного лиганда L с гидратом перхлората кобальта в качестве источника иона кобальта(II) в ацетонитриле получен с высоким выходом гомолептический комплекс [Co(L)2](ClO4)2 (I), выделенрый в индивидуальном виде и охарактеризованный методами элементного анализа, спектроскопии ЯМР и ЦВА. Согласно результатам метода ЦВА (рис. 1), в ацетонитрильном растворе комплекса I в присутствии гексафторфосфата тетрабутиламмония, выполняющего роль дополнительного электролита, наблюдаются две обратимые одноэлектронные волны окисления со значениями E1/2 = –1.066 и 0.654 В относительно пары Ag/Ag+. Первый процесс соответствует окислению иона кобальта Co2+/Co+, а значение второго потенциала окисления близко к потенциалу пары Fc/Fc+. Так как расстояния между полуволнами окисления–восстановления (ΔEp = Epa – Epc) составляли 80 мВ, оба процесса считались нернстовыми. Для пары сравнения Fc/Fc+ в аналогичных условиях значение ΔEp также равно 80 мВ [21].
Рис. 1.
Циклическая вольтамперограмма 1 мМ раствора комплекса I в ацетонитриле, С(TBAPF6) = = 0.1 М, скорость развертки – 100 мВ/с, стеклоуглеродный электрод (3 мм).
Для подтверждения полученных таким образом данных о составе и строении комплекса I также проведен РСА его монокристаллов (рис. 2), образовавшихся в результате диффузии паров диэтилового эфира в его раствор в метаноле в виде кристаллосольвата с разупорядоченными молекулами указанных растворителей (см. Экспериментальную часть). Это позволило определить спиновое состояние иона кобальта(II), который оказался высокоспиновым при температуре 120 К, о чем свидетельствуют расстояния Co–N с атомами азота двух бис(пиразол-3-ил)пиридиновых лигандов (КЧ 6) (табл. 2), характерные для комплексов кобальта(II) в высокоспиновом состоянии (2.0–2.2 Å [2]). Ионы железа(II) в ферроценильных заместителях ожидаемо находятся в низкоспиновом (диамагнитном) состоянии, наблюдаемом для ферроцена и его производных.
Рис. 2.
Общий вид комплекса I. Здесь и далее перхлорат-анионы и атомы водорода (за исключением принадлежащих NH-группам) не показаны, а остальные атомы представлены в виде эллипсоидов тепловых колебаний (p = 50%). Нумерация приведена только для ионов металлов и избранных гетероатомов.
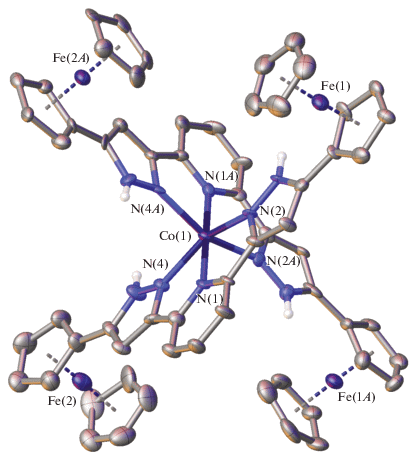
Таблица 2.
Основные геометрические параметры для комплекса I по данным рентгеноструктурного исследования при 120 К*
| Параметр | Значение |
|---|---|
| Co–N(Py), Å | 2.044(8)/2.057(8) |
| Co–N(Pz), Å | 2.131(9)–2.153(8) |
| θ, град | 88.1127(13) |
| N(Py)CoN(Py), град | 178.1428(7) |
| Fe–C(Cp), Å | 2.000(12)–2.074(12) |
| α, град | 80.689(17)–84.429(14) |
| Fe…Fe, Å | 7.276(2)/7.640(2) |
| S(TP-6) | 4.021 |
| S(OC-6) | 11.012 |
* θ – двугранный угол между среднеквадратичными плоскостями 2,6-бис(пиразол-3-ил)пиридиновых лигандов, атомы N(Py) и N(Pz) соответствуют атомам азота пиридинового и пиразол-3-ильного фрагментов, а α – углу поворота Cp кольца ферроценильных заместителей относительно плоскости пиразол-3-ильного кольца. S(TP-6) и S(OC-6) – отклонениe формы полиэдра CoN6 от идеальной тригональной призмы (TP-6) и идеального октаэдра (OC-6) соответственно.
Бис(пиразол-3-ил)пиридиновые лиганды в комплексе I образуют вокруг центрального иона металла координационное окружение, близкое к октаэдрическому (рис. 3). Например, значения угла θ между среднеквадратичными плоскостями двух лигандов и угла N(Py)MN(Py), равные 90° и 180° в случае идеального октаэдра, составляют 88.1127(13)° и 178.1428(7)°. Более точно форму координационного полиэдра CoN6 характеризуют так называемые “меры симметрии” [22], описывающиe ее отклонение от идеального октаэдра S(OC-6). Чем эти значения меньше, тем лучше форма полиэдра описывается соответствующим многогранником. В комплексе I величина октаэдрической “меры симметрии” S(OC-6), оцененная на основе рентгенодифракционных данных при помощи программы Shape 2.1 [22], оказывается равной 4.021 (табл. 2). Для сравнения “мера симметрии”, характеризующая отклонение от еще одного идеального полиэдра с шестью вершинами – тригональной призмы (TPR-6), традиционно встречающейся у высокоспиновых комплексов железа(II) с N-гетероциклами [23], – принимает заметно более высокое значение в 11.012 (табл. 2).
Рис. 3.
Проекция комплекса I в перпендикулярном направлении, иллюстрирующая близкую к октаэдрической форму координационного полиэдра иона кобальта(II). Нумерация атомов приведена только для ионов металлов.
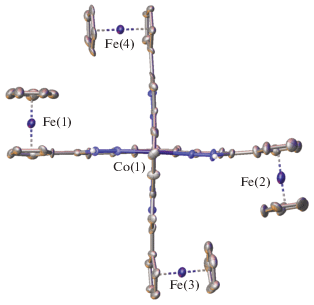
Незначительное отклонение формы координационного полиэдра иона кобальта(II) в комплексе I от идеального октаэдра, в первую очередь, вызвано “жесткостью” бис(пиразол-3-ил)пиридинового лиганда [24]. Например, аналогичные значения “мер симметрии” ранее наблюдались для высокоспиновых комплексов кобальта(II) с другими бис(пиразол-3-ил)пиридинами [25, 26]. Однако нельзя исключить и влияние стерического эффекта объемных ферроценильных заместителей в пятом положении пиразол-3-ильного кольца, которые располагаются перпендикулярно плоскости последнего (табл. 2). При этом указанные заместители оказываются попарно повернутыми друг навстречу другу (рис. 3). Подобное их расположение способствует образованию в кристалле I бесконечных цепочек из катионов [Co(L)2]2+ (рис. 4), построенных вдоль кристаллографической оси b стекинг-взаимодействиями между циклопентадиенильными кольцами ферроценильных заместителей и связанными с ними пиразол-3-ильными фрагментами с углом между ними в 6.0(5)°–7.9(5)° и расстоянием между их центроидами в 3.521(7)–3.828(7) Å. Они дополнительно стабилизированы укороченными контактами C–H…N (C…N 3.410(16) Å, CHN 159.3(6)°) между теми же циклопентадиенильными кольцами и перпендикулярными им пиразол-3-ильными фрагментами соседних катионов [Co(L)2]2+, а также образованными ими контактами C–H…O с перхлорат-анионами (H…O 2.4361(9)–2.9097(7) Å), “обрамляющими” упомянутые бесконечные цепочки. Таким образом, ион кобальта(II) в окружении бис(пиразол-3-ил)пиридиновых лигандов с объемными электронодонорными ферроценильными заместителями в положении 5 пиразол-3-ильных колец в комплексе I находится в высокоспиновом состоянии в кристалле при 120 K, как однозначно следует из данных его РСА при этой температуре.
Рис. 4.
Фрагмент кристаллической упаковки комплекса I, иллюстрирующий образование в кристалле бесконечных цепочек за счет стекинг-взаимодействий.

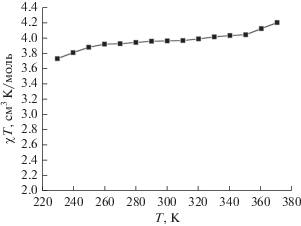
Согласно результатам метода Эванса [19], основанного на использовании спектроскопии ЯМР, в таком же спиновом состоянии он остается и в растворе комплекса I в ДМФА, выбор которого в качестве растворителя позволил нам зарегистрировать спектры ЯМР в широком диапазоне температур (230–370 К). Метод Эванса активно используется в поиске новых комплексов металлов с температурно-индуцированным спиновым переходом [8] как самый доступный способ измерения магнитной восприимчивости растворов. Для этого в стандартную ампулу для ЯМР спектроскопии, содержащую раствор парамагнитного комплекса и стандартного соединения, такого как тетраметилсилан (ТМС), в известной концентрации, помещают специальную коаксиальную вставку, содержащую раствор ТМС в том же растворителе, в котором при охлаждении не будет наблюдаться образования осадка, что является одним из ограничений метода Эванса. Разница в значениях химического сдвига ТМС в спектре ЯМР, зарегистрированном от этих двух растворов, позволяет рассчитать магнитную восприимчивость раствора исследуемого парамагнитного соединения и тем самым однозначно установить спиновое состояние иона металла. Для раствора комплекса I в ДМФА рассчитанное таким образом значение χТ (рис. 5) практически не отклоняется от значения 3.9 см3 моль–1 K, соответствующей иону кобальта(II) в высокоспиновом состоянии (S = 3/2), на всем интервале температур 230–370 K, доступных для выбранного растворителя. Наблюдаемая стабилизация высокоспинового состояния в растворе, в котором отсутствуют эффекты кристаллической упаковки [8], однозначно свидетельствует о “внутримолекулярной” природе данного явления.
Рис. 5.
Температурная зависимость магнитной восприимчивости комплекса I в растворе ДМФА по данным метода Эванса спектроскопии ЯМР.
Таким образом, синтезирован и охарактеризован комплекс кобальта(II) с новым 2,6-бис(пиразол-3-ил)пиридиновым лигандом, содержащим редокс-активный ферроценильный заместитель в положении 5 пиразол-3-ильного кольца. Согласно результатам проведенного для него низкотемпературного рентгенодифракционного исследования, в первую очередь длинам связей Со–N, ион кобальта(II) в указанном комплексе находится в высокоспиновом состоянии (S = 3/2) даже при 120 К. Он также не претерпевает температурно-индуцируемого спинового перехода в растворе в ДМФА, что подтверждается данными спектроскопии ЯМР (метод Эванса) в диапазоне температур 230–370 K. Можно предположить, что дальнейшая замена иона кобальта(II) на ион железа(II), который в окружении 2,6-бис(пиразол-3-ил)пиридиновых лигандов может менять свое спиновое состояние под действием температуры [12], позволит получить первый комплекс 2,6-бис(пиразол-3-ил)пиридина, сочетающий способность к редокс-переключению и температурно-индуцированному спиновому переходу.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Sato O., Tao J., Zhang Y.-Z. // Angew. Chem. Int. Ed. 2007. V. 46. № 13. P. 2152.
Spin-Crossover Materials: Properties and Applications / Ed. Halcrow M.A. Chichester (United Kingdom): John Wiley & Sons, Ltd., 2013.
Kahn O., Martinez C. J. // Science. 1998. V. 279. № 5347. P. 44.
Matsuda M., Isozaki H., Tajima H. // Thin Solid Films. 2008. V. 517. № 4. P. 1465.
Senthil Kumar K., Ruben M. // Coord. Chem. Rev. 2017. V. 346. P. 176.
Coronado E., Giménez-Marqués M. et al. // J. Am. Chem. Soc. 2013. V. 135. № 43. P. 15986.
Bartual-Murgui C., Akou A., Thibault C. et al. // J. Mat. Chem. C. 2015. V. 3. № 6. P. 1277.
Halcrow M.A. // Crystals. 2016. V. 6. № 5. P. 58.
Halcrow M.A. // Coord. Chem. Rev. 2009. V. 253 № 21. P. 2493.
Halcrow M.A. // Coord. Chem. Rev. 2005. V. 249. № 25. P. 2880.
Kershaw Cook L.J., Kulmaczewski R., Mohammed R. et al. // Angew. Chem. Int. Ed. 2016. V. 55. № 13. P. 4327.
Nikovskiy I., Polezhaev A.V., Novikov V.V. et al. // Chem. Eur. J. 2020. V. 26. P. 5629.
Gaudette A.I., Thorarinsdottir A.E., Harris T.D. // Chem. Commun. 2017. V. 53. № 96. P. 12962.
Romero-Morcillo T., Valverde-Muñoz F.J., Piñeiro-López L. et al. // Dalton Trans. 2015. V. 44. № 43. P. 18911.
Luca O.R., Crabtree R.H. // Chem. Soc. Rev. 2013. V. 42. № 4. P. 1440.
Polezhaev A.V., Chen C.-H., Kinne A.S. et al. // Inorg. Chem. 2017. V. 56. № 16. P. 9505.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Evans D.F. // J. Chem. Soc. 1959. P. 2003.
Bain G.A., Berry J.F. // J. Chem. Educ. 2008. V. 85. № 4. P. 532.
Bligh R.Q., Moulton R., Bard A.J. et al. // Inorg. Chem. 1989. V. 28. № 13. P. 2652.
Alvarez S. // Chem. Rev. 2015. V. 115. P. 13447.
Kershaw Cook L., Mohammed R., Sherborne G. // Coord. Chem. Rev. 2015. V. 289–290. P. 2.
Alvarez S. // J. Am. Chem. Soc. 2003. V. 125. № 22. P. 6795.
Павлов А.А., Белов А.С., Савкина С.А. и др. // Коорд. химия. 2018. Т. 44. № 4. C. 236 (Pavlov A.A., Belov A.S., Savkina S.A. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 8. P. 489). https://doi.org/10.1134/S1070328418080067
Павлов А.А., Никовский И.А., Полежаев А.В. и др. // Коорд. химия. 2019. Т. 45. № 6. C. 341 (Pavlov A.A., Nikovskii I.A., Polezhaev A.V. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 6. P. 402). https://doi.org/10.1134/S1070328419060046
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия