Координационная химия, 2021, T. 47, № 8, стр. 489-498
Координация гексагидро-1,3,5-триметил-1,3,5-триазина в карбоксилатных комплексах кадмия(II) и кобальта(II)
М. А. Шмелев 1, *, Ю. К. Воронина 1, С. С. Чекурова 2, Н. В. Гоголева 1, Т. М. Иванова 1, О. И. Лямина 1, Е. В. Фатюшина 1, М. А. Кискин 1, А. А. Сидоров 1, И. Л. Еременко 1, 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: shmelevma@yandex.ru
Поступила в редакцию 19.03.2021
После доработки 30.03.2021
Принята к публикации 31.03.2021
Аннотация
На примере гексагидро-1,3,5-триметил-1,3,5-триазина (TACH) исследовано влияние объемного тридентатного лиганда на геометрию карбоксилатных комплексов. При взаимодействии [Co2Gd(NO3)- (Piv)6(MeCN)2] (Piv = анион пивалиновой кислоты) с TACH получен комплекс [Co2Gd(NO3)- (Piv)6(TACH)2] (I), в структуре которого сохраняется исходный гетерометаллический металлофрагмент и ионы кобальта(II) координируют молекулу N-донорного лиганда с формированием полусэндвичевой структуры. При использовании пентафторбензоатов Cd(II) и Eu(III) в реакции с TACH удалось выделить только гомометаллический комплекс [Cd(Рfb)2(TACH)2] (II) (Рfb = анион пентафторбензойной кислоты). Большое координационное число иона кадмия(II) в структуре II позволило получить сэндвичевый комплекс с двумя молекулами TACH, координированными к одному иону металла. Строение новых комплексов определено методом РСА (CIF files CCDC № 2062230 (I) и 2062229 (II)). Показано, что связывание молекулы N-донорного лиганда ионом металла приводит к значительному искажению координационных полиэдров металлоцентров и изменению конформации гексагидро-1,3,5-триметил-1,3,5-триазина).
Использование N-донорных лигандов нашло в координационной химии широчайшее распространение. В зависимости от особенностей строения и координационных возможностей такие лиганды используются для “конструирования” заданного окружения металлоцентров. Из большого числа первичных, вторичных и третичных аминов можно выделить 1,4,7-триазациклононан (TACN), гексагидро-1,3,5-триазин и их производные, атомы азота которых способны занимать координационные места одной треугольной грани окружения металла [1–4].
В синтез и исследование соединений с TACN и его производными было вовлечено большое число ученых и комплексам с этим лигандом посвящено множество публикаций ведущих специалистов в области координационной, металлорганической, физической и органической химии [5–7]. Для макроциклического 1,4,7-триазациклононана граневой тип координации является наиболее предпочтительным. Избежать его возможно только в случае координационного окружения, совершенно исключающего такой тип связывания, например квадратного, или при прочном блокировании части позиций координационного полиэдра другими лигандами. Одновременно с уникальностью TACN можно отметить и определенную тривиальность в поведении этого лиганда, выражающуюся в ограниченности проявляемых типов координации. Известно только два сэндвичевых катионных комплекса с 1,4,7-триметил-1,4,7-триазациклононаном (L'): [Na(L')2](A)2 [8] и [К(L')2](A)2 [9] (A = тетракис(3,5-бис(трифторметил)фенил)борат). Для редкоземельных элементов сэндвичевых фрагментов с производными 1,4,7-триазациклононана не получено, из литературы известны только комплексы с полусэндвичевым типом структуры [ScCl3(L')], [MCl3(L')] (M = Sc, Y) [10, 11].
Хотя с производными TACN получено очень большое количество соединений, можно допустить, что в ряде случаев вместо него, по-видимому, можно было использовать диэтилентриамин или его производные, которые также способны к граневой координации к металлоцентру.
Известен другой циклический тридентатный N-донорный лиганд, также способный обеспечить граневую тридентатно-хелатную координацию – гексагидро-1,3,5-триазин и его 1,3,5-производные, из которых наиболее часто использовались гексагидро-1,3,5-триметил-1,3,5-триазин (TACH) и 1,3,5-трибензилгексагидро-1,3,5-триазин. По нашему мнению, в достаточно большом числе случаев использование производных гексагидро-1,3,5-триазина вместо 1,4,7-триметил-1,4,7-триазациклононана позволило бы избежать стерических затруднений и получить значительно большее структурное разнообразие соединений.
Окружение металлоцентра может быть полностью сформировано двумя координированными молекулами TACH с образованием катионных сэндвичевых комплексов, а в случае металлов, проявляющих большие координационные числа, такие сэндвичевые фрагменты могут быть достроены двумя или тремя лигандами с частичной компенсацией положительного заряда и образованием катионных комплексов или с полной компенсацией заряда и образованием молекулярных комплексов [12–17].
Производные гексагидро-1,3,5-триазина достаточно широко используются в координационной и металлоорганической химии, например для увеличения стабильности соединений, неустойчивых к действию воды и кислорода [14, 18]. Как правило, такие лиганды координируются к металлоцентрам всеми тремя атомами азота, образуя полусэндвичевые фрагменты. Несмотря на доступность и низкую цену производных гексагидро-1,3,5-триазина известно только несколько карбоксилатных комплексов c его триметилзамещенным, TACH, в которых он образует полусэндвичевые фрагменты. Это моноядерный [Ln(L)- (OOCC(Ph)3)3] (Ln = La, Nd) и биядерный [Ln2(L)(OOCC(Ph)3)6] комплексы лантанидов [2].
В настоящей статье мы рассматриваем два важных примера координации TACH в карбоксилатных комплексах. При этом в одном случае он обеспечивает образование полусэндвичевого фрагмента в составе комплекса [Co2Gd(NO3)(Piv)6-(TACH)2] (I) с устойчивым гетерометаллическим металлоостовом, а в другом – формирование в структуре [Cd(Рfb)2(TACH)2] (II) сэндвичевого фрагмента, сформированного двумя монодентатно координированными триазиновыми лигандами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом новых комплексов, выполняли на воздухе с использованием ацетонитрила (99.9%), TACH (97%, Sigma-Aldrich). [{Cd(Рfb)(H2O$)_{4}^{ + }$}n · n(Рfb)] (Рfb = пентафторбензоат-анион), [Eu2(Рfb)6(H2O)8] · 2H2O и [Co2Gd(NO3)(Piv)6(MeCN)2] (Piv = пивалат-анион) получали по известным методикам [19, 20]. ИК-спектр соединений регистрировали на ИК-спектрофотометре с Фурье-преобразованием Spectrum 65 (PerkinElmer) методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 4000–400 см–1. Элементный анализ выполняли на CHNS-анализаторе EuroЕА 3000 (EuroVector).
Синтез [Co2Gd(NO3)(Piv)6(TACH)2] (I). К раствору 0.150 г комплекса [Co2Gd(NO3)(Piv)6(MeCN)2] (0.147 ммоль) в 15 мл MeCN добавляли навеску 0.036 г TACH (0.294 ммоль, Co : TACH = 1 : 1) и перемешивали 20 мин при нагревании до 70°С. Полученный раствор выдерживали при комнатной температуре в закрытой виале. Образовавшиеся через 7 сут кристаллы, пригодные для РСА, отделяли от маточного раствора декантацией, промывали холодным ацетонитрилом (Т = ~5°C). Выход соединения I 0.147 г (82.5% в расчете на [Co2Gd(NO3)(Piv)6(MeCN)2].
ИК-спектр (НПВО; ν, см–1): 3675 cл, 2956 ср, 2867 ср, 2803 ср, 1608 с, 1578 ср, 1563 с, 1481 с,. 1458 ср, 1419 с, 1400 с, 1377 ср, 1355 с, 1270 сл, 1223 ср, 1168 сл, 1123 с, 1117 ср, 1091 сл, 1049 сл, 1000 ср, 981 сл, 961 ср, 930 ср, 903 ср, 840 ср, 805 сл, 791 ср, 698 сл, 612 с, 573 ср, 549 ср, 432 с, 443 с, 419 с, 403 с.
Синтез [Cd(Рfb)2(TACH)2] (II). К раствору [{Cd(Рfb)(H2O$)_{4}^{ + }$}n.n(Рfb)–] (0.100 г, 0.166 ммоль) в 7 мл MeCN добавляли 0.042 г TACH (0.322 ммоль, Cd : L = 1 : 2). Реакционную смесь перемешивали 15 мин и полученный бесцветный раствор выдерживали при 75°С в закрытой виале. Образовавшиеся через 10 сут бесцветные кристаллы, пригодные для РСА, отделяли от маточного раствора декантацией, промывали холодным ацетонитрилом (Т = ~5°C). Выход соединения II 0.055 г (42.3% в расчете на [{Cd(Рfb)(H2O$)_{4}^{ + }$} n ⋅ n(Рfb)–]).
ИК-спектр (НПВО; ν, см–1): 3298 сл, 2804 сл, 1705 сл, 1625 сл, 1555 ср, 1351 с, 1470 с. 1400 ср, 1372 с, 1350 с, 1298 ср, 1163сл, 1114 ср, 990 ср, 938 сл, 841 ср, 743 ср, 526 ср, 473 сл, 439 сл, 404 сл.
РСА монокристаллов выполнен на дифрактометре Bruker Apex II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [21]. Для всех соединений введена полуэмпирическая поправка на поглощение по программе SADABS [22]. Структуры расшифрованы прямыми методами и уточнены полноматричным МНК в анизотропном приближении для всех неводородных атомов. Атомы водорода при атомах углерода органических лигандов генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX [23] с использованием OLEX 2 [24]. Геометрия полиэдров металлов определена с использованием программы SHAPE 2.1 [25, 26]. Кристаллографические данные и детали уточнения структур I, II приведены в табл. 1, основные длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические параметры и детали уточнения структур I, II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| М | 1202.27 | 792.96 |
| Т, K | 296(2) | 296.15 |
| Сингония | Моноклинная | Триклинная |
| Пр. гр. | P21/c | P1 |
| a Å | 12.134(8) | 10.5023(4) |
| b Å | 23.002(14) | 15.5799(6) |
| c Å | 22.025(14) | 20.8838(10) |
| α, град | 90 | 75.171(2) |
| β, град | 102.487(10) | 85.547(2) |
| γ, град | 90 | 74.271(2) |
| V, Å3 | 6002(7) | 3179.5(2) |
| Z | 4 | 4 |
| ρ(выч.), г см3 | 1.331 | 1.657 |
| μ, мм–1 | 1.698 | 0.788 |
| θmax, град | 26.000 | 26.000 |
| Tmin/Tmax | 0.5874/0.7725 | 0.2893/0.3812 |
| Число измеренных рефлексов | 23 212 | 31 483 |
| Число независимых рефлексов | 11 115 | 12 419 |
| Число рефлексов с I > 2σ(I) | 8899 | 7249 |
| Rint | 0.0234 | 0.0416 |
| Число уточняемых параметров | 7066 | 8303 |
| GOOF | 1.020 | 0.966 |
| R1 (I > 2σ(I)) | 0.0332 | 0.0690 |
| wR2 (I > 2σ(I)) | 0.0892 | 0.2124 |
| Δρmin/Δρmax, е Å–3 | –0.806/0.626 | –0.536/1.521 |
Таблица 2.
Основные длины связей (Å) и углы (град) для комплексов I и II
| I | II | ||
|---|---|---|---|
| Связь | d, Å | Связь | d, Å |
| Co(1)–N(2) | 2.455(4) | Cd(1A)–N(1A) | 2.452(5) |
| Co(1)–N(3) | 2.307(4) | Cd(1A)–N(2A) | 2.690(5) |
| Co(1)–N(4) | 2.329(4) | Cd(1A)–N(3A) | 2.666(5) |
| Co(1)–O(5) | 1.953(3) | Cd(1A)–N(4A) | 2.467(5) |
| Co(1)–O(7) | 1.963(3) | Cd(1A)–N(5A) | 2.700(5) |
| Co(1)–O(9) | 1.954(4) | Cd(1A)–N(6A) | 2.634(6) |
| Co(2)–N(5) | 2.297(3) | Cd(1A)–O(1A) | 2.311(5) |
| Co(2)–N(6) | 2.267(3) | Cd(1A)–O(3A) | 2.297(6) |
| Co(2)–N(7) | 2.427(3) | Cd(1B)–N(7) | 2.441(5) |
| Co(2)–O(11) | 1.971(3) | Cd(1B)–N(8) | 2.672(6) |
| Co(2)–O(13) | 1.964(3) | Cd(1B)–N(10) | 2.690(6) |
| Co(2)–O(15) | 1.968(3) | Cd(1B)–N(11) | 2.463(5) |
| Gd(1)–O(1) | 2.518(3) | Cd(1B)–N(12) | 2.647(6) |
| Gd(1)–O(2) | 2.525(4) | Cd(1B)–N(13) | 2.700(7) |
| Gd(1)–O(4) | 2.297(3) | Cd(1B)–O(1B) | 2.323(6) |
| Gd(1)–O(6) | 2.292(3) | Cd(1B)–O(3B) | 2.311(6) |
| Gd(1)–O(8) | 2.296(3) | Угол | ω, град |
| Gd(1)–O(10) | 2.284(3) | N(1A)Cd(1A)N(2A) | 53.8(2) |
| Gd(1)–O(12) | 2.327(3) | N(1A)Cd(1A)N(3A) | 53.7(2) |
| Gd(1)–O(14) | 2.277(3) | N(3A)Cd(1A)N(2A) | 51.3(2) |
| Угол | ω, град | N(1A)Cd(1A)O(1A) | 90.5(2) |
| N(2)Co(1)N(4) | 57.1(1) | N(2A)Cd(1A)O(1A) | 144.1(2) |
| N(4)Co(1)O(7) | 88.8(2) | N(3A)Cd(1A)O(1A) | 107.4(2) |
| O(5)Co(1)O(7) | 114.4(1) | N(3A)Cd(1A)O(3A) | 125.4(2) |
| O(5)Co(1)N(2) | 86.9(1) | N(2A)Cd(1A)O(3A) | 74.4(2) |
| N(3)Co(1)O(9) | 137.9(2) | N(1A) Cd(1A)O(3A) | 92.6(2) |
| O(7)Co(1)O(9) | 113.5(2) | N(4A)Cd(1A)O(1A) | 85.1(2) |
| O(5)Co(1)O(9) | 111.1(2) | N(5A)Cd(1A)O(1A) | 131.4(2) |
| N(4)Co(1)O(9) | 85.9(2) | N(6A)Cd(1A)O(1A) | 85.0(2) |
| N(2)Co(1)O(9) | 86.6(2) | N(1A)Cd(1A)N(4A) | 169.4(2) |
| N(3)Co(1)N(4) | 57.8(2) | N(1A)Cd(1A)N(5A) | 134.6(2) |
| N(3)Co(1)N(2) | 57.1(2) | O(1A)Cd(1A)O(3A) | 115.3(2) |
| N(3)Co(1)O(5) | 82.3(2) | N(7)Cd(1B)N(8) | 53.7(2) |
| N(3)Co(1)O(7) | 88.3(2) | N(7)Cd(1B)N(10) | 53.6(2) |
| N(6)Co(2)N(7) | 57.8(1) | N(8)Cd(1B)N(10) | 51.5(2) |
| N(7)Co(2)O(11) | 88.6(1) | O(3B)Cd(1B)N(7) | 92.5(2) |
| O(11)Co(2)O(15) | 113.9(1) | O(3B)Cd(1B)N(8) | 125.4(2) |
| N(6)Co(2)O(15) | 87.7(1) | O(3B)Cd(1B)N(10) | 74.2(2) |
| O(13)Co(2)O(15) | 118.0(1) | O(3B)Cd(1B)N(11) | 80.7(2) |
| N(6)Co(2)O(13) | 89.9(1) | O(3B)Cd(1B)N(12) | 129.3(2) |
| N(7)Co(2)O(13) | 87.3(1) | O(3B)Cd(1B)N(13) | 84.3(2) |
| O(13)Co(2)O(11) | 103.6(1) | O(3B)Cd(1B)O(1B) | 115.8(2) |
| N(5)Co(2)O(11) | 91.6(1) | N(11)Cd(1B)N(12) | 54.4(2) |
| N(5)Co(2)O(13) | 141.6(1) | N(11)Cd(1B)N(13) | 53.5(2) |
| N(5)Co(2)N(6) | 59.5(2) | N(12)Cd(1B)N(13) | 51.7(2) |
Координаты атомов и другие параметры соединений I и II депонированы в Кембриджском банке структурных данных (КБСД) (№ 2062230 (I) и 2062229 (II) соответственно); deposit@ ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии предварительно полученного гетерометаллического комплекса [Co2Gd(Рiv)6- (NO3)(MeCN)2] [20] с TACH (Co : TACH = 1 : 1) в MeCN образуются кристаллы соединения [Co2Gd(NO3)(Piv)6(TACH)2] (I), в структуре которого сохраняется исходный гетерометаллический металлофрагмент и ионы кобальта(II) координируют молекулу N-донорного лиганда с формированием полусэндвичевой структуры. При взаимодействии [{Cd(Рfb)$({{{\text{H}}}_{{\text{2}}}}{\text{O}})_{4}^{ + }$}n ⋅ n(Рfb) –] и [Eu2(Рfb)6- (H2O)8] ⋅ 2H2O с TACH (Cd : Eu : TACH = 1 : 1 : 2) в MeCN удалось выделить только гомометаллический комплекс кадмия(II) [Cd(Рfb)2(TACH)2] (II). Отметим, что ранее по аналогичной методике был синтезирован ряд гетерометаллических Cd−Eu комплексов с монодентатными, мостиковыми и хелатирующими N-донорными лигандами и анионами замещенных бензойных кислот [27–32]. Соединение II затем было получено и при отсутствии соли РЗЭ в реакционной смеси (см. Экспериментальную часть). Большое координационное число иона кадмия(II) в структуре II позволило получить сэндвичевый комплекс с двумя молекулами TACH координированными к одному иону металла.
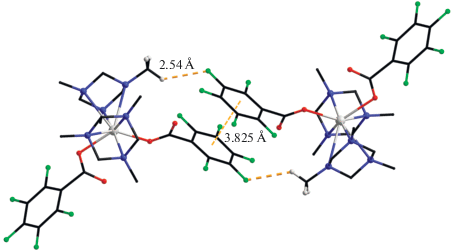
Строение соединений I и II было установлено методом РСА. Комплекс I кристаллизуется в моноклинной пространственной группе P21/c. В трехъядерном {Co2Gd} остове центральный ион гадолиния(III) связан с каждым терминальным ионом кобальта(II) тремя мостиковыми Рiv-анионами (рис. 1а). В одном из координированных пивалат-анионов трет-бутильная группа разупорядочена по двум позициям в соотношении ~1 : 1. Ион Gd достраивает окружение координацией хелатно-связанного нитрат-аниона до додекаэдра с треугольными гранями (GdO8). Каждый ион кобальта(II) координирует κ3-связанную молекулу TACH, достраивая свое окружение до сильно искаженного октаэдра (CoN3O3, табл. 2, рис. 1б). Все связи N–Co имеют заметно большую длину по сравнению со средней длиной координационной связи Co–N, причем одна из них удлиненная по сравнению с первыми двумя (Co(1)–N(2) 2.455(4), Co(1)–N(3) 2.307(4), Co(1)–N(4) 2.329(4), Co(2)–N(5) 2.297(3), Co(2)–N(6) 2.267(4), Co(2)–N(7) 2.427(3) Å). Координированная молекула TACH находится в конформации кресла и геометрия гексагидро-1,3,5-триазинового фрагмента претерпевает незначительные искажения при координации к иону кобальта(II) (табл. 3).
Рис. 1.
Строение молекулы I (а) и координационный полиэдр иона Co(1) (б). R = (CH3)3C, заместители при карбоксильной группе и атомы водорода на рисунке (а) не показаны.
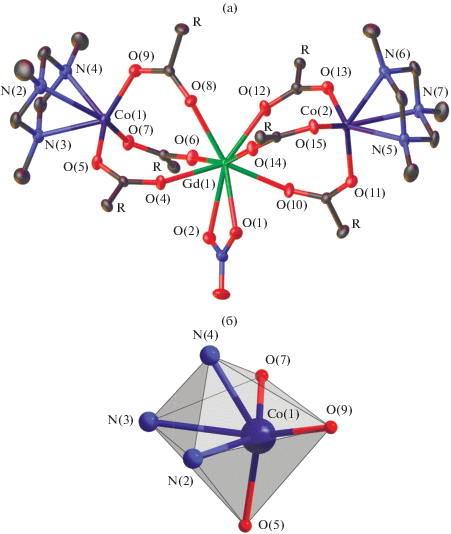
Таблица 3.
Геометрические характеристики некоординированной молекулы TACH [36] и молекулы TACH в составе комплексов I и II
| Связь/угол | TACH [36] | [Co2Gd(NO3)(Piv)6(TACH)2] (I) | [Cd(Рfb)2(TACH)2] (II) |
|---|---|---|---|
| C–N, Å | 1.451(1)–1.473(1) | 1.410(6)–1.446(7) | 1.435(14)–1.469(14) |
| CNC, град | 109.0–112.4 | 109.5–111.4 | 109.0–110.8 |
| NCN, град | 110.4–111.8 | 103.5–106.7 | 104.9–108.2 |
По сравнению с ранее синтезированными {Co2Ln(Piv)6(NO3)(L)2} комплексами с монодентатными и хелатирующими лигандами (L), координация к иону кобальта(II) объемной молекулы TACH приводит к удлинению связей Co–Ln и увеличению значения угла CoLnCo в трехъядерном {Co2Ln} металлоостове (L = TACH, Co(1)–Gd(1) 4.143(2), Co(2)–Gd(1) 4.173(3) Å, угол CoGdCo 144.21(2)°; L = MeCN [20], Co…Ln 3.987(1) Å, угол CoLnCo 136.39(1)°; L = пиридин [33], Co…Ln 4.034(6) Å, угол CoLnCo 137.85°; L = хинолин [34], Co…Ln 4.031(3) Å, угол CoLnCo 137.83°; L = = 2,4,4,5,5-пентаметил-2-имидазолин-1-оксил-3-оксид [35], Co…Ln 3.970(1) Å, угол CoLnCo 142.19°).
Кристаллическая упаковка комплекса I дополнительно стабилизирована C–H…O взаимодействиями между атомами H трет-бутильных групп и атомами О Piv-анионов с формированием супрамолекулярного слоя (табл. 4).
Таблица 4.
Геометрические параметры С–H…F и С–H…O контактов в кристалле соединений I, II
| Водородная связь | Расстояние, Å | Угол DHA, град | ||
|---|---|---|---|---|
| D–H | H…A | D…A | ||
| I | ||||
| C(38)–H(38A)…O(15) | 0.97 | 2.59 | 2.938(6) | 101 |
| C(38)–H(38B)…O(3) | 0.97 | 2.56 | 3.499(7) | 164 |
| II | ||||
| C(15B)–H(15D)…O(2B) | 0.97 | 2.35 | 3.128(11) | 137 |
| C(17A)–H(17A)…O(2A) | 0.97 | 2.35 | 3.123(11) | 136 |
| C(18B)–H(18F)…O(4A) | 0.96 | 2.56 | 3.517(12) | 177 |
| C(20A)–H(20A)…O(4B) | 0.96 | 2.54 | 3.498(14) | 173 |
| C(20A)–H(20C)…F(5A) | 0.96 | 2.53 | 3.471(12) | 168 |
| C(22A)–H(22B)…O(4B) | 0.97 | 2.49 | 3.430(11) | 162 |
| C(22B)–H(22D)…O(4A) | 0.97 | 2.45 | 3.379(12) | 161 |
| C(25B)–H(25F)…F(6B) | 0.96 | 2.54 | 3.285(13) | 135 |
Комплекс II кристаллизуется в триклинной пространственной группе P$\bar {1}$. Независимая часть элементарной ячейки содержит две структурно подобные молекулы [Cd(Рfb)2(TACH)2] (II). Ион кадмия(II)координирует две κ3-связанные молекулы TACH с формированием сэндвичевой структуры (рис. 2), достраивая свое окружение до искаженного додекаэдра с треугольными гранями координацией двух монодентатно связанных Рfb-анионов (рис. 2б, CdN6O2). Практически все связи N–Cd в соединении II имеют заметно большую длину по сравнению со средней длиной координационной связи Cd–N, тогда как длины связей Cd–O имеют типичные значения. Молекула TACH в структуре II находится в конформации кресла и геометрия гексагидро-1,3,5-триазинового фрагмента претерпевает незначительные искажения при координации к иону кадмия(II) (табл. 3).
Рис. 2.
Строение молекулы II (а) и координационный полиэдр иона кадмия(II) (б). Атомы водорода на рисунке (а) не показаны.
Кристаллическая упаковка комплекса II дополнительно стабилизирована взаимодействиями C–H…F, C–H…O между атомами H координированных молекул TACH, атомами фтора пентафторфенильных заместителей и атомами О карбоксильных групп (рис. 3, табл. 4), а также стэкинг-взаимодействиями между двумя пентафторбензоатными анионами соседних молекул комплекса (расстояние между центрами взаимодействующих фрагментов и угол между плоскостями составляет 3.825 Å и 0.00°).
С точки зрения структуры представляется интересным отметить изменение конформации гексагидро-1,3,5-триметил-1,3,5-триазина, находящегося в координационной сфере металла по сравнению с конформацией отдельной молекулы. Так, ранее было показано, что в кристалле [36] и газовой фазе [37] молекула ТАСH находится в моноаксиальной конформации, а в растворе – в виде смеси диаксиальной и моноаксиальной конформаций, полностью экваториальная конформация не обнаружена. Квантовохимические расчеты барьера перехода моноаксиальной конформации в полностью экваториальную показали, что он составляет 20 кДж/моль [36]. Такое конформационное поведение объясняется отталкиванием неподеленных пар электронов (НЭП) на атомах азота и аномерным эффектом [38–42].
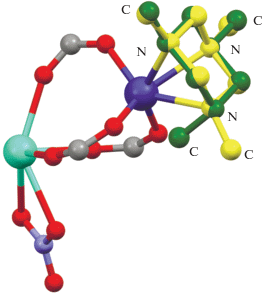
Анализ данных по геометрии ТАСH в кристаллах различных соединений, представленных в КБСД, показал [43], что при введении этого лиганда в координационную сферу металла моноаксиальная конформация сохраняется только в случае координации по одному атому азота, а при связывании двумя и тремя атомами происходит изменение пирамидализации атома азота с переходом конформации цикла в полностью экваториальную. В этом случае НЭП всех трех атомов N оказываются доступны для координации ионом металла, а энергетический выигрыш от образования комплекса превышает энергозатраты на изменение конформации одного или нескольких циклов. Аналогичный переход наблюдается и в случае синтезированных нами комплексов I и II (рис. 4).
Рис. 4.
Наложение свободной молекулы TACH (зеленый фрагмент) и молекулы TACH в составе комплекса II (желтый фрагмент).
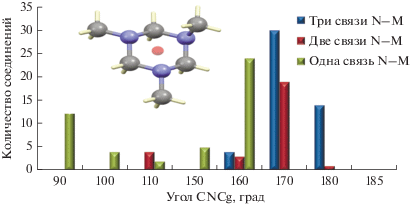
Для подробного анализа конформаций представленных соединений удобно использовать угол СNCg, где С – атом углерода метильной группы, Cg – центроид кольца. На диаграмме видно, что все углы, реализующиеся в трикоординированных молекулах, находятся в пределах 160°–170°, а в монокоординированных треть углов имеет значения 90°–110°, что соответствует моноаксиальной конформации всех циклов. Наиболее интересная ситуация наблюдается в случае дважды координированных молекул: всего в КБСД представлено восемь таких структур, из них в четырех реализуется полностью экваториальная конформация, а в трех – весьма необычная диаксиальная. Сравнение строения этих комплексов показало, что экваториальная структура реализуется в случае, когда молекула ТACH хелатно координирована к одному иону, а диаксиальная – в случае мостиковой координации к двум различным ионам металла (рис. 5).
Рис. 5.
Гистограмма распределения угла CNCg в моно-, би- и тридентатно координированных молекулах TACH.
Кроме того, в КБСД представлена одна структура (YOLCOU), представляющая собой сокристаллизат ТACH с перфторированным трехртутным антикрауном ((o-C6F4Hg)3). В кристалле данного соединения также реализуется полностью экваториальная конформация гетероцикла, однако формально координации ТАСН ионами ртути не происходит, несмотря на четкое положение этих атомов друг над другом, так как расстояния Hg…N в данном соединении составляют 2.85–2.94 Å, что значительно превышает среднюю длину координационной связи Hg–N (2.5 Å). По-видимому, в этом случае наблюдается нековалентное взаимодействие НЭП атомов азота с ионами ртути, для реализации которого необходима их доступность, как и в процессе образования координационных связей [44].
Таким образом, нам удалось выделить полусэндвичевый гетерометаллический комплекс [Co2Gd(NO3)(Piv)6(TACH)2] (I) и сэндвичевый гомометалличесий комплекс [Cd(Рfb)2(TACH)] (II). Большое координационное число иона кадмия(II) в структуре II позволило получить сэндвичевый комплекс с двумя молекулами TACH, координированными к одному иону металла. Координация молекул κ3-TACH к иону кобальта(II) и кадмия(II) приводит к значительному искажению координационного окружения металла и изменению конформации 1,3,5-триметил-1,3,5-триазациклогексана, что наблюдается в случае комплексов I, II.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Kohn R.D., Coxon A.G.N., Chunawat S. et al. // Polyhedron. 2020. V. 185. P. 114572.
Виноградов А. А., Лысенко К. А., Ананьев И. В. и др. // Коорд. химия. 2020. Т. 46. № 5. С. 270 (Vinogradov A.A., Lyssenko K.A., Ananyev I.V. et al. // Russ. J. Coord. Chem. 2020. V. 65. P. 308). https://doi.org/10.1134/S1070328420050097
Levin N., Codesido N.O., Marcolongo Juan Pablo et al. // Inorg. Chem. 2018. V. 57. P. 12270.
Zhang C.-X., Fang D.-W., Wang J.-L. et al. // Inorg. Chim. Acta. 2020. V. 507. P. 119599.
Gordon J.B., Vilbert A.C., Siegler M.A. et al. // J. Am. Chem. Soc. 2019. V. 141. P. 3641.
Yang L., He X., Dinca M. // J. Am. Chem. Soc. 2019. V. 141. P. 10475.
Levin N., Codesido N.O., Marcolongo Juan Pablo et al. // Dalton Trans. 2019. V. 48. P. 6767.
Everett M., Jolleys A., Levason W. et al. // Chem. Commun. 2014. V. 50. P. 5843.
Dyke J., Levason W., Light M.E. et al. // Dalton Trans. 2015. V. 44. P. 13853.
Curnock E., Levason W., Light M.E. et al. // Dalton Trans. 2018. V. 47. P. 6059.
Hajela S., Schaefer W.P., Bercaw J.E. // J. Organomet. Chem. 1997. V. 532. P. 45.
Hulsmann M., Neumann B., Stammler H.-G., Mitzel N.W. // Eur. J. Inorg. Chem. 2012. P. 4200.
Kohn R.D., Pan Z., Kociok-Kohn G., Mahon M.F. // Dalton Trans. 2002. P. 2344.
Nieland A., Lamm J.-H., Mix A. et al. // Z. Anorg. Allg. Chem. 2014. V. 640. P. 2484.
Krieck S., Gorls H., Westerhausen M. // J. Am. Chem. Soc. 2010. V. 132. P. 12492.
Kamps I., Neumann B., Stammler H.-G., Mitzel N.W. // Organometallics. 2010. V. 29. P. 4746.
Kohn R.D., Seifert G., Pan Zhida et al. // Angew. Chem., Int. Ed. 2003. V. 42. P. 793.
Venugopal A., Kamps I., Bojer D. et al. // Dalton Trans. 2009. P. 5755.
Шмелев М.А., Гоголева Н.В., Кузнецова Г.Н. и др. // Коорд. химия. 2020. № 8. С. 497 (Shmelev M.A., Gogoleva N.V., Kuznetsova G.N. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 8. P. 557). https://doi.org/10.1134/S1070328420080060
Kiskin M., Zorina-Tikhonova E., Kolotilov S. et al. // Eur. J. Inorg. Chem. 2018. № 12. P. 1356.
SMART (control) and SAINT (integration). Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. SADABS. Madison (WI, USA): Bruker AXS Inc., 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. //J. A-ppl. Cryst. 2009. V. 42. P. 339.
Alvarez S., Llunell M. // Dalton Trans. 2000. № 19. P. 3288.
Casanova D., Llunell M., Alemany P. et al. // Chem. Eur. J. 2005. V. 11. P. 1479.
Шмелев М.А., Гоголева Н.В., Сидоров А.А. и др. // Коорд. химия. 2020. № 1. С. 3 (Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 1. P. 1). https://doi.org/10.1134/S1070328420010078
Шмелев М.А., Гоголева Н.В., Сидоров А.А. и др. // Коорд. химия. 2020. № 7. С. 437 (Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 7. P. 493). https://doi.org/10.1134/S1070328420070076
Shmelev M.A., Kiskin M.A., Voronina J.K. et al. // Materials. 2020. V. 13. № 24. P. 5689.
Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // Inorg. Chim. Acta. 2021. V. 515. P. 120050.
Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // Chem. Select. 2020. V. 5. P. 8475.
Шмелев М.А., Кузнецова Г.Н., Долгушин Ф.М. и др. // Коорд. химия. 2021. № 2. С. 92 (Shmelev M.A., Kuznetsova G.N., Dolgushin F.M. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 2. P. 127).
Sap’yanik A.A., Lutsenko I.A., Kiskin M.A. et al. // Russ. Chem. Bull. 2016. V. 65. P. 2601.
Cui Y., Chen G., Ren J. et al. // Inorg. Chem. 2000. V. 39. P. 4165.
Fursova E.Yu., Kuznetsova O.V., Ovcharenko V.I. et al. // Russ. Chem. Bull. 2007. P. 1742.
Sicking C., Mix A., Neumann B. et al. // Dalton Trans. 2012. V. 41. P. 104.
Zverev V.G., Kuznetsov V.V., Rykov A.N. et al. // Russ. J. Phys. Chem. A. 2007. V. 81. P. 1639.
Jones R.A.Y., Katritzkya A.R., Snarey M. // J. Chem. Soc. B. 1970. P. 135.
Bushweller C.H., Lourandos M.Z., Brunelle J.A. // J. Am. Chem. Soc. 1974. V. 96. P. 1591.
Hutchins R.O., Kopp L.D., Eliel E.L. // J. Am. Chem. Soc. 1968. V. 90. P. 7174.
Harris N.J., Lammertsma K. // J. Am. Chem. Soc. 1997. V. 119. P. 6583.
Jewett J.G., Breeyear J.J., Brown J.H., Bushweller C.H. // J. Am. Chem. Soc. 2000. V. 122. P. 308.
Groom C.R., Bruno I.J., Lightfoot M.P., Ward S.C. // Acta Crystallogr. B. 2016. V. 72. P. 171.
Tugashov K.I., Gribanyov D.A., Dolgushin F.M. et al. // Organometallics. 2019. V. 38. № 15. P. 2910.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия