Координационная химия, 2021, T. 47, № 9, стр. 529-534
Амидофенолятные комплексы тантала
П. А. Петров 1, *, Е. А. Голубицкая 1, И. В. Ельцов 2, Т. С. Сухих 1, М. Н. Соколов 1
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: panah@niic.nsc.ru
Поступила в редакцию 09.03.2021
После доработки 16.04.2021
Принята к публикации 19.04.2021
Аннотация
При взаимодействии Ta(NMe2)5 с 2,4-ди-трет-бутил-6-((2,6-диизопропилфенил)амино)фенолом (H2APDipp) получены смешанно-лигандные амидофенолятные комплексы [Ta(APDipp)(NMe2)3] (I) и [Ta(APDipp)2(NMe2)] (II), охарактеризованные с помощью рентгеноструктурного анализа (CIF files CCDC № 2060699 (I), 2060700 (II ∙ 0.5C5H12)) и ЯМР-спектроскопии.
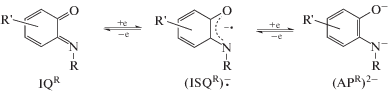
Бидентантные N-замещенные о-иминобензохиноны являются структурными аналогами о‑бензохинонов и дииминов [1]. Все три класса лигандов относятся к редокc-активным, поскольку могут претерпевать серию обратимых окис-лительно-восстановительных переходов (схема 1 ; IQR = иминохинон, (ISQR)–∙ = иминосемихинолят, (APR)2– = амидофенолят). При этом окислительно-восстановительные потенциалы о-иминохинонов смещены в более отрицательный диапазон по сравнению с потенциалами о-хинонов. С другой стороны, стерическое влияние иминобензохинонов менее выражено по сравнению с дииминами. Таким образом, использование производных иминохинонов в качестве лигандов дает возможность стерической и электронной настройки координационного узла, например для получения комплексов с нужными магнитными свойствами [2–11]. Кроме того, для комплексов с производными иминобензохинонов возможно протекание реакций окислительного присоединения и восстановительного элиминирования, которые не изменяют степень окисления центрального атома, а затрагивают π-систему лиганда. Эти реакции могут протекать как стехиометрически [12–16], так и в каталитическом варианте [17].
Схема 1 .
На сегодняшний день существуют два основных метода синтеза катехолатных и семихинолятных комплексов. Первый из них – взаимодействие хинона с металлом или его низковалентным комплексом (чаще всего карбонилом). В этом случае хинон окисляет достаточно активный металл или его соединение, восстанавливаясь, в зависимости от условий реакции, до катехолата или семихинолята. Второй метод состоит в замещении лиганда при взаимодействии галогенидов металла и катехолата или семихинолята (чаще всего Na, K или Tl). В случае ниобия и тантала слабой стороной этого подхода является то, что их галогениды чрезвычайно реакционноспособны и могут, в частности, расщеплять связи С–О эфирных растворителей [18, 19]. Именно отсутствие удобных металлсодержащих предшественников представляется причиной чрезвычайно малого числа известных катехолатов ниобия и тантала. Единственный на сегодняшний день катехолатный комплекс тантала – [Ta(Cat)2(HCat)(Py)] – был получен при взаимодействии Ta(OEt)5 и пирокатехина при соотношении 1 : 3 в пиридине [20]. Комплекс ниобия был получен аналогично. С другой стороны, известно, что амиды (в частности, диалкиламиды) ранних переходных металлов являются удобными предшественниками других соединений.
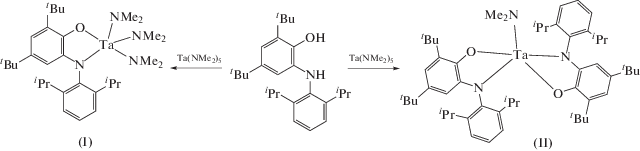
Настоящая работа посвящена исследованию взаимодействия диметиламида тантала(V) Ta(NMe2)5 с 2,4-ди-трет-бутил-6-((2,6-диизопропилфенил) амино)фенолом (H2APDipp), содержащим при атоме азота объемный диизопропилфенильный заместитель.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтезы проводили в инертной атмосфере с использованием стандартной аппаратуры Шленка. Растворители подвергались обезвоживанию и дегазации кипячением и перегонкой в атмосфере аргона с использованием соответствующих осушителей. Спектры ЯМР регистрировали на спектрометре Bruker Avance III 500 с рабочей частотой 500.03 МГц для ядер 1H, 125.73 МГц для ядер 13С и 50.67 МГц для ядер 15N; в качестве стандартов использовали сигналы растворителя (δ(1H) = 7.16 м.д., δ(13C) = 128.06 м.д.) [21]. Спектры на ядре 15N получали проекцией двумерной 1H,15N-HMBC-корреляции, калибровку сигналов проводили относительно внешнего стандарта формамида (δ(15N) = 112.5 м.д.). Определение строения и отнесение сигналов в спектрах ЯМР на ядрах 1H, 13С и 15N проводили на основании гетероядерных 1H,13C-HMBC, 1H,15N-HMBC и 1H,13C-HSQC двумерных корреляций. Элементный анализ выполняли в Аналитической лаборатории ИНХ СО РАН.
Синтез [Ta(APDipp)(NMe2)3] (I). 150 мг (0.37 ммоль) Ta(NMe2)5 и 145 мг (0.38 ммоль) H2APDipp помещали в сосуд Шленка, вакуумировали и сконденсировали в него при пониженном давлении и охлаждении жидким азотом 30 мл толуола. После отогревания до комнатной температуры полученный оранжевый раствор нагревали на масляной бане (T = 55°C) при перемешивании в течение 2 сут. Растворитель упаривали в вакууме, остаток экстрагировали 30 мл пентана, экстракт декантировали в двухколенную ампулу. Медленное упаривание привело к образованию оранжевых кристаллов. Выход 77 мг (30%).
ЯМР 1H (500 МГц; C6D6; δ, м.д.): 1.15 (д., J = = 7.0 Гц, 6H, CH(CH3)2), 1.29 (д., J = 7.0 Гц, 6H, CH(CH3)2), 1.32 (с., 9H, t-Bu-4), 1.74 (s., 9H, t-Bu-6), 2.21, 2.69 (ш.с., 12H, N(CH3)2), 3.25 (ш. м., 14H, N(CH3)2 и CH(CH3)2), 6.12 (д., J = 2.1 Гц, 1H, CH-3), 7.10 (д., J = 2.1 Гц, 1H, CH-5), 7.17 (т., J = 7.7 Гц, 1H, CH-4 (Dipp)), 7.28 (д., J = 7.7 Гц, 2H, CH-3 (Dipp)).
ЯМР 13C{1H} (126 МГц; C6D6; δ, м.д.): 24.1 (CH(CH3)2), 26.5 (CH(CH3)2), 28.8 (CH(CH3)2), 30.5 (C(CH3)3(t-Bu-6)), 32.3 (C(CH3)3(t-Bu-4)), 34.7 (C(CH3)3(t-Bu-4)), 35.1 (C(CH3)3(t-Bu-6)), 39.0 (N(CH3)2), 44.6 (N(CH3)2), 46.7 (N(CH3)2), 110.3 (C-3), 113.4 (C-5), 123.6 (С-3,5 (Dipp)), 126.0 (С-4 (Dipp)), 134.4 (C-6), 139.6 (C-4), 144.7 (С-2,6 (Dipp)), 150.1 (C–O), 150.9 (C–N).
ЯМР 15N (51 МГц; C6D6; δ, м.д.): 211.5 (NDipp).
ИК-спектр (KBr; ν, см–1): 2961 c, 2867 cр, 1653 cр, 1636 cр, 1558 cр, 1541 cр, 1472 cр, 1457 c, 1437 cр, 1419 cр, 1361 сл, 1326 cр, 1240 cр, 1102 cр, 1026 cр, 990 cр, 796 cр, 743 cл, 538 сл.
Синтез [Ta(APDipp)2(NMe2)] ∙ 0.5C5H12 (II ∙ ∙ 0.5C5H12). 100 мг (0.249 ммоль) Ta(NMe2)5 и 192 мг (0.503 ммоль) H2APDipp помещали в сосуд Шленка, вакуумировали и сконденсировали в него при пониженном давлении и охлаждении жидким азотом 30 мл толуола. После отогревания до комнатной температуры полученную оранжево-красную смесь нагревали на масляной бане (T = 55°C) при перемешивании в течение 2 сут. Растворитель упаривали в вакууме, остаток экстрагировали 30 мл пентана, затем декантировали в двухколенную ампулу. Медленное упаривание привело к образованию темно-красного масла, в котором после аккуратного нагревания на воздушной бане в течение 3 сут образовались сростки красно-коричневых кристаллов. Выход 150 мг (61%).
ЯМР 1H (500 МГц, C6D6 δ, м.д.): 1.10 (д., J = 6.9 Гц, 6H, CH(CH3)2-2), 1.13 (c., 9H, t-Bu-4), 1.20 (c., 9H, t-Bu-6), 1.22 (д., J = 6.7 Гц, 6H, CH(CH3)2-2), 1.30 (д., J = 6.9 Гц, 6H, CH(CH3)2-6), 1.40 (д., J = 7.0 Гц, 6H, CH(CH3)2-6), 3.39 (с., 6H, N(CH3)2), 3.49 (септ., J = 6.8 Гц, 2H, CH(CH3)2-2), 3.51 (септ., J = = 6.9 Гц, 2H, CH(CH3)2-6), 6.14 (д., J = 2.1 Гц, 2H, CH-3), 6.92 (д., J = 2.1 Гц, 1H, CH-5), 7.20 (д.д., 2H, 3J = 7.6 Гц, 4J = 2.0 Гц, CH-3 (Dipp)), 7.22 (т., 2H, J = 7.6 Гц, CH-4 (Dipp)), 7.32 (д.д., 2H, 3J = = 7.1 Гц, 4J = 2.0 Гц, CH-5 (Dipp)).
ЯМР 13C{1H} (126 МГц, C6D6 δ, м.д.): 24.7 (CH(CH3)2-6), 25.3 ((CH(CH3)2)-2), 25.5 ((CH(CH3)2)-2), 25.5 ((CH(CH3)2)-6), 28.5 ((CH(CH3)2)-6), 28.6 ((CH(CH3)2)-2), 30.1 (C(CH3)3(t-Bu-6)), 31.8 (C(CH3)3(t-Bu-4)), 34.6 (C(CH3)3(t-Bu-6)), 34.8 (C(CH3)3(t-Bu-4)), 44.3 (N(CH3)2)), 110.3 (C-3), 114.6 (C-5), 123.7 (С-5 (Dipp)), 125.3 (С-3 (Dipp)), 125.7 (С-4 (Dipp)), 135.6 (C-6), 143.5 (C-1 (Dipp)), 144.3 (С-4), 145.3 (C-6 (Dipp)), 145.7 (C-2 (Dipp)), 146.9 (C–O), 151.6 (C–N).
ЯМР 15N (51 МГц, C6D6 δ, м.д.): 189.7 (NMe2), 206.8 (NDipp).
ИК-спектр (KBr, ν, см–1): 3057 сл, 2963 с, 2867 с, 2790 сл, 1576 ср, 1465 с, 1442 с, 1410 с, 1360 ср, 1321 ср, 1286 ср, 1251 ср, 1229 ср, 1201 с, 1109 сл, 1056 сл, 977 ср, 926 ср, 907 ср, 857 ср, 824 с, 801 ср, 748 сл, 647 ср, 586 ср, 554 ср.
РСА. Все измерения проведены по стандартной методике на автоматическом четырехкружном дифрактометре Bruker-Nonius X8 APEX (двухкоординатный CCD детектор, λ = 0.71073 Å, графитовый монохроматор). Интенсивности отражений измерены методом φ-сканирования узких (0.5°) фреймов. Поглощение учтено эмпирически (SADABS) [22]. Структуры расшифрованы с использованием программ SHELXS [23] и SHELXT [24] и уточнены с использованием программы SHELXL [25] в анизотропном приближении для неводородных атомов с использованием программной оболочки Olex2 [26]. Атомы водорода локализованы геометрически и уточнены в приближении жесткого тела. Кристаллографические характеристики комплекса и детали дифракционного эксперимента приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структур I и II · 0.5C5H12
| Параметр | Значение | |
|---|---|---|
| I | II · 0.5C5H12 | |
| Брутто-формула | C32H55N4OTa | C56.5H86N3O2Ta |
| М | 692.75 | 1020.23 |
| Сингония, пр. гр. | Триклинная, P1 | Моноклинная, P21/n |
| a, Å | 10.1202(5) | 11.3038(6) |
| b, Å | 12.1128(7) | 23.2747(13) |
| c, Å | 14.6967(8) | 20.7177(11) |
| α, град | 93.090(2) | 90 |
| β, град | 98.061(2) | 91.566(2) |
| γ, град | 110.526(2) | 90 |
| V, Å3 | 1660.18(16) | 5448.6(5) |
| Z | 2 | 4 |
| μ, мм–1 | 3.339 | 2.058 |
| Размер кристалла, мм | 0.27 × 0.22 × 0.18 | 0.23 × 0.21 × 0.05 |
| F(000) | 712.0 | 2140.0 |
| Область сбора данных 2θ, град | 3.612–54.262 | 2.632–48.812 |
| Диапазон индексов h, k, l | –12 ≤ h ≤ 11,
–15 ≤ k ≤ 15, –18 ≤ l ≤ 18 |
–13 ≤ h ≤ 13,
–27 ≤ k ≤ 27, –24 ≤ l ≤ 19 |
| Число измеренных, независимых и наблюдаемых (I > 2σ(I)) отражений | 19 766, 7305, 7027 | 57 326, 8960, 7060 |
| Rint | 0.0215 | 0.0727 |
| Число уточняемых параметров | 359 | 591 |
| GOOF | 1.064 | 1.172 |
| R1, wR2 (I > 2σ(I)) | 0.0153, 0.0366 | 0.0624, 0.1270 |
| R1, wR2 (все отражения) | 0.0165, 0.0370 | 0.0828, 0.1336 |
| Число ограничений | 0 | 0 |
| Δρmin/Δρmax, e Å–3 | –0.48/0.41 | –3.63/1.93 |
Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDC № 2060699 (I) и 2060700 (II ∙ 0.5C5H12); http://www.ccdc.cam.ac.uk/conts/retrieving.html).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
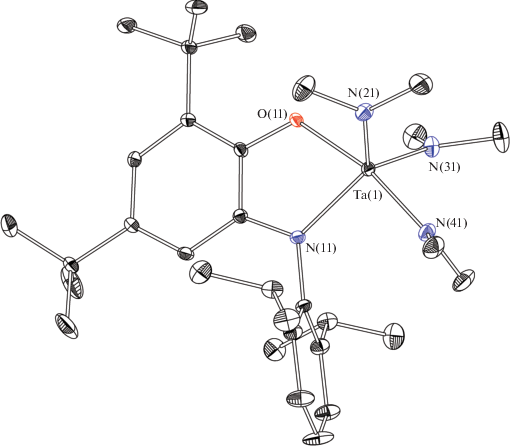
Реакция Ta(NMe2)5 и аминофенола H2APDipp (1 : 1) в толуоле с перекристаллизацией продукта из пентана привела к выделению амидофенолятного комплекса [Ta(APDipp)(NMe2)3] (I, схема 2 ). Он имеет искаженное тригонально-бипирамидальное строение (рис. 1), при этом атомы азота N(11), N(21) и N(31) образуют экваториальную плоскость тригональной бипирамиды (ТБП), соответствующие углы NTaN равны 121.51(6)°, 117.27(7)° и 120.13(6)°. Атомы O(21) и N(41) находятся в аксиальных положениях, а длина связи Ta(1)–N(41) (1.9959(16) Å) несколько превышает соответствующие значения для диметиламидных лигандов в экваториальной плоскости комплекса. Количественный анализ структуры с помощью программы Shape [27, 28] однозначно указывает на ТБП в качестве координационного полиэдра (SQ(ТБП) = 0.613).
Схема 2 .
Рис. 1.
Молекулярная структура комплекса I. Некоторые длины связей и углы: Ta(1)–O(11) 2.0129(12), Ta(1)–N(11) 2.0632(15), Ta(1)–N(21) 1.9634(15), Ta(1)–N(31) 1.9653(16), Ta(1)–N(41) 1.9958(16) Å и O(11)Ta(1)N(11) 75.00(5)°.
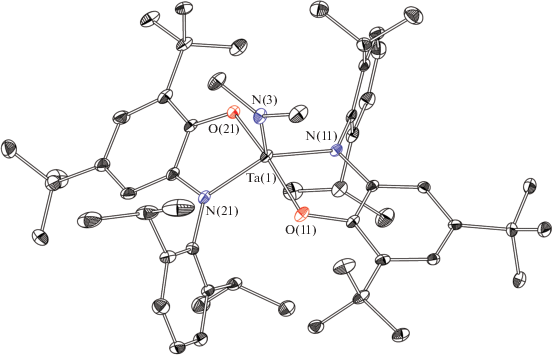
При взаимодействии Ta(NMe2)5 и аминофенола H2APDipp в соотношении 1 : 2 в толуоле с последующей перекристаллизацией из пентана был выделен бис(амидофенолятный) комплекс [Ta(APDipp)2- (NMe2)] ∙ 0.5C5H12 (II ∙ 0.5C5H12). Комплекс II, скорее, имеет искаженное квадратно-пирамидальное (КП) строение (КЧ Ta 5), хотя анализ структуры при помощи программы Shape дает сравнимые значения для обоих (ТБП и КП) координационных полиэдров (SQ(ТБП) = 1.745, SQ(КП) = 2.115). Амидофенолятные лиганды находятся в базальной плоскости КП в трансоидном положении друг относительно друга (рис. 2). Длины связей C–O и C–N, равные 1.368(10) и 1.417(11) Å характерны для амидофенолятов. Длина связи Ta(1)–N(3) (1.923(7) Å) и сумма трех валентных углов при атоме N(3) (360.0°) подтверждают координацию лиганда в амидной форме. В качестве альтернативы, координационный полиэдр комплекса II можно рассматривать как искаженную тригональную бипирамиду с тремя атомами N в экваториальной плоскости и аксиальными атомами O. Углы NTaN лежат в пределах 113.4(3)°–129.8(3)°, угол O(1)Ta(1)O(2) равен 161.1(2)°, что указывает на сильное отклонение от идеальной геометрии ТБП.
Рис. 2.
Молекулярная структура комплекса II. Некоторые длины связей и углы: Ta(1)–O(11) 1.941(5), Ta(1)–O(21) 1.927(5), Ta(1)–N(11) 2.029(7), Ta(1)–N(21) 2.038(7), Ta(1)–N(3) 1.923(7) Å и O(11)Ta(1)N(11) 78.5(3)°, O(21)Ta(1)N(21) 76.8(3)°.
При взаимодействии Ta(NMe2)5 с H2APDipp в мольном соотношении 1 : 3 также образуется комплекс II. Его образование вместо анионного трис(амидофенолята) [Ta(APDipp)3]– или нейтрального [Ta(APDipp)2(HAPDipp)] можно объяснить наличием объемного диизопропилфенильного заместителя при атоме азота. Известные гомолептические комплексы [MIII(ISQR)3] (M = Cr, Fe, Co) содержат при атоме N иминосемихинолята относительно небольшие фенильные и 3,5-дифторфенильные заместители [1]. Также известен комплекс ванадия [VV(APPh)2(HAPPh)], содержащий монопротонированный N-фенил-3,5-ди-трет-бутиламидофенолят [1]. Можно сделать вывод, что стерические трудности, обусловленные наличием трех объемных диизопропилфенильных групп, слишком велики даже для такого относительно крупного центрального иона как Ta5+.
Комплексы I и II также были охарактеризованы методом ЯМР на ядрах 1H, 13C и 15N. Результаты анализа свидетельствуют о достаточно жесткой конформационной структуре соединений в растворе. При этом структура соединения II является более жесткой: в соединении I наблюдается лишь неэквивалентность метильных групп изопропильного фрагмента, в то время как в спектрах соединения II все группы атомов проявляются в виде отдельных хорошо разрешенных сигналов. Химические сдвиги ариламидного атома азота практически совпадают для I и II (δN = 211.5 и 206.8 м.д. соответственно). Сигнал диметиламидного лиганда для II (δN = 189.8 м.д.) несколько смещен в слабое поле по сравнению с Ta(NMe2)5 (164.6 м.д.). В спектре 15N ЯМР комплекса I сигналы диметиламидных лигандов зафиксировать не удалось, что может быть связано с недостаточно быстрым (в шкале времени ЯМР) конформационным обменом между неэквивалентными позициями в стереохимически нежесткой структуре с КЧ 5. Подтверждением этого является значительное уширение сигналов групп ${\text{NMe}}_{2}^{ - }$ в спектре ЯМР 1H комплекса I (ω1/2 ~ 7–25 Гц) по сравнению с комплексом II (ω1/2 ~ 2 Гц). Следует отметить сдвиг в сильное поле сигнала углерода при связи C–N (С-2) по сравнению с углеродом при связи C–O (С-1). Также в значительно более слабом поле располагается сигнал атома H-3. Причина этого, по всей видимости, кроется во взаимно-перпендикулярном расположении колец: атом углерода C-2 располагается практически в плоскости кольца диизопропилфенильного фрагмента и испытывает дезэкранирующее действие ароматического кольца, тогда как атом водорода H-5, наоборот, находится над плоскостью кольца и попадает в область экранирования (ср. [29]).
Таким образом, в данной работе показано, что продуктами реакции Ta(NMe2)5 с аминофенолом H2APDipp являются, в зависимости от соотношения реагентов, [Ta(APDipp)(NMe2)3] и [Ta(APDipp)2- (NMe2)], представляющие собой первые амидофенолятные комплексы тантала. Трис-амидофенолятный комплекс получить не удается, по-видимому, по стерическим причинам. Примечательно, что в обоих комплексax реализуется КЧ 5, что предполагает известную координационную ненасыщенность и льюисовскую кислотность амидофенолятных комплексов. Комплекс II обладает сильно искаженной структурой с промежуточной между КП и ТБП геометрией координационного полиэдра тантала.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Poddel’sky A.I., Cherkasov V.K., Abakumov G.A. // Coord. Chem. Rev. 2009. V. 253. P. 291.
Ершова И.В., Пискунов А.В., Черкасов В.К. // Успехи химии. 2020. Т. 89. № 11. С. 1157 (Ershova I.V., Piskunov A.V., Cherkasov V.K. // Russ. Chem. Rev. 2020. V.89. P. 1157).https://doi.org/10.1070/RCR4957
Ершова И.В., Пискунов А.В. // Коорд. химия. 2020. Т. 46. № 3. С. 132 (Ershova I.V., Piskunov A.V. // Russ. J. Coord. Chem. 2020. V. 46. P. 154). https://doi.org/10.1134/S1070328420030021
Piskunov A.V., Pashanova K.I., Bogomyakov A.S. et al. // Polyhedron. 2020. V. 186. 114610.
Piskunov A.V., Meshcheryakova I.N., Piskunova M.S. et al. // J. Mol. Struct. 2019. V. 1195. P. 417.
Ershova I.V., Bogomyakov A.S., Fukin G.K., Piskunov A.V. // Eur. J. Inorg. Chem. 2019. P. 938.
Чегерев М.Г., Пискунов А.В. // Коорд. химия. 2018. Т. 44. № 2. С. 109 (Chegerev M.G., Piskunov A.V. // Russ. J. Coord. Chem. 2018. V. 44. P. 258).https://doi.org/10.1134/S1070328418040036
Piskunov A.V., Maleeva A.V., Fukin G.K. et al. // Inorg. Chim. Acta. 2017. V. 455. P. 13.
Piskunov A.V., Ershova I.V., Bogomyakov A.S. et al. // Inorg. Chem. 2015. V. 54. P. 6090.
Piskunov A.V., Maleeva A.V., Bogomyakov A.S. et al. // Polyhedron. 2015. V. 102. P. 715.
Piskunov A.V., Meshcheryakova I.N., Maleeva A.V. et al. // Eur. J. Inorg. Chem. 2014. P. 3252–3258.
Piskunov A.V., Meshcheryakova I.N., Fukin G.K. et al. // Dalton Trans. 2013. V. 42. P. 10533.
Пискунов А.В., Пискунова М.С., Чегерев М.Г. // Изв. АН. Сер. хим. 2014. Т. 63. № 4. С. 912 (Piskunov A.V., Piskunova M.S., Chegerev M.G. // Russ. Chem. Bull. 2014. V. 63. P. 912).
Piskunov A.V., Ershova I.V., Fukin G.K., Shavyrin A.S. // Inorg. Chem. Commun. 2013. V. 38. P. 1270.
Piskunov A.V., Chegerev M.G., Fukin G.K. // J. Organomet. Chem. 2016. V. 803. P. 51.
Matson E.M., Opperwall S.R., Fanwick P.E., Bart S.C. // Inorg. Chem. 2013. V. 52. P. 7295.
Blackmore K.J., Lal N., Ziller J.W., Heyduk A.F. // J. Am. Chem. Soc. 2008. V. 130. P. 2728.
Bini R., Chiappe C., Marchetti F. et al. // Inorg. Chem. 2010. V. 49. P. 339.
Marchetti, F., Pampaloni, G., Zacchini S. // Inorg. Chem. 2008. V. 47. P. 365.
Boyle T.J., Tribby L.J., Alam T.M. et al. // Polyhedron. 2005. V. 24. P. 1143.
Fulmer G.R., Miller A.J.M., Sherden N.H. et al. // Organometallics. 2010. V. 29. P. 2176.
APEX2 (version 1.08), SAINT (version 7.03), SADABS (version 2.11), SHELXTL (version 6.12). Madison (WI, USA): Bruker AXS Inc., 2004.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. App-l. Cryst. 2009. V. 42. P. 339.
SHAPE (version 2.1). Barcelona (Spain): Universitat de Barcelona, 2013.
Alvarez S., Alemany P., Casanova D. et al. // Coord. Chem. Rev. 2005. V. 249. P. 1693.
Shuvalov V.Y., Eltsov I.V., Tumanov N.A. et al. // Eur. J. Org. Chem. 2017. V. 36. P. 5410.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия