Координационная химия, 2022, T. 48, № 1, стр. 45-56
Синтез и строение дисульфаниламидглиоксима и комплексных соединений Ni(II) и Cu(II) с этим лигандом. Стимулирующие протеолитические свойства [Cu(DsamH2)3]SO4 · 5H2O
П. Н. Боурош 1, 2, *, Э. Б. Коропчану 3, А. П. Рижа 2, Д. Уреке 2, А. А. Чилочи 4, С. Ф. Клапко 4, Е. Г. Дворнина 4, С. В. Лаблюк 4, И. И. Булхак 2
1 Институт прикладной физики
Кишинев, Республикa Молдовa
2 Институт химии
Кишинев, Республикa Молдовa
3 Тираспольский государственный университет
Кишинев, Республикa Молдовa
4 Институт микробиологии и биотехнологии
Кишинев, Республикa Молдовa
* E-mail: pavlina.bourosh@ifa.md
Поступила в редакцию 12.05.2021
После доработки 23.06.2021
Принята к публикации 28.06.2021
- EDN: CCKHGE
- DOI: 10.31857/S0132344X22010017
Аннотация
При взаимодействии дихлорглиоксима c сульфаниламидом получен новый глиоксим – дисульфаниламидглиоксим (DsamH2, L), а на его основе синтезированы два координационных соединения [Ni(DsamH)2] · 2H2O (I) и [Cu(DsamH2)3]SO4 · 5H2O (II), состав и структура которых определены методами элементного анализа, ИК-, УФ-, ЯМР-спектроскопии, а для L и II проведен РСА (CIF files CCDC № 2080777 и 2080778 соответственно). Доказано, что в зависимости от условий синтеза были получены как бис-, так и трис-лигандные комплекcы с этим лигандом. Различная степень депротонирования лиганда DsamH2 в комплексах I и II привели к получению как молекулярного, так и ионного комплексного соединения. Комплексное соединение II в оптимально подобранных концентрациях оказывает стимулирующие действие на синтез протеаз штаммов микромицетов биотехнологического значения Fusarium gibbosum CNMN FD 12 и Trichoderma koningii Oudemans CNMN FD 15.
Координационные соединения d-металлов с хелатообразующими лигандами, привлекают внимание их устойчивостью, которая обеспечена стабильностью образованного каркаса вокруг центрального иона металла, как в твердом состоянии, так и в растворах [1–3]. При этом в образовании комплексных соединений можно выделить как вклад атома металла, так и полидентатных лигандов, а также смешанных лигандов [2, 4]. Ряд исследований последних лет подтверждает, что большое разнообразие соединений с диоксимами получено введением в основном дополнительных лигандов, что привело к образованию моно- [2, 5], ди- [6–8] и полиядерных гомометаллических комплексов [9, 10]. Интерес к соединениям с диоксимами поддерживается также возможностями их использования в качестве моделей физиологически важных веществ [11, 12], в микробиологии [13, 14], медицине [15] и сельском хозяйстве [16], а в последнее время исследованы и люминесцентные свойства соединений этого класса [9, 10]. Диверсификация диоксимов, особенно их объемное увеличение с добавлением донорных группировок, влияет как на состав и структуру координационных соединений, так и на свойства, в том числе биологические [17–19].
Перспективное направление в воспроизводстве естественного биосинтеза связано с синтезом химических соединений, которые могут быть использованы как модели биологических объектов, исследуя их воздействие на метаболические процессы микроорганизмов. Установлено, что внедрение различных диоксиматов Co(III) в питательные среды некоторых микроорганизмов стимулирует биосинтез ферментов у штаммов-продуцентов и повышает накопление биомассы [14, 20]. Таким образом, актуальной задачей является изучение биологической активности новых координационных соединений с металлами с целью выявления возможного их практического использования, при этом результаты могут также служить теоретической основой для целенаправленного синтеза соединений с заданными свойствами.
При конденсации дихлорглиоксима с сульфаниламидом получен новый диоксим – дисульфаниламидглиоксим (DsamH2, L). При взаимодействии DsamH2 с хлоридом никеля и сульфатом меди(II) синтезированы координационные соединения [Ni(DsamH)2] · 2H2O (I) и [Cu(DsamH2)3]SO4 · 5H2O (II), состав и структура которых определены методами элементного анализа, ИК-, УФ-, ЯМР-спектроскопии, а для L и II кристаллическая структура определена методом РСА. Соединение II тестировано как стимулирующее синтез протеаз штаммов микромицетов биотехнологического значения Fusarium gibbosum CNMN FD 12 и Trichoderma koningii Oudemans CNMN FD 15.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты NiCl2 ∙ 2H2O, CuSO4 ∙ 5H2O, NaOH, Na2CO3, сульфаниламид, 25%-ый аммиачный раствор и растворители (“x. ч.”), полученные из коммерческих источников и дихлорглиоксим, полученный синтетическим путем, использовались без дополнительной очистки.
Cинтез DsamH2 (L) выполняли по методике [21, 22], но при более долгом перемешивании в течении 5–6 ч. Выход 0.28 г (63%). Вещество растворимо в ДМФ, ДМСО, менее растворимо в спиртах.
Для получения соединений I и II использовали методику [22].
Cинтез [Ni(DsamH)2] · 2H2O (I). К теплому раствору 0.214 г (0.5 ммоль) дисульфаниламидглиоксима в 30 мл метанола добавляли 0.06 г (0.25 ммоль) NiCl2 · 6H2O в 15 мл метанола. Смесь перемешивали в течении 15 мин при 60°C. При перемешивании добавляли 5–6 капель аммиака, после чего в растворе появлялся осадок коричневого цвета. Осадок отфильтровывали, промывали холодным метанолом, эфиром, после чего высушивали на воздухе. Выход 0.2 г (43%). Вещество растворимо в ДМФ, ДМСО, но слабо растворимо в метаноле. Получить качественные монокристаллы, пригодные для PCA не удалось, вероятно, из-за слабой растворимости комплекса в легко улетучиваемых растворителях.
| Найдено, %: | C 35.47; | H 3.54; | N 17.62; | Ni 5.92. |
| Для C28H34N12O14S4Ni | ||||
| вычислено, %: | C 35.41; | H 3.61; | N 17.70; | Ni 6.18. |
Cинтез [Cu(DsamH2)3]SO4 · 5H2O (II). Дисульфаниламидглиоксим массой 0.214 г (0.5 ммоль) растворяли в 40 мл метанола, раствор нагревали на водяной бане до 60°C (раствор 1). Сульфат меди(II) пятиводный массой 0.063 г (0.25 ммоль) растворяли в минимальном количестве воды, после чего добавляли 20 мл метанола (раствор 2). Раствор 2 капельно, при постоянном перемешивании, добавляли к раствору 1, полученный раствор отфильтровывали и оставляли для медленного испарения при комнатной температуре. В течение 5 сут в растворе образовывались кристаллы в виде продолговатых пластинок. Выход 0.4 г (52%). Вещество слабо растворимо в ДМФ, ДМСО.
| Найдено, %: | C 32.72; | H 3.71; | N 16.34; | Cu 3.99. |
| Для C42H58N18O27S7Cu | ||||
| вычислено, %: | C 32.86; | H 3.81; | N 16.42; | Cu 4.14. |
Состав и строение соединений L, I, II устанавливали на основе элементного анализа, ИК-, УФ- и ЯМР-спектроскопии, а для монокристаллов L и II – методом РСА. ИК-спектры снимали на FT-IR Perkin-Elmer Spectrum 100 в вазелиновом масле в области 4000–400 см–1, ATР – 4000–650 cм–1, УФ-спектры – на спектрофотометре Perkin-Elmer Lambda 25. Спектры ЯМР 1H, 13C регистрировали на спектрометрe 400 Brucker с рабочей частотой для 1H 400.13 МГц и для 13C 100.61 МГц в растворах ДМСО-d6, используя внутренний стандарт TMC. Сигналы выражены в м.д.
РСА. Экспериментальные данные для L и II получены при комнатной температуре 293(2) К на дифрактометре Xсalibur Е (МоKα-излучение, графитовый монохроматор). Параметры элементарной ячейки уточнены по всему массиву, и остальные экспериментальные данные получены с использованием комплекса программ CrysAlis Oxford Diffraction [23]. Структура соединений решена прямыми методами и уточнена методом наименьших квадратов в анизотропном полноматричном варианте для неводородных атомов (SHELX-97) [24]. Позиции атомов водорода сольватных молекул воды определены из разностного Фурье-синтеза, остальных атомов Н – рассчитаны геометрически. Все атомы Н уточнены изотропно в модели “жесткого тела” c Uэфф = 1.2Uэкв или 1.5Uэкв соответствующих атомов – C, N и O. Характеристики эксперимента и уточнения структуры соединений L и II приведены в табл. 1, некоторые межатомные расстояния и валентные углы – в табл. 2 , геометрические параметры межмолекулярных водородных связей (МВС) – в табл. 3.
Таблица 1.
Кристаллографические данные и характеристики эксперимента для L и II
| Параметры | L | II |
|---|---|---|
| Эмпирическая формула | C14H16N6O6S2 | C42H58N18O27S7Cu |
| M | 428.45 | 1535.02 |
| Сингония | Тригональная | Моноклинная |
| Пр. гр. | P3121 | P21/c |
| a, Å | 8.2460(3) | 15.3303(9) |
| b, Å | 8.2460(3) | 14.9756(7) |
| c, Å | 23.6703(17) | 28.782(2) |
| α, град | 90 | 90 |
| β, град | 90 | 97.818(6) |
| γ, град | 120 | 90 |
| V, Å3 | 1393.85(12) | 6546.4(7) |
| Z | 3 | 4 |
| ρ(выч.), г/см3 | 1.531 | 1.557 |
| μ, мм–1 | 1.027 | 0.651 |
| F(000) | 666 | 3172 |
| Размеры кристала, мм | 0.18 × 0.18 × 0.12 | 0.50 × 0.30 × 0.02 |
| Область θ, град | 2.98–25.50 | 2.86–25.05 |
| Интервалы индексов отражений | –9 ≤ h ≤ 5, –3 ≤ k ≤ 9, –17 ≤ l ≤ 28 |
–18 ≤ h ≤ 17, –10 ≤ k ≤ 17, –34 ≤ l ≤ 26 |
| Число измерeнных/независимых рефлексов (Rint) | 2472/1680 (0.0263) | 24 527/11 594 (0.0932) |
| Число рефлексов с I > 2σ(I) | 1524 | 3262 |
| Заполнение, % | 99.8 (θ = 25.50°) | 99.9 (θ = 25.05°) |
| Число уточняемых параметров | 128 | 876 |
| GOOF | 1.000 | 1.007 |
| R факторы (I > 2σ(I)) | R1 = 0.0471 wR2 = 0.1002 |
R1 = 0.0632 wR2 = 0.1429 |
| R факторы (по всему масиву) | R1 = 0.0542 wR2 = 0.1073 |
R1 = 0.2095 wR2 = 0.1830 |
| Δρmax/Δρmin, e Å–3 | 0.243/–0.302 | 0.870/–0.430 |
Таблица 2.
Межатомные расстояния (d) и валентные углы (ω) в соединении II и лиганде L
| В координационном полиэдре Cu(II) соединения II | ||||
|---|---|---|---|---|
| Связь | d, Å | Связь | d, Å | |
| Cu(1)–N(1) | 2.019(6) | Cu(1)–N(4) | 1.989(6) | |
| Cu(1)–N(2) | 1.978(6) | Cu(1)–N(5) | 2.005(6) | |
| Cu(1)–N(3) | 2.508(5) | Cu(1)–N(6) | 2.282(6) | |
| Угол | ω, град | Угол | ω, град | |
| N(1)CuN(2) | 79.6(3) | N(2)CuN(6) | 100.6(2) | |
| N(1)CuN(3) | 100.0(2) | N(3)CuN(4) | 71.4(3) | |
| N(1)CuN(4) | 168.8(2) | N(3)CuN(5) | 82.4(3) | |
| N(1)CuN(5) | 94.9(3) | N(3)CuN(6) | 154.2(2) | |
| N(1)CuN(6) | 91.0(2) | N(4)CuN(5) | 91.0(2) | |
| N(2)CuN(3) | 104.3(2) | N(4)CuN(6) | 99.9(2) | |
| N(2)CuN(4) | 95.4(3) | N(5)CuN(6) | 73.3(2) | |
| N(2)CuN(5) | 171.9(3) | |||
| Во фрагментах органической молекулы L и координированного лиганда в II | ||||
| Связь | L | II | ||
| d, Å | ||||
| N(1)–C(1) | 1.283(5) | 1.299(9) | 1.298(9) | 1.302(9) |
| N(1)–O(1) | 1.421(4) | 1.379(7) | 1.394(6) | 1.388(7) |
| N(2)–C(2) | 1.311(9) | 1.311(9) | 1.296(9) | |
| N(2)–O(2) | 1.395(7) | 1.399(6) | 1.418(8) | |
| C(1)–C(1)*/C(2) | 1.488(8) | 1.480(10) | 1.489(9) | 1.495(10) |
| Угол | ω, град | |||
| O(1)N(1)C(1) | 108.7(3) | 112.9(6) | 111.3(6) | 113.0(6) |
| O(2)N(2)C(2) | 110.9(6) | 111.2(5) | 110.1(7) | |
| N(1)C(1)C(1)*/(2) | 115.3(3) | 113.7(7) | 113.3(7) | 111.2(7) |
| N(2)C(2)C(1) | 109.6(6) | 114.5(6) | 112.0(7) | |
Таблица 3.
Геометрические параметры межмолекулярых водородных связей в структуре L и II
| Контакт D–H···A | Расстояние, Å | Угол DHA, град |
Преобразования симметрии для А | ||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| L | |||||
| O(1)–H(1)∙∙∙O(2) | 0.82 | 2.03 | 2.838(5) | 167 | –x + y + 1, –x, z – 1/3 |
| N(2)–H(1)∙∙∙O(3) | 0.86 | 2.35 | 3.122(5) | 149 | x, y, z |
| N(3)–H(2)∙∙∙N(1) | 0.96 | 2.11 | 3.028(5) | 158 | –x + 2, –x + y + 2, –z + 1/3 |
| N(3)–H(1)∙∙∙N(3) | 0.92 | 2.11 | 3.004(5) | 163 | x – y + 1, –y + 1, –z + 2/3 |
| II | |||||
| O(1)–H(1)∙∙∙O(2S) | 0.82 | 1.75 | 2.563(7) | 171 | x, y, z |
| O(2)–H(2)∙∙∙O(4S) | 0.82 | 1.79 | 2.605(7) | 177 | –x + 2, y + 1/2, –z + 3/2 |
| O(3)–H(3)∙∙∙O(3S) | 0.82 | 1.94 | 2.762(7) | 174 | x, y, z |
| O(4)–H(4)∙∙∙O(3S) | 0.82 | 1.83 | 2.651(7) | 178 | –x + 2, y + 1/2, –z + 3/2 |
| O(5)–H(5)∙∙∙O(1w) | 0.79 | 2.31 | 2.936(7) | 137 | x, y, z |
| O(6)–H(6)∙∙∙O(3) | 0.82 | 2.46 | 3.142(7) | 141 | –x + 2, y + 1/2, –z + 3/2 |
| N(11)–H(1)∙∙∙O(11) | 0.86 | 2.33 | 3.049(12) | 141 | –x + 2, –y + 1, –z + 1 |
| N(21)–H(2)∙∙∙O(62) | 0.86 | 2.47 | 3.224(12) | 150 | x + 1, y, z |
| N(22)–H(1)∙∙∙O(32) | 0.86 | 2.17 | 2.853(11) | 136 | –x + 3, y – 1/2, –z + 3/2 |
| N(22)–H(2)∙∙∙O(1w) | 0.86 | 2.21 | 3.025(9) | 158 | –x + 2, y – 1/2, –z + 3/2 |
| N(31)–H(1)∙∙∙O(2w) | 0.86 | 2.36 | 3.161(10) | 156 | –x + 2, y – 1/2, –z + 3/2 |
| N(32)–H(1)∙∙∙O(12) | 0.90 | 2.53 | 3.276(13) | 141 | x, –y + 3/2, z + 1/2 |
| N(41)–H(1)∙∙∙O(3w) | 0.86 | 2.27 | 3.054(10) | 151 | –x + 2, y + 1/2, –z + 3/2 |
| N(42)–H(2)∙∙∙O(1S) | 0.90 | 1.95 | 2.739(11) | 145 | –x + 2, –y + 1, –z + 2 |
| N(51)–H(1)∙∙∙O(3w) | 0.86 | 2.07 | 2.905(8) | 162 | x, y, z |
| N(52)–H(2)∙∙∙O(7w) | 0.86 | 1.98 | 2.82(2) | 166 | x, y, z |
| N(61)–H(2)∙∙∙O(2w) | 0.86 | 2.11 | 2.935(9) | 161 | x, y, z |
| O(1w)–H(1)∙∙∙O(52) | 0.85 | 2.04 | 2.815(9) | 151 | –x + 1, y – 1/2, –z + 3/2 |
| O(1w)–H(2)∙∙∙O(1S) | 0.93 | 2.01 | 2.934(9) | 171 | x, y, z |
| O(2w)–H(1)∙∙∙O(21) | 0.83 | 2.01 | 2.845(10) | 179 | –x + 2, –y + 1, –z + 1 |
| O(2w)–H(2)∙∙∙O(42) | 0.87 | 2.03 | 2.899(11) | 179 | x, –y + 3/2, z – 1/2 |
| O(3w)–H(1)∙∙∙O(4w) | 0.87 | 2.06 | 2.929(14) | 180 | –x + 2, –y + 1, –z + 1 |
| O(3w)–H(2)∙∙∙O(2S) | 0.90 | 2.08 | 2.979(9) | 179 | x, y, z |
| O(4w)–H(1)∙∙∙O(6w) | 0.85 | 1.85 | 2.70(2) | 179 | –x + 3, –y + 1, –z + 1 |
| O(4w)–H(2)∙∙∙N(32) | 0.88 | 2.48 | 3.16(2) | 134 | x, –y + 3/2, z – 1 |
| O(5w)–H(1)∙∙∙O(4S) | 0.92 | 1.86 | 2.77(2) | 170 | x, y + 1, z |
| O(5w)–H(2)∙∙∙O(51) | 0.85 | 1.86 | 2.71(2) | 179 | x, y, z |
| O(6w)–H(1)∙∙∙O(6w) | 0.85 | 2.31 | 3.16(4) | 173 | –x + 3, –y + 1, –z + 1 |
| O(6w)–H(2)∙∙∙N(12) | 0.90 | 2.46 | 3.26(3) | 148 | x, y, z |
| O(6w)–H(2)∙∙∙O(12) | 0.90 | 2.43 | 3.26(2) | 152 | x, y, z |
| O(7w)–H(1)∙∙∙O(61) | 0.85 | 2.59 | 3.34(2) | 177 | x, y, z |
| O(7w)–H(2)∙∙∙O(1S) | 0.85 | 2.48 | 3.33(2) | 179 | –x + 1, y + 1/2, –z + 3/2 |
Позиционные и тепловые параметры атомов соединений L и II депонированы в Кембрижском банке структурных данных (КБСД) (№ 2080777, 2080778 соответственно); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Биологические методы. Oбъектами исследований служили штаммы мицелиальных грибов Fusarium gibbosum CNMN FD 12 и Trichoderma koningii Oudemans CNMN FD 15 – активные продуценты комплекса протеолитических ферментов (кислых, нейтральных и щелочных протеаз) [25, 26]. Эти штаммы хранятся в Национальной коллекции непатогенных микроорганизмов Республики Молдова при Институте микробиологии и биотехнологии.
Культивирование продуцентов осуществлялось глубинным способом.
Активность кислых (pH 3.6) и нейтральных (pH 7.4) протеаз в культуральной жидкости определяли по методу Вильштеттера, который основан на определении количества свободных карбоксильных групп, образующихся при гидролизе 5%-ного раствора желатина. При этом за единицу протеолитической активности принимали количество фермента, которое образует 1 мг аминного азота за 1 ч в стандартных условиях опыта [27]. Статистическую обработку результатов проводили с использованием компьютерных программ по методу Доспехова [28].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
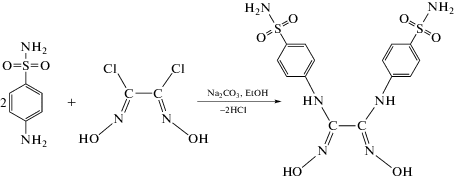
При конденсации дихлорглиоксима с сульфаниламидом в молярном соотношении 1 : 2 был получен дисульфаниламидглиоксим (схема 1 ) [22].
Схема 1 .
В ИК-спектре DsamH2 наблюдаются полосы при 3424, 3357, 3283 ν(NH), 3076 cм–1 ν(OH), которые смещены в сторону более низких значений частот благодаря молекулярным ассоциациям на основе оксимных NОН- и NH-групп, а также при 1642 ν(C=N), 1592 ν(CC)aром, 1302, 1150 ν(SO), 935 ν(NO) и 767, 725 cм–1 δ(CH) [29–32].
В спектре ЯМР 1H DsamH2 два дублета при 7.54 м.д. (2H, J = 8.78 Гц) и 6.89 м.д. (2H, J = 8.78 Гц) принадлежат ароматическому кольцу, сигнал при 7.16 м.д. соответствует NH2-группе, а сигнал при 8.77 м.д. принадлежит NH-группе сульфаниламидного фрагмента. Результаты спектра ЯМР 1H подтверждают, что конденсация сульфаниламида с дихлордиоксимом происходит через NH2-группу, непосредственно связанную с ароматическим кольцом, поскольку она претерпевает самое сильное смещение в слабое поле, а при интегрировании сигналов становится заметным потеря протона у этой группы. Сигнал, соответствующий протонам оксимной группы, присутствует при 10.89 м.д. В спектре ЯМР 13C DsamH2 сигналы 118.71 и 126.77 м.д. соответствуют третичным атомам углерода, при 136.17 и 143.01 м.д. – углерода ароматического кольца, а сигнал при 142.50 м.д. принадлежит оксимному атому углерода.
При взаимодействии солей меди или никеля с дисульфаниламидглиоксимом получены два различных комплексных соединения – бис-диоксимат никеля и трис-диоксимин меди, так как учитывалось, что образование трис-диоксиминов характерно при pH ~2, а бис-диоксиматов при pH ~5–6. При этом получение слабокислой среды осуществлялось добавлением 1–2 капель аммиачного раствора, а кислотной – добавлением соляной кислоты, подобно получению комплексов с дианилинглиоксимом [33].
В случае диоксимата Ni(II) с DsamH2 в УФ-спектре присутствуют полосы при 202 и 280 нм, которые указывают на наличие лиганда в комплексе. При этом при добавлении капли раствора аммиака наблюдается уменьшение интенсивности полосы в области 280 нм, связанное, по-видимому, с образованием внутримолекулярных водородных связей, характерных для бис-диоксиматов, что способствует сдвигу электронного облака с ароматического кольца к металлоциклу.
В ИК-спектре бис-диоксимата Ni(II) (I) значение ν(ОН) 3076 см–1 – следствие сильной внутримолекулярной водородной связи типа О–Н∙∙∙О. Так как оксимные группы =NOH в бис-диоксиматах переходных металлов образуют сильные водородные связи типа О–Н∙∙∙О, полоса при 3650–3100 см–1, соответствующая колебанию ν(ОН) некоординированных оксимных молекул [30, 32], смещается в спектрах в области 2350 и 2340 см–1, например для Ni(Dmg)2 и Pd(Dmg)2 соответственно (Dmg – анион диметилглиоксима). При этом установлена зависимость частоты ν(ОН) от расстояния О–Н∙∙∙О [30, 32]. В ИК-спектре трис-диоксимина Cu(II) (II) присутствуют полосы (cм–1): 3469–3208 ν(NH), 3071–3075 ν(OH), 1643–1646 ν(C=N), 1588–1595 ν(CC)aром, 900–913 ν(NO) и 741–747 δ(CH). Однако в спектре бис-диоксимата Ni(II) (I) проявляются как большинство из вышеприведенных полос, так и полосы, характерные для ионизированной оксимной группы при 1255 и 1093 cм–1.
В спектре ЯМР для I присутствует сигнал протона оксимной группы, который подтверждает образование внутримолекулярных водородных связей. Существенные сдвиги претерпевают сигналы протонов групп NH и атомов углерода ароматических колец, связанных с этими группами, что объясняется смещением электронной плотности от диоксимных фрагментов к металлоциклу. То же cамое наблюдается и в спектрах ЯМР 13C комплексов I и II.
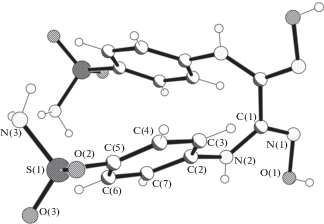
Сoeдинение L кристаллизуется в тригональной пространственной группе P3121 (табл. 1). Независимая часть элементарной ячейки L содержит 1/2 органической молекулы DsamH2 с симметрией С2. Молекулярная структура L показана на рис. 1. Диоксимный фрагмент DsamH2 стабилизирован в анти (E,E) конформацию, при этом торсионные углы NCCN, образованные с вовлечением атомов азота N(1) и N(2), равны, соответственно, 57.5° и –49.1°. Анализ результатов КБСД [34] указывает на подобное строение некоординированных диоксимов, при этом кристаллизованных как в виде нейтральных молекул, так и как протонированных органических катионов. Межатомные расстояния O–N и N–C в оксимных фрагментах в L несущественно отличаются от подобных в нейтральных и в органических катионах модифицированных диоксимов с аминогруппой [35–38]. Например, в L межатомное расстояние O–N равно 1.420(3) Å (табл. 2), а в нейтральных молекулах N,N'-бис(2-(морфолино)этиламино)глиоксима [35] – 1.434 и (2Z,3Z)хиноксалин-2,3(1Н,4Н)диондиоксима [36] – 1.422 Å.
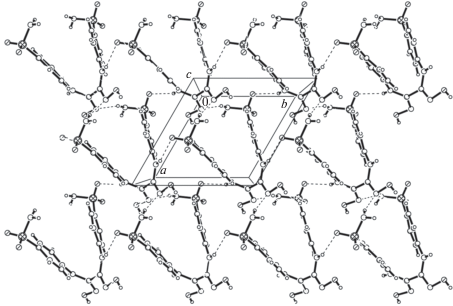
В кристалле L молекулы DsamH2 объединены системой МВС O–H···N и N–H···O (табл. 3), в которых в качестве доноров протонов вовлечены ОН-группы оксимных фрагментов и NH-группы как внутренних, так и концевых фрагментов молекулы, а как акцепторы выступают атомы азота оксимных фрагментов и атомы кислорода сульфо-групп. При этом в кристалле можно выделить формирование различных слоев (рис. 2).
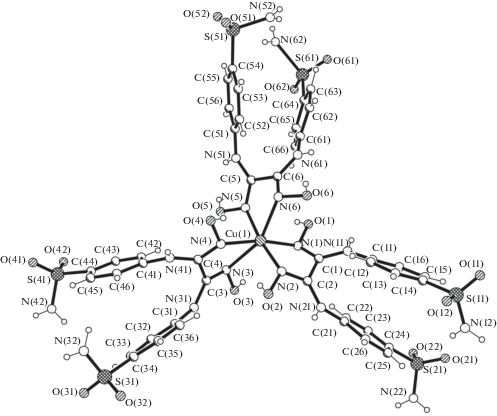
Соединение II кристаллизуется в моноклинной пространственной группе Р21/c. В независимой части элементарной ячейки соединения II ионного типа находится один комплексный катион [Cu(DsamH2)3]2+ в общем положении (рис. 3), один aнион ${\text{SO}}_{4}^{{2 - }}$ и семь молекул кристаллизационной воды, четыре из которых с коэффициентом заполнения 1/2. Координационный полиэдр Cu(II) в комплексном катионе имеет форму искаженной тетрагональной бипирамиды, образованной набором донорных атомов N6; все атомы азота, принадлежащие оксимным группам трех нейтральных лигандов DsamH2. Каждый органический лиганд DsamH2 координируется к центральному атому металла хелатно-бидентатным способом, образуя пятичленные металлоциклы. Длины связей Cu–N в координационном полиэдре находятся в интервале 1.978(6)–2.508(5) Å (табл. 2). Подобное строение найдено в трис-комплексах Ni(II) [21, 33, 39–42] и Co(II) [43–46], в которых производные этого лиганда координированы бидентатно-хелатным способом в основном как нейтральный лиганд. Комплексные катионы [Cu(DsamH2)3]2+ дополнительно стабилизированы слабыми внутримолекулярными π…π-взаимодействиями между ароматическими фрагментами лигандов, при этом расстояния центроид…центроид в них равны 3.580, 3.680 и 3.868 Å.
Анализ КБСД [34] выявил моноядерные моно- и бис-комплексы меди с оксамидоксимом [47–51], один биядерный комплекс и один координационный полимер Cu(II), содержащие по одному из этих лигандов, координированному бидентатно-хелатно к каждому атому металла, в которых мостиковыми лигандами служат анионы ${\text{SO}}_{4}^{{2 - }}$ [49]. При этом в комплексе Ni(II) c оксамидоксимом [52] для дополнительного сульфанилато-лиганда обнаружены два различных монодентатных способа координирования – как через один атом О, так и через один атом N. Так как в КБСД [34] обнаружены комплексы переходных металлов с лигандами, содержащими бензолсульфамидный фрагмент, координированные через атом О или N [53, 54], можно предположить, что при определенных условиях лиганд DsamH2 может быть вовлечен в комплекс как мостиковый.
В кристалле II комплексные катионы [Cu(DsamH2)3]2+, aнионы ${\text{SO}}_{4}^{{2 - }}$ и кристаллизационные молекулы воды объединены сложной системой МВС (табл. 3), в которых в качестве доноров протонов вовлечены ОН-группы оксимных фрагментов и NH-групп как внутренних, так и концевых фрагментов комплексных катионов и молекулы воды, а как акцепторы выступают атомы азота и кислорода концевых SO2NH2-групп лигандов, а также атомы О анионов ${\text{SO}}_{4}^{{2 - }}$ и кристаллизационных молекул воды. Комплексные катионы между собой связаны как МВС O–H···O и N–H···O, так и слабыми межмолекулярными π…π-взаимодействиями между ароматическими кольцами соседних молекул (расстояние центроид…центроид 4.044–4.284 Å). При этом комплексные катионы объединены между собой МВС с вовлечением внешнесферных компонентов: O–H···O с анионом ${\text{SO}}_{4}^{{2 - }},$ O–H···O(w), N–H···O(w), O(w)–H···O и O(w)–H···N с вовлечением молекул воды, а также МВС O(w)–H···O между молекулами воды и анионами (рис. 4). В кристалле II комплексные катионы [Cu(DsamH2)3]2+ и aнионы ${\text{SO}}_{4}^{{2 - }}$ упаковываются сравнительно плотно, так что пустоты, доступные для кристаллизационных молекул, составляют 670.7 Å3 из объема элементарной ячейки (или 10.2%), при этом без сравнительно объемного аниона ${\text{SO}}_{4}^{{2 - }}$ пустоты составляют 989.8 Å3 из объема элементарной ячейки (или 15.1%). Таким образом, в II комплексные катионы [Cu(DsamH2)3]2+, объединенные МВС, образуют собственную супрамолекулярную структуру, а внешние анионы ${\text{SO}}_{4}^{{2 - }}$ и кристаллизационные молекулы воды, располагаясь в полостях посредством МВС, стабилизируют ее и существенно влияют на стабильность кристаллической структуры в целом.
Влияние координационного соединения II на биосинтез протеаз штаммом микроскопического гриба Fusarium gibbosum CNMN FD 12 изучалось в динамике на 4-е, 5-е и 6-е сут культивирования – период, соответствующий максимуму биосинтеза изучаемых ферментов при классическом культивировании продуцента.
При добавлении комплекса меди II в питательную среду, максимальное значение энзиматической активности регистрируется при концентрации 5.0 мг/л, на 5-е сут культивирования продуцента, и совпадает со временем проявления максимума в контрольном варианте. Активность кислых протеаз в этот момент составляет 4.284 ед./мл по сравнению с 2.77 ед./мл в контроле, превышая уровень контроля на 54.5%. С увеличением концентрации до 10.0 и 15.0 мг/л активность кислых протеаз уменьшается в среднем на 5% по сравнению с контролем (табл. 4).
Таблица 4.
Влияние комплекса Cu(II) (II) на протеолитическую активность микромицета Fusarium gibbosum CNMN FD 12
| Концентрация координационных соединений (мг/л) | Aктивность кислых протеаз (pH 3.6) | |||||
|---|---|---|---|---|---|---|
| 4-е сут | 5-е сут | 6-е сут | ||||
| eд./мл | % к контролю |
eд./мл | % к контролю |
eд./мл | % к контролю |
|
| 5.0 | 0.25 ± 0.01 | 50.0 | 4.28 ± 0.07 | 154.5 | 2.02 ± 0.04 | 171.4 |
| 10.0 | 0.59 ± 0.04 | 116.7 | 2.69 ± 0.07 | 97.0 | 0.76 ± 0.07 | 64.3 |
| 15.0 | 0.42 ± 0.01 | 84.0 | 2.52 ± 0.07 | 90.9 | 0.17 ± 0.01 | 14.3 |
| Контроль | 0.50 ± 0.04 | 100.0 | 2.77 ± 0.04 | 100.0 | 1.18 ± 0.07 | 100.0 |
| Aктивность нейтральных протеаз (pH 7.4) | ||||||
| 5.0 | 2.02 ± 0.04 | 160.0 | 6.30 ± 0.04 | 187.5 | 3.53 ± 0.04 | 140.0 |
| 10.0 | 1.60 ± 0.04 | 126.7 | 5.96 ± 0.07 | 177.5 | 4.20 ± 0.08 | 166.7 |
| 15.0 | 1.34 ± 0.07 | 104.3 | 4.79 ± 0.04 | 142.5 | 2.52 ± 0.07 | 100.0 |
| Контроль | 1.26 ± 0.01 | 100.0 | 3.36 ± 0.07 | 100.0 | 2.52 ± 0.04 | 100.0 |
Aктивность нейтральных протеаз в экспериментальном варианте значительно превышает уровень контроля при всех испытуемых концентрациях, составляя 6.30, 5.96 и 4.79 ед./мл соответственно, по сравнению с 3/36 ед./мл в контрольном варианте, что на 42.5–87.5% выше контроля.
Максимум биосинтеза кислых протеаз мицелиального гриба Trichoderma koningii Oudemans CNMN FD (1.76–1.93 ед./мл) зарегистрирован на 8-е сут культивирования, превышая значение максимума контроля (1.59 ед./мл, 9-е сут) на 10.7–21.4%. Благоприятными концентрациями для биосинтеза являются 5.0 и 10.0 мг/л, a самые высокие значения достигнуты при концентрации 10 мг/л (1.93 ед./мл) (табл. 5).
Таблица 5.
Влияние комплекса Cu(II) (II) на протеолитическую активность микромицета Trichoderma koningii Oudemans CNMN FD 15
| Концентация координационных соединений (мг/л) | Активность кислых протеаз (рН 3.6) | |||||
|---|---|---|---|---|---|---|
| 8-е сут | 9-е сут | 10-е сут | ||||
| eд./мл | % к контролю |
eд./мл | % к контролю |
eд./мл | % к контролю |
|
| 5.0 | 1.76 ± 0.03 | 222.8/110.7* | 0.92 ± 0.01 | 57.9 | 0.59 ± 0.04 | 140.5 |
| 10.0 | 1.93 ± 0.01 | 244.3/121.4* | 0.08 ± 0.03 | 5.0 | 0.42 ± 0.02 | 100.0 |
| 15.0 | 0.84 ± 0.04 | 106.3 | ||||
| Контроль | 0.79 ± 0.01 | 100.0 | 1.59 ± 0.07 | 100.0 | 0.42 ± 0.02 | 100.0 |
| Активность нейтральных протеаз (рН 7.4) | ||||||
| 5.0 | 4.04 ± 0.04 | 177.9/136.0* | 4.53 ± 0.08 | 152.5 | 3.15 ± 0.04 | 138.8 |
| 10.0 | 3.03 ± 0.07 | 133.5 | 2.64 ± 0.07 | 88.9 | 3.27 ± 0.01 | 144.1/110.1* |
| 15.0 | 2.01 ± 0.04 | 88.5 | 2.52 ± 0.01 | 84.8 | 2.64 ± 0.02 | 116.3 |
| Контроль | 2.27 ± 0.01 | 100.0 | 2.97 ± 0.02 | 100.0 | 2.27 ± 0.01 | 100.0 |
Максимум активности нейтральных протеаз 4.53 ед/мл при концентрации комплекса 5.0 мг/л, проявляется на 9-e cут культивирования продуцента и совпадает с проявлением максимума биосинтеза в контрольном варианте, превышая уровень контроля на 52.5%. При данной концентрации активность нейтральных протеаз выше контроля в течение всего периода культивирования (8–10-е сут), превышая на 36.0% максимальный уровень контроля уже на 8-е сут. При концентрации комплекса в 10 мг/л активность нейтральных протеаз превышает уровень контроля (на 10.1%) только на 10-е сут культивирования.
Таким образом, выявлено, что новый диоксим – дисульфаниламидглиоксим – ведет себя подобно дианилинглиоксиму: трис-диоксимины и бис-диоксиматы получаются в зависимости от рН растворов. Введение дополнительных фрагментов, содержащих различные функциональные группировки, в диоксимный лиганд увеличивает его дентатность, а также влияет на способы вовлечения его в систему водородных связей. Комплексное соединение Cu(II) с лигандом DsamH2 в оптимально подобранных концентрациях обеспечивает стимулирующее действие на синтез протеаз штаммов микромицетов биотехнологического значения Fusarium gibbosum CNMN FD 12 и Trichoderma koningii Oudemans CNMN FD 15, увеличивая активность кислых и нейтральных протеаз на 21.4–54.5% и, соответственно, 52.5–87.5% по сравнению с контролем. В результате это соединение представляет интерес в биотехнологических разработках как потенциальный биостимулятор ферментообразования у штаммов мицелиальных грибов-продуцентов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Janiak Ch. // Dalton Trans. 2003. P. 2781.
Боурош П.Н., Коропчану Э.Б., Симонов Ю.А. и др. // Коорд. xимия. 2002. Т. 28. № 9. С. 689 (Bourosh P.N., Coropceanu E.B., Siminov Yu.A. et al. // Russ. J. Coord. Chem. 2002. V. 28. № 9. P. 647). https://doi.org/10.1023/A:1020095101054
Melnic E., Coropceanu E.B., Forni A. et al. // Cryst. Growth Des. 2016. V. 16. № 11. P. 6275.
Croitor L., Coropceanu E.B., Chisca D. et al. // Cryst. Growth Des. 2014. V. 14. № 6. P. 3015.
Coropceanu E.B., Croitor L., Fonari M.S. // Polyhedron. 2012. V. 38. № 1. P. 68.
Coropceanu E., Croitor L., Gdaniec M. et al. // Inorg. Chim. Acta. 2009. V. 362. № 7. P. 2151.
Coropceanu E.B., Croitor L., Botoshansky M.M. et al. // Polyhedron. 2011. V. 30. № 15. P. 2592.
Coropceanu E., Rija A., Lozan V. et al. // Cryst. Growth Des. 2016. V. 16. № 2. P. 814.
Croitor L., Coropceanu E.B., Siminel A.V. et al. // Cr-ystEngComm. 2012. V. 14. № 10. P. 3750.
Coropceanu E.B., Croitor L., Siminel A.V. et al. // Polyhedron. 2016. V. 109. P. 107.
Bresciani Pahor N., Farcolin M., Marzilli L.G. et al. // Coord. Chem. Rev. 1985. V. 63. P. 1.
Randaccio L., Bresciani Pahor N., Zangrando E., Marzilli L.G. // Chem. Soc. Rev. 1989. V. 18. P. 225.
Десятник А.А., Гэрбэлэу Н.В., Коропчану Э.Б. и др. // Коорд. химия. 2002. Т. 28. № 2. С. 144 (Desyatnik A.A., Gerbeleu N.V., Koropchanu E.B. et al. // Russ. J. Coord. Chem. 2002. V. 28. № 2. P. 135). https://doi.org/10.1023/A:1014240303176
Боурош П.Н., Коропчану Э.Б., Десятник А.А. и др. // Коорд. химия. 2009. Т. 35. № 10. С. 761 (Bourosh P.N., Koropchanu E.B., Ciloci A.A. et al. // Russ. J. Coord. Chem. 2009. V. 35. № 10. P. 751). https://doi.org/10.1134/S1070328409100078
Mokhir A., Krämer R., Voloshin Y.Z, Varzatskii O.A. // Bioorg. Med. Chem. Let. 2004. V. 14. № 11. P. 2927.
Коропчану Э.Б., Булхак И., Штефырцэ A.A. и др. // Коорд. химия. 2017. Т. 43. № 3. С. 156 (Coropceanu E.B., Bulhac I.I., Shtefyrtse A.A. et al. // Russ. J. Coord. Chem. 2017. V. 43. № 3. P. 164). https://doi.org/10.1134/S1070328417030046
Ocak U., Kantekin H., Gok Y., Misir M.N. // New J. Chem. 2003. V. 27. P. 1251.
Gumus G., Ahsen V., Lebrun C. et al. // New J. Chem. 2004. V. 28. P. 177.
Уреке Д., Рижа А., Булхак И. и др. // Журн. неорган. химии. 2020. Т. 65. № 12. С. 1633 (Ureche D., Rija A., Bulhac A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 12. P. 1838). https://doi.org/10.1134/S0036023620120189
Боурош П.Н., Коропчану Э.Б., Чилочи А.А. и др. // Коорд. химия. 2013. Т. 39. № 11. С. 669 (Bourosh P.N., Coropceanu E.B., Ciloci A.A. et al. // Russ. J. Coord. Chem. 2013. V. 39. № 11. P. 777). https://doi.org/10.1134/S107032841311002X
Yuksel F., Gurek G., Durmus M. et al. // Inorg. Chim. Acta. 2008. V. 361. № 8. P. 2225.
Rija A., Bulhac I., Coropceanu E. et al. // Chem. J. Mold. 2011. V. 6. № 2. P. 73. http://www.cjm.asm.md/ sites/default/files/article_files/Rija%20016%20.pdf
CrysAlis RED, O.D.L. Version 1.171.34.76. Data Collection and Processing Software for Agilent X-ray Diffractometers, 2003.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Deseatnic-Ciloci A., Tiurina J., Lupascu G. et al. // Brevet MD 4186. BOPI 2012. № 11.
Deseatnic-Ciloci A., Tiurina J., Lupascu G. et al. // Brevet MD 4285. BOPI 2014. № 5.
Грачева И.М., Грачев Ю.П., Мосичев М.С. и др. Лабораторный практикум по технологии ферментных препаратов. М.: Легкая и пищ. пром-ть, 1982. 240 с.
Доспехов Б. Планирование полевого опыта и статическая обработка данных. М.: Колос, 1985. С. 192.
Беллами Л. Инфракрасные спектры сложных молекул. М.: Изд-во ИЛ, 1963. 590 с.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 541 с.
Тарасевич Б.Н. ИК спектры основных классов органических соединений. Справочные материалы. М., 2012. 54 с.
Накамото К. Инфракрасные спектры неорганических и координационных соединений. М.: Mир, 1966. 411 с.
Коропчану Э.Б., Уреке Д., Рижа А.П. и др. // Коорд. химия. 2021. Т. 47. № 1. С. 21 (Coropceanu E.B., Ureche D., Rija A.P. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 1. P. 17). https://doi.org/10.1134/S1070328421010024
Allen F.H. // Acta Crystallogr. B. 2002. V. 58. № 3–1. P. 380.
Durmus M., Ahsen V., Luneau D., Pecaut J. // Inorg. Chim. Acta. 2004. V. 357. P. 588.
Kakanejadifard A., Amani V. // Acta Crystallogr. E. 2008. V. 64. P. o1512.
Endres H., Schendzielorz M. // Acta Crystallogr. C. 1984. V. 40. P. 453.
Уреке Д., Булхак И., Рижа А. и др. // Коорд. химия. 2019. Т. 45. № 12. С. 720 (Ureche D., Bulhac I., Rija A. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 12. P. 843). https://doi.org/10.1134/S107032841912008X
Belombe M.M., Nenwa J., Kammoe A.L., Poudeu P.F.P. // Acta Crystallogr. E. 2006. V. 62. P. m2583.
Belombe M.M., Nenwa J., Mbiangue Y.A. et al. // Acta Crystallogr. E. 2008. V. 64. P. m1440.
Endres H., Jannack T. // Acta Crystallogr. B. 1980. V. 36. P. 2136.
Nenwa J., Djonwouo P.L., Belombe M.M. et al. // ScienceJet. 2013. V. 2. P. 43.
Belombe M.M., Nenwa J., Mbiangue Y.A. et al. // Dalton Trans. 2009. P. 4519.
Belombe M.M., Nenwa J., Bebga G. et al. // Acta Crystallogr. E. 2007. V. 63. P. m2037.
Bekaroglu O., Sarisaban S., Koray A.R. et al. // Acta Crystallogr. B. 1978. V. 34. P. 3591.
Belombe M.M., Nenwa J., Lonnecke P., Hey-Hawkins E. // Z. Anorg. Allg. Chem. 2009. V. 635. P. 420.
Kawata S., Kitagawa S., Machida H. et al. // Inorg. Chim. Acta. 1995. V. 229. P. 211.
Endres H., Genc N., Nothe D. // Z. Naturforsch. B. 1983. V. 38. P. 90.
Endres H., Nothe D., Rossato E., Hatfield W.E. // Inorg. Chem. 1984. V. 23. P. 3467.
Endres H., Genc N. // Acta Crystallogr. C. 1983. V. 39. P. 704.
Nenwa J., Djonwouo P.L., Nfor E.N. et al. // Z. Naturforsch. B. 2014. V. 69. P. 321.
Endres H. // Z. Anorg. Allg. Chem. 1984. V. 513. P. 78.
Tommasino J.-B., Pilet G., Renaud F.N.R. et al. // Polyhedron. 2012. V. 37. P. 27.
Xiao B., Gong T.-J., Xu J. et al. // J. Am. Chem. Soc. 2011. V. 133. P. 1466.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия