Координационная химия, 2022, T. 48, № 1, стр. 18-28
Исследование распределения электронной плотности в кристалле биосовместимого металл-органического координационного полимера
А. А. Ищенко 1, 2, А. М. Пак 1, Ю. В. Нелюбина 1, 2, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
2 Московский физико-технический институт (национальный исследовательский университет)
Москва, Россия
* E-mail: unelya@ineos.ac.ru
Поступила в редакцию 11.05.2021
После доработки 02.06.2021
Принята к публикации 03.06.2021
- EDN: QMXLTG
- DOI: 10.31857/S0132344X22010029
Аннотация
В гидротермальных условиях синтезирован ранее описанный металл-органический координационный полимер [Zn3(HCit)2(H2O)2]n (HCit = лимонная кислота) (I), целиком образованный биосовместимыми компонентами. Подбором условий гидротермального синтеза его удалось получить в виде монокристаллов хорошего качества, которое позволило провести для него детальный анализ функции распределения электронной плотности, восстановленной по данным прецизионного рентгенодифракционного эксперимента, что является вторым примером такого исследования для биосовместимого металл-органического координационного полимера.
Металл-органические координационные полимеры (МОКП) [1] – уникальный класс кристаллических материалов, периодическая структура которых образована ионами металлов или их кластерами, выполняющими роль металлосодержащих узлов, и координированными к ним лигандами, выполняющими роль органических линкеров. Подобное сочетание органической и неорганической составляющих, которые можно выбирать в достаточно широких пределах, позволяет получать такие материалы с заданными физико-химическими свойствами (например, пористостью [2]), что лежит в основе их применения в хранении [3] и разделении [4] газов, в качестве протон-проводящих мембран [5], катализаторов или их “контейнеров” в различных химических процессах [6] и даже в структурной биологии [7]. Кроме того, МОКП, образованные биосовместимыми компонентами, активно используются в медицине [8], в первую очередь, для контролируемого высвобождения терапевтических агентов, в том числе входящих в их состав в качестве органических линкеров [9], а также для создания оптических сенсоров и контрастных агентов для магнитно-резонансной томографии [10]. Недавно также была показана возможность использования кристаллических материалов данного типа для создания на их основе функциональной пищевой упаковки [11, 12].
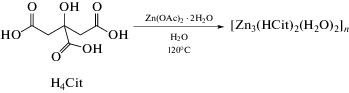
Одним из популярных способов синтеза МОКП [13] является сольвотермальный метод, который позволяет получать монокристаллы хорошего качества, подходящие для установления их кристаллической структуры [14] (и даже распределения в них электронной плотности [15–18]) при помощи РСА. В настоящей работе таким образом нами синтезирован ранее описанный [19–22] МОКП [Zn3(HCit)2(H2O)2]n (HCit = лимонная кислота) (I) (cхема 1), в состав которого входят только биосовместимые компоненты – координированные молекулы воды и продукты реакции ацетата цинка, играющего ключевую роль во многих физиологических процессах [23, 24], и лимонной кислоты, широко используемой в пищевой промышленности [25]. Полученный кристаллический продукт нами выделен в индивидуальном виде и охарактеризован при помощи элементного анализа и рентгеновской дифракции. Кроме того, для образовавшихся в подобранных гидротермальных условиях высококачественных монокристаллов I мы также провели прецизионный рентгенодифракционный эксперимент, данные которого позволили проанализировать экспериментальное распределение электронной плотности в кристалле полученного металл-органического координационного полимера.
Схема 1 .
Подобные исследования для данного класса кристаллических материалов встречаются достаточно редко [26–28], в первую очередь, из-за жестких требований, предъявляемых к качеству изучаемого образца. Среди них – монокристалл большого размера, редко достижимого даже для простых органических соединений, и отсутствие в нем неупорядоченных фрагментов, что особенно проблемно для пористых МОКП, которые в порах содержат (часто разупорядоченные) молекулы растворителей или других веществ-гостей [15, 17, 29]. Как результат, примеров исследования распределения электронной плотности, восстановленной по данным прецизионных рентгенодифракционных экспериментов, в кристаллах металл-органических координационных полимеров достаточно мало и почти [17, 30–32] все они использовали более интенсивное синхротронное излучение [15, 16, 18, 33–35]). Из них [Zn(HCOO)2(H2O)2] [30] – единственный МОКП, образованный биосовместимыми компонентами, которые кроме иона цинка(II) включают молекулы воды и анионы муравьиной кислоты, применяемой в качестве консервирующего агента в пищевой промышленности и биологически активной добавки [36, 37].
Рис. 1.
Зависимость фрактальной размерности d f от остаточной электронной плотности ρ0 для распределения электронной плотности в I, полученного в результате мультипольного уточнения по прецизионным рентгенодифракционным данным.

В настоящей работе анализ экспериментального распределения электронной плотности проведен для полученного в гидротермальных условиях монокристалла [Zn3(HCit)2(H2O)2]n (I), что является вторым примером такого исследования для биосовместимого металл-органического координационного полимера.
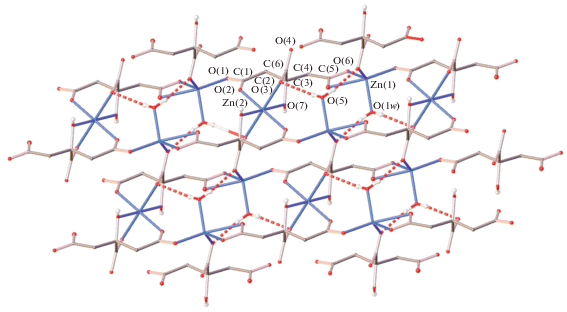
Рис. 2.
Фрагмент кристаллической упаковки I, иллюстрирующий образование двумерного координационного слоя. Атомы водорода СH2-групп не показаны для ясности, а нумерация приведена только для симметрически-независимых атомов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом комплекса, выполняли на воздухе с использованием коммерчески доступных органических растворителей и реагентов. Анализ на содержание углерода и водорода проводили на микроанализаторе CarloErba, модель 1106. Синтез I проводили по модифицированной методике [19] в гидротермальных условиях (схема 1 ).
Синтез [Zn3(HCit)2(H2O)2]n (I). Смесь лимонной кислоты (0.1921 г, 1 ммоль) и Zn(OAc)2 ⋅ 2H2O (0.2195 г, 1 ммоль) растворяли в дистиллированной воде (1 мл), нагревали в запаянной стеклянной ампуле до 120°С со скоростью 200°С/ч и выдерживали при указанной температуре в течение 24 ч с последующим медленным охлаждением до комнатной температуры в течение 5 ч. Полученные бесцветные призматические кристаллы, один из которых отбирали для проведения рентгенодифракционного исследования и возвращали после его окончания, отделяли от маточного раствора, промывали дистиллированной водой и этанолом, а затем высушивали на воздухе. Выход I 0.153 г (75%).
РCA. Рентгенодифракционное исследование монокристалла I, извлеченного из запаянной стеклянной ампулы сразу же после ее охлаждения до комнатной температуры, проводили при 120 К на дифрактометре Bruker APEX2 DUO CCD (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структура расшифрована с использованием программы ShelXT [15] и уточнена в полноматричном МНК по $F_{{hkl}}^{2}$ с помощью программы Olex2 [16] в анизотропном приближении для неводородных атомов. Атомы водорода локализованы из разностных Фурье-синтезов электронной плотности и уточнены в изотропном приближении. Основные кристаллографические данные и параметры уточнения представлены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения структуры I
| Параметр | Значение |
|---|---|
| Брутто-формула | C12H14O16Zn3 |
| М | 610.34 |
| Сингония | Моноклинная |
| Пр. гр. | P21/c |
| Z | 2 |
| a, Å | 6.11710(10) |
| b, Å | 14.5347(3) |
| c, Å | 9.5647(2) |
| β, град | 102.4480(10) |
| V, Å3 | 830.41(3) |
| ρ(выч.), г см–3 | 2.441 |
| μ, см–1 | 43.95 |
| F(000) | 608 |
| 2θmax, град | 120 |
| Число измеренных отражений | 262 359 |
| Число независимых отражений | 12 523 |
| Число отражений с I > 2σ(I) | 11 184 |
| Количество уточняемых параметров | 170 |
| R1 (для отражений с I > 2σ(I)) | 0.0214 |
| wR2 (для всех отражений) | 0.0501 |
| GOОF | 1.073 |
| Остаточная электронная плотность (Δρmin/Δρmax), e Å–3 | –0.759/1.392 |
Полный набор рентгеноструктурных параметров для I депонирован в Кембриджском банке структурных данных (CCDC 2082522; http:// www.ccdc.cam.ac.uk/).
Мультипольное уточнение I проводили в рамках формализма Хансена–Коппенса [38] с использованием пакета программ XD [39] с остовной и валентной электронной плотностью, полученной из волновых функций, основанных на релятивистском решении уравнения Дирака-Фока. Перед уточнением длины связей С–H нормировали на стандартные нейтронографические значения [40] в 1.091 Å, гидроксильной группы О–H – на 0.970 Å [40], O–H – на величину 0.972 Å, полученную из нейтронографических данных для аналогичных структур [41]. Анизотропные тепловые параметры атомов водорода оценивали с помощью программы Shade3 Server [42]. Мультипольное разложение для атомов цинка, углерода и кислорода ограничивали гексадекапольным уровнем, а для атомов водорода – дипольным. Уточнение проводили по Fhkl. Все ковалентно-связанные пары атомов удовлетворяли критерию Хиршфельда [43] на жесткость связи. Соответствующие значения не превышали 9 × 10–4 Å2. Результаты мультипольного уточнения: R = 0.0172, Rw = 0.0140, GOOF = 1.0048 по 11 633 отражениям с I > 3σ(I). Значения остаточной электронной плотности не превышали 0.29 e Å–3. Полученный по результатам анализа остаточной плотности [44] характер зависимости фрактальной размерности d f от ρ0 (pис. 1) демонстрирует небольшие отклонения от гауссова распределения остаточной электронной плотности, что свидетельствует об “адекватности” полученных в ходе уточнения параметров мультипольной модели Хансена–Коппенса [45].
Для расчета ν(r) из рентгенодифракционных данных использовано приближение в рамках теории Томаса–Ферми [46]. Согласно данному подходу плотность кинетической энергии g(r) можно получить, исходя из выражения g(r) = = 3/10(3π2)2/3[ρ(r)]5/3 + (1/72)|∇ρ(r)|2/ρ(r) + 1/6∇2ρ(r), которое в сочетании с локальной теоремой вириала [47] 2g(r) + v(r) = 1/4∇2ρ(r) позволяет рассчитывать как плотность потенциальной энергии v(r), так и локальную плотность энергии he(r). Поиск КТ (3, –1) и расчет в них топологических характеристик ρ(r), включая he(r), g(r) и v(r), проводили с использованием программы WinXPRO [48].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее металл-органический координационный полимер [Zn3(HCit)2(H2O)2]n (I) получали в сольвотермальных условиях при выдерживании соли цинка с лимонной кислотой в водной среде или в различных смесях этанол–вода при температуре в интервале от 140 до 200°С. Время синтеза варьировали от 16 до 72 ч, а соотношение соли цинка, в качестве которой использовали ацетат, нитрат или сульфат цинка(II), к лимонной кислоте выбирали в пределах от 1 : 1 до 1 : 1.5 [19–22]. Хотя выбор растворителя и соотношения исходных реагентов не влиял на образование I, при использовании ацетата цинка(II) отсутствовала необходимость регулирования pH раствора добавлением основания, например щелочи или аммиака. По этой причине I в настоящей работе получали из ацетата цинка(II) и лимонной кислоты в гидротермальных условиях (cхема 1) по модифицированной методике [19]. Использование более низкой температуры (120 вместо 200°С [19]) и времени синтеза (24 вместо 72 ч [19]) позволило нам не только синтезировать целевой продукт с более высоким выходом (75 вместо 63% [19]), но и получить для данного металл-органического координационного полимера монокристаллы подходящего качества для проведения прецизионного рентгенодифракционного исследования.
Как отмечалось ранее [19–22], I представляет собой 2D-координационный полимер (pис. 2), в котором роль металлосодержащих узлов играют два симметрически-независимых иона цинка(II), находящихся в различном окружении анионов лимонной кислоты, депротонированных по трем карбоксильным группам и выполняющих функцию органических линкеров, и молекул воды. Координационный полиэдр иона Zn(1) имеет форму, близкую к искаженной тригональной бипирамиде (табл. 2), в которой экваториальные позиции занимают атомы кислорода двух карбоксильных групп O(4) и O(6) (Zn–O 2.0170(4) и 2.0623(4) Å) и одной молекулы воды (Zn–O 2.0342(4) Å), а аксиальные – атомы кислорода карбоксильных групп O(1) и O(5) (Zn–O 1.9749(4) и 2.3197(4) Å) аниона лимонной кислоты. Напротив, для иона цинка Zn(2), занимающего в кристалле частное положение (центр инверсии), наблюдается (псевдо)октаэдрическое окружение, образованное атомами кислорода четырех карбоксильных (Zn–O 2.0422(4) и 2.0829(3) Å) и двух гидроксильных (Zn–O 2.1207(3) Å) групп аниона. Для количественного описания формы соответствующих полиэдров мы также использовали “меры симметрии” [49], характеризующие ее отклонение от идеальной тригональной бипирамиды S(TBPY-5) и идеального октаэдра S(OC-6) (табл. 2). Чем эти значения меньше, тем лучше форма полиэдра описывается выбранным многогранником. В полученном нами металл-органическом координационном полимере I величины S(TBPY-5) и S(OC-6), оцененные на основе рентгенодифракционных данных при помощи программы Shape 2.1 [49], для ионов Zn(1) и Zn(2) составляют 3.893 и 0.966 соответственно. Для сравнения отклонение формы их координационных полиэдров от альтернативных многогранников с пятью и шестью вершинами – квадратной пирамиды (SPY-5) и тригональной призмы (TP-6) – заметно выше (5.026 и 15.602), что указывает на корректность их описания искаженной тригональной бипирамидой и практически идеальным октаэдром.
Таблица 2.
Основные геометрические параметры I
| Параметр* | Zn(1) | Zn(2) |
|---|---|---|
| M–OCOO, Å | 1.9749(4)–2.3197(4) | 2.0422(4), 2.0829(3) |
| M–OOH, Å | 2.1207(3) | |
| M–${{{\text{O}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, Å | 2.0342(4) | |
| S(TBPY-5) | 3.893 | |
| S(SPY-5) | 5.026 | |
| S(OC-6) | 0.966 | |
| S(TP-6) | 15.602 |
* OCOO, OOH, ${{{\text{O}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ – атомы кислорода карбоксильной и гидроксильной группы цитрат-аниона и молекул воды, а S(TBPY-5), S(SPY-5), S(OC-6) и S(TP-6) – отклонения формы полиэдра иона металла от тригональной бипирамиды (TBPY-5), квадратной пирамиды (SPY-5), октаэдра (OC-6) и тригональной призмы (TP-6).
Перечисленные выше координационные связи с анионом лимонной кислоты, выполняющим роль органического линкера, приводят к образованию двумерного координационного слоя вдоль кристаллографической плоскости ac (pис. 2), дополнительно стабилизированного водородными связями между координированной к иону Zn(1) молекулой воды и карбоксильными группами данного аниона (O…O 2.8450(5) и 3.0317(5) Å, OHO 173.6(18)° и 157.0(17)°). Прочная водородная связь между его гидроксильной и одной из карбоксильных групп (O…O 2.6454(4) Å, OHO 170.0(16)°) объединяет двумерные координационные слои между собой в плотный трехмерный каркас (рис. 3) с максимальным объемом пор менее 2.15 Å3, как следует из оценки рентгенодифракционных данных в программе OLEX2 [50].
Рис. 3.
Фрагмент кристаллической упаковки I, иллюстрирующий упаковку двумерных координационных слоев в кристалле. Атомы водорода СH2-групп не показаны для ясности.

Высокое разрешение указанных (прецизионных) данных, которого мы достигли для образовавшегося в выбранных условиях гидротермального синтеза монокристалла I, позволило нам извлечь из них не только координаты атомов и связанные с ними структурные параметры, которые обсуждались ранее [19–22], но и полное распределение электронной плотности (ЭП), определяющее все свойства кристаллических материалов [45], например магнитные, которые часто являются объектом подобных исследований для металл-органических координационных полимеров [15, 30, 31, 33]. Несмотря на возникающие при этом проблемы [15, 17, 29], существенно ограничивающие число таких работ, полученное в результате мультипольного уточнения рентгенодифракционных данных (см. Экспериментальную часть) экспериментальное распределение ЭП для I характеризуется всеми ожидаемыми признаками. В частности, максимумы деформационной ЭП (ДЭП) наблюдаются на серединах ковалентных связей в анионе лимонной кислоты и у атомов кислорода его гидроксильной и карбоксильных групп, а также молекулы воды в положениях, соответствующих двум неподеленным электронным парам (рис. 4). Последние (за исключением принадлежащих атомам O(2) и O(3) [51]) направлены к областям накопления ДЭП у ионов цинка, что ранее наблюдалось для второго биосовместимого металл-органического координационного полимера [Zn(HCOO)2(H2O)2] [30], для которого такое исследование было проведено. Однако в нашем случае распределение ДЭП вокруг двух симметрически-независимых ионов цинка, находящихся в тригонально-бипирамидальном и (псевдо)октаэдрическом (как в [Zn(HCOO)2(H2O)2] [30]) окружении, отличается более выраженной асимметрией (рис. 5), напоминающей 3d-орбитали переходных металлов, как в некоторых других комплексах цинка(II) [51–53]. Заселенность соответствующих орбиталей (табл. 3) двух ионов цинка в I, оцененная по результатам мультипольного уточнения прецизионных рентгенодифракционных данных, согласуется с их полностью заполненной 3d-оболочкой (9.99(2) и 9.98(2) е), что свидетельствует о важной роли 4s-электронов в связывании металл–лиганд. На это опосредованно указывают и их заряды (+0.87 и +0.94 е), полученные при анализе распределения ЭП в рамках теории “Атомы в Молекуле” [47] (табл. 4), которые близки к таковым в металл-органическом координационном полимере [Zn(HCOO)2(H2O)2] (+0.90 и +0.94 е [30]). Координированная молекула воды также [30] практически нейтральная, тогда как заряд аниона лимонной кислоты с тремя депротонированными карбоксильными группами составляет –1.30 е.
Рис. 4.
Двумерные распределения ДЭП в области координационных связей, образованных ионами цинка Zn(1) (слева) и Zn(2) (справа) в кристалле I. Контуры проведены с шагом 0.1 е Å3, а соответствующие положительные и отрицательные значения показаны синим и красным цветом соответственно.

Рис. 5.
Изоповерхность трехмерного распределения ДЭП (значения 0.3 и –0.3 е Å–3 показаны синим и красным цветом соответственно) вокруг ионов цинка Zn(1) (a) и Zn(2) (б) в кристалле I.

Таблица 3.
Заселенности 3d-орбиталей ионов цинка(II) в кристалле I*
| Катион | ${{d}_{{z2}}}$ | dxz | dyz | ${{d}_{{x2 - y2}}}$ | dxy | Σ |
|---|---|---|---|---|---|---|
| Катион Zn(1) | 2.04(1) | 2.07(1) | 1.81(1) | 2.17(1) | 1.90(1) | 9.99(2) |
| Катион Zn(2) | 2.14(1) | 2.02(1) | 1.97(1) | 1.73(1) | 2.12(1) | 9.98(2) |
* Заселенности 3d-орбиталей рассчитаны в соответствии со стандартным подходом [54] в программе XD2016 [39] при выборе локальных осей z и y для ионов Zn(1) и Zn(2) в тригонально-бипирамидальном и октаэдрическом окружении вдоль связей Zn(1)–O(1), Zn(1)–O(1w), Zn(2)–O(7) и Zn(2)–O(2) с атомами кислорода, занимающими аксиальное и экваториальное положение в тригональной бипирамиде и октаэдре соответственно, и оси x перпендикулярно указанным направлениям.
Таблица 4.
Суммарные заряды и объемы ионов и молекул воды в кристалле I*
| Ион/молекула | Заряд, е | Объем, Å3 |
|---|---|---|
| Катион Zn(1) | +0.87 | 12.2 |
| Катион Zn(2) | +0.94 | 10.7 |
| Анион | –1.30 | 168.4 |
| Вода | –0.02 | 21.0 |
Еще одна особенность I, встречавшаяся ранее для металл-органических координационных полимеров [30] и комплексов цинка(II) [51], заключается в неравных заселенностях пяти формально заполненных 3d-орбиталей у обоих симметрически-независимых ионов цинка (табл. 3). Так, для иона Zn(1) в искаженном тригонально-бипирамидальном окружении наблюдается предпочтительное заселение орбиталей dx2 –y2, dxz и dz2, ориентированных к лигандам, что согласуется с направлением неподеленных электронных пар последних к накоплениям ЭП у иона металла (рис. 4). Напротив, у иона Zn(2) орбитали dx2 –y2 и dz2 оказываются наименее и наиболее заселенными, что согласуется с соответствующими накоплениями ЭП, ориентированными к неподеленным электронным парам аксиальных атомов кислорода O(7), но не к аналогичным парам экваториальных атомов кислорода O(2) и O(3) (рис. 4). Таким образом, в кристалле металл-органического координационного полимера I реализуется смешанный сценарий распределения ЭП в области координационных связей, одновременно сочетающий два ранее обнаруженных для (псевдо)октаэдрических комплексов цинка(II) противоположных варианта [51–53].
Наблюдаемая разница в заселенностях 3d-орбиталей, зарядах, а также объемах (12.2 и 10.7 Å3) двух симметрически-независимых ионов цинка (табл. 3, 4) отражает различное координационное окружение этих двух ионов, один из которых, Zn(1), образует самую короткую и самую длинную координационные связи.
Топологический анализ распределения ЭП в кристалле I в рамках теории “Атомы в Молекуле” [47] выявил критические точки КТ (3, –1), приписываемые связывающим взаимодействиям [55, 56] для описанных выше координационных и водородных связей внутри двумерных координационных слоев и между ними, а также для ряда более слабых контактов (табл. 5). Во всех случаях координационные связи Zn–O относятся к взаимодействиям, занимающим промежуточное положение между обобществленными взаимодействиями, характерными для ковалентных связей (например, в анионе лимонной кислоты), и взаимодействиями закрытых оболочек, типичным примером которых являются слабые ван-дер-ваальсовы контакты. Об этом свидетельствуют положительные значения лапласиана ∇2ρ(r) (3.63–9.52 e Å–5) и отрицательные – плотности электронной энергии he(r) (от –0.0112 до –0.0012 a. е.) в КТ (3, –1) координационных связей, аналогичные таковым в металл-органическом координационном полимере [Zn(HCOO)2(H2O)2] [30]. Наиболее прочной из них ожидаемо является самая короткая связь Zn(1)–O(1) (ρ(r) = 0.55 e Å–3, ∇2ρ(r) = 9.52 e Å–5, he(r) = –0.0112 a. е.), энергия которой, оцененная на основе успешно применяемой для этой цели [57] корреляции с плотностью потенциальной энергии в КТ (3, –1) [58, 59], достигает 38.0 ккал/моль. Для сравнения энергия самой слабой координационной связи (ρ(r) = 0.27 e Å–3, ∇2ρ(r) = 3.63 e Å–5, he(r) = –0.0012 a. е.) с атомом кислорода O(5), занимающим максимально удаленное от иона Zn(1) аксиальное положение в его тригонально-бипирамидальном окружении, составляет 12.6 ккал/моль. Наблюдаемая линейная зависимость (с величиной достоверности аппроксимации R2 = 0.90) между энергией и расстоянием металл–лиганд в сочетании с небольшими отрицательными значениями he(r) в КТ (3, –1) указывает на преимущественно ионную природу данных взаимодействий, но с некоторым вкладом ковалентной составляющей, как и в МОКП [Zn(HCOO)2(H2O)2] [30]. Интересно, что энергия всех координационных связей, образуемых двумя симметрически-независимыми ионами цинка в различном координационном окружении, принимает достаточно близкие значения в 147.3 и 152.5 ккал/моль.
Таблица 5.
Топологические параметры функции ρ(r) в КТ (3, –1), соответствующих различным типам межатомных взаимодействий в кристалле I
| Взаимодействие | d, Å* | ρ(r), e Å–3 | ∇2ρ(r), e Å–5 | he(r), a. е. | –v(r), a. е. | Eint, ккал/моль |
|---|---|---|---|---|---|---|
| Координационные связи | ||||||
| Zn(1)–O(1) | 1.974 | 0.55 | 9.52 | –0.0112 | 0.1211 | 38.0 |
| Zn(1)–O(1w) | 2.036 | 0.52 | 8.67 | –0.0100 | 0.1100 | 34.5 |
| Zn(1)–O(4) | 2.017 | 0.52 | 8.75 | –0.0093 | 0.1100 | 34.3 |
| Zn(1)–O(5) | 2.321 | 0.27 | 3.63 | –0.0012 | 0.0400 | 12.6 |
| Zn(1)–O(6) | 2.062 | 0.45 | 7.45 | –0.0057 | 0.0888 | 27.9 |
| Zn(2)–O(2) | 2.084 | 0.41 | 6.54 | –0.0046 | 0.0771 | 24.2 |
| Zn(2)–O(3) | 2.042 | 0.44 | 7.79 | –0.0038 | 0.0884 | 27.8 |
| Zn(2)–O(7) | 2.121 | 0.41 | 6.54 | –0.0048 | 0.0774 | 24.3 |
| Водородные связи внутри слоя | ||||||
| O(3)…H(1wA) | 2.120 | 0.04 | 1.29 | 0.0039 | 0.0056 | 1.8 |
| O(4)…H(1wB) | 1.877 | 0.06 | 3.37 | 0.0107 | 0.0137 | 4.3 |
| Водородные связи между слоями | ||||||
| O(6)…H(7) | 1.687 | 0.26 | 5.53 | 0.0065 | 0.0445 | 13.9 |
| Слабые взаимодействия внутри слоя | ||||||
| O(1w)…H(2B) | 2.308 | 0.04 | 1.20 | 0.0035 | 0.0054 | 1.7 |
| O(1w)…C(5) | 3.505 | 0.03 | 0.34 | 0.0008 | 0.0019 | 0.6 |
| O(2)…O(2) | 3.354 | 0.03 | 0.40 | 0.0011 | 0.0020 | 0.6 |
| O(7)…H(2A) | 2.834 | 0.03 | 0.42 | 0.0012 | 0.0020 | 0.6 |
| Слабые взаимодействия между слоями | ||||||
| O(1)…H(4A) | 2.578 | 0.03 | 0.70 | 0.0020 | 0.0033 | 1.0 |
| O(1)…C(5) | 3.461 | 0.02 | 0.32 | 0.0009 | 0.0016 | 0.5 |
| O(6)…H(2A) | 2.900 | 0.03 | 0.41 | 0.0011 | 0.0021 | 0.6 |
Остальные взаимодействия, которые отвечают за формирование двумерных координационных слоев в дополнение к ковалентным и координационным связям и за их связывание друг с другом в кристалле I, относятся к взаимодействиям закрытых оболочек, характеризующимся положительными значениями лапласиана ∇2ρ(r) и плотности электронной энергии he(r) в соответствующих КТ (3, –1). При этом наиболее сильным взаимодействием (с энергией 13.9 ккал/моль), превосходящим по прочности описанную выше длинную координационную связь Zn(1)–O(5), является водородная связь между гидроксильной и карбоксильной группами (ρ(r) = 0.26 e Å–3, ∇2ρ(r) = 5.53 e Å–5, he(r) = 0.0065 a. е.) анионов лимонной кислоты из соседних координационных слоев. Заметно меньших значений энергии в 4.3 и 1.8 ккал/моль достигают образуемые молекулой воды водородные связи внутри слоя (ρ(r) = 0.06 и 0.04 e Å–3, ∇2ρ(r) = 3.37 и 1.29 e Å–3, he(r) = 0.0107 и 0.0039 a. е.). Подобные различия хорошо описываются экспоненциальной зависимостью энергии от расстояния между атомом водорода и его акцептором (с величиной достоверности аппроксимации R2 = 0.98), аналогичной наблюдавшейся ранее для водородных связей [60]. Одна из двух водородных связей в двумерном координационном слое при этом оказывается сравнимой по энергии с дополнительными слабыми контактами с участием атомов кислорода, например, C–H…O (табл. 5), энергия которых лежит в интервале 0.5–1.7 ккал/моль. Суммарная энергия взаимодействий, объединяющих двумерные координационные слои друг с другом, на одну формульную единицу [Zn3(HCit)2(H2O)2] принимает достаточно заметное значение в ~32 ккал/моль. Соответственно, они могут вносить важный вклад в высокую термическую стабильность данного МОКП [22], сохраняющего свою целостность при нагревании вплоть до 283°C в отличие от его 1D- и 2D-аналогов с другими металлами, содержащих в своем составе цитрат-анионы и координированные молекулы воды, но при этом имеющих другое кристаллическое строение.
Таким образом, подбором условий гидротермального синтеза нам удалось получить МОКП [Zn3(HСit)2(H2O)2]n не только с более высоким выходом, но и в виде монокристаллов, подходящих как для стандартного РСА (что является известным преимуществом сольвотермального метода [14]), так и для прецизионного исследования экспериментального распределения электронной плотности [15–18]. Проведенное исследование, которое, например, выявило смешанный [51–53] тип распределения ЭП в области координационных связей Zn–O (рис. 4), является вторым таким примером в случае металл-органического координационного полимера, полностью образованного биосовместимыми компонентами (в дополнение к [Zn(HCOO)2(H2O)2] [30]). Имеются проблемы, существенно ограничивающие число подобных работ для данного уникального [1] класса кристаллических материалов (в первую очередь, вызванные разупорядоченными молекулами растворителя в порах [15, 17, 29]), помимо подбора условий синтеза и активации [17], в том числе при помощи подходов с высокой пропускной способностью [61]. Решением проблемы может быть поиск альтернативных вариантов “реконструирования” распределения ЭП, связанных с использованием модели переносимого атома или ее аналогов [17, 62]. Это позволит достичь более глубокого понимания различных практически-важных свойств (например, магнитных [15, 30, 31, 33]) металл-органических координационных полимеров и способов их управления методами “инженерии кристаллов” [63, 64].
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Yaghi O., Li H. // J. Am. Chem. Soc. 1995. V. 117. № 41. P. 10401.
Yaghi O.M., O’Keeffe M., Ockwig N.W. et al. // Nature. 2003. V. 423. № 6941. P. 705.
Wilmer C.E., Leaf M., Lee C.Y. et al. // Nature Chem. 2012. V. 4. № 2. P. 83.
Herm Z.R., Wiers B.M., Mason J.A. et al. // Science. 2013. V. 340. № 6135. P. 960.
Yoon M., Suh K., Natarajan S., Kim K. // Angew. Chem. Int. Ed. 2013. V. 52. № 10. P. 2688.
Lee J., Farha O.K., Roberts J. et al. // Chem. Soc. Rev. 2009. V. 38. № 5. P. 1450.
Inokuma Y., Yoshioka S., Ariyoshi J. et al. // Nature. 2013. V. 495. № 7442. P. 461.
Giménez-Marqués M., Hidalgo T., Serre C., Horcajada P. // Coord. Chem. Rev. 2016. V. 307. P. 342.
Miller S.R., Heurtaux D., Baati T. et al. // Chem. Commun. 2010. V. 46. № 25. P. 4526.
Imaz I., Rubio-Martínez M., An J. et al. // Chem. Commun. 2011. V. 47. № 26. P. 7287.
Zhao J., Wei F., Xu W., Han X. // Appl. Surface Sci. 2020. V. 510. P. 145418.
Chopra S., Dhumal S., Abeli P. et al. // Postharv. Biol. Technol. 2017. V. 130. P. 48.
Stock N., Biswas S. // Chem. Rev. 2011. V. 112. № 2. P. 933.
Zhao Y., Li K., Li J. // Z. Natur. B. 2010. V. 65. № 8. P. 976.
Clausen H.F., Overgaard J., Chen Y.S., Iversen B.B. // J. Am. Chem. Soc. 2008. V. 130. № 25. P. 7988.
Poulsen R.D., Jørgensen M.R.V., Overgaard J. et al. // Chem. Eur. J. 2007. V. 13. № 35. P. 9775.
Novaković S.B., Bogdanović G.A., Heering C. et al. // Inorg. Chem. 2015. V. 54. № 6. P. 2660.
Poulsen R.D., Bentien A., Graber T., Iversen B.B. // Acta Cryst. A. 2004. V. 60. № 5. P. 382.
Li X.H., Chen W.L., Wang E.B. // Acta Crystallogr. E. 2009. V. 65. P. m183.
Che P., Fang D., Zhang D. et al. // J. Coord. Chem. 2005. V. 58. № 17. P. 1581.
Wu J. // Acta Crystallogr. E. 2008. V. 64. P. m583.
Zhang G., Yang G., Ma J.S. // Cryst. Growth & Des. 2006. V. 6. № 2. P. 375.
Kloubert V., Rink L. // Food Funct. 2015. V. 6. № 10. P. 3195.
Kimura T., Kambe T. // Int. J. Mol. Sci. 2016. V. 17. № 3. P. 336.
Gurtler J.B., Mai T.L. Encyclopedia of Food Microbiology / Eds. Batt C.A., Tortorello M.L. Oxford: Academic Press, 2014. P. 119.
Tolborg K., Iversen B.B. // Chem. Eur. J. 2019. V. 25. № 66. P. 15010.
Krawczuk A., Macchi P. // Chem. Centr. J. 2014. V. 8. № 1. P. 68.
Macchi P. // CHIMIA Int. J. Chem. 2009. V. 63. № 1–2. P. 29.
Jørgensen M.R.V., Clausen H.F., Christensen M. et al. // Eur. J. Inorg. Chem. 2011. V. 2011. № 4. P. 549.
Jørgensen M.R.V., Cenedese S., Clausen H.F. et al. // Inorg. Chem. 2013. V. 52. № 1. P. 297.
Dos Santos L.H.R., Lanza A., Barton A.M. et al. // J. Am. Chem. Soc. 2016. V. 138. № 7. P. 2280.
Kubus M., Lanza A., Scatena R. et al. // Inorg. Chem. 2018. V. 57. № 9. P. 4934.
Poulsen R.D., Bentien A., Chevalier M., Iversen B.B. // J. Am. Chem. Soc. 2005. V. 127. № 25. P. 9156.
Jørgensen M.R., Hathwar V.R., Bindzus N. et al. // IU-CrJ. 2014. V. 1. P. 267.
Garino C., Borfecchia E., Gobetto R. et al. // Coord. Chem. Rev. 2014. V. 277–278. P. 130.
Pietzke M., Meiser J., Vazquez A. // Mol. Metabol. 2020. V. 33. P. 23.
Momb J., Lewandowski J.P., Bryant J.D. et al. // PNAS. 2012. P. 201211199.
Hansen N.K., Coppens P. // Acta Crystallogr. A. 1978. V. 34. P. 909.
Volkov A., Macchi P., Farrugia L.J. et al. XD2016 – A Computer Program Package for Multipole Refinement, Topological Analysis of Charge Densities and Evaluation of Intermolecular Energies from Experimental and Theoretical Structure Factors. 2016.
Allen F.H., Bruno I.J. // Acta Cryst. B. 2010. V. 66. P. 380.
Chandler G.S., Wajrak M., Khan R.N. // Acta Cryst. B. 2015. V. 71. P. 275.
Madsen A. // J. Appl. Cryst. 2006. V. 39. P. 757.
Hirshfeld F.L. // Acta Cryst. A. 1976. V. 32. № 1. P. 239.
Meindl K., Henn J. // Acta Cryst. A. 2008. V. 64. P. 404.
Корлюков А.А., Нелюбина Ю.В. // Успехи химии. 2019. Т. 88. С. 677.
Киржниц Д.А., Лозовик Ю.Е., Шпатаковская Г.В. // Успехи физ. наук. 1975. Т. 711. С. 3.
Bader R.F.W. Atoms in Molecules. A Quantum Theory / Ed. Bader R.F.W. Oxford: Clarendron Press, 1990.
Stash A., Tsirelson V. // J. Appl. Cryst. 2002. V. 35. P. 371.
Alvarez S. // Chem. Rev. 2015. V. 115. P. 13447.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Lee C.-R., Wang C.-C., Chen K.-C. et al. // J. Phys. Chem. A. 1999. V. 103. № 1. P. 156.
Wang R., Lehmann C.W., Englert U. // Acta Cryst. B. 2009. V. 65. № 5. P. 600.
Kotova O., Lyssenko K., Rogachev A. et al. // J. Photochem. Photobiol. A. 2011. V. 218. № 1. P. 117.
Holladay A., Leung P., Coppens P. // Acta Cryst. A. 1983. V. 39. № 3. P. 377.
Bader R.F.W. // J. Phys. Chem. A. 1998. V. 102. P. 7314.
Bader R.F.W. // Chem. Eur. J. 2006. V. 12. P. 2896.
Lyssenko K.A. // Mendeleev Commun. 2012. V. 22. № 1. P. 1.
Espinosa E., Molins E., Lecomte C. // Chem. Phys. Letts. 1998. V. 285. № 3–4. P. 170.
Espinosa E., Alkorta I., Rozas I. et al. // Chem. Phys. Letts. 2001. V. 336. P. 457.
Лысенко К.А., Барзилович П.Ю., Нелюбина Ю.В. и др. // Изв. АН. Cер. хим. 2009. № 1. С. 31.
Stock N., Bein T. // Angew. Chem. Int. Ed. 2004. V. 43. № 6. P. 749.
Chimpri A.S., Macchi P. // Phys. Scrip. 2013. V. 87. № 4. P. 048105.
Allendorf M.D., Stavila V. // CrystEngComm. 2015. V. 17. № 2. P. 229.
Moulton B., Zaworotko M.J. // Chem. Rev. 2001. V. 101. № 6. P. 1629.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия