Координационная химия, 2022, T. 48, № 11, стр. 690-698
Трифлаты кобальта [Co(H2O)6](CF3SO3)2 и Co(CF3SO3)2: синтез, кристаллическое строение, термическая устойчивость и магнитные свойства
Е. В. Карпова 1, *, М. А. Рябов 1, М. А. Захаров 1, А. М. Алексеева 1, А. В. Миронов 1, Е. С. Козлякова 1, 2, В. В. Королев 2, И. В. Морозов 1, 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Национальный исследовательский технологический университет “МИСиС”
Москва,, Россия
* E-mail: karpova@inorg.chem.msu.ru
Поступила в редакцию 02.02.2022
После доработки 15.03.2022
Принята к публикации 15.03.2022
- EDN: XULKRT
- DOI: 10.31857/S0132344X22110056
Аннотация
Гексагидрат трифлата кобальта [Co(H2O)6](CF3SO3)2 (I) получен кристаллизацией из водного раствора. Дегидратация I в токе аргона при 200°C приводит к образованию безводной соли Co(CF3SO3)2 (II). Кристаллические структуры I и II установлены по монокристальным и порошковым рентгеновским дифракционным данным соответственно. Соединение I изоструктурно [Ni(H2O)6](CF3SO3)2 и кристаллизуется в пр. гр. P$\bar {3}$m1, а = 7.3914(16), с = 8.704(2) Å, V = 411.8(2) Å3, Z = 1. Структура соединения II (пр. гр. R$\bar {3}$, а = 4.9996(1), с = 31.3137(8) Å, V = 677.86(3) Å3, Z = 3) принадлежит к структурному типу M(CF3SO3)2, где M = Mg, Ca, Zn. В структурах обоих соединений атомы кобальта находятся в октаэдрическом окружении атомов кислорода, принадлежащих молекулам воды (I) или трифлатным группам (II). В I катионы [Co(H2O)6]2+, расположенные в узлах правильной треугольной сетки за счет соединения водородными связями с анионами (CF3SO3)–, образуют слои, параллельные плоскости (001). При дегидратации I с образованием II связывание октаэдров [CoO6] осуществляется через группу μ3-CF3SO3 с сохранением слоистой структуры. Полученные соединения охарактеризованы методами ИК-спектроскопии, термогравиметрического анализа с дифференциальным термическим анализом и масс-спектральным анализом газообразных продуктов разложения. Результаты исследования магнитных свойств I и II свидетельствуют об отсутствии магнитного упорядочения при низких температурах и соответствуют парамагнитному поведению I и II при высоких температурах со значительным вкладом спин-орбитального взаимодействия в эффективный магнитный момент атома кобальта.
Безводные трифлаты проявляют свойства кислот Льюиса и применяются в качестве катализаторов в различных органических реакциях. Трифторметансульфоновая кислота CF3SO3H и ее соли – трифторметансульфонаты (трифлаты) – находят широкое применение в реакциях нуклеофильного замещения. Например, метил- и этилтрифлаты примерно в 25 000 раз более реакционноспособны, чем соответствующие тозилаты, причем гидролиз этилтрифлата является процессом SN2 [1]. Интерес к трифлатам связан не только с их применением в качестве катализаторов. Многие трифлаты вплоть до настоящего времени остаются малоизученными, в том числе отсутствуют сведения об их кристаллическом строении и термической стабильности. Кроме того, определенный интерес представляет изучение магнитных свойств трифлатов, что обусловлено возможностью реализации низкоразмерного магнитного упорядочения или геометрически обусловленной фрустрации [2]. В настоящее время представленные в литературе сведения о кристаллическом строении трифлатов d-элементов весьма ограничены. Так, имеются данные о структурах некоторых гексагидратов трифлатов 3d-металлов M(CF3SO3)2 ⋅ 6H2O, где M = Fe [3], Ni [4]; для трифлатов кобальта в литературе имеется информация только о синтезе и некоторых свойствах гептагидрата трифлата [Co(H2O)6](CF3SO3)2 ⋅ H2O [5]. Также есть данные о структурах нескольких трифлатов двухвалентных металлов M(CF3SO3)2, где M = Mg, Ca, Ba, Zn, Cu [6] и свойствах безводного трифлата Co(CF3SO3)2 [5, 7]. В настоящей работе мы представляем синтез и кристаллическое строение гексагидрата трифлата кобальта [Co(H2O)6](CF3SO3)2 (I) и безводного трифлата Co(CF3SO3)2 (II). Полученные соединения охарактеризованы методом ИК-спектроскопии, проведено исследование их термической стабильности и магнитных свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали трифторметансульфоновую кислоту (CF3SO3H, 99%, марки extra pure, фирмы ACROS), основный карбонат кобальта Co(OH)2x(CO3)1 – х (марки “ч.д.а.”), дистиллированная вода.
Образцы соединения I хранили под маточным раствором в герметично закрытых бюксах или в виде кристаллического образца в герметично закрытых бюксах, образцы соединения II – в перчаточном боксе марки “Спектроскопические системы” с контролируемой атмосферой аргона (p(O2), p(H2O) < 0.1 м.д.).
Синтез [Co(H2O)6](CF3SO3)2 (I). Соединение I получали при постепенном концентрировании водного раствора, приготовленного растворением основного карбоната кобальта(II) в 30%-ной трифторметансульфоновой кислоте:
В результате взаимодействия исходных веществ (независимо от их соотношения) образуется раствор красно-оранжевого цвета. Выдерживание раствора в течение 7 сут на воздухе при комнатной температуре приводит к кристаллизации оранжево-красных кристаллов I ромбоэдрической формы.
ИК-спектр образца I (ν, см–1): 3600–3200 ν(OH), 1648, 1615 δ(OH), 1229, 1187 ν(CF3), νas(SO3), 1028 νs(SO3), 767, 719 ν(C–S), δs(CF3), 633 δas(SO3) [7, 8].
Синтез Co(CF3SO3)2 (II). Условия синтеза соединения II выбирали на основании результатов термического анализа. Поликристаллический однофазный образец II получали в результате выдерживания образца соединения I в платиновом тигле в токе аргона в течение 3 ч при 200°С. Для предотвращения взаимодействия II с парами воды все синтетические операции и хранение образцов осуществляли в инертной атмосфере аргона, а при проведении исследований методом порошковой рентгеновской дифракции использовали рентгеноаморфный скотч.
ИК-спектры регистрировали на спектрометре Perkin Elmer Spectrum One, оборудованном приставкой для регистрации спектров методом НПВО в интервале волновых чисел от 580 до 4000 см–1.
Термогравиметрический анализ (ТГ), дифференциальный термический анализ (ДТА) и масс-спектрометрию (МС) газообразных продуктов разложения образцов проводили с использованием анализатора NETZSCH STA409 PC/PG, оборудованного квадрупольным масс-анализатором NETZSCH QMS403C в токе аргона (скорость подачи газа 20 мл/мин, скорость нагрева 5°С/мин) в температурном диапазоне 20–800°C.
Поликристаллический образец соединения I был исследован методом синхротронной порошковой рентгеновской дифракции (λ = 0.35451 Å, T = 200 K) (European Synchrotron Radiation Facility (ESRF), ID22, Гренобль, Франция).
Порошковые рентгеновские дифракционные данные для образцов II получали при комнатной температуре с использованием камеры Гинье высокого разрешения (Image Plate Huber G670, CoKα-излучение, λ = 1.79028 Å, Ge(111) монохроматор, угловой диапазон 3.000–100.300 2θ°, шаг 0.005). Предварительно перетертые в агатовой ступке образцы в инертной атмосфере аргона наносили на лавсановую рентгеноаморфную пленку и закрепляли на кассете дифрактометра рентгеноаморфным скотчем марки Kapton®. Часть образцов была исследована с использованием дифрактометра Rigaku D/MAX 2500 (геометрия “на отражение”, CuKα-излучение, λ = 1.540598 Å, графитовый монохроматор).
Для обработки данных порошковой рентгеновской дифракции использовали базы данных PDF-2+ [9], а также комплекс программ STOE WinXPow [10] и JANA2006 [11].
Дополнительные сведения о кристаллической структуре II можно получить из базы данных Fachinformationszentrum Karlsruhe (ICSD № 2141865; crysdata@fiz-karlsruhe.de).
РСА I проведен на дифрактометре STOE StadiVari Pilatus 100 K (CuKα-излучение, λ = 1.54186 Å). Обработку и анализ структурных данных в процессе решения и уточнения проведены в программной оболочке WinGX [12]. Принимая во внимание неопределенную форму кристалла, использованного для проведения структурных экспериментов, учет поглощения произведен аналитически. Измеренные интенсивности отражений скорректированы на факторы Лоренца и поляризации. Структура I решена с помощью программы SHELXT [13]. Первоначально были найдены атомы кобальта, серы и кислорода. Атомы углерода, фтора и водорода найдены из разностных синтезов Фурье. Позиции неводородных атомов уточнены анизотропно, позиции атома водорода – в изотропном приближении в полноматричном приближении в программе SHELXL [14]. Кристаллографические данные и параметры монокристального дифракционного эксперимента для I представлены в табл. 1, основные межатомные расстояния для структуры I приведены в табл. 2 [4, 5].
Таблица 1.
Кристаллографические данные и параметры эксперимента и уточнения для I
| Параметр | Значение |
|---|---|
| Брутто-формула | С2H12O12F6S2Co |
| Пр. группа | P$\bar {3}$m1 (№ 164) |
| a, Å | 7.3914(16) |
| c, Å | 8.704(2) |
| V, Å3 | 411.8(2) |
| Z | 1 |
| ρ(выч.), г см−3 | 1.876 |
| Излучение (λ, Å) | CuKα (1.54186) |
| Интервал h, k, l | −8 ≤ h ≤ 7; −1 ≤ k ≤ 8; −10 ≤ l ≤ 10 |
| Интервал 2θ, град | 5.08−66.13 |
| T, K | 293(2) |
| μ, cм−1 | 11.695 |
| Число отражений собрано/независимых/I > 2σ(I) | 2358/307/197 |
| Rint | 0.056 |
| Число уточняемых параметров | 31 |
| Полнота данных, % | 98.1 |
| GOОF | 0.996 |
| R1 | 0.049 |
| wR2 (I ≥ 2σ(I)) | 0.110 |
| Остаточная электронная плотность (max/min), e Å−3 | 0.301/−0.419 |
Таблица 2.
Межатомные расстояния (Å) в структурах I и II в сравнении с изоструктурными аналогами [Ni(H2O)6](CF3SO3)2 [4] и Zn(CF3SO3)2 [6]
| Связь | [Co(H2O)6](CF3SO3)2* | [Ni(H2O)6](CF3SO3)2 | Co(CF3SO3)2* | Zn(CF3SO3)2 |
|---|---|---|---|---|
| M–O | 2.074(5) | 2.035(2) | 2.032(1) | 2.069(2) |
| S–O | 1.447(4) | 1.443(2) | 1.508(2) | 1.445(3) |
| C–S | 1.809(15) | 1.830(6) | 1.758(5) | 1.820(2) |
| C–F | 1.321(6) | 1.322(3) | 1.376(2) | 1.302(3) |
Дополнительные сведения о кристаллической структуре I можно получить из базы данных Fachinformationszentrum Karlsruhe (ICSD № 1941425; crysdata@fiz-karlsruhe.de).
Измерения температурных (χ(T)) и полевых (M(B)) зависимостей намагниченности при 2–300 К и 0–9 Тл соответственно выполняли с использованием СКВИД-магнитометра MPMS-XL7 (Magnetic Property Measurement System, Quantum Design), а также вибромагнитометра в составе системы измерения физических свойств (PPMS, Quantum Design). Для недопущения изменения гидратного состава образцов их хранили и измеряли в запаянных стеклянных ампулах в атмосфере аргона. Масса измеряемых образцов составляла от 15 до 25 мг.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Поликристаллический образец I, полученный путем перетирания кристаллов, был исследован методом синхротронной порошковой рентгеновской дифракции при температуре 200 K. Положение и относительные интенсивности рефлексов на рентгенограмме образца I сходны с таковыми для гексагидрата трифлата никеля [Ni(H2O)6]- (CF3SO3)2 [4] (рис. 1). Это позволяет предположить получение изоструктурного соединения [Co(H2O)6](CF3SO3)2 (I). Все рефлексы на рентгенограмме были проиндицированы в тригональной сингонии, пространственной группе P$\bar {3}$m1, с параметрами ячейки a = 7.3592(2), c = 8.72103(4) Å, Rp = = 0.106.
Рис. 1.
Экспериментальная (а), расчетная (б) и разностная (в) рентгенограммы [Co(H2O)6](CF3SO3)2, полученные на синхротронном излучении (λ = 0.35451Å, 200 K).

Закономерное увеличение параметров элементарной ячейки по сравнению с [Ni(H2O)6]- (CF3SO3)2 (a = 7.368(3), c = 8.672(4) Å [4]) связано с увеличением ионного радиуса катиона Co2+ (высокоспиновое состояние, КЧ 6: r(Co2+) = = 0.745 Å, r(Ni2+) = 0.69 Å).
ИК-спектр образца I коррелирует с ИК-спектром безводного трифлата кобальта [15], отнесение сделано в соответствии с данными, представленными в [8]. По сравнению с данными для безводной соли [15] появление на ИК-спектре широкого пика в диапазоне 3200–3600 см–1 свидетельствует о наличии кристаллизационной воды. Полоса симметричного валентного колебания νas(SO3) смещена в коротковолновую область, что может быть связано с различием в координации трифлат-аниона, как и в [5, 7].
С использованием ТГ- и ДТА-анализов, совмещенных с МС-анализом газообразных продуктов разложения, установлено, что разложение соединения I протекает в две стадии (рис. 2). Первая стадия – дегидратация – начинается сразу после начала нагревания и оканчивается при 135°С. Выход на плато после потери 22.77% начальной массы образца соответствует удалению всей кристаллизационной воды и образованию безводной соли II по реакции (теоретическая потеря массы 23.2%):
Рис. 2.
Термогравиметрическая зависимость изменения относительной массы (ТГ) и основные ионные токи в масс-спектре (MC) газообразных продуктов разложения для образца I (приведены массовые числа соответствующих ионных токов).

Согласно данным термического анализа, соединение II устойчиво в широком диапазоне температур – до 460°C. В температурном диапазоне 460–520°C происходит резкая потеря массы, составляющая 55.93 мас. % от исходной массы, что хорошо соответствует образованию CoF2 (теоретическая потеря массы 55.91%), причем появление молекул воды не наблюдается. Данные порошковой рентгеновской дифракции образца после термического анализа подтверждает образование фторида кобальта CoF2. Таким образом, при температуре выше 460°C соединение II разлагается с образованием CoF2 (рис. 3) [16].
Рис. 3.
Сравнение рентгенограммы кристаллического продукта разложения образца II с теоретической рентгенограммой CoF2 (штрих-диаграмма) [16]).

Рентгенограмма полученного образца II показана на рис. 4. Все рефлексы на рентгенограмме проиндицированы в гексагональной сингонии с параметрами a = 4.9996(1), c = 31.3137(8) Å. Систематические погасания рефлексов (hkl: –h + k + l = = 3n) соответствуют пр. гр. R$\bar {3}$, характерной для безводных трифлатов двухзарядных катионов M(CF3SO3)2, где M = Mg, Ca, Zn [6]. Следует отметить, что соединение II крайне гигроскопично: даже незначительный по продолжительности контакт образца II с воздухом приводил к появлению примеси кристаллогидрата I.
Рис. 4.
Участок рентгенограмм образца II (излучение CoKα). Верхняя рентгенограмма получена при более длительном дифракционном эксперименте. Знаком * отмечен рефлекс примеси I. Индексы рефлексов соответствуют гексагональной ячейке с параметрами: a = 4.9996(1), c = 31.3137(8) Å.

Структура I (рис. 5) состоит из слоев, образованных октаэдрами [Co(H2O)6] и трифлатными группами (СF3SO3), расположенными вдоль направления [001]. В октаэдрах присутствует шесть равных контактов Co–O, связывающих атом кобальта с атомами кислорода молекул воды. Формирование слоев происходит за счет водородных связей, образованных атомами водорода молекул воды и атомами кислорода трифлатной группы (Ow–H 0.87(5), H…O 1.98(5), Ow…O 2.817(4) Å, ∠Ow–H…O 161°).
В слоях, параллельных плоскости (001), октаэдры [Co(H2O)6] расположены по мотиву правильной треугольной сетки (рис. 6а). Группы CF3 направлены в межслоевое пространство, так, что минимальное расстояние в плоскости (001) между атомами фтора из соседних слоев составляет 3.045 Å.
Рис. 6.
Экспериментальная (а), расчетная (б) и разностная (в) рентгенограммы, полученные в результате уточнения структуры II методом Ритвельда. Область (выделено серым), соответствующая примеси I, образующейся при увеличении времени дифракционного эксперимента, была исключена из уточнения.

Структура II определена методом Ритвельда по данным порошковой рентгеновской дифракции с использованием структуры Zn(CF3SO3)2 [6] в качестве исходной модели. Кристаллографические данные и параметры порошкового дифракционного эксперимента II представлены в табл. 3, значения основных межатомных расстояний – в табл. 2. Экспериментальная, расчетная и разностная рентгенограммы показаны на рис. 6.
Таблица 3.
Кристаллографические данные и основные параметры порошкового рентгеновского эксперимента для II
| Параметр | Значение |
|---|---|
| Брутто-формула | C2O6F6S2Co |
| М | 357.1 |
| Пр. группа | R$\bar {3}$ (№ 148) |
| a, Å | 4.9996(1) |
| c, Å | 31.3137(8) |
| V, Å3 | 677.86(3) |
| Z | 3 |
| ρ(выч.), г см−3 | 2.62 |
| Излучение (λ, Å) | CoKα/1.79028 |
| Интервал 2θ, град | 8.440–100.005 |
| T, K | 295 |
| μ, cм–1 | 12.89 |
| Число точек | 18313 |
| Число наблюдаемых рефлексов | 105 |
| Число уточняемых параметров | 31 |
| RI, Rexp | 0.0603, 0.0179 |
| Rp, Rwp | 0.022, 0.030 |
| GОF | 1.66 |
Следует отметить, что в [6] решение структур соединений M(CF3SO3)2, где M = Mg, Ca, Zn, проводили с использованием данных синхротронной порошковой рентгеновской дифракции. При этом в структурную модель вводили разупорядочение атомов O и F по трем позициям с постоянной заселенностью 0.333, расположенным на расстояниях менее 0.05 Å друг от друга. В данной работе использована структурная модель с одной кристаллографически независимой позицией O и одной позицией F. Атом O входит в первую координационную сферу кобальта, что делает маловероятным его разупорядочение. Ситуация с возможным разупорядочением CF3-групп гораздо сложнее. Если в структуре I данные группы соседних слоев располагаются в одной плоскости, что создает стерические затруднения для их свободного вращения, то в структуре II CF3-группы разделены полостью (ширину которой можно оценить, как 2.71 Å), что допускает возможность свободного вращения. Подобное вращение известно даже для более крупных фрагментов молекул, таких как метилированный циклопентадиенил [17]. Наиболее вероятно, что существует несколько предпочтительных положений CF3-групп в структуре Co(CF3SO3)2, но определить их с использованием лабораторных порошковых дифракционных данных не представляется возможным, поэтому в данной работе мы ограничились структурной моделью с одной независимой позицией атома F.
Дегидратация I с образованием II сопровождается сохранением слоистой структуры за счет связывания октаэдров [CoO6] µ3-(CF3SO3)-группами (рис. 7). При этом сохраняется треугольный мотив расположения катионов Co2+.
В структуре II по сравнению с I наблюдается закономерное незначительное сокращение расстояния Co–O (табл. 2) при существенном (от ~7.4 до ~5 Å) сокращении расстояния между соседними [CoO6]/(CF3SO3)-группами в слое. Это приводит к смещению слоев друг относительно друга вдоль направления [001] на (1/3, 1/3, 0) и утроению с-параметра. В структуре II CF3-группы разделены полостью, в то время как в I атомы F соседних слоев находятся практически в одной плоскости.
Поведение температурных зависимостей магнитной восприимчивости (χ(T)) I и II (рис. 8) может быть описано законом Кюри–Вейса $\chi = {{\chi }_{0}} + \frac{{{{C}_{{CW}}}}}{{T - \Theta }}$ в широком интервале температур 15‒300 K для I и 90‒300 К для II. Температурные зависимости χ(T) (рис. 8а) для I и II измерены в поле B = 0.1 Тл. Показаны зависимости обратной восприимчивости 1/(χ – χ0) (рис. 8а, вставка), демонстрирующие линейное поведение при высоких температурах согласно закону Кюри–Вейса и отклонение от линейности при низких, что может говорить о вкладе эффектов спин-орбитального взаимодействия ионов кобальта и эффектов кристаллического поля. Зависимости M(B) для I и II, измеренные при температурах 2 и 300 К, представлены на рис. 8б.
Рис. 8.
Температурные зависимости магнитной восприимчивости χ(T) для I (голубой) и II (красный), измеренные в режиме охлаждения в поле (FC) B = 0.1 Tл (на вставке приведены зависимости обратной восприимчивости (χ – χ0)−1(T)) (а); полевые зависимости намагниченности для I и II, измеренные при температурах 2 и 300 К (черными линиями показана аппроксимация экспериментальных кривых функцией Бриллюэна) (б).
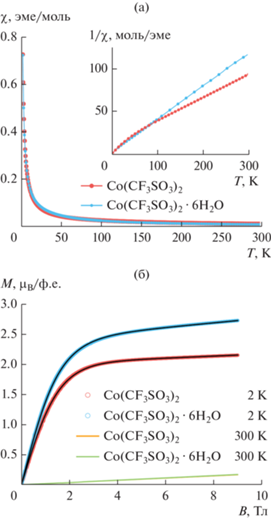
Признаков магнитного упорядочения для трифлатов кобальта при низких температурах не наблюдается. Качественно полученные данные χ(T) и M(B) для обоих образцов соответствуют парамагнитному поведению на всем исследуемом диапазоне температур 2‒300 К со значительным вкладом спин-орбитального взаимодействия в магнитные свойства. Низкотемпературные зависимости M(B) были описаны суммой функции Бриллюэна и линейного вклада, предположительно соответствующего парамагнетизму ван Флека [18]:
Для соединения I оптимальное значение g-фактора составило 3.32, значение полного углового момента (J) ‒ 0.72 при 2 К. Для безводной соли II g‑фактор равен 3.84, а J близок к теоретическому, равному 1/2. Такие высокие значения g-фактора соответствуют литературным данным для Co2+ в октаэдрическом окружении [19]. Близость полного углового момента к J = 1/2, отличающегося от чисто спинового значения S = 3/2, также хорошо известна для соединений кобальта.
Отклонение от закона Кюри‒Вейса может быть связано с вкладом обменных взаимодействий ближнего порядка, спин-орбитальным взаимодействием или вкладом дефектов/примесей. Отрицательное значение константы Вейса θ ≈ ‒5.6 К для I и θ ≈ ‒54 К для II говорит о преобладании антиферромагнитного обменного взаимодействия в магнитной подсистеме. Константа Кюри CCW ≈ ≈ 2.53 эме/(моль K) для I и CCW ≈ 3.96 эме/(моль K) для II дает оценку эффективного магнитного момента (μэфф), равного 4.5 и 5.6 μB соответственно. Эти величины существенно превышают теоретическое чисто спиновое значение для высокоспинового Co2+ с S = 3/2 (${{\mu }_{{{\text{эфф}}}}} = 2\sqrt {S(S + 1)} = 3.87\,\,{{\mu }_{{\text{B}}}}$). Это свидетельствует о значительном вкладе спин-орбитального взаимодействия в магнитный момент, что соответствует данным полевых зависимостей M(B). Сравнение с данными, представленными в [5], демонстрирует сходство полученных значений. Для гидрата значение μэфф несколько выше и составляет 4.87 μB, что может быть связано с наличием примесей или с тем, что данная характеристика представлена для соединения другого состава Co(CF3SO3)2 · 7H2O. Для безводной соли значение магнитного момента несколько ниже, чем определено нами, и составляет 5.31 μB, что может быть связано с наличием примеси кристаллогидрата.
Полученные нами данные для I, в том числе и количественно, показывают сходство с известными молекулярными магнетиками на основе ионов Co(II) в октаэдрическом окружении лигандов. Сходное поведение χ(T) и M(B) наблюдалось для квадратной магнитной 2D-решетки Co(II) [20], для молекулярных кластеров на основе Co(II) различной величины [21], для треугольной магнитной 2D-подрешетки Co(OH)2 [22], а также соответствует теоретическим представлениям о поведении молекулярных магнетиков на основе Co(II) [23]. В то же время сравнительно большое значение температуры Вейса θ = ‒54 К для II говорит о наличии достаточно сильного магнитного обменного взаимодействия между ионами кобальта, которое можно грубо оценить по формуле ∑J ≈ 3θ/(S(S + 1)) ≈ ‒43 K. Отсутствие признаков магнитного упорядочения вплоть до низких температур (2К), а также треугольный мотив ионов кобальта в структуре, указывают на то, что в данном соединении сильный вклад в магнитные свойства может вносить фрустрация обменных взаимодействий. Однако следует помнить, что подобную картину может давать сильный вклад спин-орбитального взаимодействия, искажая полученные значения температуры Вейса. Для более точного описания магнитной подсистемы трифлатов кобальта потребуется провести первопринципные расчеты его магнитной подсистемы с учетом спин-орбитального взаимодействия.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Su T.M., Sliwinski W.F., Schleyer P.V.R. // J. Am. Chem. Soc. 1969. V. 91. № 19. P. 5386.
Васильев А.Н., Волкова О.С., Зверева Е.А. и др. Низкоразмерный магнетизм. М.: Физматлит. 2018. 297 с.
Kaduk J.A. // Powder Diffr. 1999. V. 14. № 3. P. 166.
Сидоров А.А., Решетников А.В., Деомидов С.М. и др. // Журн. неорган. химии. 2000. Т. 45. С. 793.
Jansky M.T., Yoke J.T. // J. Inorg. Nucl. Chem. 1979. V. 41. № 12. P. 1707.
Dinnebier R., Sofina N., Hildebrandt L. et al. // Acta Crystallogr. B. 2006. V. 62. № 3. P. 467.
Boumizane K., Herzog-Cance M.H., Jones D.J. et al. // Polyhedron. 1991. V. 10. № 23–24. P. 2757.
Socrates G. Infrared and Raman Characteristic Group Frequencies: Tables and Charts. Chichester (England): John Wiley & Sons. 2004. 347 p.
ICDD PDF-2+ (Database). International Centre for Diffraction Data: Newtown Square (PA, USA), 1998.
WinXPOW D.S. Version 2.21. Stoe & Cie GmbH. Darmstadt (Germany), 2007.
Petříček V., Dušek M., Palatinus L. // Z. Kristallogr. Cryst. Mater. 2014. B. 229. № 5. S. 345.
Farrugia L.J. // J. Appl. Crystallogr. 1999. V. 32. P. 837.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Arduini A.L., Garnett M., Thompson R.C. et al. // Canad. J. Chem. 1975. V. 53. № 24. P. 3812.
ICDD PDF-2 (Database). International Centre for Diffraction Data: Newtown Square (PA, USA). № 00-024-0329, 071-0653, 081-2033.
Kudinov A.R., Muratov D.V., Rybinskaya M.I. et al. // J. Organometallic Chem. 1991. V. 414. P. 97.
Blundell S. Magnetism in Condensed Matter: Oxford Master Series in Physics. Oxford University Press, 2001. P. 29.
Piwowarska D., Gnutek P., Rudowicz C. // Appl. Magn. Reson. 2019. V. 50. P. 797.
Tiwari A., Bhosle V.M., Ramachandran S. et al. // Appl. Phys. Lett. 2006. V. 88. № 14. P. 142511.
Murrie M. // Chem. Soc. Rev. 2010. V. 39. № 6. P. 1986.
Li J.R., Yu Q., Tao Y. et al. // Chem. Commun. 2007. № 22. P. 2290.
Lloret F., Julve M., Cano J. et al. // Inorg. Chim. Acta. 2008. V. 361. № 12–13. P. 3432.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия




