Координационная химия, 2022, T. 48, № 12, стр. 745-751
Гидротермальный синтез и кристаллическая структура [{Ag3(Bipy)3(CN)}2Re6Se8(CN)6]
А. В. Ермолаев 1, *, Ю. В. Миронов 1
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
* E-mail: ermolaev@niic.nsc.ru
Поступила в редакцию 06.05.2022
После доработки 10.06.2022
Принята к публикации 23.06.2022
- EDN: LHAVKH
- DOI: 10.31857/S0132344X22600175
Аннотация
Супрамолекулярный ансамбль [{Ag3(Bipy)3(CN)}2Re6Se8(CN)6] (I) получен реакцией Cs2.75K1.25[Re6Se8(CN)4(OH)2] · H2O с K[Ag(CN)2] и 2,2'-бипиридином (Bipy) в условиях гидротермального синтеза. Кристаллическая структура состоит из полимерных слоев [{Ag3(Bipy)3- (CN)}2Re6Se8(CN)6]. Внутри слоя каждое кластерное ядро {Re6Se8}2+ соединено с шестью атомами Ag через CN-мостик. Завершают формирование слоя аргентофильные взаимодействия Ag···Ag 2.9035(6)–2.9697(5) Å. Наблюдаются π–π-стекинг-взаимодействия как внутри слоя, так и между полимерными слоями. Полученное соединение охарактеризовано методами РСА (CCDC № 2170365), ИК и элементного анализа.
Среди множества известных разнообразных кластерных соединений рения наиболее представительными являются октаэдрические кластерные халькоцианидные комплексы [Re6Q8(CN)6]4– (Q = S, Se, Te) [1–9]. В результате развития химии кластеров рения данный ряд соединений был дополнен смешанолигандными кластерными анионами транс-[Re6Q8(CN)6 –n(OH)n]4– (Q = S, n = 2, 4 [10, 11]; Q = Se, n = 2 [12]). Подобные соединения интересны тем, что включают в состав как относительно лабильные лиганды OH–, которые можно заместить на неорганические или органические [10, 11], так и амбидентатные лиганды CN–, способные формировать полимерные соединения с переходными металлами различной размерности за счет мостиков –CN–M–CN– [13]. В то же время встречающиеся у одновалентных монетных металлов взаимодействия металл–металл можно рассматривать как способ увеличения размерности или обогащения супрамолекулярной топологии [14–16]. Такие взаимодействия обладают прочностью, сравнимой с прочностью водородных связей, что дает возможности для укрепления желаемых каркасов [17, 18]. Эти взаимодействия (для серебра обычно называемые аргентофильными взаимодействиями) встречаются во многих многоядерных комплексах Ag(I) [19–22]. Широкое использование Ag(I) обусловлено его высоким сродством к лигандам-донорам наряду с гибким координационным числом и геометрией [23–25]. Недавно нами были получены первые примеры соединений на основе анионных октаэдрических кластерных халькогенидных комплексов рения и одновалентных комплексных катионов переходных металлов (Cu+ и Ag+) [26–31].
В настоящей работе в продолжение этих исследований изучено взаимодействие Cs2.75K1.25-[Re6Se8(CN)4(OH)2] · H2O с K[Ag(CN)2] и Bipy.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходную кластерную соль Cs2.75K1.25-[Re6Se8(CN)4(OH)2] · H2O получали по ранее описанной методике [10]; остальные реагенты коммерческие (чистота 99.5+%). Порошковые дифрактограммы регистрировали в интервалах углов 2θ 5°–60° на автоматическом дифрактометре Philips PW 1700 (CuKα-излучение, λ = 1.54056 Å, графитовый монохроматор, внутренний кремниевый стандарт). Соотношение тяжелых элементов определяли методом энергодисперсионного рентгеновского анализа (EDAX) с помощью анализатора химического состава Bruker QUANTAX 70 на настольном сканирующем электронном микроскопе Hitachi TM3000. ИК-спектры в диапазоне 4000–400 см–1 записывали для образцов в виде таблеток с KBr на Фурье-спектрометре Bruker Vertex 80. Элементный анализ на C, H, N проводили на приборе Euro EA 3000 analyzer.
Синтез [{Ag3(Bipy)3(CN)}2Re6Se8(CN)6] I. Запаянную стеклянную ампулу, заполненную смесью 50.0 мг Cs2.75K1.25[Re6Se8(CN)4(OH)2] · H2O (0.022 ммоль), 25.7 мг K[Ag(CN)2] (0.129 ммоль), 20.2 мг 2,2'-бипиридила (0.129 ммоль) и 0.5 мл дистиллированной воды, нагревали до 150°С, выдерживали 48 ч, затем охлаждали в течение 12 ч. Выделенный продукт представлял собой оранжевые ромбовидные кристаллы. Выход 61.1 мг (80%). EDAX показал соотношение элементов в образце Ag : Re : Se = 5.81 : 6 : 7.89.
ИК-спектр (ν, см–1): 3086 сл, 3074 сл, 3059 сл, 3032 сл, 2124 с, 2077 с, 1589 с, 1576 с, 1564 с, 1483 cр), 1469 с, 1435 с, 1311 ср, 1279 ср, 1244 ср, 1213 сл, 1151 ср, 1097 сл, 1055 сл, 1039 пл, 977 сл, 895 сл, 758 с, 735 с, 650 ср, 619 ср.
РСА монокристалa I проведен на дифрактометре Bruker D8 Venture, оснащенном CMOS PHOTON III детектором и источником IµS 3.0 (фокусирующие зеркала Монтеля, MoKα-излучение, λ = 0.71073 Å) при 150(2) K. Поглощение учтено эмпирически по интенсивностям эквивалентных отражений (SADABS) [32]. Кристаллическая структура расшифрована прямым методом. Положения атомов водорода молекул Bipy рассчитаны геометрически и уточнены по модели “наездника”. Окончательное уточнение проведено полноматричным МНК в анизотропном приближении для всех неводородных атомов. Все расчеты выполнены по комплексу программ SHELX-2018/3 [33], рисунки – в программе DIAMOND [34]. Кристаллографические данные, детали экспериментов и уточнения приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структуры I
| Параметр | Значение |
|---|---|
| Брутто-формула | C68H48N20Se8Ag6Re6 |
| М | 3541.36 |
| Сингония | Триклинная |
| Пр. гр. | $P\bar {1}$ |
| a, Å | 13.8161(3) |
| b, Å | 14.3229(3) |
| c, Å | 19.0861(4) |
| α, град | 86.955(1) |
| β, град | 84.297(1) |
| γ, град | 88.279(1) |
| V, Å3 | 3751.7(2) |
| Z | 2 |
| ρ(выч.), г см–3 | 3.135 |
| µ(MoKα), мм–1 | 15.099 |
| Размер кристалла, мм | 0.10 × 0.08 × 0.04 |
| Область сбора данных θ, град | 2.375–36.293 |
| Диапазоны h, k, l | –23 ≤ h ≤ 23, –23 ≤ k ≤ 23, –31 ≤ l ≤ 31 |
| Число измеренных отражений | 93 083 |
| Число независимых отражений (Rint) | 36 205 (0.0475) |
| Число наблюдаемых отражений (I > 2σ(I)) | 27915 |
| Число уточняемых параметров | 219 |
| F(000) | 3200 |
| R (F 2 > 2σ(F 2)) | R1 = 0.0361 wR2 = 0.0721 |
| R (F 2 по всем отражениям) | R1 = 0.0548 wR2 = 0.0861 |
| GOOF | 1.024 |
| Δρmax/Δρmin, e Å–3 | 2.615/–2.185 |
Координаты атомов и величины тепловых параметров депонированы в Кембриджском банке структурных данных (CCDC 2170365; https:// www.ccdc.cam.ac.uk/structures/) и могут быть получены у авторов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящей работе исследовано взаимодействие анионного октаэдрического кластерного комплекса рения [Re6Se8(CN)4(OH)2]4– с K[Ag(CN)2] и 2,2'-бипиридином (Bipy). Методики синтеза, использованные нами при изучении реакций октаэдрических кластерных комплексов рения, например с Ni2+ [35–37], в данном случае привели к получению рентгеноаморфного порошка. Недавно реакцией с участием Cs2.75K1.25[Re6Se8(CN)4(OH)2] · H2O с AgCN и Bipy в гидротермальных условиях синтезировано (и охарактеризовано) соединение [{Ag(Bipy)}{Ag4(Bipy)4(μ-CN)}{Re6Se8(CN)6}], представляющее собой трехмерный каркас, построенный из кластерных анионов [Re6Se8(CN)6]4– и двух различных типов Ag(I)-содержащих катионов, моноядерного {Ag(Bipy)}+ и четырехъядерного {Ag4(Bipy)4(μ-CN)}3+, все из которых связаны между собой цианидными мостиками [27]. Супрамолекулярная структура поддерживается аргентофильными взаимодействиями Ag···Ag, но неожиданно демонстрирует очень ограниченное π–π-стекинг-взаимодействие пиридиновых колец. Гидротермальный синтез с использованием K[Ag(CN)2] вместо AgCN в аналогичных условиях приводит к получению соединения I. Процедура этого метода состоит в следующем: стеклянную ампулу заполняют реагентами и запаивают, затем нагревают и выдерживают при заданной температуре.
В ИК-спектре соединения I преобладают полосы поглощения характерные для хелатных лигандов Bipy. Относительно слабые полосы поглощения 3086, 3074, 3059, 3032, 1483, 1469, 1435 см–1 обусловлены колебаниями С–Н с участием ароматических атомов водорода. Полосы поглощения переменной интенсивности около 1589, 1576, 1564, 1244, 1151, 894, 650 см–1 соответствуют колебаниям ароматических колец лигандов Bipy. Полосы колебаний между 1213 и 977 см–1 указывают на присутствие Bipy. Кроме того, полосы в области 758–619 см–1 можно рассматривать как характерные колебания координированных лигандов Bipy. Очень сильная полоса при 2124 см–1 относится к частотам валентных колебаний мостикового (Ag–CN–Re) лиганда CN–. К валентным колебаниям координированного к атому Ag лиганда CN– относится очень сильная полоса при 2077 см–1 [38].
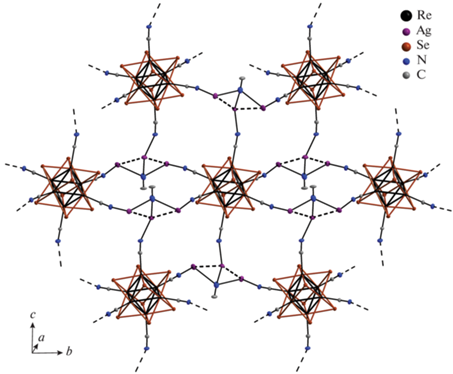
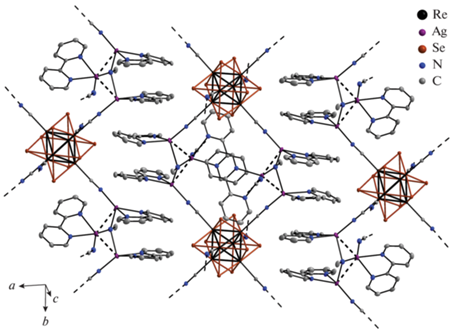
Соединение I кристаллизуется в пр. гр. $P\bar {1}$ (триклинная сингония). В независимой части элементарной ячейки содержится два фрагмента слоистого координационного полимера [{Ag3(Bi-py)3(CN)}2Re6Se8(CN)6]. Координационный полимер формируется из кластерного аниона [Re6Se8(CN)6]4– (рис. 1) и мостиковых катионных комплексов {Ag3(Bipy)3(CN)}2+ (рис. 2). Пространственное строение кластерного аниона в I аналогично тому, что и в других родственных комплексах [10, 27, 39]. Aтомы рения образуют октаэдр, атомы селена координированы к его граням по μ3-типу, при этом каждый атом рения дополнительно координирован лигандом CN– через атом углерода. Значение длин связей в кластерном ядре сравнимы с данными для других комплексов, содержащих кластерное ядро [Re6Se8(CN)6]4– (табл. 2). В структуре есть два кристаллографически независимых мостиковых катионных комплекса {Ag3(Bipy)3(CN)}2+. В данном катионном комплексе к каждому атому Ag хелатно координирован лиганд Bipy. Кроме этого, каждый атом Ag соединен с кластерным ядром CN– мостиком. Свой вклад в общую структурную стабилизацию обсуждаемого фрагмента вносят аргентофильные взаимодействия Ag–Ag (2.9035(6), 2.9233(5), 2.9312(6), 2.9697(5) Å), которые объединяют три атома Ag в цепь, формирующую полимерный слой (рис. 3). Значения длин связей хорошо согласуются с удвоенным эмпирическим ковалентным радиусом атома Ag (3.06 Å) и лишь ненамного превышают расстояние между атомами в металлическом серебре (2.886 Å). Углы AgAgAg равны 97.248(15)° и 97.341(15)°. Между этими тремя атомами Ag находится терминальный лиганд CN–. Кратчайшие расстояния Ag–NCN равны 2.118(5) и 2.150(5) Å, расстояния от крайних атомов Ag до NCN равны 2.465(5)–2.591(5) Å. В структуре наблюдаются π–π-стекинг взаимодействия как внутри катионного фрагмента, так и между соседними ближайшими катионными фрагментами внутри полимерного слоя и между слоями (рис. 4). Расстояние между центрами ароматических колец внутри катионного фрагмента несколько длиннее (4.121–4.211 Å), чем между слоями (3.710–3.842 Å). Вместе они образуют практически прямую линию вдоль оси b. Расстояние между центрами ароматических колец ближайших катионных фрагментов внутри слоя 3.654 Å. Таким образом, за счет π–π-стекинг-взаимодействий формируется супрамолекулярный ансамбль, состоящий из полимерных слоев, перпендикулярных оси a. Структура является плотноупакованной.
Рис. 1.
Строение кластерного аниона [Re6Se8(CN)6]4–. Приведены тепловые эллипсоиды с 50%-ной вероятностью.
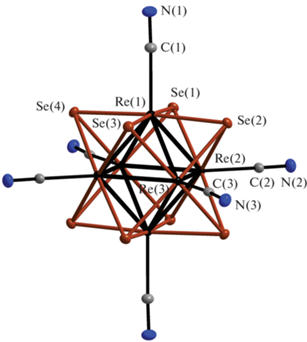
Рис. 2.
Строение мостиковых катионных комплексов {Ag3(Bipy)3(CN)}2+. Приведены тепловые эллипсоиды с 50%-ной вероятностью.
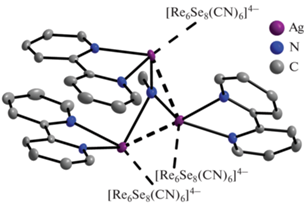
Таблица 2.
Основные геометрические характеристики в комплексе I и некоторых известных соединениях
| Соединение | d, Å | |||
|---|---|---|---|---|
| Re–Re | Re–(µ3-Q) | Re–C | Ag/Cu–N | |
| I | 2.6281(2)– 2.6421(2) | 2.5076(4)– 2.5299(5) | 2.100(4)– 2.123(4) | 2.118(5)– 2.591(5) |
| Cs2.75K1.25[Re6Se8(CN)4(OH)2] · H2O [10] | 2.6160(2)– 2.6239(2) | 2.518(2)– 2.532(2) | 2.01(2)– 2.05(2) | |
| K4[Re6Se8(CN)6] · 3.5H2O [39] | 2.624(1)– 2.642(1) | 2.516(1)– 2.538(1) | 2.09(2)– 2.12(2) | |
| [{Cu(Bipy)(μ-CN)Cu(Bipy)}2{Cu(Bipy)}2Re6Se8(CN)6] [26] | 2.6306(2)– 2.6420(2) | 2.5107(4)– 2.5385(4) | 2.106(4)– 2.110(4) | 1.844(4)– 2.118(4) |
| [{Ag(Bipy)}{Ag4(Bipy)4(μ-CN)}Re6Se8(CN)6}] [27] | 2.6285(4)– 2.6386(4) | 2.5171(7)– 2.5309(7) | 2.096(6)– 2.118(7) | 2.111(7)– 2.577(5) |
Рис. 4.
Фрагмент супрамолекулярного ансамбля [{Ag3(Вipy)3(CN)}2Re6Se8(CN)6]. Атомы водорода не показаны для ясности.
Таким образом, в результате взаимодействия Cs2.75K1.25[Re6Se8(CN)4(OH)2] · H2O c K[Ag(CN)2] и Bipy в условиях гидротермального синтеза происходит замещение лигандов OH– на CN–, формирование катионных фрагментов и образование соединения [{Ag3(Bipy)3(CN)}2Re6Se8(CN)6], представляющего собой супрамолекулярный ансамбль, в котором аргентофильные взаимодействия формируют полимерный слой, а π–π-стекинг- взаимодействия связывают ближайшие слои между собой. Оказалось, что замена источника Ag(I) с полимерного AgCN на анионный комплекс [Ag(CN)2]– приводит к кардинальной разнице продуктов реакции с октаэдрическим кластерным комплексом рения.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Bennett M.V., Beauvais L.G., Shores M.P. et al. // J. Am. Chem. Soc. 2001. V. 123 P. 8022. https://doi.org/10.1021/ja0110473
Baudron S.A., Deluzet A., Boubekeur K. et al. // Chem. Commun. 2002. P. 2124. https://doi.org/10.1039/b205241e
Park S.-M., Kim Y., Kim S.-J. // Eur. J. Inorg. Chem. 2003. P. 4117. https://doi.org/10.1002/ejic.200300255
Baudron S.A., Batail P., Coulon C. et al. // J. Am. Chem. Soc. 2005. V. 127. P. 11785. https://doi.org/10.1021/ja0523385
Ranganathan A., El-Ghayoury A., Meziere C. et al. // Chem. Commun. 2006. P. 2878. https://doi.org/10.1039/b600159a
Xu L., Kim Y., Kim S.-J. et al. // Inorg. Chem. Commun. 2007. V. 10. P. 586. https://doi.org/10.1016/j.inoche.2007.02.005
Carlsson S., Zorina L., Allan D.R. et al. // Inorg. Chem. 2013. V. 52. P. 3326. https://doi.org/10.1021/ic302790m
Fedorov V.E., Naumov N.G. // Struct. Bond. 2019. V. 180. P. 31. https://doi.org/10.1007/430_2019_33
Агафонов М.А., Александров Е.В., Артюхова Н.А. и др. // Журн. структур. химии. 2022. Т. 63. С. 535. https://doi.org/10.26902/JSC_id93211
Naumov N.G., Ledneva A.Y., Kim S.J. et al. // J. Cluster Sci. 2009. V. 20. P. 225. https://doi.org/10.1007/s10876-009-0233-x
Mironov Y.V., Brylev K.A., Kim S.-J. et al. // Inorg. Chim. Acta. 2011. V. 370. P. 363. https://doi.org/10.1016/j.ica.2011.01.110
Mironov Y.V., Brylev K.A., Smolentsev A.I. et al. // Rsc Adv. 2014. V. 4. P. 60808. https://doi.org/10.1039/c4ra10697k
Ермолаев А.В., Смоленцев А.И., Миронов Ю.В. // Коорд. химия. 2014. Т. 40. С. 487 (Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // Russ. J. Coord. Chem. 2014. V. 40. P. 558). https://doi.org/10.1134/s1070328414080028
Liu X., Guo G.C., Fu M.L. et al. // Inorg. Chem. 2006. V. 45. P. 3679. https://doi.org/10.1021/ic0601539
Etaiw S.E.H., El-Bendary M.M. // Inorg. Chim. Acta. 2015. V. 435. P. 167. https://doi.org/10.1016/j.ica.2015.06.020
Zheng R., Zhang H.X., Liu Y.P. et al. // J. Solid State Chem. 2017. V. 246. P. 258. https://doi.org/10.1016/j.jssc.2016.11.037
Yuan L., Qin C., Wang X. et al. // Dalton Trans. 2009. № 21. P. 4169. https://doi.org/10.1039/b818535b
Zhao X., Sun X., Han Z. et al. // J. Solid State Chem. 2013. V. 207. P. 178. https://doi.org/10.1016/j.jssc.2013.09.023
Dai L.M., You W.S., Wang E.B. et al. // Cryst. Growth Des. 2009. V. 9. P. 2110. https://doi.org/10.1021/cg8006734
Lin Y.M., Guan Z.J., Liu K.G. et al. // Dalton Trans. 2015. V. 44. P. 2439. https://doi.org/10.1039/c4dt03394a
Hau S.C.K., Mak T.C.W. // J. Organomet. Chem. 2015. V. 792. P. 123. https://doi.org/10.1016/j.jorganchem.2015.03.013
Gao X.M., Bigdeli F., Wang H.H. et al. // Polyhedron. 2021. V. 194. P. 114940. https://doi.org/10.1016/j.poly.2020.114940
Dawn S., Salpage S.R., Smith M.D. et al. // Inorg. Chem. Commun. 2012. V. 15. P. 88. https://doi.org/10.1016/j.inoche.2011.09.045
Banerjee K., Roy S., Biradha K. // Cryst. Growth Des. 2014. V. 14. P. 5164. https://doi.org/10.1021/cg500898c
Emashova S.K., Titov A.A., Filippov O.A. et al. // Eur. J. Inorg. Chem. 2019. V. 2019. P. 4855. https://doi.org/10.1002/ejic.201901050
Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // Polyhedron. 2015. V. 102. P. 417. https://doi.org/10.1016/j.poly.2015.10.024
Ermolaev A.V., Smolentsev A.I., Brylev K.A. et al. // J. Mol. Struct. 2018. V. 1173. P. 627. https://doi.org/10.1016/j.molstruc.2018.07.028
Ермолаев А.В., Смоленцев А.И., Миронов Ю.В. // Журн. структур. химии. 2021. Т. 62. С. 626 (Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // J. Struct. Chem. 2021. V. 62. P. 585). https://doi.org/10.1134/s0022476621040107
Ермолаев А.В., Смоленцев А.И., Миронов Ю.В. // Журн. структур. химии. 2021. Т. 62. С. 1754 (Ermolaev A.V., Smolentsev A.I. Mironov Y.V. // J. Struct. Chem. 2021. V. 62. P. 1648). https://doi.org/10.1134/s002247662110019x
Ермолаев А.В., Смоленцев А.И., Миронов Ю.В. // Коорд. химия. 2021. Т. 47. С. 424 (Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // Russ. J. Coord. Chem. 2021. V. 47. P. 473). https://doi.org/10.1134/s1070328421070022
Ермолаев А.В., Смоленцев А.И., Миронов Ю.В. // Журн. структур. химии. 2022. Т. 63. С. 36 (Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // J. Struct. Chem. 2022. V. 63. P. 75). https://doi.org/10.1134/s0022476622010085
APEX2 (version 1.08), SAINT (version 7.03), SADABS (version 2.11). Madison (WI, USA): Bruker Advanced X-ray Solutions, 2004.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/s2053229614024218
DIAMOND (version 3.2a). Bonn (Germany): Crystal Impact GbR, 2009.
Ермолаев А.В., Смоленцев А.И., Миронов Ю.В. // Журн. структур. химии. 2011. Т. 52. С. 1161 (Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // J. Struct. Chem. 2011. V. 52. P. 1124). https://doi.org/10.1134/s0022476611060151
Smolentsev A.I., Ermolaev A.V., Mironov Y.V. // J. Mol. Struct. 2012. V. 1014. P. 57. https://doi.org/10.1016/j.molstruc.2012.02.005
Ермолаев А.В., Смоленцев А.И., Миронов Ю.В. // Коорд. химия. 2016. Т. 42. С. 700 (Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // Russ. J. Coord. Chem. 2016. V. 42. P. 730). https://doi.org/10.1134/s1070328416110026
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. John Wiley & Sons, Inc., 2008. P. 1.
Наумов Н.Г., Вировец А.В., Подберезская Н.В. // Журн. структур. химии. 1997. Т. 38. С. 1018 (Nau-mov N.G., Virovets A.V., Podberezskaya N.V. et al. // J. Struct. Chem. 1997. V. 38. P. 857). https://doi.org/10.1007/bf02763902
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия