Координационная химия, 2022, T. 48, № 12, стр. 739-744
Антиканцерогенные свойства комплексов Au(III)
И. А. Луценко 1, *, О. В. Лосева 2, А. В. Иванов 2, И. А. Мальянц 3, В. О. Шендер 3, М. А. Кискин 1, И. Л. Еременко 1, 4
1 Институт общей и неорганической химии им. Н.С. Курнакова PAH
Москва, Россия
2 Институт геологии и природопользования ДВО РАН
Благовещенск, Россия
3 Федеральный научно-клинический центр физико-химической медицины ФМБА
Москва, Россия
4 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: irinalu05@rambler.ru
Поступила в редакцию 26.05.2022
После доработки 13.06.2022
Принята к публикации 16.06.2022
- EDN: KERXZA
- DOI: 10.31857/S0132344X22700062
Аннотация
Взаимодействием раствора H[AuCl4] с 1,10-фенантролином (Рhen) в ацетонитриле получен комплекс состава (H2Рhen)[AuCl4]Cl (I). По данным РСА (CCDC № 2165199) в структуре I Рhen представлен необычной дважды протонированной (катионной) формой (H2Рhen)2+. Взаимное объединение ионных структурных единиц ([AuCl4]–, Cl– и (H2Рhen)2+) водородными связями D–H···Cl (D = N, C) приводит к формированию супрамолекулярных 2D-псевдополимерных слоев. Биологическая активность I была измерена в отношении тестовой линии клеток аденокарциномы яичника человека (SKOV3). По данным МТТ-теста вычислена доза полумаксимального ингибирования, показавшая высокую избирательность I по отношению к раковым клеткам, которая сочетается с низкой токсичностью для клеток здоровых фибробластов.
Известно, что в медицинской практике широко используются металлосодержащие препараты, в первую очередь, содержащие платину, которые демонстрируют высокие противораковые свойства. Однако в последние два десятилетия химики, биологи, медики и другие исследователи стали направлять свои усилия на развитие синтетических путей и различного рода биологических исследований “неплатиновых” противоопухолевых агентов на основе биоэссенциальных (жизненно важных) металлов Сu, Zn, Fe, Co и др. [1–7]. Такой поворот в поисковых работах исследователей связан с несколькими причинам, во-первых, с поиском более дешевых препаратов, а во-вторых, с уменьшением токсических свойств лекарств. (Конечно, здесь следует учитывать также технологические проблемы производства, способы выбора и свойства органических лигандов для получения таких соединений.) С другой стороны, в настоящее время становятся актуальными соединения на основе Ru, Ga, Au, обладающие хорошими антипролиферативными (направлены на подавление избыточного размножения клеток) свойствами [8–10]. Золото, в многообразии его форм, используется в медицине на всем протяжении истории цивилизации – от архаичных “эликсира жизни, киновари” [11, 12] до вполне реальных терапевтических средств, например против ревматоидного артрита (тиолаты золота [13, 14]). Но именно в XX веке радиоактивное золото-198 стало применяться в противоопухолевой терапии – оно химически инертно, ингибирует формирование внутриполостной жидкости и имеет относительно короткий период полураспада (2–7 сут) [15]. Изоэлектронное строение Au(III) и Pt(II) (d8), обусловливающее формирование плоско-квадратных комплексов и относительно низкую кинетику лигандного обмена, создает предпосылки для разработки и тестирования комплексов на основе золота в качестве потенциальных противоопухолевых препаратов. Ранее в [16–18] при исследовании комплексов золота(III) с разнообразными N-донорными лигандами было установлено, что эти соединения проявляют стабильность в физиологических условиях, показывая высокую цитотоксическую активность в отношении клеток рака яичника (А2780), а также способны преодолевать явления резистентности. Поэтому целью настоящей работы явился синтез комплекса золота(III) с 1,10-фенантролином (Рhen) (H2Рhen)[AuCl4]Cl (I), установление его структуры и определение биологической активности в отношении клеток аденокарциномы яичника человека (SKOV3) для комплекса I и ранее описанных дитиокарбаматно-хлоридных комплексов золота(III) состава [Au(S2CNR2)Cl2] (R = CH3, iC3H7) [19].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез комплекса проводили на воздухе с использованием дистиллированной воды, 1,10-фенантролина (98%, Acros), ацетонитрила (“ос. ч.”, Химмед), соляной (“х. ч.”, Химмед) и азотной (65%, “х. ч.”, Химмед) кислот.
Элементный анализ выполняли на автоматическом С,H,N-анализаторе Carlo Erba EA 1108. ИК-спектры соединения регистрировали на ИК-спектрофотометре с Фурье-преобразованием Perkin-Elmer Spectrum 65 методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
Синтез (H2Рhen)[AuCl4]Cl (I). Навеску Рhen (0.18 г, 1 ммоль) растворяли в 20 мл MeCN. В полученный раствор добавляли 2 мл AuCl3 (в 2 М HCl), содержащего 22 мг золота и выдерживали при постоянном перемешивании 40 мин (60°C). Раствор отфильтровывали и оставляли испаряться при комнатной температуре. Через сутки образовались кристаллы соломенного цвета, которые отделяли от маточного раствора декантацией и сушили на воздухе. Выход I 0.25 г (76%).
ИК (НПВО; ν, см−1): 3141 сл, 3130 о.сл, 3061 о.сл, 2656 у.сл, 2579 у.сл, 2043 о.сл, 1672 о.с, 1582 ср, 1468 о.с, 1426 ср, 1383 ср, 1365 сл, 1297 о.с, 1235 ср, 1191 о.с, 1143 о.сл, 1125 ср, 1104 сл, 1258 сл, 1076 ср, 1017 о.с, 992 ср, 930 с, 885 сл, 851 сл, 803 о.сл, 753 о.с, 698 ср, 592 ср, 547 ср.
РСА комплекса I проводили при 150 K на дифрактометре Bruker Apex II (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор). Проведен полуэмпирический учет поглощения с помощью программы SADABS [20]. Структура расшифрована с использованием программы ShelXT [21] и уточнена в полноматричном МНК с помощью программы SHELXL-2018/3 [22] в анизотропном приближении для неводородных атомов. Атом водорода при атоме азота локализован из разностных Фурье-синтезов, положения атомов водорода при атомах углерода рассчитаны геометрически. Все они уточнены в изотропном приближении в модели “наездника”. Основные кристаллографические данные и параметры уточнения следующие: C12H10AuCl5N2, M = 556.44 г/моль, моноклинная пространственная группа C2/c, a = 22.1986(13), b = = 9.7043(5), c = 7.1404(5) Å, β = 94.404(2)°, V = = 1533.66(16) Å3, ρ(выч.) = 2.410 г/см3, Z = 4, угол сканирования 2.29° < θ < 30.61°, μ(Mo) = 10.452 мм–1, измерено 9145 отражений, 2057 из которых с I ≥ 2σ, Rint = 0.0386, R1 = 0.0244 и wR2 = 0.0717 по наблюдаемым рефлексам с F > 2σ(F2) и R1 = 0.0285 и wR2 = 0.0754 по всем отражениям, число уточняемых параметров – 96.
Полный набор рентгеноструктурных параметров депонирован в Кембриджском банке структурных данных (CCDC № 2165199; deposit@ccdc.cam.uk).
МТТ-тест. Цитотоксический эффект различных концентраций комплекса I и комплекса состава [Au(S2CNR2)Cl2] на клеточной линии аденокарциномы яичника человека (SKOV3) и первичной культуре дермальных фибробластов человека (HDF) был измерен с помощью MTT-теста. Данный тест основан на измерении активности митохондриального фермента сукцинатдегидрогеназы и широко используется для оценки противоопухолевой активности потенциальных препаратов in vitro. По данным МТТ-теста была вычислена доза полумаксимального ингибирования (IC50) для обоих веществ. Клетки SKOV3 получены из коллекции ATCC, первичная культура HDF была ранее получена от здорового донора. Клетки SKOV3 и HDF культивировались в среде DMEM (10% FBS, 2 mM глутамин, 1% гентамицин). Культивирование клеток осуществлялось в пластиковых флаконах в стерильных условиях, клетки инкубировались при 37°С в условиях 5% СО2.
Стоковые растворы (50 mM) соединений I, [Au{S2CN(СH3)2}Cl2] и [Au{S2CN(iС3H7)2}Cl2] [19] были приготовлены в ДМСО в соответствии с методикой [6]. Конечный объем среды в лунках составлял 100 мкл. Через 48 ч с момента добавления препаратов жизнеспособность клеток измеряли с помощью реагента MTT (Sigma). В лунки с клетками (к 100 мкл среды) добавляли по 10 мкл рабочего раствора MTT (7 мг/мл), инкубировали в течение 3 ч, после чего среду заменяли на раствор ДМСО. С помощью планшетного спектрофотометра (TECAN Infinite M Plex) определяли оптическую плотность каждой лунки при 570 нм с последующим вычитанием фонового поглощения. Значение концентрации, вызывающее 50% ингибирования роста популяции клеток (IC50), определено на основе дозозависимых кривых.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
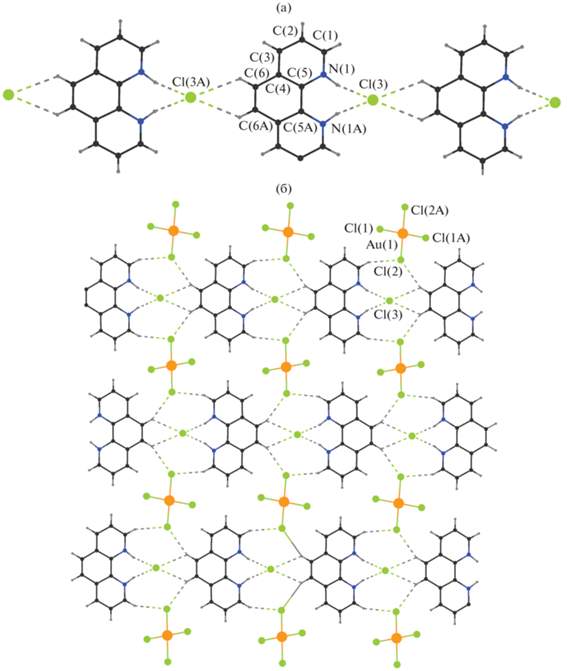
По данным РСА, ионное соединение I, включающее плоско-квадратный анион [AuCl4]‒ (Au‒Cl 2.2800(11), 2.2875(6) Å, ClAuCl 89.63(3)°, 90.37(3)°, 180°), анион хлора и дважды протонированную форму фенантролина (H2Рhen)2+, кристаллизуется в моноклинной пространственной группе C2/c. В кристалле атом Au располагается на центре инверсии, через дискретный атом хлора Cl(3) и катион (H2Рhen)2+ (между парами атомов C(5) и C(5A), C(6) и C(6A)) проходит ось второго порядка. Атомы H при атомах азота N(1) и углерода C(6) катиона (H2Рhen)2+ участвуют в образовании H-связей с атомом Cl(3), формируя бесконечную супрамолекулярную ленту вдоль оси 0b (рис. 1а, основные параметры H-связей приведены в табл. 1). Соседние цепочки связаны в псевдополимерный слой (hkl = 1, 0, ‒1) за счет контактов C‒H…Cl, образуемых двумя диагонально ориентированными атомами хлора Cl(2) аниона [AuCl4]‒ и четырьмя атомами H при атомах углерода в четырех ближайших катионах (H2Рhen)2+ (рис. 1а, табл. 1).
Таблица 1.
Параметры H-контактов в кристалле I
| Тип контакта | Расстояние, Å | D–H…A, град | Преобразование симметрии | ||
|---|---|---|---|---|---|
| D–H | H…A | D…A | |||
| N(1)‒H…Cl(3) | 0.93(4) | 2.11(4) | 3.015(3) | 166(3) | |
| C(1)‒H…Cl(2) | 0.95 | 2.75 | 3.634(4) | 156 | x, 1 – y, 1/2 + z |
| C(6)‒H…Cl(2) | 0.95 | 2.876 | 3.759(4) | 155 | x, 1 – y, 1/2 + z |
| C(6)‒H…Cl(3) | 0.95 | 2.849 | 3.505(4) | 127 | x, –1 + y, z |
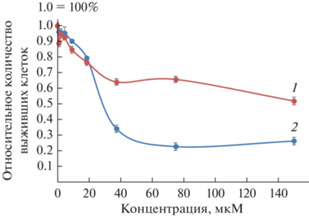
Биологические испытания были проведены в отношении аденокарциномы яичника SKOV3 для I и ранее структурно охарактеризованных дитиокарбаматно-хлоридных комплексов состава [Au{S2CN(СH3)2}Cl2], [Au{S2CN(iС3H7)2}Cl2] [19]. Цитотоксичность соединений была определена в отношении клеток аденокарциномы яичника человека SKOV3 и первичной культуры фибробластов человека линии HDF в качестве неопухолевого контроля. Перспективными считаются препараты, которые вызывают гибель опухолевых клеток при минимальных концентрациях, при этом в меньшей степени нарушая жизнеспособность нормальных клеток. Комплекс I более токсичен для опухолевых клеток, чем для здоровых фибробластов (рис. 2). IC50 для SKOV3 и HDF составляет 27 мкМ и >150 мкМ соответственно. Комплекс I менее токсичен для клеток аденокарциномы яичника, чем цисплатин (CP), но при этом значительно безопаснее для здоровых фибробластов (величина токсичности почти в 7 раз меньше, чем у СР) (табл. 2). Таким образом, I может рассматриваться для дальнейшего изучения в качестве потенциального противоопухолевого средства.
Рис. 2.
Результаты цитотоксичности для I. Выживаемость клеток HDF (1) и SKOV3 (2), инкубированных с различными концентрациями I или ДМСО в качестве контроля. (Представлено среднее значение MTT-индекса ± стандартное отклонение, рассчитанное по данным 3 измерений.)
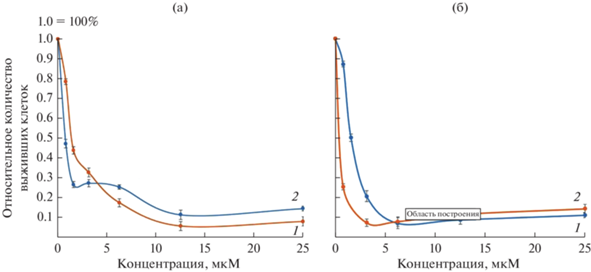
В [18] для комплекса золота с координированным фенантролином [Au(Рhen)Cl2]Cl была исследована цитотоксичность в отношении нескольких раковых линий CCRF-CEM (лейкемия) и A2780 (рак яичника). Анализ полученных профилей цитотоксичности показывает схожесть с СР, однако преодолевает устойчивость к СР, показывая эффективность в отношении резистентной линии. Для сравнения противоопухолевой эффективности комплексов на основе Au(III) были исследованы ранее структурно охарактеризованные дитиокарбаматно-хлоридные комплексы [Au{S2CN(СH3)2}Cl2] и [Au{S2CN(iС3H7)2}Cl2] [19]. Однако в отличие от I, они характеризуются повышенной токсичность не только для опухолевых, но и для здоровых клеток (рис. 3; табл. 2), что существенно усложняет (но не исключает) возможность их использования в терапевтических целях.
Рис. 3.
Результаты исследования цитотоксичности [Au{S2CN(СH3)2}Cl2] (а) и [Au{S2CN(iС3H7)2}Cl2] (б). Выживаемость клеток HDF (1) и SKOV3 (2), инкубированных с различными концентрациями или ДМСО в качестве контроля. (Представлено среднее значение MTT-индекса ± стандартное отклонение, рассчитанное по данным 3 измерений.)
Таким образом, в работе получен и структурно охарактеризован ионный комплекс золота(III) состава (H2Phen)[AuCl4]Cl (I), включающий плоско-квадратный анион [AuCl4]– и редкую дважды протонированную форму фенантролина (H2Phen)2+. За счет системы водородных связей D–H···Cl (D = N, C) чередующиеся внешнесферные катионы (H2Phen)2+ и анионы Cl– выстраивают псевдополимерные ленты, которые объединяются анионами золота(III) в 2D-супрамолекулярные слои. Для исследованного соединения I экспериментально выявлена высокая противоопухолевая активность в отношении клеток аденокарциномы яичника человека (SKOV3), которая сочетается с низкой токсичностью для здоровых клеток первичной культуры дермальных фибробластов человека.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Barry N.P.E., Sadler P.J. // Chem. Commun. 2013. V. 49. P. 5106.
Ott I., Gust R. // Arch. Pharm. Chem. Life Sci. 2007. V. 340. P. 117.
Ndagi U., Mhlongo N., Soliman M. // Drug Des. Devel. Ther. 2017. V. 11. P. 599.
Perontsis S., Geromichalou E., Perdih F. et al. // J. Inorg. Biochem. 2020. P. 111213.
Луценко И.А., Никифорова М.Е., Кошенскова К.А. и др. // Коорд. химия. 2022. Т. 48. С. 83 (Lutsenko I.A., Nikiforova M.E., Koshenscova K.A. et al. // Russ. J. Coord. Chem. 2021. V. 47. P. 881). https://doi.org/10.1134/S1070328421350013
Ngwane A.H., Petersen R.-D., Baker B. // IUBMB Life. 2019. P. 1.
El-Ayaan U., Abdel-Aziz A.M. // Eur. J. Med. Chem. 2005. V. 40. P. 1214.
Deo K.M., Pages B.J., Ang D.L. // Inter. J. Mol. Sci. 2016. V. 17. P. 1818.
Eryazici I., Moorefield C.N., Newkome G.R. // Chem. Rev. 2008. V. 108. P. 1834.
Ott I. // Coord. Chem. Rev. 2009. V. 253. P. 1670.
Kauffman G.B. // Gold Bulletin. 1985. V. 18. № 1. P. 31.
Mahdihassan S. // Am. J. Chin. Med. 1985. V. 13. № 3. P. 93.
Menard H.A., Beaudet F., Davis P. et al. // J. Rheumatol. Suppl. 1982. V. 8. P. 179.
Silver S. Radioactive Isotopes in Medicine and Biology Medicine. Philadelphia: Lea & Febiger, 1962. 347 p.
Parish R.V. // Gold Bulletin. 1987. V. 20. № 1. P. 3.
Calamai P., Carotti S., Guerri A. et al. // Anticancer. Drug. Des. 1998. V. 13. P. 67.
Marcon G., Carotti S., Coronello M. et al. // J. Med. Chem. 2002. V. 45. P. 1672.
Messori L., Abbate F., Marcon G. et al. // J. Med. Chem. 2000. V. 43. P. 3541.
Лосева О.В., Родина Т.А., Иванов А.В. и др. // Коорд. химия. 2018. Т. 44. С. 303 (Loseva O.V., Rodina T.A., Ivanov A.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 604). https://doi.org/10.1134/S107032841810007x
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G. M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия