Координационная химия, 2022, T. 48, № 12, стр. 718-729
Комплексы Cu(II) с CF3-замещенными спин-мечеными пиразолами
А. С. Богомяков 1, *, Г. В. Романенко 1, С. В. Фокин 1, Э. Т. Чубакова 1, Е. В. Третьяков 2, В. И. Овчаренко 1
1 Институт “Международный томографический центр”
Новосибирск, Россия
2 Институт органической химии им. Н.Д. Зелинского РАН
Москва, Россия
* E-mail: bus@tomo.nsc.ru
Поступила в редакцию 22.06.2022
После доработки 06.07.2022
Принята к публикации 06.07.2022
- EDN: NCCHWB
- DOI: 10.31857/S0132344X22600242
Аннотация
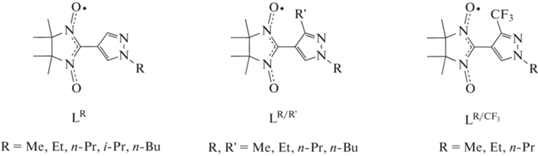
Синтезированы CF3-замещенные пиразолилнитроксилы ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ и комплексы Cu(II) с ними. Методом РСА исследована молекулярная и кристаллическая структура полученных соединений (СCDC № 2180506–2180521). Установлено, что введение в пиразольный цикл акцепторной группы CF3 снижает донорную способность атома N и координация нитронилнитроксилов ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ в гетероспиновых комплексах осуществляется только посредством атомов O нитронилнитроксильных фрагментов. Магнетохимические исследования цепочечно-полимерных комплексов [Cu(Hfac)2${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$]n (Hfac = гексафторацетилацетонат-анион) в области 2–300 K обнаружили для них наличие ферромагнитного упорядочения при температуре ниже 5 K. Термически индуцированные магнитно-структурные фазовые переходы зарегистрированы в двух полиморфных модификациях молекулярного комплекса α-[Cu(Hfac)2${{({{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}})}_{2}}$] и β-[Cu(Hfac)2${{({{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}})}_{2}}$]. Данные модификации представляют собой новые примеры молекулярных гетероспиновых комплексов, способных претерпевать термически индуцированные магнитно-структурные фазовые переходы без разрушения кристаллов.
В ходе систематического исследования дышащих кристаллов на основе цепочечно-полимерных гетероспиновых комплексов бис-(гексафторацетилацетонато)меди Cu(Hfac)2 со спин-мечеными алкилзамещенными пиразолами (LR) (схема 1 ) состава [Cu(Hfac)2LR], а также их сольватов [Cu(Hfac)2LR] ∙ xSolv были зарегистрированы на термомагнитных кривых разнообразные магнитные аномалии, присущие природе данного класса соединений [1–5]. Было установлено, что наблюдаемые аномалии чувствительны даже к незначительным изменениям в упаковке соединений [3, 5]. Аналогичные магнитные эффекты проявляли и многоспиновые соединения [Cu(Hfac)2LR/R'] с диалкилзамещенными пиразолами (LR/R') (схема 1 ), исследование которых позволило не только существенно расширить круг магнитноактивных соединений, но и обнаружить комплексы, в кристаллах которых при изменении температуры реализуются обратимые топохимические реакции полимеризации–деполимеризации и деполимеризации–полимеризации (single crystal to single crystal transformation, SC ↔ SC), сопровождающиеся гистерезисными эффектами на кривых зависимости эффективного магнитного момента (μэфф) от температуры [6–8]. Были также обнаружены ациклические олигомерные молекулярные комплексы Cu(II) со спин-мечеными пиразолами необычного состава 5 : 4 и циклические биядерные комплексы, способные претерпевать спиновые переходы [9].
Поскольку одним из благоприятных факторов для возникновения механической активности в кристаллах служит присутствие фторированных компонентов [10], мы предприняли попытку получения и исследования гетероспиновых комплексов, содержащих наряду со стехиометрически нежeсткой фторированной акцепторной матрицей [Cu(Hfac)2], фторированное производное спин-меченого пиразола $({{L}^{{{R \mathord{\left/ {\vphantom {R {C{{F}_{3}}}}} \right. \kern-0em} {C{{F}_{3}}}}}}})$ (схема 1 ).
В настоящей работе мы описываем методики синтеза нитронилнитроксилов ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}},$ комплексов Cu(Hfac)2 с этими радикалами и результаты исследования строения и магнитных свойств полученных соединений.
Схема 1 .
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гидрат сульфата 2,3-бис(гидроксиамино)-2,3-диметилбутана [11] и 4-формил-3-трифторметил-1H-пиразол [12] синтезированы по описанным в литературе методикам. Коммерческие реактивы и растворители использовали без дополнительной очистки. ТСХ выполняли на пластинках Silica Gel 60 F254 с закрепленным слоем сорбента на алюминиевой фольге. Для колоночной хроматографии применяли силикагель с размером зерен 0.063–0.200 мм (Merck). Элементный анализ выполнен на микроанализаторе Euro EA 3000. ИК-спектры образца в таблетках KBr записывали на спектрофотометре Bruker Vector-22.
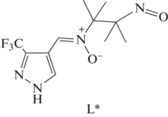
Синтез 2-(3-трифторметил-1H-пиразол-4-ил)-4,4,5,5-тетраметил-4,5-дигидро-1Н-имидазол-3-оксид-1-оксил $({{L}^{{{H \mathord{\left/ {\vphantom {H {C{{F}_{3}}}}} \right. \kern-0em} {C{{F}_{3}}}}}}}).$ К 4-формил-3-трифторметил-1H-пиразолу (0.67 г, 4.0 ммоль) прибавляли раствор гидрата сульфата 2,3-бис-гидроксиламино-2,3-диметилбутана (1.30 г, 4.8 ммоль) в 13 мл воды, реакционную смесь перемешивали 2 ч и обрабатывали NaHCO3 до прекращения выделения CO2. Выделившийся 2-(3-трифторметил-1H-пиразол-4-ил)-4,4,5,5-тетраметил-имидазолидин-1,3-диол (диол) отфильтровывали, промывали водой и ацетоном, сушили и перекристаллизовывали из смеси EtOAc с гексаном (3 : 1). Выход 0.85 г (74%). К перемешиваемому раствору диола (0.85 г, 2.9 ммоль) в CH3OH (18 мл) прибавляли порциями MnO2 (4.2 г, 49 ммоль) в течение 10 мин, затем реакционную смесь перемешивали в течение 1.5 ч при комнатной температуре. Реакционную смесь фильтровали, осадок промывали CH3OH. Фильтрат упаривали, остаток хроматографировали на колонке с силикагелем (1.5 × 15 см). Фракцию бирюзового цвета, выходившую первой, упаривали, остаток кристаллизовали из смеси эфира с гексаном и получали нитрозопроизводное – N-(2,3-диметил-3-нитрозобутан-2-ил)-1-(3-(трифторметил)-1H-пиразол-4-ил)метанимин-оксид (L*) (cхема 2), строение которого установлено методом РСА. Выход 44 мг (5.3%), Тпл = 134–135°С.
ИК-спектр (ν, см–1): 3130, 3072, 2998, 2924, 2361, 1604, 1563, 1480, 1396, 1369, 1321, 1259, 1182, 1127, 1062, 937, 919, 838, 759, 724, 669, 636.
| Найдено, %: | С 45.3; | Н 4.5; | N 19.2; | F 20.2. |
| Для C11H14N4O2F3 | ||||
| вычислено, %: | C 45.4; | H 4.8; | N 19.2; | F 19.6. |
Схема 2 .
Вторую основную фракцию фиолетового цвета также упаривали и выделяли нитроксил ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}.$ Выход 770 мг, 91%, Тпл = 182–183°С (эфир–гексан).
ИК-спектр (ν, см–1): 3113, 2990, 2362, 1597, 1510, 1460, 1403, 1359, 1279, 1222, 1169, 1122, 1083, 1051, 940, 805, 739, 649.
| Найдено, %: | С 44.9; | Н 5.1; | N 19.4; | F 19.4. |
| Для C11H14F3N4O2 | ||||
| вычислено, %: | C 45.4; | H 4.8; | N 19.2; | F 19.6. |
Синтез 2-(1-метил-3-трифторметил-1H-пиразол-4-ил)-4,4,5,5-тетраметил-4,5-дигидро-1Н-имидазол-3-оксид-1-оксил $({{{\mathbf{L}}}^{{{{{\mathbf{Me}}} \mathord{\left/ {\vphantom {{{\mathbf{Me}}} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}} \right. \kern-0em} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}}}}{\mathbf{)}}{\mathbf{.}}$ NaH (60% в минеральном масле, 34 мг, 0.86 ммоль) прибавляли в атмосфере аргона к перемешиваемому при комнатной температуре раствору ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (245 мг, 0.86 ммоль) в ДМФА (3 мл). Реакционную смесь перемешивали в течение 30 мин, прибавляли диметилсульфат (102 мкл, 1.0 ммоль) и перемешивали еще 30 мин. Растворитель отгоняли в вакууме при температуре бани ~70°С, остаток хроматографировали на колонке с силикагелем (1.5 × 18 см), продукт элюировали этилацетатом. Фракцию фиолетового цвета упаривали, остаток кристаллизовали из смеси CH2Cl2 с гексаном (1 : 5). Выход 160 мг (62%), Тпл = 110–111°С.
ИК-спектр (ν, см–1): 3139, 3034, 2993, 2947, 1597, 1498, 1480, 1457, 1412, 1399, 1375, 1359, 1306, 1285, 1243, 1222, 1070, 1151, 1136, 1080, 1059, 1020, 870, 838, 768, 739, 645, 616, 588.
| Найдено, %: | С 46.7; | Н 5.1; | N 18.1; | F 18.4. |
| Для C12H16N4O2F3 | ||||
| вычислено, %: | C 47.2; | H 5.3; | N 18.3; | F 18.7. |
Синтез 2-(1-этил-3-трифторметил-1H-пиразол-4-ил)-4,4,5,5-тетраметил-4,5-дигидро-1Н-имидазол-3-оксид-1-оксил ${\mathbf{(}}{{{\mathbf{L}}}^{{{{{\mathbf{Et}}} \mathord{\left/ {\vphantom {{{\mathbf{Et}}} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}} \right. \kern-0em} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}}}}{\mathbf{)}}$ выполняли по аналогичной методике с использованием EtBr (0.11 мл, 1.4 ммоль). Выход 0.19 г (85%), Тпл = 128–129°С.
ИК-спектр (ν, см–1): 3095, 2985, 2944, 1604, 1508, 1484, 1452, 1404, 1371, 1324, 1251, 1238, 1176, 1129, 1106, 1089, 1062, 1025, 962, 861, 828, 767, 741, 656.
| Найдено, %: | С 48.5; | Н 5.3; | N 17.5; | F 18.2. |
| Для C13H18F3N4O2 | ||||
| вычислено, %: | C 48.9; | H 5.7; | N 17.5; | F 17.8. |
Синтез 2-(1-пропил-3-трифторметил-1H-пиразол-4-ил)-4,4,5,5-тетраметил-4,5-дигидро-1Н-имидазол-3-оксид-1-оксил ${\mathbf{(}}{{{\mathbf{L}}}^{{{{{\mathbf{Pr}}} \mathord{\left/ {\vphantom {{{\mathbf{Pr}}} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}} \right. \kern-0em} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}}}}{\mathbf{)}}$ выполняли по аналогичной методике с использованием PrBr (0.073 мл, 0.80 ммоль). Выход 0.15 г (82%), Тпл = = 106–107°С.
ИК-спектр (ν, см–1): 3126, 2990, 2943, 2878, 1604, 1509, 1490, 1450, 1406, 1370, 1327, 1281, 1240, 1220, 1143, 1061, 1017, 901, 863, 831, 741, 653.
| Найдено, %: | С 50.4; | Н 5.3; | N 17.1; | F 18.2. |
| Для C14H20N4O2F3 | ||||
| вычислено, %: | C 50.4; | H 6.0; | N 16.8; | F 17.1. |
Синтез [Cu(Hfac)2${{{\mathbf{L}}}^{{{{{\mathbf{Me}}} \mathord{\left/ {\vphantom {{{\mathbf{Me}}} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}} \right. \kern-0em} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}}}}$]n (I). К раствору ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (0.0300 г, 0.1 ммоль) в 2 мл CH2Cl2 прибавляли раствор Cu(Hfac)2 (0.0477 г, 0.1 ммоль) в 2 мл гексана, при этом реакционная смесь приобретала интенсивный коричнево-красный оттенок. Реакционную смесь выдерживали при –18°С в течение ~130 ч. Образовавшиеся кристаллы темно-коричневого цвета в форме призм отфильтровывали, промывали охлажденным гексаном и сушили на воздухе. Выход 0.070 г (90%).
| Найдено, %: | C 33.2; | H 2.8; | N 7.3; | F 36.3. |
| Для C22H18N4O6F15Cu | ||||
| вычислено, %: | C 33.7; | H 2.3; | N 7.2, | F 36.4. |
Синтез [Cu(Hfac)2${{{\mathbf{L}}}^{{{{{\mathbf{Et}}} \mathord{\left/ {\vphantom {{{\mathbf{Et}}} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}} \right. \kern-0em} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}}}}$]n (II). Смесь Cu(Hfac)2 (0.0674 г, 0.14 ммоль) и ${{{\text{L}}}^{{{{{\text{Et}}} \mathord{\left/ {\vphantom {{{\text{Et}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (0.0313 г, 0.1 ммоль) растворяли в 2 мл толуола. Часть растворителя медленно отдували током воздуха до объема ~1 мл, после чего реакционную смесь выдерживали при –18°С в течение 40 ч. Кристаллы коричневого цвета отфильтровывали, промывали охлажденным гексаном и высушивали на воздухе. Выход 0.039 г (50%).
| Найдено, %: | C 35.1; | H 2.7; | N 6.7; | F 35.7. |
| Для C23H20N4O6F15Cu | ||||
| вычислено, %: | C 34.7; | H 2.5; | N 7.0; | F 35.8. |
Синтез [Cu(Hfac)2${{{\mathbf{L}}}^{{{{{\mathbf{Pr}}} \mathord{\left/ {\vphantom {{{\mathbf{Pr}}} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}} \right. \kern-0em} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}}}}$]n (III). Смесь Cu(Hfac)2 (0.0472 г, 0.1 ммоль) и ${{{\text{L}}}^{{{{{\text{Pr}}} \mathord{\left/ {\vphantom {{{\text{Pr}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (0.0301 г, 0.1 ммоль) растворяли в 4 мл гексана. Часть растворителя медленно отдували током воздуха до объема ~1 мл, раствор выдерживали при –18°С в течение 48 ч. Кристаллы коричневого цвета отфильтровывали, промывали охлажденным гексаном и сушили на воздухе. Выход 0.028 г (36%).
| Найдено, %: | C 35.6; | H 2.6; | N 7.0; | F 35.3. |
| Для C24H22CuF15N4O6 | ||||
| вычислено, %: | C 35.5; | H 2.7; | N 6.9; | F 35.1. |
Синтез α-[Cu(Hfac)2${{{\mathbf{(}}{{{\mathbf{L}}}^{{{{{\mathbf{Me}}} \mathord{\left/ {\vphantom {{{\mathbf{Me}}} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}} \right. \kern-0em} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}}}}{\mathbf{)}}}_{{\mathbf{2}}}}$] (IV). Навеску Cu(Hfac)2 (0.0300 г, 0.06 ммоль) растворяли в 1.5 мл Et2O. Навеску ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (0.0200 г, 0.07 ммоль) растворяли в 3 мл Et2O. К раствору ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ прибавляли раствор Cu(Hfac)2, при этом реакционная смесь приобретала интенсивный красно-коричневый оттенок. После тщательного перемешивания к реакционной смеси прибавляли 2 мл толуола и выдерживали ее при –18°С в течение ~17 сут. Образовавшиеся кристаллы темно-винного цвета отфильтровывали, промывали охлажденным гексаном и сушили на воздухе. Выход 0.014 г (39%). Тпл = 116–117°С.
| Найдено, %: | C 39.2; | H 3.2; | N 10.4; | F 30.6. |
| Для C34H34N8O8F18Cu | ||||
| вычислено, %: | C 37.5; | H 3.1; | N 10.3; | F 31.4. |
Синтез β-[Cu(Hfac)2${{{\mathbf{(}}{{{\mathbf{L}}}^{{{{{\mathbf{Me}}} \mathord{\left/ {\vphantom {{{\mathbf{Me}}} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}} \right. \kern-0em} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}}}}{\mathbf{)}}}_{{\mathbf{2}}}}$] (V). Смесь навесок Cu(Hfac)2 (0.0318 г, 0.07 ммоль) и ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (0.0400 г, 0.13 ммоль) растворяли в 2 мл толуола. Реакционную смесь энергично перемешивали, затем полученный раствор выдерживали при ‒30°С в течение ~20 сут. Образовавшиеся кристаллы отфильтровывали, промывали охлажденным гексаном и сушили на воздухе. Выход 0.008 г (11%).
РCA. Наборы отражений для монокристаллов соединений получены на автоматических дифрактометрах производства Bruker AXS – SMART APEX (MoKα-излучение) с гелиевым охладителем открытого потока Helix (Oxford Cryosystems) и Apex Duo (CuKα-излучение) с криосистемой Cobra (Oxford Cryosystems) по стандартной методике. Структуры расшифрованы прямыми методами и уточнены полноматричным методом наименьших квадратов анизотропно для неводородных атомов. Атомы H были частично локализованы при синтезе разностной электронной плотности (остальные – рассчитаны геометрически) и включены в уточнение в модели наездника. Все расчеты проводили с использованием пакета программ SHELX [13]. Кристаллографические характеристики исследованных соединений и детали экспериментов представлены в табл. 1–3.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур нитроксилов ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$
| Параметр | Значение | |||||
|---|---|---|---|---|---|---|
| ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$ | ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$-а | ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$-b | ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$-c | ${{{\text{L}}}^{{{{{\text{Et}}} \mathord{\left/ {\vphantom {{{\text{Et}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$ | ${{{\text{L}}}^{{{{{\text{Pr}}} \mathord{\left/ {\vphantom {{{\text{Pr}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$ | |
| М | 291.26 | 305.29 | 319.32 | 333.34 | ||
| T, K | 296 | 296 | 296 | 296 | ||
| Пр. группа, Z | P21/c, 4 | $P\bar {1},2$ | P21/c, 4 | P21/c, 8 | P21/c, 4 | P21/c, 8 |
| a, Å b, Å c, Å |
10.3659(9) 10.1986(8) 13.1267(13) |
7.4217(7) 10.1430(10) 10.1759(9) |
10.2998(11) 20.745(2) 7.2967(8) |
7.1341(14) 11.872(2) 35.062(7) |
10.492(4) 13.397(5) 11.253(4) |
7.7542(11) 17.776(2) 12.2262(18) |
| α, град | 93.043(6) | |||||
| β, град | 110.696(6) | 100.238(6) | 102.072(7) | 90.00(3) | 100.50(3) | 90.998(12) |
| γ, град | 107.590(6) | |||||
| V, Å3 | 1298.2(2) | 713.91(12) | 1524.6(3) | 2969.6(10) | 1555.3(10) | 1685.0(4) |
| ρ(выч.) г/см3 | 1.490 | 1.420 | 1.330 | 1.366 | 1.364 | 1.314 |
| θmax, град | 45.234 | 28.335 | 66.075 | 23.245 | 28.502 | 28.409 |
| Ihkl измеренных/ независимых Rint | 3798/1061 0.042 |
11 870/3519 0.0491 |
7619/2459 0.0308 |
7124/2617 0.0341 |
13 771/3850 0.1168 |
15 197/4176 0.1697 |
| Ihkl наблюдаемых (I > 2σ(I))/N | 921/186 | 1765/195 | 2201/218 | 1900/488 | 882/227 | 1054/208 |
| GООF | 1.027 | 0.916 | 1.026 | 0.989 | 0.645 | 0.971 |
| R1/wR2 (I > 2σ(I)) | 0.0358/0.0816 | 0.0404/0.0944 | 0.0515/0.1520 | 0.0546/0.1469 | 0.0425/0.0661 | 0.0741/0.1296 |
| R1/wR2 | 0.0539/0.0905 | 0.0928/0.1085 | 0.0555/0.1570 | 0.0724/0.1596 | 0.2624/0.0918 | 0.3133/0.1894 |
| CCDC | 2 180 506 | 2 180 509 | 2 180 516 | 2 180 511 | 2 180 520 | 2 180 519 |
Таблица 2.
Кристаллографические данные, параметры эксперимента и уточнения структур L*, I–III
| Параметр | Значение | |||
|---|---|---|---|---|
| L* | [Cu(Hfac)2${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$] (I) | [Cu(Hfac)2${{{\text{L}}}^{{{{{\text{Et}}} \mathord{\left/ {\vphantom {{{\text{Et}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$] (II) | [Cu(Hfac)2${{{\text{L}}}^{{{{{\text{Pr}}} \mathord{\left/ {\vphantom {{{\text{Pr}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$] (III) | |
| М | 292.27 | 782.94 | 796.97 | 810.99 |
| T, K | 296 | 296 | 296 | 296 |
| Пр. группа, Z | P21/c, 4 | $P\bar {1},2$ | Pbca, 8 | Pbca, 8 |
| a, Å b, Å c, Å |
9.552(2) 10.951(3) 13.308(4) |
10.2987(5) 12.4776(6) 13.0064(6) |
19.0454(5) 16.0497(5) 20.6628(6) |
18.878(4) 16.199(4) 21.179(5) |
| α, град | 80.128(2) | 90 | 90 | |
| β, град | 100.27(2) | 84.107(2) | 90 | 90 |
| γ, град | 69.199(2) | 90 | 90 | |
| V, Å3 | 1369.8(6) | 1537.70(13) | 6316.1(3) | 6477(3) |
| ρ(выч.) г/см3 | 1.417 | 1.691 | 1.676 | 1.663 |
| θmax, град | 28.371 | 28.469 | 55.696 | 45.211 |
| Ihkl измеренных/ независимых Rint |
12 379/3409 0.0584 |
17 865/6995 0.0563 |
36 473/4031 0.0921 |
51 137/2626 0.1062 |
| Ihkl наблюдаемых (I > 2σ(I))/N |
1163/237 | 3038/536 | 2884/595 | 1643/452 |
| GООF | 0.721 | 1.013 | 0.867 | 1.027 |
| R1/wR2 (I > 2σ(I)) | 0.0398/0.0782 | 0.0524/0.1084 | 0.0385/0.0966 | 0.0689/0.1779 |
| R1/wR2 | 0.1452/0.1020 | 0.1483/0.1412 | 0.0569/0.1050 | 0.1151/0.2182 |
| CCDC | 2 180 507 | 2 180 510 | 2 180 512 | 2 180 517 |
Таблица 3.
Кристаллографические данные, параметры эксперимента и уточнения структур IV и V
| Параметр | Значение | |||||
|---|---|---|---|---|---|---|
| α-[Cu(Hfac)2(${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{{{\text{F}}}_{3}}}}}}}$)2] (IV) | β-[Cu(Hfac)2(${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{{{\text{F}}}_{3}}}}}}}$)2] (V) | |||||
| M | 1088.23 | 1088.23 | ||||
| T, K | 296 | 120 | 296 | 240 | 150 | 120 |
| Пр. группа, Z | $P\bar {1},2$ | $P\bar {1},2$ | ||||
| a, Å b, Å c, Å |
10.3895(2) 10.7909(2) 12.1712(2) |
10.3149(3) 10.5119(3) 12.0415(3) |
9.9143(13) 10.3735(13) 12.4117(17) |
9.8761(5) 10.3715(5) 12.3466(6) |
9.8143(3) 10.3698(3) 12.2101(3) |
9.8144(3) 10.3851(6) 12.1083(4) |
| α, град β, град γ, град |
114.9670(10) 95.5240(10) 107.4420(10) |
114.6410(10) 96.652(2) 107.010(2) |
71.403(9) 68.312(8) 82.932(9) |
71.292(3) 67.635(3) 82.894(3) |
71.068(2) 66.787(2) 82.912(2) |
103.196(3) 113.618(2) 97.311(3) |
| V, Å3 | 1140.32(4) | 1091.54(5) | 1124.2(3) | 1107.74(10) | 1080.26(6) | 1067.29(8) |
| ρ(выч.) г/см3 | 1.585 | 1.656 | 1.607 | 1.631 | 1.673 | 1.693 |
| θmax, град | 28.028 | 28.484 | 51.763 | 28.534 | 28.404 | 28.368 |
| Ihkl измеренных/ независимых Rint |
19 717/5494 0.0501 |
19 535/5394 0.0711 |
10 752/2352 0.0318 |
18 983/5450 0.0500 |
17 944/5296 0.0760 |
18 246/5264 0.0920 |
| Ihkl наблюдаемых (I > 2σ(I))/N | 3749/385 | 4018/386 | 2055/367 | 3256/367 | 2980/368 | 2516/342 |
| GООF | 0.953 | 0.894 | 1.037 | 0.925 | 0.841 | 0.863 |
| R1/wR2 (I > 2σ(I)) | 0.0356/0.0879 | 0.0378/0.0885 | 0.0376/0.1028 | 0.0402/0.0929 | 0.0429/0.0772 | 0.0473/0.0947 |
| R1/wR2 | 0.0579/0.0954 | 0.0564/0.0950 | 0.0425/0.1071 | 0.0792/0.1031 | 0.0849/0.0865 | 0.7782/0.1231 |
| CCDC | 2 180 508 | 2 180 521 | 2 180 518 | 2 180 515 | 2 180 514 | 2 180 513 |
Полные наборы рентгеноструктурных данных депонированы в Кембриджском банке структурных данных (№ 2180506–2180521, http://www. ccdc.cam.ac.uk).
Магнитные измерения проводили на СКВИД-магнитометре MPMSXL (Quantum Design) в интервале температур 2–300 K в магнитном поле до 5 кЭ. Парамагнитные составляющие магнитной восприимчивости (χ) определяли с учетом диамагнитного вклада, оцененного по схеме Паскаля. Эффективный магнитный момент (µэфф) вычисляли по формуле μэфф = ${{[{{3k\chi T} \mathord{\left/ {\vphantom {{3k\chi T} {\left( {{{N}_{{\text{A}}}}\mu _{{\text{B}}}^{2}} \right)}}} \right. \kern-0em} {\left( {{{N}_{{\text{A}}}}\mu _{{\text{B}}}^{2}} \right)}}]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ ≈ (8χT)1/2, где NA, μB и k – число Авогадро, магнетон Бора и постоянная Больцмана соответственно.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
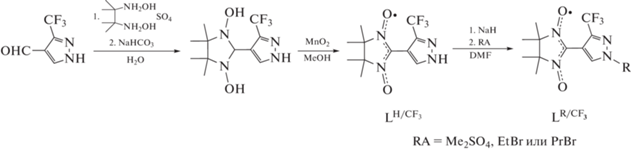
Синтез 2-(1-R-3-трифторметил-1H-пиразол-4-ил)-4,4,5,5-тетраметил-4,5-дигидро-1Н-имидазол-3-оксид-1-оксилов $({{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}})$ включал конденсацию 4-формил-3-трифторметил-1H-пиразола с бис(гидроксиламином), приводящую к образованию дигидрокси-производного, его окисление в нитронилнитроксил ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ и последующее алкилирование ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (схема 3 ).
Схема 3 .
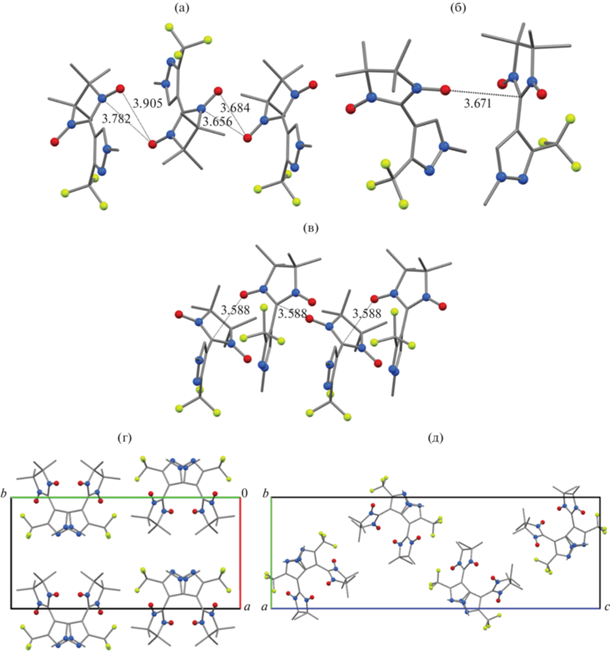
Реакция алкилирования замещенного пиразола ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ протекала региоселективно с образованием только одного изомера, содержащего CF3-группу в положении 3 ароматического цикла. Об этом свидетельствуют данные рентгеноструктурного исследования монокристаллов ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}.$ Длины связей N–O во всех ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ находятся в интервале 1.273(4)–1.289(4) Å, типичном для нитронилнитроксильных радикалов [14]. В структуре ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}},$ в отличие от ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}},$ молекулы образуют цепи за счет H-связей между иминной группой пиразола и одним из атомов ONO (рис. 1). Для ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ удалось выделить три полиморфные модификации соединения (${{{\mathbf{L}}}^{{{{{\mathbf{Me}}} \mathord{\left/ {\vphantom {{{\mathbf{Me}}} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}} \right. \kern-0em} {{\mathbf{C}}{{{\mathbf{F}}}_{{\mathbf{3}}}}}}}}}$-а-с), в которых молекулы различаются значениями углов между плоскостями пиразольного цикла и парамагнитного фрагмента {CN2O2} (табл. 4), упаковкой молекул и характером межмолекулярных контактов (рис. 2). Кратчайшие расстояния между парамагнитными центрами (ПМЦ) – атомами ONO соседних молекул во всех ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ превышают 3.5 Å.
Рис. 1.
Строение цепи ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}.$
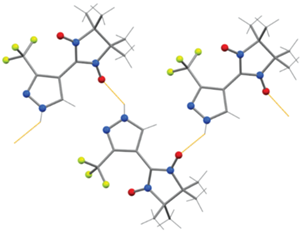
Таблица 4.
Стереохимические характеристики нитроксилов ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$
| Соединение | N–O, Å | ∠CN2O2-Pz, град |
|---|---|---|
| ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$ | 1.283(3), 1.290(3) | 40.3 |
| ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$-a | 1.281(2), 1.270(2) | 34.9 |
| ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$-b | 1.275(5), 1.284(5) 1.276(4), 1.267(4) |
64.8 68.6 |
| ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$-c | 1.276(2), 1.281(2) | 63.1 |
| ${{{\text{L}}}^{{{{{\text{Et}}} \mathord{\left/ {\vphantom {{{\text{Et}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$ | 1.277(3), 1.287(3) | 46.9 |
| ${{{\text{L}}}^{{{{{\text{Pr}}} \mathord{\left/ {\vphantom {{{\text{Pr}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$ | 1.273(4), 1.289(4) | 50.0 |
Рис. 2.
Кратчайшие контакты и упаковки молекул в модификациях ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}{\text{:}}$ ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$-а (a); ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$-b (б, в); ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$-c (г, д).
Температурные зависимости µэфф для нитроксилов ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$ (R = H, Me, Et, Pr) представлены на рис. 3. Значения µэфф при 300 K близки к теоретической чисто спиновой величине 1.73 µB для монорадикала. При понижении температуры µэфф сначала постепенно, а ниже 100 K резко уменьшается, что указывает на доминирование антиферромагнитных обменных взаимодействий между спинами нитроксилов. Экспериментальные зависимости µэфф(T) хорошо описываются выражением, полученным при суммировании вкладов от обменно-связанных димеров (спин-Гамильтониан H = –2JS1S2) и монорадикалов, магнитная восприимчивость χ которых подчиняется закону Кюри-Вейсса:
Рис. 3.
Зависимости μэфф(T) для ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (R = H, Me, Et, Pr). Точки – экспериментальные значения, сплошные линии – теоретические кривые.
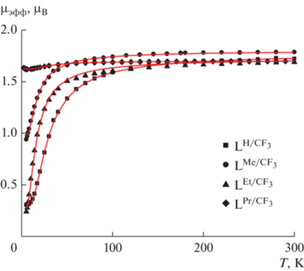
Оптимальные значения параметров обменного взаимодействия J, доли p и постоянной Вейсса θ составляют –24.7 см–1, 3.4% и 0 K (фикс.) для ${{{\text{L}}}^{{{{\text{H}} \mathord{\left/ {\vphantom {{\text{H}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}};$ –12.0 см–1, 31% и 0 K (фикс.) для ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}};$ ‒13.9 см–1, 2.3% и 0 K (фикс.) для ${{{\text{L}}}^{{{{{\text{Et}}} \mathord{\left/ {\vphantom {{{\text{Et}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ и –19.1 см–1, 90% и 0.1 K для ${{{\text{L}}}^{{{{{\text{Pr}}} \mathord{\left/ {\vphantom {{{\text{Pr}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}.$ В случае ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ образец, по-видимому, является смесью модификаций, в одной из которых нитроксилы образуют обменно-связанные димеры (69%), тогда как во второй обменные взаимодействия между спинами радикалов пренебрежимо малы (31%). Хотя для ${{{\text{L}}}^{{{{{\text{Pr}}} \mathord{\left/ {\vphantom {{{\text{Pr}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ полиморфные модификации не были обнаружены, магнетохимическое исследование показало, что в образце, по-видимому, присутствует примесь модификации ${{{\text{L}}}^{{{{{\text{*Pr}}} \mathord{\left/ {\vphantom {{{\text{*Pr}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (10%), имеющей другую кристаллическую структуру, в которой реализуются достаточно сильные антиферромагнитные взаимодействия. Основная же масса образца представляет собой фазу со слабыми ферромагнитными обменными взаимодействиями между спинами нитроксилов, что согласуется с данными РСА о строении кристаллов ${{{\text{L}}}^{{{{{\text{Pr}}} \mathord{\left/ {\vphantom {{{\text{Pr}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}.$
При взаимодействии эквимольных количеств Cu(Hfac)2 с ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ (R = Me, Et, Pr) были получены близкие по строению цепочечно-полимерные координационные соединения [Cu(Hfac)2${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$]n (I–III). В качестве примера на рис. 4 представлен фрагмент цепочки [Cu(Hfac)2${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$]n. Парамагнитные лиганды выполняют бидентатно-мостиковую функцию за счет координации атомов ONO нитронилнитроксильного фрагмента соседними фрагментами Cu(Hfac)2. Такой способ координации нехарактерен для моно- и диалкилпиразолил замещенных нитроксилов LR и LR/R', но реализовывался в комплексах гексафторацетилацетонатов 3d-металлов с алкил-, изоксазолил- и фенилзамещенными нитронилнитроксилами [15–22].
Рис. 4.
Фрагмент цепочки в структуре [Cu(Hfac)2${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$]n при 295 K. Здесь и далее серым цветом показан углеродный скелет, желто-зеленым – атомы F, голубым – Cu, красным – O, синим – N; атомы H, CF3-группы Hfac и Me-группы тетраметильного фрагмента не показаны.
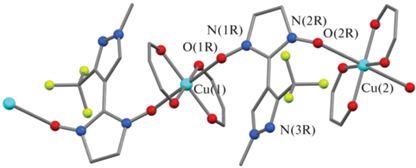
Геометрические характеристики центросимметричных координационных узлов CuO6 в комплексах I–III близки: плоско-квадратное окружение ионов Cu(II) из четырех атомов OHfac дополняется до искаженно-октаэдрического атомами ONO двух нитроксилов. Расстояния Cu–ONO велики – 2.344(2)–2.669(6) Å, значения углов ∠CuONON лежат в интервале 129.6(2)–152.0(2) (табл. 5).
Таблица 5.
Значения избранных длин связей (Å) и углов (град) в полимерно-цепочечных комплексах I–III
| Параметры | Значение | |||||
|---|---|---|---|---|---|---|
| [Cu(Hfac)2(${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$)] (I) | [Cu(Hfac)2(${{{\text{L}}}^{{{{{\text{Et}}} \mathord{\left/ {\vphantom {{{\text{Et}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$)] (II) | [Cu(Hfac)2(${{{\text{L}}}^{{{{{\text{Pr}}} \mathord{\left/ {\vphantom {{{\text{Pr}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$)] (III) | ||||
| Cu–ONO | 2.496(2) | 2.513(2) | 2.344(2) | 2.649(3) | 2.368(6) | 2.669(6) |
| Cu–OHfac | 1.927(2) 1.931(2) |
1.932(2) 1.946(2) |
1.926(2)–1.937(2) | 1.920(5)–1.951(5) | ||
| ∠CuON | 152.0(2) | 129.6(2) | 131.2(2) | 145.4(2) | 132.7(5) | 147.2(6) |
| N–O | 1.278(3) | 1.279(3) | 1.290(3) | 1.279(3) | 1.292(7) | 1.266(7) |
| ∠CN2O2-Pz | 37.4 | 38.1 | 39.6 | |||
Экспериментальные зависимости µэфф(T) для комплексов I–III имеют сходный характер (рис. 5). При 300 K значения µэфф лежат в интервале 2.7–2.8 µB и при понижении температуры сначала постепенно, а ниже 100 K резко возрастают, что указывает на наличие ферромагнитных обменных взаимодействий между спинами парамагнитных центров. Это соответствует данным РСА об аксиальной координации нитроксильных фрагментов ионами Cu2+ с расстояниями 2.3–2.4 Å. В соответствии с данными теоретических исследований [23, 24], подобная геометрия координационных узлов обеспечивает ортогональность магнитных орбиталей в обменных кластерах {>N–•O–Cu–O•–N<}. Анализ экспериментальных зависимостей µэфф(T) проводили с использованием выражения магнитной восприимчивости для ферромагнитно связанных цепей [25] с учетом межцепочечных взаимодействий zJ' в приближении молекулярного поля. Оптимальные значения параметров обменного взаимодействия J и zJ' составляют 6.5 см–1 и –0.28 см–1 для комплекса I, 2.7 см–1 и –0.22 см–1 для II и 2.4 см–1 и –0.17 см–1 для III. Следует отметить, что уменьшение энергии межцепочечных обменных взаимодействий коррелирует c увеличением размера алкильного заместителя в ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}.$
Рис. 5.
Зависимости μэфф(T) для [Cu(Hfac)2${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$]n, R = Me (◼), Et (⚫), Pr (▲). Точки – экспериментальные значения, сплошные линии – теоретические кривые.
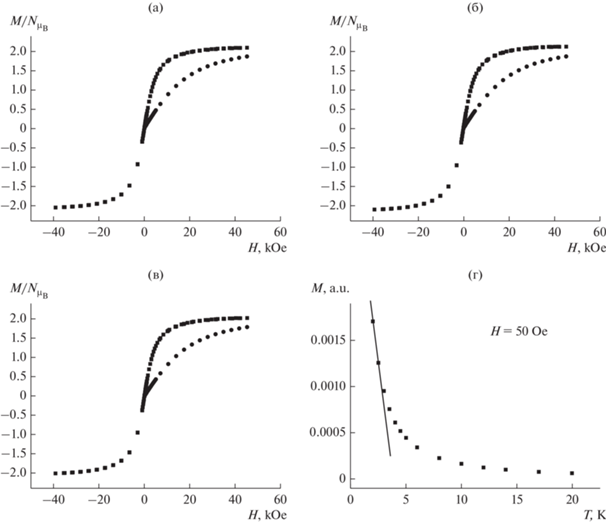
В области низких температур зависимости намагниченности от напряженности внешнего магнитного поля для комплексов I–III нелинейны (рис. 6). При 2 K в магнитных полях выше 20 кЭ намагниченность выходит на насыщение ~2 µB, что указывает на ферромагнитное упорядочение спинов. Значение намагниченности насыщения хорошо согласуется с теоретической величиной 2.08 µB для двух парамагнитных центров на формульную единицу – иона Cu(II) со спином S = 1/2 при g = 2.15 и нитроксила со спином S = 1/2 при g = 2.00. При 5 K намагниченность приближается к насыщению в магнитных полях выше 40 кЭ. Таким образом, для комплексов I–III можно оценить температуру Кюри как TC ≤ 3 K.
Рис. 6.
Зависимости M(H) для [Cu(Hfac)2${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$]n (R = Me (a), Et (б), Pr (в)) при 2 K (◼) и 5 K (⚫). Температурная зависимость намагниченности [Cu(Hfac)2${{{\text{L}}}^{{{{{\text{Pr}}} \mathord{\left/ {\vphantom {{{\text{Pr}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$]n в поле H = 50 Э (г).
Для ${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$ помимо цепочечно-полимерного комплекса в результате варьирования соотношения реагентов удалось выделить две полиморфные модификации центросимметричного молекулярного комплекса [Cu(Hfac)2${{({{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}})}_{2}}$]. Синтетические сложности не позволили выделить чистые фазы в необходимых для их полной характеризации количествах. По этой причине магнитные свойства были исследованы только для одного полиморфа – α-[Cu(Hfac)2${{({{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}})}_{2}}$] (IV). Структуру же удалось решить как для как α-, так и для β-модификции (V).
Молекулы α- и β-модификаций различаются длинами связей Cu–ONO, равными 2.469(2) Å в IV и 2.317(2) Å в V, значениями межплоскостных углов ∠CN2O2-Pz (рис. 7) и межмолекулярными расстояниями между некоординированными атомами ONO (табл. 6). Рентгеноструктурное исследование в области 300–120 K показало, что для α-фазы изменение длин связей Cu–ONO незначительно (Δ = 0.041 Å), но при этом заметно – на 0.148 Å – сокращаются межмолекулярные расстояния ONO…ONO. В структуре β-фазы при охлаждении до 120 K длины связей Cu–ONO укорачиваются на 0.262 Å при соответствующем удлинении одной из осей OHfac–Cu–OHfac (Δ = 0.250 Å), т.е. в бипирамиде {CuO6} происходит смена направления удлиненной ян-теллеровской оси. Такое сокращение расстояний в трехспиновых кластерах {–•O–Cu–O•–} приводит к смене характера обменных взаимодействий со слабого ферромагнитного на сильный антиферромагнитный.
Рис. 7.
Сравнение строения молекул α- и β-[Cu(Hfac)2${{({{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}})}_{2}}$] при 296 K (a) и 120 K (б) (синим цветом выделена молекула α-модификации, желтым – β-модификации).
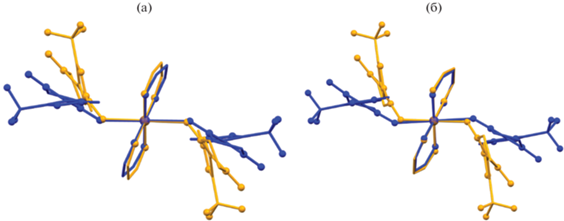
Таблица 6.
Избранные значения длин связей (Å) и углов (град) в комплексах IV и V
| Параметр | Значение | |||||
|---|---|---|---|---|---|---|
| α-[Cu(Hfac)2(${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$)2] (IV) | β-[Cu(Hfac)2(${{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{3}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{3}}}}}}}$)2] (V) | |||||
| Т, K | 296 | 120 | 296 | 240 | 150 | 120 |
| Cu–ONO | 2.469(1) | 2.428(1) | 2.316(2) | 2.280(2) | 2.175(2) | 2.054(2) |
| N–O | 1.286(2) 1.271(2) |
1.287(2) 1.277(2) |
1.292(3) 1.273(3) |
1.288(2) 1.266(2) |
1.300(2) 1.266(2) |
1.303(3) 1.263(3) |
| Cu–OHfac | 1.934(1) 1.940(1) |
1.940(1) 1.940(1) |
1.959(2) 1.975(2) |
1.968(1) 1.992(1) |
1.973(2) 2.073(2) |
1.975(2) 2.225(2) |
| ∠CN2O2–Pz | 39.2 | 39.6 | 27.0 | 25.5 | 24.7 | 25.3 |
| –•O…O•– | 3.706(2) | 3.558(2) | 4.707(4) | 4.765(3) | 4.786(3) | 4.758(3) |
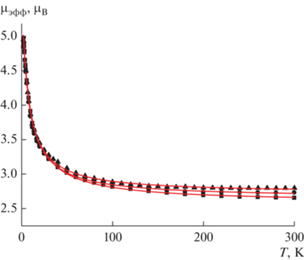
На рис. 8a приведена экспериментальная зависимость µэфф(T) для α-модификации IV. Значение µэфф при 300 K, равное 3.12 µB, согласуется с теоретическим значением 3.0 µB для трех невзаимодействующих ПМЦ со спинами S = 1/2 при g = 2. При понижении температуры ниже 100 K значение µэфф резко уменьшается, достигая при 19 K значения 1.84 µB, что соответствует одному ПМЦ со спином S = 1/2 при среднем значении g = 2.12 и свидетельствует о возникновении антиферромагнитных обменных взаимодействий, характерных для экваториальной координации нитроксилов. Дальнейшее уменьшение µэфф до 1.57 µB при 5 K связано с межмолекулярными обменными взаимодействиями между ПМЦ.
Рис. 8.
Зависимость μэфф(T) для α-[Cu(Hfac)2${{({{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}})}_{2}}$] (a) и температурные зависимости доли высокотемпературной фазы для α- (⚫) и β- (◼) модификаций [Cu(Hfac)2${{({{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}})}_{2}}$] (б).
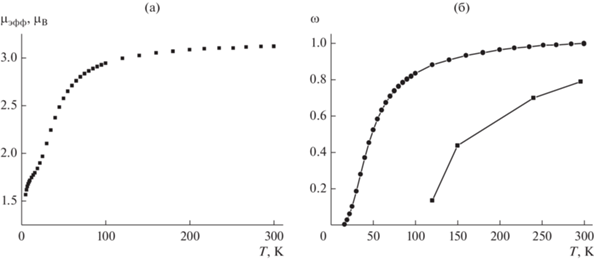
Следовательно, в твердых фазах обоих полиморфов IV и V и реализуются термически индуцируемые фазовые переходы, для α-фазы, по данным магнетохимических измерений, переход происходит в области температур 100–20 K, тогда как для β-фазы основные структурные изменения происходят в температурном интервале 250–120 K. Для сравнения на рис. 8б показаны изменения доли высокотемпературной фазы при понижении температуры для IV и V, рассчитанные по экспериментальным данным. Доля кластеров ω, в которых произошел структурный переход, для α-модификации оценивалась из анализа зависимости μэфф(T) с использованием выражения ${{\mu }}_{{{\text{эфф}}}}^{2}$ = (1 – ‒ ω)(µLT)2 + ω(µHT)2, где µLT = 1.84 µB, µHT = 3.12 µB – значения μэфф для низкоспиновых и высокоспиновых модификаций соответственно). Для β-модификации уменьшение доли высокоспиновых кластеров оценивалось по относительному изменению расстояний Cu–ONO, в предположении, что расстояние Cu–ONO 2.469(1) Å (как в α-фазе) соответствует 100% содержанию высокоспиновых, а 1.99 Å – 100% низкоспиновых кластеров. Фактически полиморфы IV и V представляют собой новые примеры молекулярных гетероспиновых комплексов, способных претерпевать термически индуцированные магнитно-структурные фазовые переходы без разрушения кристаллов (single-crystal-to-single-crystal transformation).
Таким образом, в результате проведенного исследования синтезированы и охарактеризованы CF3-замещенные спин-меченые пиразолы ${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}.$ Установлено, что введение CF3-группы в пиразольный цикл снижает донорную способность атома N пиразольного цикла, что приводит к координации только атомов ONO парамагнитного фрагмента нитроксила. При бидентантно-мостиковой координации парамагнитного лиганда происходит образование цепочечно-полимерных комплексов [Cu(Hfac)2${{{\text{L}}}^{{{{\text{R}} \mathord{\left/ {\vphantom {{\text{R}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}}$]n, для которых обнаружено ферромагнитное упорядочение при температуре ниже 5 K. При монодентантной координации нитронилнитроксила образуется моноядерный молекулярный комплекс [Cu(Hfac)2${{({{{\text{L}}}^{{{{{\text{Me}}} \mathord{\left/ {\vphantom {{{\text{Me}}} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{C}}{{{\text{F}}}_{{\text{3}}}}}}}}})}_{2}}$], существующий в виде двух полиморфных модификаций, для каждой из которых зафиксированы термически индуцированные магнитно-структурные фазовые переходы.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ovcharenko V.I., Maryunina K.Y., Fokin S.V. et al. // Russ. Chem. Bull. 2004. V. 53. № 11. P. 2406.
Ovcharenko V. // Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds / Ed. Hicks R. Chichester (UK): John Wiley & Sons, Ltd., 2010. P. 461.
Ovcharenko V., Bagryanskaya E. // Spin-Crossover Materials: Properties and Applications / Ed. Halcrow M.A. Oxford, UK: John Wiley & Sons Ltd., 2013. P. 239.
Ovcharenko V.I., Romanenko G.V., Maryunina K.Y. et al. // Inorg. Chem. 2008. V. 47. № 20. P. 9537.
Romanenko G.V., Maryunina K.Y., Bogomyakov A.S. et al. // Inorg. Chem. 2011. V. 50. № 14. P. 6597.
Romanenko G.V., Fokin S.V., Chubakova E.T. et al. // J. Struct. Chem. 2022. V. 63. № 1. P. 87.
Ovcharenko V.I., Fokin S.V., Kostina E.T. et al. // Inorg. Chem. 2012. V. 51. № 22. P. 12188.
Ovcharenko V., Fokin S., Chubakova E. et al. // Inorg. Chem. 2016. V. 55. № 12. P. 5853.
Fokin S.V., Kostina E.T., Tret’yakov E.V. et al. // Russ. Chem. Bull. 2013. V. 62. № 3. P. 661.
Naumov P., Chizhik S., Panda M.K. et al. // Chem. Rev. 2015. V. 115. № 22. P. 12440.
Ovcharenko V.I., Fokin S.V., Romanenko G.V. et al. // Russ. Chem. Bull. 1999. V. 48. № 8. P. 1519.
Gallagher M.G., Jamieson C.C., Lyons A.J. et al. Pat. US 2009/0131455A1 USA. US, 2009. P. 18.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. № 1. P. 3.
Tretyakov E.V., Ovcharenko V.I. // Russ. Chem. Rev. 2009. V. 78. № 11. P. 971.
Caneschi A., Gatteschi D., Laugier J., Rey P. // J. Am. Chem. Soc. 1987. V. 109. № 7. P. 2191.
Ressouche E., Boucherle J.X., Gillon B. et al. // J. Am. Chem. Soc. 1993. V. 115. № 9. P. 3610.
Onguchi T., Fujita W., Yamaguchi A. et al. // Mol. Cryst. Liq. Cryst. 1997. V. 296. № 1. P. 281.
Caneschi A., Gatteschi D., Sessoli R. et al. // J. Mater. Chem. 1992. V. 2. № 12. P. 1283.
Caneschi A., Gatteschi D., Renard J.P. et al. // Inorg. Chem. 1989. V. 28. № 17. P. 3314.
Koreneva O.V., Romanenko G.V., Shvedenkov Y.G. et al. // Polyhedron. 2003. V. 22. № 14–17. P. 2487.
Fokin S.V., Tolstikov S.E., Tretyakov E.V. et al. // Russ. Chem. Bull. 2011. V. 60. № 12. P. 2470.
Sherstobitova T., Maryunina K., Tolstikov S. et al. // ACS Omega. V. 4. № 17. P. 17160.
De Panthou F.L., Luneau D., Musin R. et al. // Inorg. Chem. 1996. V. 35. № 12. P. 3484.
Musin R.N., Schastnev P.V., Malinovskaya S.A. // Inorg. Chem. 1992. V. 31. № 20. P. 4118.
Baker G.A., Rushbrooke G.S., Gilbert H.E. // Phys. Rev. A. 1964. V. 135. № 5. P. A1272.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия