Координационная химия, 2022, T. 48, № 12, стр. 730-738
Спиновое состояние клатрохелата железа(II) в продуктах сокристаллизации с 2-аминопиридином и 2-гидроксипиридином
Г. Л. Денисов 1, А. С. Белов 1, Е. Г. Лебедь 1, Ю. В. Нелюбина 1, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: unelya@ineos.ac.ru
Поступила в редакцию 29.04.2022
После доработки 18.05.2022
Принята к публикации 19.05.2022
- EDN: PVAPMK
- DOI: 10.31857/S0132344X22700025
Аннотация
Сокристаллизацией ранее описанного карбоксисодержащего клатрохелата железа(II) (I) с 2-гидроксипиридином и 2-аминопиридином получено два новых кристаллических продукта: соль и сокристалл данного комплекса соответственно, образованные двухточечным гетеросинтоном кислота-пиридин, который часто встречается в многокомпонентных кристаллах ароматических кислот и орто-замещенных пиридинов. Нейтральная природа продукта сокристаллизации с 2-гидроксипиридином нарушает правило pKa, выполняющееся в случае 2-аминопиридина, что вызвано смещением равновесия в кристаллической фазе в сторону кето-формы 2-гидроксипиридина – пиридона-2. Согласно данным рентгеноструктурного анализа, комплекс I в соли и сокристалле находится в низкоспиновом состоянии и не претерпевает температурно-индуцированного спинового перехода в диапазоне температур 100–298 К.
Интерес к комплексам переходных металлов, способных существовать в двух спиновых состояниях (низко- и высокоспиновом, НС и ВС), вызван возможностью обратимого перехода между ними при приложении подходящего внешнего воздействия (например, температуры или давления), которым можно управлять методами молекулярного и супрамолекулярного дизайна [1]. Подобный спиновый переход, сопровождающийся резким изменением магнитных, оптических и других свойств соответствующих комплексов, позволяет создавать на их основе разнообразные устройства и материалы [2, 3], включая сенсоры [4], элементы устройств молекулярной спинтроники [5] и “мягкой” робототехники [6].
Одним из классов соединений, претерпевающих спиновый переход под действием температуры [7, 8], являются макробициклические трис-диоксиматные клеточные комплексы (клатрохелаты [9]) кобальта(II) [8, 10, 11], выгодно отличающиеся от других классов координационных соединений высокой термической и химической стабильностью, простотой получения и широкими возможностями химической модификации [9]. Хотя изоструктурные им комплексы железа(II) сохраняют свои состояния НС или ВС в растворах и кристаллах [12–14], введением второго компонента (растворителя) в кристаллическую решетку одного из представителей данного ряда нам недавно удалось обеспечить его существование в разных спиновых состояниях [15]. Аналогичный подход, подразумевавший сокристаллизацию (псевдо)октаэдрических комплексов железа(II) с органическими соединениями (4,4'-бипиридилом и его аналогами), приводил к образованию сокристаллов, в которых выбранный НС-комплекс претерпевал температурно-индуцированный спиновый переход [16].
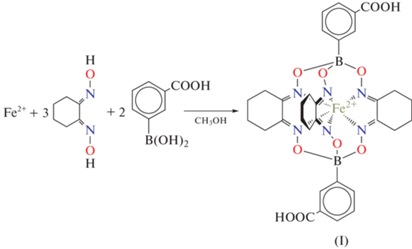
В настоящей работе мы синтезировали ранее описанный [17, 18] клатрохелат железа(II) (I), находящийся в состоянии НС и содержащий две карбоксильные группы в мета-положениях обоих фенильных колец (cхема 1), что делает его похожим на дикарбоновые ароматические кислоты, например фталевую или терефталевую. Это открывает широкие возможности для получения на его основе двухкомпонентных систем за счет образования супрамолекулярных синтонов кислота-пиридин [19] с различным числом водородных связей [20–22].
Схема 1 .
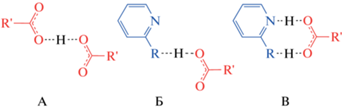
В качестве производных пиридина для сокристаллизации с комплексом I мы выбрали 2-гидроксипиридин (2-OH-Py) и 2-аминопиридин (2‑NH2-Py), которые способствуют преимущественному возникновению синтона кислота-пиридин по сравнению с конкурирующим синтоном кислота-кислота в сокристаллах/солях с карбоновыми кислотами [22]. Гомосинтон кислота-кислота (А) и одноточечный (Б), двухточечный (В) гетеросинтоны кислота-пиридин представлены на cхеме 2. Полученные при этом кристаллические продукты и спиновое состояние I в них изучены при помощи рентгеноструктурного анализа. Для одного из них нам даже удалось получить рентгенодифракционные данные при двух разных температурах (100 и 298 К), чтобы сделать однозначный вывод о наличии или отсутствии температурно-индуцированного спинового перехода.
Схема 2 .
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции выполняли на воздухе с использованием коммерчески доступных реагентов, органических растворителей и сорбентов. Анализ на углерод, азот и водород проводили на микроанализаторе Carlo Erba, модель 1106. Содержание железа определяли спектрофотометрическим методом. Спектры ЯМР 1H и 13C{1H} раствора комплекса I в ДМСО-d6 регистрировали на спектрометре Bruker Avance 600. Измерения химических сдвигов проводили относительно остаточного сигнала этого растворителя.
Синтез C32H34B2N6O10Fe (I). FeCl2 · 4H2O (0.65 г, 3.26 ммоль), ниоксим (1.62 г, 11.4 ммоль) и мета-карбоксифенилборную кислоту (1.35 г, 8.1 ммоль) растворяли/суспендировали в метаноле (30 мл) и полученную реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Выпавший осадок отфильтровывали, промывали метанолом (15 мл, 3 порции), диэтиловым эфиром (15 мл, 3 порции) и гексаном (15 мл, 3 порции) и высушивали в вакууме с образованием целевого продукта в виде оранжевого мелкокристаллического порошка. Выход 2.20 г (90%).
ЯМР 1H (ДМСО-d6; δ, м.д.): 1.75 (с., 12H, β‑CH2), 2.85 (с., 12H, α-CH2), 7.43 (м., 2H, мета-Ph), 7.79 (м., 2H, Ph), 7.87 (м., 2H, Ph), 8.18 (с., 2H, Ph), 12.75 (с., 2H, OH). ЯМР 13C{1H} (ДМСО-d6; δ, м.д.): 21.25 (с., β-CH2), 26.34 (с., α-CH2), 127.81, 129.11, 129.91, 132.97, 136.51 (все с., Ph), 152.78 (с., C=N), 168.46 (с., C=O).
| Найдено, %: | C 51.70; | H 4.55; | N 11.22; | Fe 7.70. |
| Для C32H34N6O10B2Fe | ||||
| вычислено, %: | C 51.90; | H 4.59; | N 11.35; | Fe 7.57. |
Сокристаллизация C32H34B2FeN6O10 · 2C5H5NO · · C2H3N (II). К раствору I (0.0374 г, 0.05 ммоль) в 1.5 мл ацетонитрила добавляли раствор 2-гидроксипиридина (0.094 г, 0.1 ммоль) в 0.3 мл ацетонитрила. Полученную смесь нагревали до полного растворения I и выдерживали в закрытой стеклянной виале при комнатной температуре, при этом происходило частичное выпадение оранжевого порошка I. Виалу визуально осматривали каждые 3–4 сут на предмет образования кристаллических продуктов в течение 7 мес., по истечении которых на поверхности оранжевого порошка I появилось несколько красных призматических кристаллов II.
Сокристаллизация [C32H33B2FeN6O10][C5H6N2] · · C5H7N2 (III). К раствору I (0.0075 г, 0.01 ммоль) в 1.0 мл метанола добавляли раствор 2-аминопиридина (0.00188 г, 0.02 ммоль) в 0.5 мл метанола. Полученную смесь нагревали до полного растворения I и выдерживали в закрытой стеклянной виале при комнатной температуре, при этом происходило частичное выпадение оранжевого порошка I. Виалу визуально осматривали каждые 3–4 сут на предмет образования кристаллических продуктов в течение 2 мес., по истечении которых на поверхности оранжевого порошка I появилось несколько красных призматических кристаллов III.
РCA монокристаллов II и III, полученных в описанных выше условиях сокристаллизации, проведен на дифрактометре Bruker Quest D8 (Mo-Kα-излучение, графитовый монохроматор, ω-сканирование) при 100 K; для III также были получены данные при комнатной температуре. Структуры расшифрованы с использованием программы ShelXT [23] и уточнены в полноматричном МНК с помощью программы Olex2 [24] в анизотропном приближении по $F_{{hkl}}^{2}.$ Атомы водорода в группах NH и OH локализованы в разностном Фурье-синтезе, положения остальных атомов водорода рассчитаны геометрически, и все они уточнены в изотропном приближении по модели наездника. Основные кристаллографические данные и параметры уточнения представлены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для сокристалла II и соли III при 100 К и комнатной температуре (RT)
| Параметр | Значение | ||
|---|---|---|---|
| II | III (100 K) | III (RT) | |
| Брутто формула | C44H47B2FeN9O12 | C42H46B2FeN10O10 | C42H46B2FeN10O10 |
| Молекулярная масса | 971.37 | 928.36 | 928.36 |
| T, K | 100 | 100 | 298 |
| Кристаллическая система | Триклинная | Моноклинная | Моноклинная |
| Пр. группа | $P\bar {1}$ | P21/c | P21/c |
| Z | 2 | 4 | 4 |
| a, Å | 11.0256(5) | 9.3082(2) | 9.3939(5) |
| b, Å | 14.1914(6) | 18.6468(4) | 18.7352(10) |
| c, Å | 14.6082(6) | 24.6575(6) | 24.7326(13) |
| α, град | 101.489(2) | 90 | 90 |
| β, град | 90.061(2) | 95.9810(10) | 95.961(3) |
| γ, град | 106.841(2) | 90 | 90 |
| V, Å3 | 2139.65(16) | 4256.46(17) | 4329.3(4) |
| ρ(выч.), г/см–3 | 1.508 | 1.449 | 1.424 |
| μ, см–1 | 4.30 | 4.26 | 4.19 |
| F(000) | 1012 | 1936 | 50 |
| 2θmax, град | 54 | 54 | 50 |
| Число измеренных отражений | 23 334 | 48 745 | 104 553 |
| Число независимых отражений | 9176 | 9284 | 7617 |
| Число отражений с I > 3σ(I) | 6731 | 6166 | 5125 |
| Количество уточняемых параметров | 614 | 624 | 632 |
| R1 | 0.0608 | 0.0572 | 0.0451 |
| wR2 | 0.1278 | 0.1493 | 0.1302 |
| GOОF | 1.025 | 1.028 | 1.014 |
| Остаточная электронная плотность (max/min), e Å–3 | 0.847/–0.694 | 0.676/–0.409 | 0.401/–0.313 |
Структурные данные для II и III при 100 K и для III при комнатной температуре депонированы в Кембриджском банке структурных данных (CCDC № 2168570, 2168571 и 2168572 соответственно; http://www.ccdc.cam.ac.uk/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез клатрохелата железа(II) (I), содержащего в апикальных положениях карбоксильные группы, проводили по описанной ранее методике [18] прямой темплатной реакцией ниоксима, мета-карбоксифенилборной кислоты и водного хлорида железа(II) (cхема 1). Комплекс I выделен в индивидуальном виде (получен оранжевый мелкокристаллический порошoк) и охарактеризован при помощи элементного анализа и спектроскопии ЯМР.
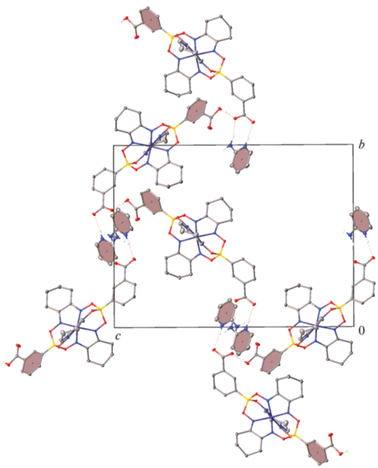
Полученный комплекс I сокристаллизовали с двумя орто-замещенными пиридинами 2-OH-Py и 2-NH2-Py в соотношении 1 : 2 в подходящем растворителе (ацетонитриле и метаноле соответственно), обеспечивающем хорошую растворимость обоих компонентов. При этом происходило частичное выпадение оранжевого порошка исходного комплекса I, длительное выдерживание которого в маточном растворе в закрытых стеклянных виалах при комнатной температуре с регулярным (раз в 3–4 сут) визуальных осмотром привело к появлению нескольких красных монокристаллов, которые были изучены при помощи рентгеноструктурного анализа. К сожалению, малое количество полученного в обоих случаях продукта не позволило нам применить другие популярные методы характеризации структуры и электронного строения систем на основе комплексов железа(II), включая Мёссбауэровскую спектроскопию, порошковую рентгеновскую дифракцию или спектроскопию ЯМР парамагнитных соединений. Попытки оптимизации условий сокристаллизации при использовании других соотношений компонентов (1 : 1 и 2 : 1) или других растворителей (ДМФА, хлористый метилен) приводили к образованию порошка исходного комплекса I, его монокристаллов или монокристаллов орто-замещенных пиридинов.
Согласно данным РСА, продукт сокристаллизации комплекса I с 2-OH-Py представлял собой сокристалл I · 2C5H5NO · C2H3N (II) с двумя молекулами пиридона-2, который соответствует предпочтительной таутомерной формой 2-OH-Py в кристаллической фазе [25, 26] (рис. 1a), и одной сольватной молекулой ацетонитрила. Напротив, при его сокристаллизации с 2-NH2-Py образуется соль [C5H7N2]+[I]– · C5H6N2 (III) за счет переноса протона от одной из карбоксильных групп комплекса I к 2-аминопиридину, который переходит в катионную форму (pис. 1б). Присутствие в кристалле еще и нейтральной молекулы 2-NH2-Py согласуется с величиной ΔpKa (табл. 2) двух компонентов при использовании в качестве изоструктурного аналога комплекса I бензойной или изофталевой кислот (табл. 2).
Рис. 1.
Общий вид комплекса I в сокристалле II (a) и соли III (б) в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Атомы водорода на атомах углерода не показаны для ясности, как и сольватная молекула ацетонитрила в II и минорная компонента разупорядоченного комплексного аниона в III. Нумерация приведена только для гетероатомов.
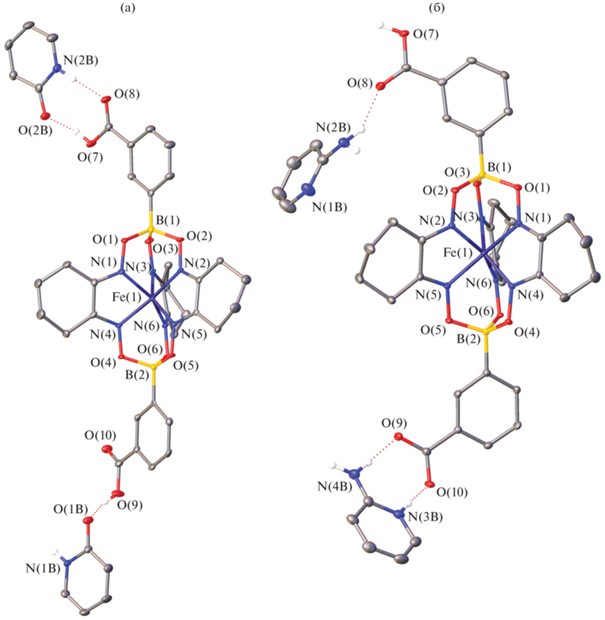
Таблица 2.
Предполагаемые значения ΔpKa для компонентов сокристалла II и соли III на основе данных для изоструктурных ароматических кислот
| Компонент (pKa*) | Бензойная кислота (3.98) | Изофталевая кислота (3.70) | Теория | Эксперимент |
|---|---|---|---|---|
| 2-OH-Py (12.02) | 8.32 | 8.04 | Соль | Сокристалл |
| 2-NH2-Py (6.67) | 2.97 | 2.69 | Возможно образование сокристалла и соли | Сокристалл и соль |
Действительно, в зависимости от выбора карбоновой кислоты и органического основания при их сокристаллизации возможно образование двухкомпонентной системы как нейтральной, так и ионной природы [27]. Согласно правилу pKa [28, 29] при ΔpKa > 3 образуется соль, а при ΔpKa < –1 – сокристалл. Если это значение попадает в промежуточный диапазон ΔpKa, то молекулярная и ионная формы равновероятны, что и наблюдается в случае соли III (табл. 2). Образование же сокристалла II вместо предсказанной соли обусловлено существованием 2-OH-Py в виде кето-таутомера [25, 26], который препятствует переносу протона с карбоксильной группы комплекса I на атом азота пиридина.
Независимо от природы указанных кристаллических продуктов одна карбоксильная/карбоксилатная группа комплекса I образует двухточечный вариант классического супрамолекулярного гетеросинтона кислота-пиридин [19] (cхема 2), встречающегося в двухкомпонентных системах карбоновых кислот с различными пиридинами [22, 27, 30], а вторая группа связывается только с орто-заместителем нейтральной молекулы пиридона-2 или 2-NH2-Py (рис. 1). В обоих случаях орто-заместитель в выбранном пиридине выполняет роль либо донора водородной связи, как в соли III (N…O 2.812(4) и 2.906(4) Å, NHO 167.5(2)° и 153.9(2)° при 100 К), либо акцептора, как в сокристалле II (O…O 2.568(4) и 2.589(3) Å, OHO 161.18(15)° и 166.72(16)°). Эта водородная связь приводит к ослаблению связи N–H…O/O–H…N в двухточечном гетеросинтоне кислота-пиридин (N…O 2.835(4) и 2.705(4) Å, NHO 167.86(18)° и 174.7(2)° при 100 К для в II и III соответственно) по сравнению с его одноточечным аналогом (cхема 2), например в серии сокристаллов и солей одноосновной ароматической кислоты с пиридинами, не замещенными по орто-положению (N…O 2.653 и 2.575(4) Å, NHO 170.9° и 173.3° в среднем соответственно) [22]. Она, однако, увеличивает вероятность возникновения гетеросинтона кислота-пиридин по сравнению с конкурирующим гомосинтоном кислота-кислота (cхема 2), характерным для одно- или двухосновных ароматических кислот, например бензойной [31], терефталевой и изофталевой [19]. При этом перенос протона с карбоксильной группы комплекса I на одну из молекул 2-NH2-Py в кристалле соли III способствует образованию не только гетеро- [20, 21], но и гомосинтона (рис. 2). Соответствующие водородные связи O–H…O между карбоксилатной и карбоксильной группами (O…O 2.582(4) Å, OHO 169.66(17)°) объединяют комплексные анионы в бесконечные зигзагообразные цепочки вдоль кристаллографической оси b. Второй атом кислорода карбоксилатной группы, который не участвует в образовании гомосинтона, дополнительно связан с аминогруппой нейтральной молекулы 2-NH2-Py (N…O 3.152(4) Å, NHO 175.8(2)°).
Рис. 2.
Фрагмент кристаллической упаковки соли III, иллюстрирующий образование водородно-связанных зигзагообразных цепочек из анионов комплекса I вдоль кристаллографической оси b. Атомы водорода на атомах углерода, минорная компонента разупорядоченного комплексного аниона, а также катионы и нейтральные молекулы 2-NH2-Py не показаны.
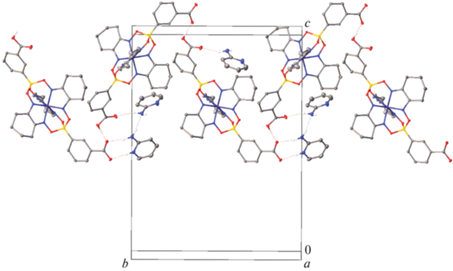
Вместо описанного выше гомосинтона кислота-кислота в сокристалле II присутствуют центросимметричные димеры пиридона-2, образованные водородными связями N–H…O (N…O 2.771(4) Å, NHO 174.09(19)°) (рис. 3), в результате чего основным супрамолекулярным мотивом является ассоциат, в состав которого входят четыре молекулы 2-O-PyH и две молекулы комплекса I (рис. 3). Такие ассоциаты объединяются друг с другом стекинг-взаимодействиями между молекулами пиридона-2 и фенильными группами соседних молекул комплекса I с расстоянием между центроидами соответствующих ароматических колец 3.701(2)–3.9107(18) Å и углом между ними 160.02(11)°–175.04(11)°. Напротив, кристаллическая упаковка соли III представляет собой трехмерный водородно-связанный каркас (рис. 4), дополнительно стабилизированный водородными связями N–H…N, попарно объединяющими молекулы и катионы 2-NH2-Py (N…N 3.063(5) Å, NHN 175.8(3)°) (рис. 2). Кроме того, эти катионы образуют стекинг-взаимодействия друг с другом и с карбоксифенильными группами анионов (расстояния между центроидами ароматических колец и углы между ними составляют 3.756(2)–3.977(3) Å и 0.00(3)°–9.91(12)° соответственно).
Рис. 3.
Фрагмент кристаллической упаковки сокристалла II, иллюстрирующий образование молекулами пиридона-2 центросимметричных водородно-связанных димеров и стекинг-взаимодействий с фенильными группами комплекса I (выделены розовым цветом), связанных между собой стекинг-взаимодействиями. Атомы водорода на атомах углерода и сольватные молекулы ацетонитрила не показаны.
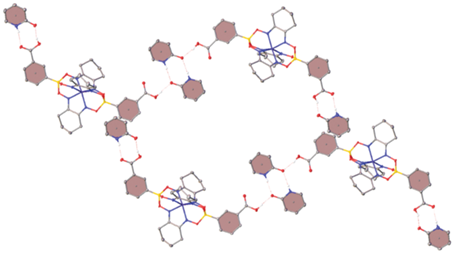
Рис. 4.
Фрагмент кристаллической упаковки соли III, иллюстрирующий образование стекинг-взаимодействий между ароматическими фрагментами комплексного аниона и катионами пиридиния (выделены розовым цветом). Атомы водорода на атомах углерода, минорная компонента разупорядоченного комплексного аниона и молекулы пиридина не показаны.
Несмотря на разную природу продукта сокристаллизации комплекса I с выбранными орто-замещенными пиридинами и образованные им разные комбинации гомо- и гетеросинтонов, молекулярная геометрия данного комплекса в сокристалле II и соли III различается незначительно (рис. 5). Основное отличие касается разворота карбоксифенильных групп относительно реберных фрагментов клеточного лиганда, угол которого относительно ближайшего такого фрагмента в среднем составляет 27.2(3)° и 16.9(4)°. В обоих случаях координационное окружение иона железа(II) в комплексе I близко к тригональной призме (ТП), в том числе и при комнатной температуре (рис. 1). Так, угол искажения φ, равный 0° для идеальной ТП и 60° для идеальной тригональной антипризмы (ТАП), в II и III составляет около 19°, что лишь немногим отличается от аналогичного значения (табл. 3) для ранее описанного [32] сольвата комплекса I с ДМСО. Более точно форму координационного полиэдра характеризуют так называемые “меры симметрии” [33], описывающие ее отклонение от идеального многогранника. Чем эти значения меньше, тем лучше форма полиэдра описывается соответствующим многогранником. В сокристалле II и соли III, как и в сольвате комплекса I с ДМСО [32], минимальные значения “меры симметрии”, оцененные на основе рентгенодифракционных данных при помощи программы Shape 2.1, соответствуют ТП (табл. 3).
Рис. 5.
Общий вид комплекса I в сокристалле II (а) и соли III (б) при 100 К вдоль нормали к плоскостям, образованным двумя наборами атомов азота клеточного лиганда (выделены розовым и зеленым цветом). Атомы водорода на атомах углерода и минорная компонента разупорядоченного комплексного аниона в III не показаны.
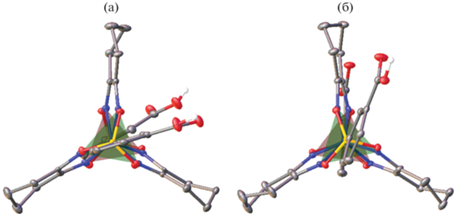
Таблица 3.
Основные геометрические параметры* для комплекса I в сокристалле II, соли III** и в описанном ранее [32] кристаллосольвате I · (DMSO)2
| Параметр | Значение | |||
|---|---|---|---|---|
| II | III (100 K) | III (RT) | I · (DMSO)2 | |
| Fe–N, Å | 1.886(4)–1.924(4) | 1.886(4)–1.924(4) | 1.884(4)–1.932(4) | 1.908(4)–1.916(4) |
| φ, град | 19.44(17) | 19.6(2) | 18.8(2) | 21.94(3) |
| h, Å | 2.3542(18) | 2.355(3) | 2.359(3) | 2.349(5) |
| S(ТП) | 1.982 | 2.050 | 1.957 | 2.554 |
| S(ТАП) | 7.959 | 7.815 | 7.996 | 6.924 |
* φ – угол ТП-ТАП искажения координационного полиэдра иона железа(II), h – высота этого полиэдра, S(ТП) и S(ТАП) – отклонения формы полиэдра FeN6 от идеальной тригональной призмы (ТП) и идеальной тригональной антипризмы (ТАП) соответственно. ** Значения приведены для мажорной компоненты разупорядоченного комплексного аниона в кристалле соли III при 100 K и RT.
Хотя тригонально-призматическое искажение (псевдо)октаэдрического окружения иона металла характерно для комплексов железа(II) в состоянии ВС [1], длины связей Fe–N комплекса I в сокристалле II и соли III соответствуют значениям, ожидаемым для НС иона железа(II) [1] даже при комнатной температуре (табл. 3). Об отсутствии в этих кристаллических продуктах температурно-индуцированного спинового перехода в ВС состояние также свидетельствует красный цвет их кристаллов, который сохранялся при охлаждении/нагревании в диапазоне температур 100–298 К. Аналогичная ситуация наблюдалась ранее [32] и для кристаллосольвата комплекса I с ДМСО (табл. 3), молекулы которого образовывали водородные связи с обеими карбоксильными группами (O…O 2.588(6) Å, OHO 169.8(3)°), из-за чего в нем отсутствовали ожидаемые супрамолекулярные гомосинтоны кислота-кислота. ТП-форма координационного полиэдра иона железа(II) в перечисленных кристаллических продуктах обусловлена жесткостью клеточного лиганда, препятствующей развороту его реберных фрагментов в сторону ТАП геометрии, которая стабилизирует состояние ВС клатрохелатов железа(II) [15].
Таким образом, сокристаллизацией ранее описанного карбоксисодержащего клатрохелата железа(II) с двумя орто-замещенными пиридинами нами получены его новые двухкомпонентные кристаллы нейтральной и ионной природы: сокристалл с 2-гидроксипиридином в виде его предпочтительного изомера пиридона-2 и соль 2‑аминопиридина. Согласно результатам проведенного рентгенодифракционного исследования (в первую очередь – длинам связей Fe–N), ион железа(II) указанного комплекса сохраняет в них свое состояние НС и не претерпевает спиновый переход в диапазоне температур от 100 К до комнатной. Нейтральная природа продукта сокристаллизации с 2-гидроксипиридином нарушает правило pKa, что вызвано существованием последнего в виде пиридона-2, являющегося его предпочтительным таутомером в кристаллической фазе, в то время как для соли с 2-аминопиридином наблюдается образование одновременно молекулярного и ионного ассоциата в полном соответствии с правилом pKa. Несмотря на такие различия, в основе супрамолекулярной организации соли и сокристалла лежит двухточечный гетеросинтон кислота-пиридин, часто встречающийся в многокомпонентных кристаллах ароматических кислот и орто-замещенных пиридинов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Spin-Crossover Materials: Properties and Applications / Ed. Halcrow M.A. Chichester (United Kingdom): John Wiley & Sons, Ltd., 2013.
Molnár G., Rat S., Salmon L. et al. // Adv. Mater. 2017. V. 30. № 5. P. 1703862.
Senthil Kumar K., Ruben M. // Coord. Chem. Rev. 2017. V. 346. P. 176.
Linares J., Codjovi E., Garcia Y. // Sensors. 2012. V. 12. P. 4479.
Coronado E. // Nature Rev. Mat. 2020. V. 5. № 2. P. 87.
Enriquez-Cabrera A., Rapakousiou A., Piedrahita Bello M. et al. // Coord. Chem. Rev. 2020. V. 419. P. 213396.
Voloshin Y.Z., Varzatskii O.A., Novikov V.V. et al. // Eur. J. Inorg. Chem. 2010. V. 2010. № 34. P. 5401.
Novikov V.V., Ananyev I.V., Pavlov A.A. et al. // J. Phys. Chem. Lett. 2014. V. 5. № 3. P. 496.
Voloshin Y., Belaya I., Krämer R. Cage Metal Complexes: Clathrochelates Revisited. Springer, 2017.
Vologzhanina A.V., Belov A.S., Novikov V.V. et al. // Inorg. Chem. 2015. V. 54. № 12. P. 5827.
Dolganov A.V., Belov A.S., Novikov V.V. et al. // Dalton Trans. 2015. V. 44. № 5. P. 2476.
Pavlov A.A., Savkina S.A., Belov A.S. et al. // Inorg. Chem. 2017. V. 56. № 12. P. 6943.
Voloshin Y.Z., Varzatskii O.A. et al.// Inorg. Chem. 2000. V. 39. № 9. P. 1907.
Varzatskii O.A., Penkova L.V., Kats S.V. et al. // Inorg. Chem. 2014. V. 53. № 6. P. 3062.
Denisov G.L., Novikov V.V., Belova S.A. et al. // Cryst. Growth Des. 2021. V. 21. № 8. P. 4594.
Birchall L.T., Truccolo G., Jackson L., Shepherd H.J. // Chem. Sci. 2022. V. 13. № 11. P. 3176.
Marmier M., Wise M.D., Holstein J.J. et al. // Inorg. Chem. 2016. V. 55. № 8. P. 4006.
Lebed E.G., Belov A.S., Dolganov A.V. et al. // Inorg. Chem. Commun. 2013. V. 30. P. 53.
Bis J.A., Zaworotko M.J. // Cryst. Growth Des. 2005. V. 5. № 3. P. 1169.
Vishweshwar P., Nangia A., Lynch V.M. // J. Org. Chem. 2002. V. 67. № 2. P. 556.
Mukherjee A., Desiraju G.R. // Cryst. Growth Des. 2014. V. 14. № 3. P. 1375.
Denisov G.L., Nelyubina Y.V. // Crystals. 2022. V. 12. № 4. P. 497.
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. P. 112.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Yang H.W., Craven B.M. // Acta Crystallogr. B. 1998. V. 54. P. 912.
De Kowalewski D.G., Contreras R.H., Díez E., Esteban A. // Mol. Phys. 2004. V. 102. № 23. P. 2607.
Mohamed S., Tocher D.A., Vickers M. et al. // Cryst. Growth Des. 2009. V. 9. № 6. P. 2881.
Cruz-Cabeza A.J. // CrystEngComm. 2012. V. 14. № 20. P. 6362.
Lemmerer A., Govindraju S., Johnston M. et al. // Crys-tEngComm. 2015. V. 17. № 19. P. 3591.
Sarma B., Nath N.K., Bhogala B.R., Nangia A. // Cryst. Growth Des. 2009. V. 9. № 3. P. 1546.
Moragues-Bartolome A.M., Jones W., Cruz-Cabeza A.J. // CrystEngComm. 2012. V. 14. № 7. P. 2552.
Marmier M., Wise M.D., Holstein J.J. et al. // Inorg. Chem. 2016. V. 55. № 8. P. 4006.
Alvarez S. // Chem. Rev. 2015. V. 115. P. 13447.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия