Координационная химия, 2022, T. 48, № 3, стр. 178-184
Новые комплексы серебра с триарилстибиновыми лигандами: особенности строения
В. В. Шарутин 1, *, О. К. Шарутина 1
1 Национальный исследовательский Южно-Уральский государственный университет
Челябинск, Россия
* E-mail: vvsharutin@rambler.ru
Поступила в редакцию 30.03.2021
После доработки 21.04.2021
Принята к публикации 24.04.2021
- EDN: YCKHHQ
- DOI: 10.31857/S0132344X22030033
Аннотация
Взаимодействием нитрата серебра с трифенил-, три(пара-толил)- и трис(2-метокси-5-бромфенил)стибином в полярных растворителях получены комплексы [(Ph3Sb)3AgNO3], [(п-Tol3Sb)4Ag]- [NO3] (I) и [(2-MeО-5-Br-C6H3)3SbAg(μ2-NO3)(Ме3CN)]2 · 2[(2-MeО-5-Br-C6H3)3SbAgNO3(Ме3CN)] (II). Комплекс [(Ph3Sb)3AgNO3] реагирует с хлоруксусной и ферроценкарбоновой кислотами в присутствии триэтиламина с образованием соответствующих карбоксилатов [(Ph3Sb)3AgOC(O)CH2Cl] (III) и [(Ph3Sb)3AgOC(O)C5H4FeC5H5] (V). После перекристаллизации III из диоксана получили сольват [(Ph3Sb)3AgOC(O)CH2Cl] (IV) · 1/2С4Н8О2. Методом рентгеноструктурного анализа (CIF files CCDC № 1985086, 2019358, 1984428, 1992301, 1973285 для структур I−V соответственно) установлено, что атомы серебра и сурьмы во всех комплексах тетракоординированы.
Бинарные органические соединения элементов 15 группы R3E (E = P, As, Sb), обладая значительными донорными свойствами за счет неподеленной электронной пары на атоме Е, являются популярными лигандами в координационной химии. Прочность связей Е−М в комплексах переходных металлов убывает в ряду R3P > R3As > R3Sb $ \gg $ R3Bi, что объясняет наиболее частое использование фосфиновых лигандов (арсиновые лиганды встречаются в меньшей степени, очевидно, в связи с их токсичностью). Многие комплексы типа (Ph3E)Мn{X} (M = = Cu, Ag, Au; E = P, As; n = 1–4) структурно охарактеризованы [1–4]. Донорные способности трифенилстибина значительно слабее, его координационные соединения стабильны только в определенных условиях. Известны комплексы серебра, в которых имеют место четыре, три, две или одна связь Ag−Sb. Например, комплексы состава [(Ph3Sb)4Ag]X} устойчивы в присутствии противоанионов с низкими нуклеофильными свойствами (X = ${\text{ClO}}_{4}^{ - },$ ${\text{NO}}_{3}^{ - }$ [5], [B(C6F5)4]− [6], [BF4]− [7], ${\text{BrO}}_{3}^{ - }$ [8]). В комплексах с тремя фрагментами Ph3Sb в координационной сфере серебра четвертое место занимает галоген (Cl, Br, I), псевдогалоген (SCN, NCS, CN) [9], остаток оксима [10], лиганд большого объема [11, 12] или бидентатный лиганд, повышающий координационное число серебра до пяти [13]. Две молекулы Ph3Sb при атоме серебра наблюдаются в биядерных структурах при наличии мостиковых лигандов, например [(Ph3Sb)2Ag{C2B9H12}]2 [14], [(Ph3Sb)2Ag(μ- X)2Ag(SbPh3)2] (X = Cl, Br, I) [15], полимерных структурах типа −Ag(SbPh3)2−CN−Ag(SbPh3)2− CN− [16]. В комплексах, где имеется одна связь Ag−Sb, координационная сфера серебра насыщается присоединением моно- или бидентатных лигандов, выполняющих различные структурные функции [13, 17]. Комплексы со связями Ag−Sb синтезированы с использованием различных солей серебра в полярных растворителях при варьировании мольных соотношений реагентов.
Отметим, что интерес к гетерометаллическим соединениям со связями Ag−Sb обусловлен не только разнообразным дизайном структур, но и обнаруженной биологической активностью [11, 12].
Анализ публикаций позволил заключить, что литературные данные касаются исследований комплексов серебра, содержащих в качестве лигандов трифенилстибин. Исключением является работа, в которой фенильная группа заменена на гетероароматическую (2-C4H3X), где X = S, O или NMe [18]. Комплексы, в которых нитрогруппа замещена на карбоксильную группу, ограничиваются двумя примерами [12].
В настоящей работе описан синтез и особенности строения новых комплексов со связью Ag−Sb: [(p-Tol3Sb)4Ag][NO3] (I), [(2-MeО-5-Br-C6H3)3SbAg(μ2-NO3)(Ме3CN)]2 · 2[(2-MeО-5-Br-C6H3)3SbAgNO3(Ме3CN)] (II), [(Ph3Sb)3AgOC(O)CH2Cl] (III) и [(Ph3Sb)3AgOC(O)C5H4FeC5H5] (V).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез [(p-Tol3Sb)4Ag][NO3] (I). К раствору 500 мг (1.2 ммоль) три(пара-толил)сурьмы в 7 мл смеси метанол : ацетонитрил (1 : 1 объемн.) приливали раствор 54 мг (0.3 ммоль) нитрата серебра в 3 мл той же смеси растворителей, перемешивали. Оставляли на сутки в темном месте. Выход кристаллов I серебристого цвета 434 мг (78%). Tпл = 174°С.
ИК-спектр (ν, см–1): 3061, 3037, 3022, 3008, 2949, 2918, 2862, 1905, 1805, 1743, 1651, 1591, 1490, 1442, 1390, 1340, 1309, 1280, 1211, 1186, 1114, 1062, 1037, 1014, 854, 844, 831, 794, 702, 634, 574, 484, 480, 432.
Синтез [(2-MeО-5-Br-C6H3)3SbAg(μ2-NO3)- (Ме3CN)]2 · 2[(2-MeО-5-Br-C6H3)3SbAgNO3(Ме3CN)] (II). К раствору 510 мг (0.75 ммоль) трис(2-метокси-5-бромфенил)стибина в 4 мл тетрагидрофурана приливали раствор 42 мг (0.25 ммоль) азотнокислого серебра в 4 мл тетрагидрофурана. Смесь оставляли на сутки в темном месте при комнатной температуре. Образовавшийся порошок перекристаллизовывали из ацетонитрила. Выход серебристых кристаллов II 167 мг (76%). Tпл = = 196°С.
ИК-спектр (ν, см–1): 3080, 3051, 3008, 2987, 2931, 2835, 2260, 1897, 1759, 1629, 1566, 1460, 1435, 1425, 1373, 1303, 1282, 1263, 1240, 1176, 1141, 1085, 1043, 1014, 887, 806, 738, 713, 665, 615, 536, 518, 437.
Синтез [(Ph3Sb)3AgOC(O)CH2Cl] (III). К смеси 200 мг (0.16 ммоль) нитрато-трис(трифенилстибин)серебра(I) (синтезирован по методике [12]), растворенного в 3 мл смеси метанол−ацетонитрил (1 : 1 объемн.), приливали раствор 15 мг (0.16 ммоль) монохлоруксусной кислоты в 3 мл той же смеси растворителей и перемешивали. Затем добавляли 0.5 мл (3.5 ммоль) триэтиламина. Смесь оставляли на сутки в темном месте. Выход бесцветных кристаллов III ∙ 1/2CH3OH 178 мг (87%). Tпл = 148°С.
ИК-спектр (ν, см–1): 2939, 2676, 2493, 1478, 1431, 1396, 1384, 1067, 996, 731, 692, 454.
После перекристаллизации III из диоксана получили сольват [(Ph3Sb)3AgOC(O)CH2Cl] (IV) · · 1/2С4Н8О2.
Аналогично синтезировали [(Ph3Sb)3AgOC-(O)C5H4FeC5H5] (V). Выход 75%. Tразл = 192°С.
ИК-спектр (ν, см–1): 3062, 3043, 2987, 1961, 1894, 1815, 1764, 1658, 1575, 1550, 1477, 1465, 1431, 1406, 1382, 1354, 1340, 1301, 1265, 1180, 1157, 1107, 1066, 1035, 1018, 997, 918, 856, 835, 819, 800, 786, 731, 694, 655, 617, 599, 542, 505, 486, 453, 416.
ИК-спектры соединений I−V записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S; образцы готовили таблетированием с KBr (область поглощения 4000−400 см−1).
РСА кристаллов I−V проведен на дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [19]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [20] и OLEX2 [21]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Основные кристаллографические данные и результаты уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры соединений I−V
| Параметр | Значение | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| М | 1750.39 | 1781.53 | 2553.05 | 2609.11 | 1396.05 |
| Сингония | Моноклинная | Триклинная | Триклинная | Триклинная | Триклинная |
| Пр. гр. | C2/c | $P\bar {1}$ | $P\bar {1}$ | $P\bar {1}$ | $P\bar {1}$ |
| a, Å | 13.717(14) | 9.360(5) | 13.131(12) | 13.173(5) | 13.892(8) |
| b, Å | 28.68(2) | 17.532(13) | 13.750(17) | 14.898(6) | 14.112(7) |
| c, Å | 19.504(14) | 18.020(11) | 14.861(16) | 27.467(6) | 14.913(8) |
| α, град | 90.00 | 97.18(4) | 93.43(5) | 93.01(2) | 84.593(18) |
| β, град | 95.62(2) | 92.836(19) | 90.61(5) | 103.083(16) | 88.53(3) |
| γ, град | 90.00 | 99.21(2) | 103.34(5) | 90.897(14) | 76.50(2) |
| V, Å3 | 7636(11) | 2889(3) | 2605(5) | 5241(4) | 2830(3) |
| Z | 4 | 2 | 1 | 2 | 2 |
| ρ(выч.), г/см3 | 1.523 | 2.048 | 1.627 | 1.653 | 1.638 |
| μ, мм–1 | 1.696 | 5.801 | 2.001 | 1.991 | 2.046 |
| F(000) | 3480.0 | 1696.0 | 1250.0 | 2560.0 | 1372.0 |
| Размер кристалла, мм | 0.65 × 0.11 × 0.11 | 0.18 × 0.18 × 0.11 | 0.23 × 0.14 × 0.06 | 0.28 × 0.16 × 0.07 | 0.26 × 0.24 × 0.21 |
| Область сбора данных по θ, град | 5.56–57.74 | 6.128–49.542 | 5.75–56.998 | 5.602−57.00 | 6.04–54.34 |
| Интервалы индексов отражений | –18 ≤ h ≤ 18, –38 ≤ k ≤ 38, –26 ≤ l ≤ 22 |
–11 ≤ h ≤ 10, –20 ≤ k ≤ 20, –21 ≤ l ≤ 21 |
–17 ≤ h ≤ 17, –18 ≤ k ≤ 18, –19 ≤ l ≤ 19 |
–17 ≤ h ≤ 17, –20 ≤ k ≤ 20, –36 ≤ l ≤ 36 |
–17 ≤ h ≤ 17, –18 ≤ k ≤ 18, –19 ≤ l ≤ 19 |
| Измерено отражений | 96 994 | 54 901 | 99 054 | 289 768 | 73 491 |
| Независимых отражений (Rint) | 9971 (0.0688) | 9847 (0.0426) | 13 189 (0.0526) | 26 492 (0.0750) | 12 505(0.0245) |
| Отражений с I > 2σ(I) | 7033 | 7747 | 9048 | 16 533 | 10 690 |
| Переменных уточнения | 427 | 667 | 568 | 1190 | 649 |
| GOOF | 1.005 | 1.016 | 1.076 | 1.066 | 1.064 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0332, wR2 = 0.0575 |
R1 = 0.0344, wR2 = 0.0772 |
R1 = 0.0381, wR2 = 0.0868 |
R1 = 0.0478, wR2 = 0.0964 |
R1 = 0.0365, wR2 = 0.0860 |
| R-факторы по всем отражениям | R1 = 0.0665, wR2 = 0.0669 |
R1 = 0.0503, wR2 = 0.0842 |
R1 = 0.0712, wR2 = 0.1046 |
R1 = 0.0980, wR2 = 0.1164 |
R1 = 0.0451, wR2 = 0.0946 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.46/–0.57 | 0.88/–0.97 | 0.79/–0.90 | 0.74/–1.21 | 1.38/–1.25 |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1985086, 2019358, 1984428, 1992301, 1973285 для структур I−V соответственно, deposit@ccdc.cam.ac.uk; http:// www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как следует из литературных данных, соединения со связями Ag−Sb синтезируют из различных солей серебра и трифенилстибина в разнообразных растворителях при варьировании мольных соотношений реагентов, что обусловливает образование комплексов определенной стехиометрии.
Мы установили, что при взаимодействии три(пара-толил)сурьмы с нитратом серебра в мольном соотношении 3 : 1 в смеси метанол−ацетонитрил (1 : 1 объемн.) вместо комплекса ожидаемой стехиометрии образуется комплекс [(p-Tol3Sb)4Ag][NO3] (I), который выделен также при проведении реакции в соотношении реагентов 4 : 1.
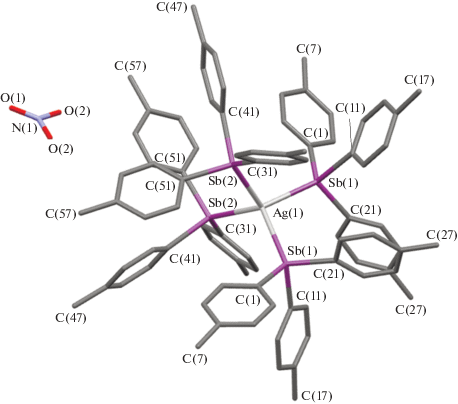
По данным РСА, комплекс I имеет ионное строение. В центросимметричном катионе координация атомов серебра и сурьмы тетраэдрическая (рис. 1). Углы SbAgSb изменяются в интервале 102.30(7)°−116.13(3)°; углы СSb(1)C и СSb(2)C, СSb(1)Ag и СSb(2)Ag варьируют в диапазонах 97.17(12)°−101.44(12)° и 97.90(12)°−100.27(12)°, 116.26(8)°−120.36(9)° и 113.51(8)°−123.26(8)° соответственно. Расстояния Ag−Sb(1) и Ag−Sb(2) равны 2.7283(14) и 2.7339(18) Å. Связи Sb(1)−C и Sb(2)−C составляют 2.119(3)−2.130(3) и 2.112(3)−2.129(3) Å. Отметим, что в симметричной молекуле три(пара-толил)сурьмы углы CSbC равны 97.31(5)°, а связи Sb−C (2.141(3) Å) несколько длиннее [22], чем в I.
Нитрат-анион практически плоский, однако углы ОNO отличаются от теоретического значения 120°: один из углов равен 109.6(8)°, при этом два других составляют 125.2(4)°. Одна из связей N(1)–O(1) (1.131(6) Å) несколько короче двух других связей (1.161(4) Å).
Каждый анион связан с тремя катионами межмолекулярными водородными связями: расстояния N−O⋅⋅⋅H−CAr 2.46−2.59 Å.
Показано, что смешение гомогенных растворов трис(5-бром-2-метоксифенил)стибина и нитрата серебра в тетрагидрофуране в мольном соотношении 3 : 1 приводит к образованию продукта, который после перекристаллизации из ацетонитрила был выделен в виде кристаллов, представляющих собой, по данным РСА, аддукт [(2-MeО-5-Br-C6H3)3SbAg(μ2-NO3)(Ме3CN)]2 · 2[(2-MeО-5-Br-C6H3)3SbAgNO3(Ме3CN)] (II). Ранее было установлено, что при проведении реакции в соотношении 1 : 1 (растворитель – смесь диоксана, метанола и ацетонитрила) продуктом реакции является сольват комплекса с диоксаном [(2-MeO-5-BrC6H3)3SbAg(NO3)(MeCN)] ⋅ (C4H8O2) [23], в котором нитратная группа бидентатна.
В кристаллической ячейке комплекса II присутствует два типа молекул: мономерная и димерная, в которых нитратный лиганд выполняет различные структурные функции: в мономерной молекуле нитратная группа проявляет бидентантные свойства, координируясь двумя атомами кислорода c одним атомом серебра, а в димерной молекуле эта группа, являясь мостиковой, связывает два атома серебра (рис. 2). Координационная сфера атома серебра Ag(2) в мономерной молекуле включает трис(5-бром-2-метоксифенил)стибин, молекулу ацетонитрила, которая координируется c атомом металла через атом азота, и хелатную нитратную группу. Валентные углы при атоме Ag(2) изменяются в интервале 51.50(17)°−126.28(18)°, при этом углы O(11)Ag(2)Sb(2), N(4)Ag(1)O(11), N(4)Ag(1)O(10) имеют значения, близкие к теоретическому 109° (114.69(13)°, 107.0(2)°, 109.2(3)°); минимальным, как и следовало ожидать, является угол O(10)Ag(2)O(11) (51.50(17)°). Расстояния Ag(2)–Sb(2) и Ag(2)–N(4) составляют 2.6253(13) и 2.244(7) Å соответственно. Длины связей Ag(2)–О(10,11) равны 2.398(5) и 2.493(5) Å, что свидетельствует об анизобидентатном типе связывания лиганда. Угол O(10)N(3)O(11) меньше теоретического значения (118.3(6)°), два других угла при атоме N(3) − 120.6(7)° и 121.2(6)°. Cвязи N(3)–O(10,11,12) равны 1.242(7), 1.236(7) и 1.240(7) Å соответственно и в пределах погрешности эксперимента совпадают. Атом Sb(2) также тетракоординирован, валентные углы варьируют от 95.84(19)° до 118.82(14)°. Расстояния Sb(2)–C равны 2.123(5), 2.128(5), 2.133(5) Å, что короче таких связей в молекуле (2-MeO-5-BrC6H3)3Sb (2.1569(16), 2.1603(15), 2.1631(15) Å [24]).
Димерная молекула является центросимметричной. Центральный фрагмент представляет собой восьмичленный цикл [Ag2O4N2]. В окружении атома Ag(1) находятся стибиновый лиганд, молекула ацетонитрила и два атома кислорода двух нитратных групп. Валентные углы при атоме Ag(1) изменяются в диапaзоне 83.6(3)°−136.1(3)°. Связь Ag(1)–Sb(1) (2.6493(15) Å) несколько длиннее аналогичной связи в мономерной молекуле. Мостиковый нитратный лиганд координируется с соседними атомами серебра практически симметрично, поскольку расстояния Ag(1)–O(7А) и Ag(1)–O(8А) имеют близкие значения (2.528(14) и 2.507(11) Å) и превышают связи Ag(2)–О(10,11). Связи N(1)–O в нитратной группе, как и следовало ожидать, не одинаковы: одна из них, самая короткая (1.189(9) Å), соответствует некоординированному атому кислорода O(9А), две другие связи (1.236(7) и 1.242(7) Å) значительно длиннее. Расстояние Ag(1)–N(2) равно 2.326(7) Å.
При атоме сурьмы Sb(1) углы находятся в интервале 96.23(19)°–124.23(13)°. Расстояния Sb(1)–C составляют 2.131(5), 2.136(5), 2,138(5) Å.
Трехмерная структура кристалла II формируется посредством многочисленных межмолекулярных водородных связей с участием электроотрицательных атомов O и Br.
В [12] описан синтез комплексов со связями Ag−Sb с салицилат- и ацетилсалицилат-анионами (Ph3Sb)3Ag(SalH) и (Ph3Sb)3Ag(Asp) и отмечены трудности, с которыми столкнулись авторы при попытке заменить нитратный анион на карбоксилатный.
Взаимодействием нитратотрис(трифенилстибин)серебра(I), синтезированного по методике [12], с монохлоруксусной и ферроценкарбоновой кислотами в присутствии избытка триэтиламина в растворе метилового спирта мы получили комплексы [(Ph3Sb)3AgOC(O)CH2Cl] ∙ 1/2CH3OH (III), который был выделен в виде сольвата [(Ph3Sb)3AgOC(O)CH2Cl] · 1/2С4Н8О2 (IV) после перекристаллизации из диоксана, и [(Ph3Sb)3AgOC(O)C5H4FeC5H5] (V).
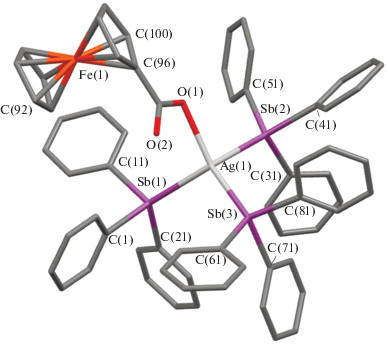
Согласно данным РСА, в сольватах III и IV (геометрические параметры которых мало отличаются и поэтому отдельно обсуждаться не будут) и в комплексе V атомы серебра имеют искаженную тетраэдрическую координацию (рис. 3, 4). Валентные углы при Ag(1) в III варьируют от 92.59(15)° до 122.25(13)°, при этом углы Sb(1)Ag(1)Sb(3), Sb(1)Ag(1)Sb(2), Sb(2)Ag(1)Sb(3) составляют 112.09(6)°, 110.56(8)°, 112.18(7)°; углы O(1)Ag(1)Sb(1), O(1)Ag(1)Sb(3) и O(1)Ag(1)Sb(2) равны 122.25(13)°, 92.59(15)° и 105.98(14)° соответственно. В V координация атома серебра существенно отличается от идеальной, поскольку интервал изменения углов достаточно велик: 88.40(9)°−137.33(11)°. Углы Sb(1)Ag(1)Sb(3), Sb(1)Ag(1)Sb(2), Sb(2)Ag(1)Sb(3) составляют 109.89(4)°, 111.92(4)°, 109.48(3)°; углы O(1)Ag(1)Sb(1), O(1)Ag(1)Sb(2) и O(1)Ag(1)Sb(3) равны 97.58(11)°, 88.40(9)° и 137.33(11)°. Длины связей Ag–Sb имеют значения 2.700(3), 2.716(2), 2.750(3) Å в III и 2.7406(13), 2.7076(16), 2.7742(13) Å в V. При атомах сурьмы углы находятся в интервалах 98.3(2)°–125.06(18)° (III) и 96.93(17)°−125.84(12)° (V). Расстояния Sb–C изменяются в диапазонах 2.107(6)–2.142(6) и 2.119(4)−2.144(5) Å в III и V соответственно.
Расстояния Ag(1)–O(1) составляют 2.307(4) и 2.308(4) Å в III и V соответственно и не отличаются от аналогичного расстояния, найденного в комплексе (Ph3Sb)3Ag(SalH) [12]. Следует отметить, что в V карбоксилатный лиганд демонстрирует тенденцию к бидентатному типу связывания, поскольку расстояние Ag(1)–O(2) равно 2.813(5) Å, в то время как в III аналогичное расстояние значительно больше (3.188(5) Å). Отметим, что в молекуле ферроценкарбоксилата тетрафенилсурьмы лиганд является бидентатным и симметрично координируется с атомом сурьмы двумя атомами кислорода (расстояния Sb–О 2.333 и 2.338 Å) [25]. В карбоксилатных лигандах комплексов III и V ординарные связи C–O (1.231(9) и 1.241(5) Å) длиннее двойных связей (1.214(8) и 1.222(5) Å), углы OCO равны 128.6(7)° и 124.2(4)°.
В ферроценильном фрагменте параллельные циклопентадиенильные кольца находятся в заслоненной конформации, угол между плоскостями кольца и карбоксильной группы составляет 20.52°.
Формирование кристаллической структуры III и V обусловлено межмолекулярными водородными связями типа С−Н···О.
Таким образом, состав комплексов со связями Ag−Sb определяется не только мольным соотношением нитрата серебра и триарилстибина в реакционной смеси. Так, три(пара-толил)сурьма с нитратом серебра дает ионный комплекс 4 : 1, в катионе которого серебро связано с четырьмя стибиновыми лигандами. Напротив, с трис(5-бром-2-метоксифенил)стибином нитрат серебра независимо от соотношения реагентов образует комплекс состава 1 : 1, в котором координационная сфера серебра насыщается за счет n-донорного растворителя и бидентатной нитратной группы, способной выполнять различные структурные функции. Нитратная группа в нитрато-трис(трифенилстибин)серебре(I) в присутствии избытка триэтиламина способна замещаться на остатки карбоновых кислот, которые образуют ковалентные связи Ag−О.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Wells A.F. Structural Inorganic Chemistry. Oxford: Clarendon Press, 1991. 1382 p.
Orpen A.G., Brammer G., Allen F.H. et al. // Dalton Trans. 1989. P. S1. https://doi.org/10.1039/DT98900000S1
Jäger L., Tretner C., Hartung H., Biedermann M. // Eur. J. Inorg. Chem. 1998. № 7. P. 1051. https://doi.org/10.1002/(SICI)1099-0682(199807)1998: 7<1051::AID-EJIC1051>3.0.CO;2-C
Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46. № 10. С. 579 (Sharutin V.V., Poddel’sky A.I., Sharutina O.K. // Russ. J. Coord. Chem. 2020. V. 46. №10. P. 663). https://doi.org/10.1134/S1070328420100012
Bowmaker G.A., Effendy, Hart R.D. et al. // Aust. J. Chem. 1997. V. 50. № 6. P. 539. https://doi.org/10.1071/C96031
Kuprat M., Schulz Axel, Thomas M., Villinger A. // Can. J. Chem. 2018. V. 96. № 6. P. 502. https://doi.org/10.1139/cjc-2017-0420
Hill A.M., Levason W., Webster M. // Inorg. Chem. 1996. V. 35. № 11. P. 3428. https://doi.org/10.1139/cjc-2017-0420
Cingolani A., Effendy, Hanna J.V. et al. // Inorg. Chem. 2003. V. 42. № 16. P. 4938. https://doi.org/10.1021/ic034243e
Effendy, Kildea J.D., White A.H. // Aust. J. Chem. 1997. V. 50. № 6. P. 587. https://doi.org/10.1071/C96035
Domasevitch K.V., Petkova E.G., Nazarenko A.Yu. et al. // Z. Naturforsch. B. 1999. V. 54. № 7. P. 904.
Banti C.N., Papatriantafyllopoulou C., Manoli M. et al. // Inorg. Chem. 2016. V. 55. № 17. P. 8681. https://doi.org/10.1021/acs.inorgchem.6b01241
Gkaniatsou E.I., Banti C.N., Kourkoumelis N. et al. // J. Inorg. Biochem. 2015. V. 150. P. 108. https://doi.org/10.1016/j.jinorgbio.2015.04.014
Cingolani A., Effendy, Pellei M. et al. // Inorg. Chem. 2002. V. 41. № 25. P. 6633. https://doi.org/10.1021/ic020375g
Park Y.-W., Kim J., Do Y. // Inorg. Chem. 1994. V. 33. № 1. P. 1. https://doi.org/10.1021/ic00079a001
Bowmaker G.A., Effendy, de Silva E.N., White A.H. // Aust. J. Chem. 1997. V. 50. № 6. P. 641. https://doi.org/10.1071/C96038
Bowmaker G.A., Effendy, Reid J.C. et al. // Dalton Trans. 1998. V. 13. P. 2139. https://doi.org/10.1039/A801085D
The Cambridge Crystallographic Database. Release. Cambridge, 2018. http://www.ccdc.cam.ac.uk
Vela J., Sharma P., Cabrera A. et al. // J. Organometal. Chem. 2001. V. 634. № 1. P. 5. https://doi.org/10.1016/S0022-328X(01)01003-8
SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison (WI, USA): Bruker AXS Inc., 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Sobolev A.N., Romm I.P., Belskii V.K., Gur’yanova E.N. // J. Organomet. Chem. 1979. V. 179. P. 153. https://doi.org/10.1016/S0022-328X(00)95217-3
Шарутина О.К. // Вестник ЮУрГУ. Сер. Химия. 2020. Т. 12. № 1. С. 49. https://doi.org/10.14529/chem200106
Шарутин В.В., Сенчурин В.С., Шарутина О.К., Чагарова О.В. // Журн. неорган. химии. 2011. Т. 56. № 10. С. 1640 (Sharutin V.V., Senchurin V.S., Sharutina O.K., Chagarova O.V. // Russ. J. Inorg. Chem. 2011. V. 56. № 10. Р. 1561). https://doi.org/10.1134/S0036023611100196
Liu R.-C., Ma Y.-Q., Yu L. et al. // Appl. Organomet. Chem. 2003. V. 17. № 9. P. 662. https://doi.org/10.1002/aoc.491
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия